Използването на солна киселина
Солната киселина намира широко приложение в индустрията за извличане на метали от руди, ецване на метали и др. Използва се и при производството на течност за запояване, при отлагане на сребро и като неразделна част от царската вода.
Мащабът на употребата на солна киселина в промишлеността е по-малък от този на азотната киселина. Това се дължи на факта, че солната киселина причинява корозия на стоманено оборудване. В допълнение, неговите летливи пари са доста вредни и също така причиняват корозия на металните изделия. Това трябва да се има предвид при съхранение на солна киселина. Солната киселина се съхранява и транспортира в резервоари и бъчви, облицовани с гума, т.е. в съдове, чиято вътрешна повърхност е покрита с киселинноустойчива гума, както и в стъклени бутилки и полиетиленови прибори.
Солната киселина се използва за производство на хлориди на цинк, манган, желязо и други метали, както и амониев хлорид. Солната киселина се използва за почистване на повърхности на метали, съдове, кладенци от карбонати, оксиди и други утайки и замърсители. В този случай се използват специални добавки - инхибитори, които предпазват метала от разтваряне и корозия, но не забавят разтварянето на оксиди, карбонати и други подобни съединения.
HCl се използва в промишленото производство на синтетични смоли, каучук. Използва се като суровина при производството на метилхлорид от метилов алкохол, етилов хлорид от етилен и винилхлорид от ацетилен.
Първа помощ и методи на лечение
Ако се открият признаци на отравяне, трябва да се извика линейка. У дома е позволено да се извършват дейности, насочени към подобряване на състоянието на пострадалия. Първата помощ при отравяне със солна киселина трябва да се извършва бързо, за да се намали рискът от негативни последици.
Събития:
- Ако солното съединение попадне върху кожата, увредените места се измиват обилно с хладка вода. Времето за обработка е най-малко половин час.
- При интоксикация с изпарения на пострадалия се осигурява достъп до чист въздух, отварят се прозорци, разкопчават се тесни дрехи.
- Препоръчва се да се следи състоянието на пациента, при липса на признаци на живот се извършва реанимация.
- Жертвата от изпаренията се оставя да пие топъл чай, вода. Препоръчително е да изплакнете носа и устата с хладка вода.
- В случай на предозиране в резултат на поглъщане на киселина, върху корема се поставя пакет с лед, за да се предотврати или намали възможно кървене.
- Не са разрешени никакви лекарствени продукти. Позволено е да се даде на пациента чаша вода (можете минерална алкална). Течността за пиене се изисква на малки глътки.
- Не е позволено да се измие стомаха, опитайте се да предизвикате повръщане у дома. Такава първа помощ може да доведе до развитие на изгаряния на гърлото, кървене.
Лечението се извършва в лечебно заведение под наблюдението на специалисти.
терапия:
- Почистване на стомаха със сонда,
- Използване на капкомери с медицински разтвори,
- Предписване на лекарства за облекчаване на болката
- Използването на лекарства, насочени към възстановяване на функционирането на органите и системите,
- Ако е необходимо, вдишване на кислород и изкуствена вентилация на белите дробове,
- Провеждане на реанимационна терапия при липса на признаци на живот,
- Избор на витамини и специално хранене.
Лечението се провежда в интензивно отделение, а след това в болница. Продължителността зависи от състоянието на пациента и степента на отравяне.
Изгаряния и отравяния
Колкото и ефективно да е това лекарство, то е опасно. Солната киселина, в зависимост от концентрацията, може да причини химически изгаряния от четири степени:
- Има само зачервяване и болка.
- Има мехури с бистра течност и подуване.
- Образувана некроза на горните слоеве на кожата.Мехури се пълнят с кръв или мътно съдържание.
- Поражението достига до сухожилията и мускулите.
Ако веществото по някакъв начин попадне в очите, е необходимо да ги изплакнете с вода, а след това с разтвор на сода. Но във всеки случай първото нещо, което трябва да направите, е да се обадите на линейка.
Поглъщането на киселина вътре е изпълнено с остри болки в гърдите и корема, подуване на ларинкса, повръщане с кървави маси. В резултат на това тежки патологии на черния дроб и бъбреците.
А първите признаци на отравяне по двойки включват суха честа кашлица, задавяне, увреждане на зъбите, парене в лигавиците и коремна болка. Първата спешна помощ е измиване и изплакване на устата с вода, както и достъп до чист въздух. Само токсиколог може да окаже реална помощ.
Свойства на химичния спектър
Киселината взаимодейства с много метали, соли. Смята се за доста силен и е наравно с дивата коза. Основната реакция се проявява във всички групи метали, разположени вляво от водорода (магнезий, желязо, цинк - електрически потенциали).
Разтворът на хлороводород в разредена форма реагира със соли, но само с тези, образувани от по-малко силни киселини. Известни на всички натриев и калциев карбонат, след взаимодействие с него, те се разлагат на вода и въглероден окис.
Азотна киселина
- качествена реакция към физиологичен разтвор. За да се получи, е необходимо да се добави сребърен нитрат към този реагент, в резултат на което ще се образува бяла утайка, от която се получава азотно вещество.
С помощта на тази смес от вода и водород се провеждат много интересни експерименти. Например, разредете го с амоняк. В резултат на това ще получите бял дим, гъст, с консистенция на малки кристали. Метиламин, анилин, манганов диоксид, калиев карбонат са реагенти, които също се влияят от киселина.
Как и защо се използва
Може би това с право е едно от важните вещества, които се намират и са необходими в почти всички клонове на човешкия живот.
Локализация на областта на приложение:
- Металургия. Повърхностно почистване от окислени участъци, разтваряне на ръжда, обработка с предварително запояване, калайдисване. Солната киселина помага за извличането на малки включвания на метали от рудите. Цирконий и титан се получават по метода за превръщане на оксиди в хлориди.
- Хранително-технологична индустрия. Като хранителна добавка се използва разтвор с ниска концентрация. Желатинът, фруктозата за диабетици съдържат чист емулгатор. Обикновената сода също има високо съдържание на това вещество. На опаковката на стоките ще го видите под името E507.
- Областта на медицината. При недостатъчен индикатор за киселинната среда в стомаха и проблеми с червата. Ниският Ph води до рак. Дори при правилно хранене, изобилие от витамини, опасността не изчезва, е необходимо да се направят тестове за получаване на сок от стомашния тракт, тъй като в недостатъчно кисела среда полезните вещества практически не се усвояват, храносмилането се нарушава.
- Солен разтвор се използва като инхибитор - защита срещу замърсявания и инфекции, антисептично действие. За производството на лепилни смеси, керамични изделия. Промива топлообменниците.
- Процедурата за пречистване на питейната вода също не е пълна без участието на хлор.
- Производство на каучук, избелване на тъканни основи.
- Можете да се грижите за вашите лещи с този разтвор.
- Вода за уста у дома
- Веществото е отличен проводник на електричество.
Как възниква отравянето
Солната киселина е безцветна течност с характерна остра миризма. Една от най-силните киселини, способна да разтваря някои метали. Лесно се превръща в газ.
Хлороводородът се използва в текстилната промишленост, кожарския бизнес, металургията на благородни метали, в производството на лепило, киселини.
Веществото присъства в стомаха в минимална концентрация. Киселината допринася за нормализирането на храносмилателния процес, предпазва тялото от вредни бактерии и микроорганизми.
При концентрация над 24% солната киселина може да причини необратими увреждания на човешкото тяло. Парите, образувани при контакт с въздуха, причиняват дразнене на органите на зрителната и дихателната система.
Има няколко фактора, които могат да провокират развитието на отравяне.
Фактори:
Възможна е интоксикация с пари при работа в помещения с лоша вентилация,
Поглъщане по небрежност, по-често при деца,
Попадането на солна киселина върху епидермиса, лигавиците в случай на неспазване на правилата за използване на реагента.
Отравянето с вещество у дома при възрастни възниква в резултат на употреба без защитно оборудване на кожата, очите и органите на дихателната система. Интоксикация може да възникне, когато киселината се прехвърля неточно от един съд в друг.
Фармакодинамика и фармакокинетика
Какво е стомашна киселинност? Това е характеристика на концентрацията на солна киселина в стомаха. Киселинността се изразява в рН
. Обикновено киселината трябва да се произвежда в състава на стомашния сок и да участва активно в процесите на храносмилане. Формула на солна киселина: HCl
. Произвежда се от париетални клетки, разположени във фундалните жлези, с участието на Н+/К+-АТФаза
. Тези клетки покриват фундуса и тялото на стомаха. Самата киселинност на стомашния сок е променлива и зависи от броя на париеталните клетки и интензивността на процесите на неутрализиране на веществото от алкалните компоненти на стомашния сок. Концентрация, произведена до - вие сте стабилни и равна на 160 mmol/l. Здравият човек обикновено трябва да произвежда не повече от 7 и най-малко 5 mmol вещество на час.
При недостатъчно или прекомерно производство на солна киселина възникват заболявания на храносмилателния тракт, способността за усвояване на определени микроелементи, като желязо, се влошава. Лекарството стимулира секрецията на стомашен сок, намалява рН
. Активира пепсиноген
, го превръща в активен ензим пепсин
. Веществото има благоприятен ефект върху киселинния рефлекс на стомаха, забавя преминаването на ненапълно усвоена храна в червата. Процесите на ферментация на съдържанието на храносмилателния тракт се забавят, болката и оригването изчезват, желязото се абсорбира по-добре.
След перорално приложение лекарството се метаболизира частично от слюнката и стомашната слуз, съдържанието на дванадесетопръстника 12. Несвързаното вещество прониква в дванадесетопръстника, където се неутрализира напълно от алкалното си съдържание.
Друга употреба на киселина в ежедневието
С киселинен състав можете лесно да почистите варовик и ръжда от фаянсови водопроводи, да премахнете пикочния камък и други замърсители. За по-голям ефект към агента се добавя инхибитор (например уротропин), който забавя химическата реакция.
Процедурата се извършва по следния начин: киселината се разрежда с вода до достигане на 5% концентрация и се добавя инхибитор в размер на 0,5 g на 1 литър течност. Повърхността се обработва с получения състав и се оставя за 30-40 минути (в зависимост от степента на замърсяване), след което се измива с вода.
Мек киселинен разтвор се използва и за премахване на петна от горски плодове, петна от мастило или ръжда от тъкани. За да направите това, материалът се накисва в състава за известно време, след което се изплаква обилно и се измива по обичайния начин.
Премахване на котлен камък в чайника
За целта се използва 3-5% разтвор на солна киселина, която се излива в чайник и се загрява до 60-80°
C за 1-2 часа или докато отлаганията на котлен камък се разпаднат. След това мащабът се разхлабва и лесно се отстранява с дървена шпатула.
Ефективността на метода се дължи на факта, че реагентът реагира с магнезиеви и калциеви карбонати и ги превръща в разтворими соли. Освободеният въглероден диоксид в същото време разрушава слоя от котлен камък и го разхлабва. След отстраняване на солните отлагания съдовете се измиват обилно с чиста вода.
Важен момент!
Този метод не е подходящ за отстраняване на котлен камък и напукан емайл или алуминиеви чайници: това ще корозира метала и ще причини сериозни щети.
Получаване на вещество
Сега можем да говорим за това какво правят, за да образуват солна киселина.
Първо, чрез изгаряне на водород в хлор се получава основният компонент, газообразният хлороводород. който след това се разтваря във вода. Резултатът от тази проста реакция е образуването на синтетична киселина.
Това вещество може да бъде получено и от отпадъчни газове. Това са химически отпадъчни (странични) газове. Те се образуват от различни процеси. Например при хлориране на въглеводороди. Хлороводородът в техния състав се нарича отработен газ. И така получената киселина, респ.
Трябва да се отбележи, че през последните години делът на отпадъчния газ в общия обем на производството му нараства. И киселината, образувана в резултат на изгаряне на водород в хлор, се измества. Въпреки това, честно казано, трябва да се отбележи, че съдържа по-малко примеси.
Производствена употреба
Има широко приложение в металургичната, хранителната и медицинската промишленост.
- Металургия. Използва се при запояване, калайдисване и почистване на метали.
- Хранително-вкусовата промишленост. Приложение в производството на регулатори на киселинността на храните, например E507.
- Електротип. Използва се за мариноване.
- Лекарство. Намира своето приложение в производството на изкуствен стомашен сок.
Включено в синтетичните багрила. Използва се в производството на почистващи и перилни препарати. Но в течности, предназначени за домашна употреба, концентрацията на сярна киселина е незначителна.
Как се произвежда солна киселина в лабораторията
Производството на веществото е мащабно, продажбата е безплатна. В условията на лабораторни експерименти се получава разтвор чрез действието на висока концентрация на сярна киселина върху обикновена кухненска сол (натриев хлорид).
Има 2 метода за разтваряне на хлороводород във вода:
- Водородът се изгаря в хлор (синтетичен).
- Свързан (отработен газ). Същността му е в извършването на органично хлориране, дехидрохлориране.
Веществото се поддава добре на синтез по време на пиролизата на отпадъци от органохлор. Това се случва в резултат на разграждането на въглеводородите при пълна липса на кислород. Можете да използвате и метални хлориди, които са суровини за неорганични вещества. Ако няма концентрирана сярна киселина (електролит), приемайте разредена.
Що се отнася до извличането на реагента в естествени условия, най-често тази химическа смес може да се намери във водите на вулканични отпадъци. Хлороводородът е компонент на минералите силвин (калиев хлорид, прилича на кости за игри), бишофит. Всичко това са методи за извличане на веществото в промишлеността.
При хората този ензим се намира в стомаха. Разтворът може да бъде киселина или основа. Един от най-често срещаните методи за извличане се нарича сулфат.
Химични свойства
Солна киселина, хлороводород или солна киселина - разтвор HCl
във вода. Според Wikipedia, веществото принадлежи към групата на неорганичните силни едноосновни to-t. Пълното име на съединението на латински: солна киселина.
Формула на солна киселина в химията: HCl
. В една молекула водородните атоми се комбинират с халогенни атоми - кл
. Ако разгледаме електронната конфигурация на тези молекули, може да се отбележи, че съединенията участват в образуването на молекулярни орбитали 1s
-водородни орбитали и двете 3s
и 3п
-орбитали на атом кл
. В химичната формула на солната киселина 1s-
, 3s-
и 3r
-атомните орбитали се припокриват и образуват 1, 2, 3 орбитали. При което 3s
-орбиталната не е обвързваща. Има изместване на електронната плътност към атома кл
и полярността на молекулата намалява, но енергията на свързване на молекулярните орбитали се увеличава (ако го разглеждаме заедно с други халогеноводороди
).
Физични свойства на хлороводород. Това е бистра, безцветна течност, която пуши, когато е изложена на въздух. Моларна маса на химично съединение = 36,6 грама на мол. При стандартни условия, при температура на въздуха от 20 градуса по Целзий, максималната концентрация на веществото е 38% от теглото. Плътността на концентрираната солна киселина в този вид разтвор е 1,19 g/cm³. Като цяло физичните свойства и характеристики като плътност, моларност, вискозитет, топлинен капацитет, точка на кипене и рН
, силно зависят от концентрацията на разтвора. Тези стойности са разгледани по-подробно в таблицата на плътностите. Например, плътността на хлороводородната киселина 10% = 1,048 kg на литър. Когато се втвърди, веществото се образува кристални хидрати
различни композиции.
Химични свойства на солната киселина. С какво реагира солната киселина? Веществото взаимодейства с метали, които стоят пред водорода в поредица от електрохимични потенциали (желязо, магнезий, цинк и други). В този случай се образуват соли и газообразни Х
. Олово, мед, злато, сребро и други метали вдясно от водорода не реагират със солна киселина. Веществото реагира с метални оксиди, произвеждайки вода и разтворима сол. Натриевият хидроксид под действието на к-ти образува и вода. Реакцията на неутрализация е характерна за това съединение.
Разредената солна киселина реагира с метални соли, които се образуват от по-слаби киселини. Например, пропионова киселина
по-слаб от солта. Веществото не реагира с по-силни киселини. и натриев карбонат
ще се образува след реакция с HCl
хлорид, въглероден окис и вода.
За химично съединение са характерни реакции със силни окислители, с манганов диоксид
, калиев перманганат
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. Веществото реагира с амоняк
, който произвежда гъст бял дим, който се състои от много фини кристали амониев хлорид. Минералът пиролузит също реагира със солна киселина, тъй като съдържа манганов диоксид
: MnO2+4HCl=Cl2+MnO2+2H2O
(окислителна реакция).
Има качествена реакция към солната киселина и нейните соли. Когато веществото взаимодейства с сребърен нитрат
бяла утайка сребърен хлорид
и се формира азотна киселина
. Уравнение на реакцията на взаимодействие метиламин
с хлороводород изглежда така: HCl + CH3NH2 = (CH3NH3)Cl
.
Вещество реагира със слаба основа анилин
. След разтваряне на анилина във вода, към сместа се добавя солна киселина. В резултат на това основата се разтваря и образува анилин хидрохлорид
(фениламониев хлорид
): (С6Н5NH3)Cl
. Реакцията на взаимодействие на алуминиев карбид със солна киселина: Al4C3+12HCL=3CH4+4AlCl3
. Реакционно уравнение калиев карбонат
с което изглежда така: K2CO3 + 2HCl = 2KCl + H2O + CO2.
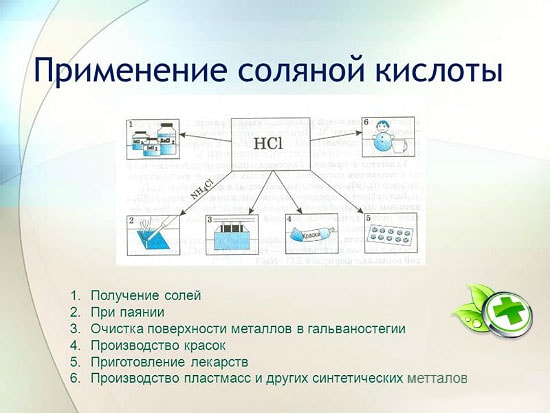
Приложение
в металургията за добив на руди, отстраняване на ръжда, котлен камък, мръсотия и оксиди, запояване и калайдисване;
в производството на синтетични каучуци и смоли;
в галваничното покритие;
като регулатор на киселинността в хранително-вкусовата промишленост;
за получаване на метални хлориди;
за получаване на хлор;
в медицината за лечение на недостатъчна киселинност на стомашния сок;
като почистващо и дезинфектантно средство.
- (HCl), воден разтвор на хлороводород, безцветен газ с остра миризма. Получава се чрез действието на сярна киселина върху готварска сол, като страничен продукт от хлорирането на въглеводороди, или чрез реакцията на водород и хлор. Солната киселина се използва за ... ... Научно-технически енциклопедичен речник
Солна киселина
- - HCl (SC) (солна киселина, солна киселина, хлороводород) е разтвор на хлороводород (HCl) във вода, добавка против замръзване. Това е безцветна течност с остър мирис, без суспендирани частици. ... ... Енциклопедия на термини, дефиниции и обяснения на строителни материали
СОЛНА КИСЕЛИНА
- (солна киселина) разтвор на хлороводород във вода; силна киселина. Безцветна течност, димяща във въздуха (техническата солна киселина е жълтеникава поради примеси от Fe, Cl2 и др.). Максималната концентрация (при 20 ° C) е 38% от масата, ... ... Голям енциклопедичен речник
СОЛНА КИСЕЛИНА
- (Acidum muriaticum, Acid, hydrochloricum), разтвор на хлороводород (HC1) във вода. В природата се среща във водата на определени източници с вулканичен произход, а също и в стомашния сок (до 0,5%). Хлороводород може да се получи ... Голяма медицинска енциклопедия
СОЛНА КИСЕЛИНА
- (солна киселина, солна киселина) силна едноосновна летлива киселина с остър мирис, воден разтвор на хлороводород; максималната концентрация е 38% от масата, плътността на такъв разтвор е 1,19 g/cm3. Използва се в ... ... Руската енциклопедия по охрана на труда
СОЛНА КИСЕЛИНА
- (солна киселина) HCl воден разтвор на хлороводород, силна едноосновна киселина, летлива, с остър мирис; примеси от желязо, хлор го оцветяват в жълтеникаво. Концентрираният S. за продажба съдържа 37% ... ... Голяма политехническа енциклопедия
солна киселина
— съществително, брой синоними: 1 киселина (171) ASIS Synonym Dictionary. В.Н. Тришин. 2013 ... Синонимен речник
СОЛНА КИСЕЛИНА
Съвременна енциклопедия
Солна киселина
- ВОДОРОДНА КИСЕЛИНА, воден разтвор на хлороводород HCl; димяща течност с остра миризма. Солната киселина се използва за получаване на различни хлориди, ецване на метали, обработка на руди, при производството на хлор, сода, каучук и др. ... ... Илюстриран енциклопедичен речник
солна киселина
- (солна киселина), разтвор на хлороводород във вода; силна киселина. Безцветна течност, "димяща" във въздуха (техническата солна киселина е жълтеникава поради примеси от Fe, Cl2 и др.). Максимална концентрация (при 20 ° C) 38% от масата, ... ... Енциклопедичен речник
Каква е опасността от интоксикация
Солната киселина е особена опасност за човешкото тяло. В случай на отравяне с такова вещество могат да се развият сериозни усложнения и нарушения на функционалността на тялото.
усложнения:
- Нарушение на черния дроб в резултат на токсичен хепатит,
- Кървене в стомаха поради разрушените стени на органа,
- Шок от болка, когато киселината навлезе в голяма площ,
- В случай на контакт с очите, зрително увреждане,
- Сериозна неизправност на бъбреците,
- Дихателна недостатъчност, задушаване, задух,
- Развитието на кома.
Подобни последици се развиват постепенно в зависимост от степента на отравяне.
Заключение
Ако спазвате предпазните мерки и правилата за безопасност, солната киселина ще се превърне в незаменим помощник в ежедневието. И можете да го закупите на най-достъпни цени в нашата компания.
Като киселини. Образователната програма предвижда запомняне от учениците на имената и формулите на шестима представители на тази група. И като разглеждате таблицата, предоставена от учебника, забелязвате в списъка с киселини тази, която е на първо място и ви интересува на първо място - солната киселина. Уви, в класната стая в училище не се изучава нито имотът, нито друга информация за него. Затова желаещите да получат знания извън училищната програма търсят допълнителна информация във всевъзможни източници. Но често мнозина не намират необходимата информация. И така темата на днешната статия е посветена именно на тази киселина.
Определение
Солната киселина е силна едноосновна киселина. В някои източници може да се нарече солна и солна вода, както и хлороводород.
Физически свойства
Това е безцветна и димяща каустична течност във въздуха (снимка вдясно). Техническата киселина обаче има жълтеникав цвят поради наличието на желязо, хлор и други добавки в нея. Най-голямата му концентрация при температура от 20 ° C е 38%. Плътността на солната киселина с такива параметри е 1,19 g/cm 3 . Но това съединение в различна степен на насищане има съвсем различни данни.С намаляване на концентрацията числената стойност на моларността, вискозитета и точката на топене намалява, но специфичният топлинен капацитет и точката на кипене се увеличават. Втвърдяването на солна киселина с всякаква концентрация дава различни кристални хидрати.
Химични свойства
Всички метали, които идват преди водорода в електрохимичния ред на тяхното напрежение, могат да взаимодействат с това съединение, образувайки соли и освобождавайки водороден газ. Ако те бъдат заменени с метални оксиди, тогава продуктите на реакцията ще бъдат разтворими сол и вода. Същият ефект ще бъде при взаимодействието на солна киселина с хидроксиди. Ако обаче към него се добави някаква метална сол (например натриев карбонат), чийто остатък е взет от по-слаба киселина (въглеродна), тогава хлорид на този метал (натрий), вода и газ, съответстващи на киселината образуват се остатък (в този случай въглероден диоксид).
Касова бележка
Обсъжданото сега съединение се образува, когато газообразният хлороводород, който може да се получи чрез изгаряне на водород в хлор, се разтваря във вода. Солната киселина, получена по този метод, се нарича синтетична. Отпадъчните газове също могат да служат като източник за получаване на това вещество. И такава солна киселина ще се нарича отработен газ. Напоследък нивото на производство на солна киселина по този метод е много по-високо от производството по синтетичен метод, въпреки че последният дава съединението в по-чиста форма. Това са всички начини да го получите в индустрията. Въпреки това, в лабораториите солната киселина се произвежда по три начина (първите два се различават само по температура и реакционни продукти), като се използват различни видове химични взаимодействия, като например:
- Влияние на наситената сярна киселина върху натриевия хлорид при температура 150 o C.
- Взаимодействието на горните вещества при условия с температура от 550 ° C и повече.
- Хидролиза на алуминиеви или магнезиеви хлориди.
Приложение
Хидрометалургията и електроформоването не могат без използването на солна киселина, където е необходимо, за почистване на повърхността на метали по време на калайдисване и запояване и за получаване на хлориди на манган, желязо, цинк и други метали. В хранително-вкусовата промишленост това съединение е известно като хранителна добавка E507 - там е необходим регулатор на киселинността, за да се направи селцер (сода) вода. Концентрираната солна киселина също се намира в стомашния сок на всеки човек и помага за смилането на храната. При този процес степента му на насищане намалява, т.к. този състав се разрежда с храна. Въпреки това, при продължително гладуване, концентрацията на солна киселина в стомаха постепенно се увеличава. И тъй като това съединение е много каустично, то може да доведе до стомашни язви.
Заключение
Солната киселина може да бъде както полезна, така и вредна за хората. Контактът му с кожата води до появата на тежки химически изгаряния, а изпаренията на това съединение дразнят дихателните пътища и очите.
Но ако боравите внимателно с това вещество, то може да ви бъде полезно повече от веднъж