експлоатация

При ванадиевите батерии и двата референтни електрода са допълнително свързани към резервоари за съхранение и помпи, така че много големи обеми електролит могат да циркулират през клетката. Циркулацията на течен електролит е малко трудна и ограничава използването на ванадиеви батерии в индустрии, изискващи мобилност, което ги прави ефективни в големи стационарни сгради.
Когато ванадиева батерия е заредена, йоните VO2+ в положително заредения референтен електрод се превръщат в йони VO2+, когато електроните се отделят от положителния извод на батерията. По същия начин, в отрицателния референтен електрод, електроните преобразуват V3+ йони във V2+. По време на разреждането този процес се обръща, което води до напрежение на отворена верига от 1,41 V при 25°C.
Други полезни свойства на ванадиевите батерии включват много бърза реакция при промени в натоварването и изключително висок капацитет на претоварване. Изследвания в Университета на Нов Южен Уелс показват, че те могат да постигнат време за реакция от по-малко от половин милисекунда при 100% промени на натоварването и да издържат на 400% претоварване за над 10 секунди. Времето за реакция в повечето случаи е ограничено от електрическото оборудване. Ванадиеви батерии на базата на сярна киселина работят само при температури от 10-40C. Ако температурата е под този диапазон, йони на сярна киселина кристализират. Ефективността на възвратно-постъпателното движение при ежедневна употреба остава на ниво 65-75%.
Характеристики на зареждане и разреждане
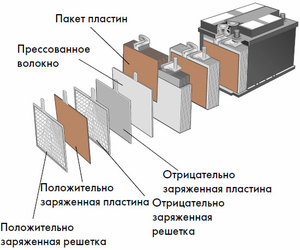
Алгоритмите за зареждане директно зависят от това как е подредена батерията и към какъв тип принадлежи. Например, някои батерии могат безопасно да попълнят капацитета си от източници на постоянно напрежение. Други работят само с регулируем източник на ток, който може да променя параметрите в зависимост от нивото на зареждане.
Неправилно организиран процес на зареждане може да повреди батерията. В екстремни случаи батерията може да се запали или експлодира. Има интелигентни батерии, оборудвани с устройства за наблюдение на напрежението. Основните параметри, които трябва да се вземат предвид при работа с обратими галванични батерии са:
- Продължителност на живота. Дори и при правилно боравене, броят на циклите на зареждане на батерията е ограничен. Различните батерии не винаги се износват по едни и същи причини. Но като цяло животът на батерията е ограничен основно от броя на пълните цикли на зареждане-разреждане и второ от проектния експлоатационен живот без позоваване на интензивността на използване.
- Време за зареждане. Основният дизайн на батерията не предполага зареждане с произволно висока скорост: вътрешното съпротивление на галваничната клетка ще доведе до преобразуване на излишния ток на зареждане в топлина, което може необратимо да повреди устройството. От физическа гледна точка времето за зареждане е ограничено от максималната скорост на дифузия на активния материал през електролита.Опростено можем да приемем, че възстановяването на пълния капацитет за един час е добър индикатор.
- Дълбочина на разтоварване. Посочено като процент от номиналната мощност. Описва използваемия капацитет. За различните типове батерии препоръчителното работно ниво на разреждане може да варира. Поради промени в работата или стареене индикаторът за максимална дълбочина губи първоначалната си стойност.
дифузионен процес.
Благодарение на процеса на дифузия, изравняването на плътността на електролита в кухината на корпуса на батерията и в порите на активната маса на плочите, поляризацията на електрода може да се поддържа в батерията, когато външната верига е изключена.
Скоростта на дифузия директно зависи от температурата на електролита, колкото по-висока е температурата, толкова по-бързо протича процесът и може да варира значително във времето, от два часа до един ден. Наличието на два компонента на електродния потенциал в преходни условия доведе до разделяне на равновесна и неравновесна ЕМП на батерията. Равновесното ЕМП на батерията се влияе от съдържанието и концентрацията на йони на активните вещества в електролита, както и от химичните и физичните свойства на активните вещества. Основната роля в големината на ЕМП играе плътността на електролита и температурата практически не го влияе. Зависимостта на ЕМП от плътността може да се изрази с формулата:
ЕДС на батерията не е равна на напрежението на батерията, което зависи от наличието или отсъствието на натоварване на нейните клеми.
admin25/07/2011
Коментар
име *
Сайт
Този сайт използва Akismet за борба със спама. Разберете как се обработват данните за вашите коментари.
« Механичен тахометър
Напрежение на батерията »
Етикети
ВАЗ, ВАЗ неизправности Сензори запалване инжекторни устройства Стартер схеми Електрически автомобили Захранване ваз 2110 газела газела бизнес регистратори ремонт на автомобили
Последни записи
- Сензори в автомобила: видове и предназначение
- Най-големият в света електрически автомобил EDumper,
- Лазерни светлини.
- Предимства и недостатъци на халогенните лампи
- Устройството и принципът на работа на сензорите за паркиране
Архиви
Архив Изберете септември 2019 г. Август 2017 юли 2017 юни 2017 май 2017 април 2017 Март 2017 г. декември 2016 г. Ноември 2016.10 2016 г. Септември 2016 2016 Mse 2016 April 2016 2016 2016 Apar 2016 April 2016 2016 2016 Apar 2016 Apar 2016 2016 2016 Apar 2016 Apar 2016 Apar 2016 2016 Apar 2016 Apar 2016 Aparth 2016 2016 2016 Apar 2016 ancover 2016 2016 Augars 2015 anture 2015 2016 Aught 2016 2016 ults 2015 2016 Aught 2016 2015 ults 2015 2016 Augars 2016 ults 2015 ac януари 2015 г. декември 2014 г. ноември 2014 г. октомври 2014 г. септември 2014 г. август 2014 г. юли 2014 г. юни 2014 г. май 2014 г. април 2014 г. февруари 2014 г. януари 2014 г. декември 2013 г. ноември 2013 г. октомври 2013 г. 2013 г. 2013 г. 2012, 2012, 2011, 2012, 2011, 2012, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, CHE, 2011, 2011, 2011, 2011, 2011, \ t Септември 2012, 2011, 2011, 2011, 2011, 2011, 2011 г.
Категории
- Акумулаторна батерия
- Видео
- Генератор
- Сензори
- Диагностика
- Запалване
- Новини
- Оборудване
- Устройства
- Ремонт
- Свещ
- Стартер
- Схема
- Устройства
- електрически автомобили
- Захранване
Ние сме в социалните мрежи
Автоелектрик@ Всички права запазени. Когато копирате материали от сайта, трябва да предоставите връзка към сайта.
Устройство и принцип на действие
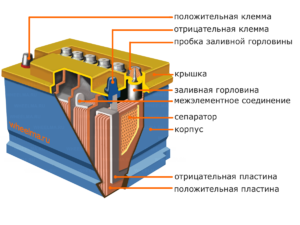
Всяка такава клетка има катод (положителен електрод) и анод (отрицателен). Тези електроди са разделени от електролит, който осигурява обмена на йони между тях. Материалите на електродите и съставът на електролита са избрани така, че да осигурят достатъчна електродвижеща сила между клемите на батерията.
Тъй като електродите съдържат ограничен потенциал от химическа енергия, батерията ще се изтощи по време на работа. Типът галванични елементи, който е пригоден за попълване след частично или пълно разреждане, се нарича батерия. Сглобка от такива взаимосвързани клетки е батерия.Работата на батерията включва циклична промяна на две състояния:
- Зареждане - батерията работи като приемник на електричество, вътре в клетките електрическата енергия се реализира в химически промени.
- Разреждане - устройството функционира като източник на електрически ток, като преобразува енергията на химичните реакции в електрическа енергия.
Области на използване
Характеристиката на ултра високия капацитет на ванадиевите редокс батерии ги прави много подходящи за използване в индустрии, изискващи високо съхранение на енергия. Например, подпомагане на балансирането на обема на производството на такива енергийни източници като вятърна или слънчева, или подпомагане на генераторите да абсорбират големи скокове на енергия, когато е необходимо, или балансиране на предлагането и търсенето на енергия за отдалечени райони.
Ограничените характеристики на саморазреждане на ванадиевите редокс батерии ги правят полезни в индустрии, където батериите трябва да се съхраняват за дълги периоди от време с минимална поддръжка и готовност. Това доведе до използването им в някои видове военна електроника, например в сензорите на минната система GATOR. Способността им да преминават през и да останат на нула ги прави подходящи за соларни приложения и индустрии, където батериите трябва да започват деня празни и да се презареждат в зависимост от натоварването и времето. Например, литиево-йонните батерии често се повреждат, когато им е позволено да се разреждат под 20% от обема си, така че те най-често работят в диапазона от 20 до 100%, което означава, че могат да използват само 20% от номиналния си капацитет.
Изключително бързото им време за реакция също ги прави практически незаменими за непрекъсваеми захранвания, където могат да се използват вместо оловно-киселинни батерии и дори дизелови генератори. Също така бързото време за реакция ги прави подходящи за контрол на честотата. В момента нито UPS, нито мерките за управление на честотата са ефективни сами по себе си, но е вероятно батерията да може да намери приложение в тези индустрии, когато се капитализира от различни източници на финансиране. В допълнение, тези възможности правят ванадиевите редокс батерии ефективно решение за малки енергийни мрежи, които зависят от надеждна работа, контрол на честотата и превключване на натоварването (като високо проникване на възобновяеми енергийни източници, силно флуктуиращи натоварвания или желание за оптимизирайте ефективността на генератора чрез изместване на времето за реакция).
Най-големите работещи ванадиеви редокс батерии
Подстанция "Minami Hyakita":
- Дата на стартиране: декември 2015 г
- Енергия: 60 MWh
- Мощност: 15 MW
- Работно време: 4 часа
- Държава: Япония
Стинки, провинция Ляонин
- Дата на стартиране: N/A
- Енергия: 10 MWh
- Мощност: 5 MW
- Работно време: 2 часа
- Държава: Китай
Вятърен парк Томаме
- Дата на стартиране: 2005 г
- Енергия: 6 MWh
- Мощност: 4 MW
- Работно време: 1 час 30 минути
- Държава: Япония
Проект Джангбей
- Дата на стартиране 2016г
- Енергия: 8 MWh
- Мощност: 2 MW
- Работно време: 4 часа.
- Държава: Китай
Проект SnoPUD MESA 2
- Дата на стартиране: март 2017 г
- Енергия: 8 MWh
- Мощност: 2 MW
- Работно време: 4 часа.
- Държава: САЩ
Подстанция в Ескондидо
- Дата на стартиране: 2017 г
- Енергия: 8 MWh
- Мощност: 2 MW
- Работно време: 4 часа.
- Държава: САЩ
Подстанция в Пулман, Вашингтон
- Дата на стартиране: април 2015 г
- Енергия: 4 MWh
- Мощност: 1 MW
- Работно време: 4 часа
- Държава: САЩ
До 2018 г. се очаква разработването на ванадиева редокс батерия да приключи в Китай. Енергията му ще бъде 800 MWh, мощността - 200 MW, а времето на работа - 4 часа.
Условия
- Последователно – елементите следват един след друг.
- Електродвижещата сила (EMF) е напрежението, генерирано от батерия или магнитна сила в съответствие със закона на Фарадей.
- Паралелно - Електрическите компоненти са подредени така, че токът протича по два или повече пътя.
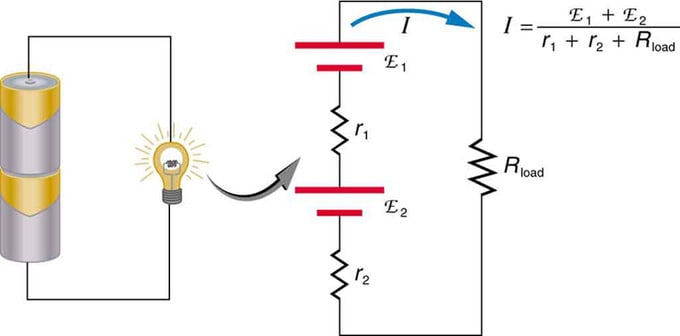
Ако използвате множество източници на напрежение, те могат да бъдат свързани последователно или паралелно. При серийната версия те са настроени в същата посока, вътрешното съпротивление се увеличава и електродвижещата сила се добавя алгебрично. Подобни видове са често срещани в фенерчетата, играчките и различни други уреди. Клетките се поставят последователно, за да се увеличи общата ЕДС.
Серийно свързване на два източника на напрежение в една и съща посока. Диаграмата показва фенер с две клетки и една лампа
Батерия - многократно свързване на волтови елементи. Но има един недостатък в серийното свързване, тъй като се добавят вътрешни съпротивления. Понякога това създава проблеми. Да приемем, че имате две батерии от 6V, които сте поставили вместо обичайните 12V. В резултат на това сте добавили не само EMF, но и вътрешното съпротивление от всяка батерия.
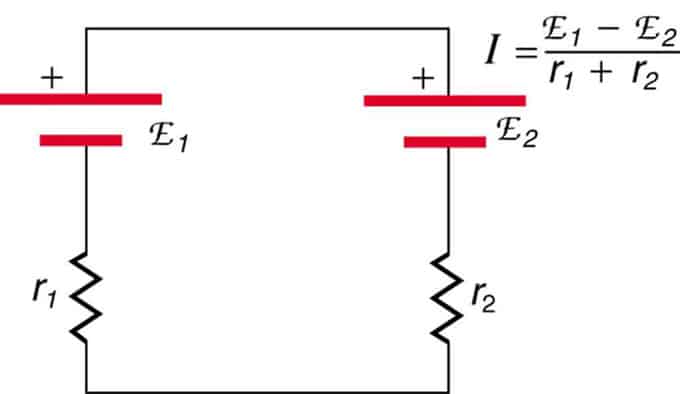
Ако клетките са разположени в опозиция (едната е разположена зад другата), тогава общият ЕМП ще намалее.
Това са два източника на напрежение, свързани последователно с противоположни емисии. Токът протича в посока на по-голяма ЕДС и е ограничен от сумирането на вътрешните съпротивления. Пример е зарядно устройство. Трябва да има повече emf от батерията
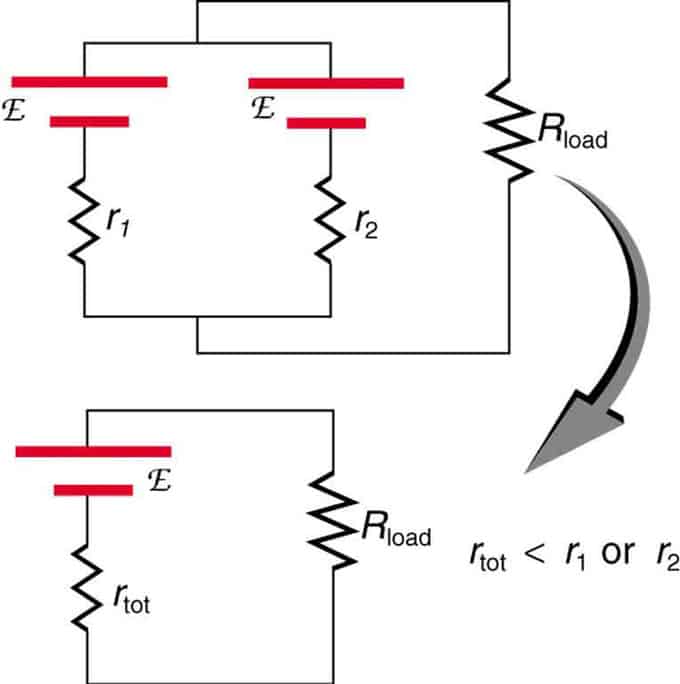
Ако два източника с една и съща електродвижеща сила са разположени успоредно и свързани към съпротивлението на товара, тогава общата ЕДС остава същата като отделните. Общото вътрешно съпротивление обаче ще бъде намалено. Оказва се, че паралелната версия може да генерира повече ток.
Два източника на напрежение с единичен EMF се комбинират в паралелна връзка. Те образуват едно ЕМП, но имат по-малко общо съпротивление, отколкото поотделно. Подобни комбинации се използват, ако трябва да постигнете повече ток.
| Общ преглед |
|
| Паралелно и последователно свързване на резистори |
|
| Правилата на Кирхоф |
|
| Волтметри и амперметри |
|
| RC вериги |
|
Исторически преглед
Разработката на първия галваничен елемент се приписва на италианския физик Алесандро Волта. Той провежда серия от експерименти с електрохимични явления през 1790-те и около 1800 г. създава първата батерия, която съвременниците му наричат "волтаична колона". Устройството се състои от редуващи се цинкови и сребърни дискове, разделени от слоеве хартия или плат, напоени с разтвор на натриев хидроксид.
Тези експерименти станаха основата на работата на Майкъл Фарадей върху количествените закони на електрохимията. Той описва принципа на работа на батерията и въз основа на работата на учения са създадени първите търговски електрически клетки. По-нататъшната еволюция изглеждаше така:
- През 1836 г. британският химик Джон Даниел представя подобрен модел на клетката, състоящ се от медни и цинкови електроди, потопени в солна киселина. Елементът на Даниел успя да осигури постоянно напрежение несравнимо по-ефективно от устройствата на Волт.
- 1839 г По-нататъшен напредък е постигнат от физика Гроув с неговата двутечна клетка, състояща се от цинк, потопен в разредена сярна киселина в порест съд. Последният отделя сярна киселина от съд, съдържащ азотна киселина с поставен платинен катод в него. Азотната киселина служи като окислител за предотвратяване на загуба на напрежение поради натрупване на водород на катода.Германският химик Робърт Бунзен замени платината с евтин въглерод в клетката на Grove и по този начин насърчи широкото приемане на този тип батерии.
- През 1859 г. Гастон Планте изобретява оловно-киселинната клетка, предшественикът на съвременния автомобилен акумулатор. Устройството на Планте е било в състояние да произведе необичайно голям ток, но е било използвано само за експерименти в лаборатории в продължение на почти две десетилетия.
- 1895-1905 години. Изобретяване на никел-кадмиеви и никел-желязо алкални елементи. Това направи възможно създаването на системи със значителен брой цикли заряд-разряд.
- От 30-те години на миналия век започва разработването на сребърно-цинкови и живачно-цинкови алкални батерии, които осигуряват висока енергийна плътност на единица тегло и обем.
- От средата на 20-ти век напредъкът в производствените технологии и навлизането на нови материали доведоха до още по-мощни и компактни батерии. Най-забележително беше въвеждането на пазара на никел-металхидридни и литиеви батерии.
Зареждане на батерии
Основна статия: зарядно устройство
Тъй като химическата енергия се изчерпва, напрежението и токът намаляват и батерията престава да функционира. Можете да зареждате батерията (батерия от батерии) от всеки източник на постоянен ток с по-високо напрежение, като същевременно ограничавате тока. Най-често срещаният е зарядният ток (в ампери), пропорционален на 1/10 от условния номинален капацитет на батерията (в амперчасове).
Въпреки това, въз основа на техническото описание, разпространявано от производителите на широко използвани електрически батерии (NiMH, NiCd), може да се предположи, че този режим на зареждане, обикновено наричан стандартен, се изчислява въз основа на продължителността на осемчасов работен ден, когато батерията, разредена в края на работния ден, се включва към мрежовото зарядно устройство преди началото на нов работен ден. Използването на такъв режим на зареждане за тези видове батерии при системна употреба ви позволява да поддържате баланс между качество и разходи при работата на продукта. Така по предложение на производителя този режим може да се използва само за никел-кадмиеви и никел-метал-хидридни батерии.
Много видове батерии имат различни ограничения, които трябва да се вземат предвид по време на зареждане и последваща употреба, например NiMH батериите са чувствителни към презареждане, литиевите батерии са чувствителни към прекомерно разреждане, напрежение и температура. NiCd и NiMH батериите имат така наречения ефект на паметта, който се състои в намаляване на капацитета, когато се извършва зареждане, когато батерията не е напълно разредена. Също така тези видове батерии имат забележимо саморазреждане, тоест постепенно губят заряд, без да са свързани към товара. За борба с този ефект може да се използва капково презареждане.
Методи за зареждане на батерията
Използват се няколко метода за зареждане на батерии; Обикновено методът на зареждане зависи от типа на батерията.
- Бавно зареждане с постоянен ток
Зареждайте с постоянен ток, пропорционален на 0,1-0,2 от условния номинален капацитет Q за около 15-7 часа, съответно.
Най-дългият и безопасен метод за зареждане. Подходящ за повечето видове батерии.
- бързо зареждане
Зареждайте с постоянен ток, пропорционален на 1/3 Q за около 3-5 часа.
- Ускорен или "делта-V" заряд
Зареждане с начален заряден ток, пропорционален на номиналния номинален капацитет на батерията, при който напрежението на батерията се измерва постоянно и зареждането приключва след пълното зареждане на батерията. Времето за зареждане е около час и половина. Батерията може да прегрее и дори да я унищожи.
- обратно зареждане
Извършва се чрез редуване на дълги импулси на зареждане с къси импулси на разреждане. Обратният метод е най-полезен при зареждане на NiCd и NiMH батерии, които се характеризират с т.нар.н. "ефект на паметта".