Vykořisťování

U vanadových průtokových baterií jsou obě referenční elektrody navíc připojeny k zásobním nádržím a čerpadlům, takže článkem mohou cirkulovat velmi velké objemy elektrolytu. Cirkulace kapalného elektrolytu je poněkud obtížná a omezuje použití vanadových baterií v průmyslových odvětvích vyžadujících mobilitu, což je činí účinnými ve velkých stacionárních budovách.
Když je vanadiová baterie nabitá, ionty VO2+ v kladně nabité referenční elektrodě se změní na ionty VO2+, když se elektrony odpojí od kladné svorky baterie. Podobně v negativní referenční elektrodě elektrony převádějí ionty V3+ na V2+. Během vybíjení je tento proces obrácený a poskytuje napětí naprázdno 1,41 V při 25 °C.
Mezi další užitečné vlastnosti vanadových průtokových baterií patří velmi rychlá reakce na změny zátěže a extrémně vysoká přetížitelnost. Výzkum na University of New South Wales ukázal, že dokážou dosáhnout doby odezvy méně než půl milisekundy při 100% změně zátěže a vydrží 400% přetížení po dobu více než 10 sekund. Doba odezvy je ve většině případů omezena elektrickým zařízením. Vanadové baterie na bázi kyseliny sírové fungují pouze při teplotách 10-40C. Pokud je teplota pod tímto rozmezím, ionty kyseliny sírové krystalizují. Účinnost při vratném pohybu při každodenním používání zůstává na úrovni 65-75%.
Vlastnosti nabíjení a vybíjení
Algoritmy nabíjení přímo závisí na tom, jak je baterie uspořádána a ke kterému typu patří. Některé baterie mohou například bezpečně doplňovat svou kapacitu ze zdrojů konstantního napětí. Jiné pracují pouze s regulovaným zdrojem proudu, který může měnit parametry v závislosti na úrovni nabití.
Nesprávně organizovaný proces nabíjení může poškodit baterii. V extrémních případech se může baterie vznítit nebo explodovat. Existují chytré baterie vybavené zařízeními pro sledování napětí. Hlavní parametry, které je třeba vzít v úvahu při provozu reverzibilních galvanických baterií, jsou:
- Životnost. I při správné manipulaci je počet nabíjecích cyklů pro baterii omezený. Různé systémy baterií se ne vždy opotřebují ze stejných důvodů. Obecně ale platí, že životnost baterie je omezena především počtem cyklů plného nabití-vybití a zadruhé konstrukční životností bez ohledu na intenzitu používání.
- Doba nabíjení. Základní konstrukce baterie neznamená nabíjení libovolně vysokou rychlostí: vnitřní odpor galvanického článku povede k přeměně přebytečného nabíjecího proudu na teplo, které může zařízení nevratně poškodit. Z fyzikálního hlediska je doba nabíjení omezena maximální rychlostí difúze aktivního materiálu elektrolytem.Zjednodušeně můžeme předpokládat, že obnovení plné kapacity za jednu hodinu je dobrým ukazatelem.
- Hloubka výboje. Udává se jako procento jmenovitého výkonu. Popisuje použitelnou kapacitu. U různých typů baterií se může doporučená provozní úroveň vybití lišit. Změnou provozu nebo stárnutím ztrácí ukazatel maximální hloubky svou původní hodnotu.
proces difúze.
Díky procesu difúze, vyrovnání hustoty elektrolytu v dutině pouzdra baterie a v pórech aktivní hmoty desek, může být polarizace elektrod v baterii zachována, když je vnější obvod vypnutý.
Rychlost difúze přímo závisí na teplotě elektrolytu, čím vyšší je teplota, tím rychleji proces probíhá a může se velmi lišit v čase, od dvou hodin až po den. Přítomnost dvou složek elektrodového potenciálu v přechodných podmínkách vedla k rozdělení na rovnovážné a nerovnovážné EMF baterie. Rovnovážné EMP baterie je ovlivněno obsahem a koncentrací iontů aktivních látek v elektrolytu a také chemickými a fyzikálními vlastnostmi aktivních látek. Hlavní roli ve velikosti EMF hraje hustota elektrolytu a teplota ji prakticky neovlivňuje. Závislost EMF na hustotě lze vyjádřit vzorcem:
Emf baterie se nerovná napětí baterie, které závisí na přítomnosti nebo nepřítomnosti zátěže na jejích svorkách.
admin25/07/2011
Komentář
Název *
místo
Tato stránka používá Akismet k boji proti spamu. Zjistěte, jak jsou zpracovávána data vašich komentářů.
« Mechanický tachometr
Napeti baterky "
Tagy
Poruchy VAZ, VAZ Senzory Zapalování Vstřikovací Zařízení Startér Schémata Elektromobily Napájecí zdroj vaz 2110 gazela gazela obchodní registrátoři autoservis
Nedávné záznamy
- Senzory v autě: typy a účel
- Největší elektromobil na světě EDumper,
- Laserová světla.
- Výhody a nevýhody halogenových žárovek
- Zařízení a princip činnosti parkovacích senzorů
Archiv
Archivy Zvolte září 2019 Srpen 2017 Červenec 2017 Červen 2017 Květen 2017 Duben 2017 Březen 2017 Prosinec 2016 Listopad 2016 Říjen 2016 Září 2016 Srpen 2016 Červenec 2016 Červen 2016 květen 2016 Duben 2016 Březen 2016.05.2016 Duben 2016.03.2016 Únor 2016 listopad 2015.03.2015 Únor 2016.11.2015 červen 2015 2015 Srpen 2015 červenec 2015 červen 2015.08.2015 Červenec 2015 červen 2015 května 2015 leden 2015 prosinec 2014 listopad 2014 říjen 2014 září 2014 srpen 2014 červenec 2014 červen 2014 květen 2014 duben 2014 únor 2014 leden 2014 prosinec 2013 listopad 2013 říjen 2013 20. září 2013 12. srpen 2013 12. září 2013 12. 2012, 2012, 2011, 2012, 2011, 2012, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, září 2012, 2011, 2011, 2011, 2011, 2011, 2011
Kategorie
- Akumulátorová baterie
- Video
- Generátor
- Senzory
- Diagnostika
- Zapalování
- zprávy
- Zařízení
- Zařízení
- Opravit
- Zapalovací svíčka
- Startér
- Systém
- Zařízení
- elektrická auta
- Zdroj napájení
Jsme na sociálních sítích
Auto Electrician@ Všechna práva vyhrazena. Při kopírování materiálů webu musíte uvést odkaz na web.
Zařízení a princip činnosti
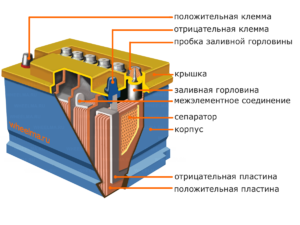
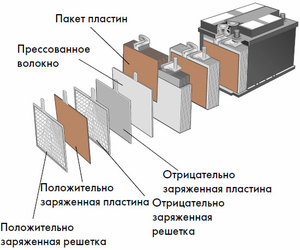
Každý takový článek má katodu (kladnou elektrodu) a anodu (negativní). Tyto elektrody jsou odděleny elektrolytem, který zajišťuje výměnu iontů mezi nimi. Materiály elektrod a složení elektrolytu se volí tak, aby poskytovaly dostatečnou elektromotorickou sílu mezi vývody baterie.
Protože elektrody obsahují omezený potenciál chemické energie, baterie se během provozu vybije. Typ galvanických článků, který je uzpůsoben pro doplňování po částečném nebo úplném vybití, se nazývá baterie. Sestava takto propojených článků je baterie.Provoz na baterie zahrnuje cyklickou změnu dvou stavů:
- Nabíjení - baterie funguje jako přijímač elektřiny, uvnitř článků se elektrická energie realizuje v chemických změnách.
- Vybíjení - zařízení funguje jako zdroj elektrického proudu přeměnou energie chemických reakcí na elektrickou energii.
Oblasti použití
Mimořádně vysoká kapacita charakteristické pro vanadové redoxní baterie je činí dobře vhodnými pro použití v průmyslových odvětvích vyžadujících vysoké skladování energie. Například pomoc při vyrovnávání objemu výroby takových zdrojů energie, jako je větrná nebo solární energie, nebo pomoc generátorům absorbovat velké přepětí v případě potřeby nebo vyrovnávání nabídky a poptávky po energii v odlehlých oblastech.
Omezené samovybíjecí vlastnosti vanadových redoxních baterií je činí užitečnými v průmyslových odvětvích, kde musí být baterie skladovány po dlouhou dobu s minimální údržbou a připraveností. To vedlo k jejich použití v některých typech vojenské elektroniky, například v senzorech těžebního systému GATOR. Jejich schopnost procházet a zůstat na nule je činí vhodnými pro solární aplikace a průmyslová odvětví, kde baterie musí začít den vybité a dobíjet se podle zatížení a počasí. Například lithium-iontové baterie se často poškodí, když se nechají vybít pod 20 % svého objemu, takže nejčastěji pracují v rozsahu 20 až 100 %, což znamená, že mohou využít pouze 20 % své jmenovité kapacity.
Jejich extrémně rychlá doba odezvy je také činí prakticky nepostradatelnými pro nepřerušitelné zdroje napájení, kde je lze použít místo olověných baterií a dokonce i dieselových generátorů. Také díky rychlé době odezvy jsou vhodné pro řízení frekvence. V tuto chvíli nejsou ani UPS, ani opatření pro řízení frekvence samy o sobě efektivní, ale je pravděpodobné, že baterie najde uplatnění v těchto odvětvích, pokud bude kapitalizace z různých zdrojů financování. Tyto schopnosti navíc dělají z vanadových redoxních baterií efektivní „jednodílné“ řešení pro malé rozvodné sítě, které závisí na spolehlivém provozu, frekvenčním řízení a potřebách přepínání zátěže (jako je vysoká penetrace obnovitelných zdrojů, vysoce kolísající zátěže nebo přání optimalizovat účinnost generátoru posunutím doby odezvy).
Největší pracovní vanadové redoxní baterie
Stanice "Minami Hyakita":
- Datum spuštění: prosinec 2015
- Energie: 60 MWh
- Výkon: 15 MW
- Pracovní doba: 4 hodiny
- Země: Japonsko
Smradlavý, provincie Liaoning
- Datum spuštění: N/A
- Energie: 10 MWh
- Výkon: 5 MW
- Pracovní doba: 2 hodiny
- Země: Čína
Větrná farma Tomamae
- Datum uvedení na trh: 2005
- Energie: 6 MWh
- Výkon: 4 MW
- Pracovní doba: 1 hodina 30 minut
- Země: Japonsko
Projekt Zhangbei
- Datum spuštění 2016
- Energie: 8 MWh
- Výkon: 2 MW
- Pracovní doba: 4 hodiny.
- Země: Čína
Projekt SnoPUD MESA 2
- Datum spuštění: březen 2017
- Energie: 8 MWh
- Výkon: 2 MW
- Pracovní doba: 4 hodiny.
- Země: USA
Stanice v Escondido
- Datum spuštění: 2017
- Energie: 8 MWh
- Výkon: 2 MW
- Pracovní doba: 4 hodiny.
- Země: USA
Rozvodna v Pullman, Washington
- Datum spuštění: duben 2015
- Energie: 4 MWh
- Výkon: 1 MW
- Pracovní doba: 4 hodiny
- Země: USA
Do roku 2018 se očekává dokončení vývoje vanadové redoxní baterie v Číně. Jeho energie bude 800 MWh, výkon - 200 MW a doba provozu - 4 hodiny.
Podmínky
- Sekvenční - prvky následují jeden po druhém.
- Elektromotorická síla (EMF) je napětí generované baterií nebo magnetickou silou v souladu s Faradayovým zákonem.
- Paralelní - Elektrické součástky jsou uspořádány tak, že proud protéká dvěma nebo více cestami.
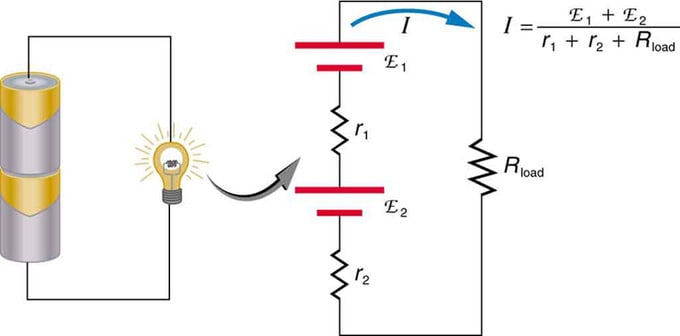
Pokud používáte více zdrojů napětí, mohou být zapojeny sériově nebo paralelně. U sériové verze jsou naladěny stejným směrem, vnitřní odpor je plusový a elektromotorická síla se přidává algebraicky. Podobné typy jsou běžné u baterek, hraček a řady dalších spotřebičů. Buňky jsou umístěny v sérii, aby se zvýšilo celkové emf.
Sériové připojení dvou zdrojů napětí ve stejném směru. Schéma ukazuje lucernu se dvěma články a jednou lampou
Baterie - vícenásobné zapojení voltových prvků. V sériovém zapojení je ale jedna nevýhoda, protože se přidávají vnitřní odpory. Někdy to vytváří problémy. Řekněme, že máte dvě 6V baterie, které vložíte místo obvyklých 12V. V důsledku toho jste přidali nejen EMF, ale také vnitřní odpor z každé baterie.
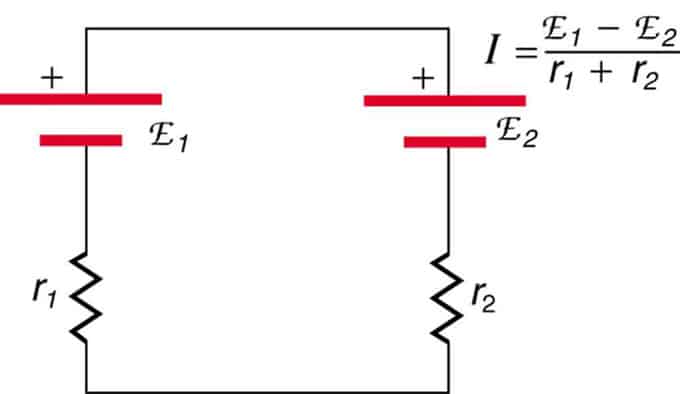
Pokud jsou buňky umístěny v opozici (jedna je umístěna za druhou), pak se celkové emf sníží.
Jedná se o dva zdroje napětí zapojené do série s opačnými emisemi. Proud teče ve směru většího EMF a je omezen součtem vnitřních odporů. Příkladem je nabíječka. Musí mít více emf než baterie
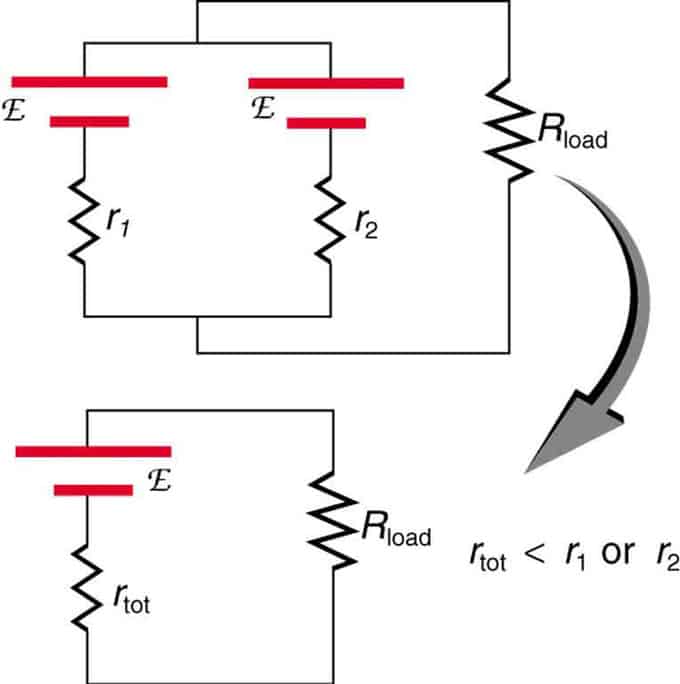
Pokud jsou dva zdroje se stejnou elektromotorickou silou umístěny paralelně a připojeny k zatěžovacímu odporu, pak celkové EMF zůstává stejné jako u jednotlivých. Celkový vnitřní odpor se však sníží. Ukazuje se, že paralelní verze může generovat více proudu.
Dva zdroje napětí s jedním EMF jsou kombinovány v paralelním zapojení. Tvoří jeden EMF, ale mají menší celkový odpor než jednotlivě. Podobné kombinace se používají, pokud potřebujete dosáhnout většího proudu.
| Přehled |
|
| Paralelní a sériové zapojení rezistorů |
|
| Kirchhoff pravidla |
|
| Voltmetry a ampérmetry |
|
| RC obvody |
|
Historický přehled
O vývoj prvního galvanického článku se zasloužil italský fyzik Alessandro Volta. V 90. letech 18. století provedl řadu experimentů s elektrochemickými jevy a kolem roku 1800 vytvořil první baterii, kterou jeho současníci nazývali „voltaický sloup“. Zařízení sestávalo ze střídajících se zinkových a stříbrných kotoučů oddělených vrstvami papíru nebo látky, které byly namočené v roztoku hydroxidu sodného.
Tyto experimenty se staly základem pro práci Michaela Faradaye o kvantitativních zákonech elektrochemie. Popsal princip fungování baterie a na základě práce vědce vznikly první komerční elektrické články. Další vývoj vypadal takto:
- V roce 1836 představil britský chemik John Daniel vylepšený model článku, sestávající z měděných a zinkových elektrod ponořených do kyseliny chlorovodíkové. Danielův prvek dokázal zajistit konstantní napětí nesrovnatelně efektivněji než Voltovy přístroje.
- 1839 Další pokrok udělal fyzik Grove se svým dvoutekutinovým článkem, tvořeným zinkem ponořeným do zředěné kyseliny sírové v porézní nádobě. Ten oddělil kyselinu sírovou z nádoby obsahující kyselinu dusičnou s platinovou katodou. Kyselina dusičná sloužila jako oxidační činidlo, aby se zabránilo ztrátě napětí v důsledku akumulace vodíku na katodě.Německý chemik Robert Bunsen nahradil v článku Grove platinu levným uhlíkem a tím podpořil široké přijetí tohoto typu baterie.
- V roce 1859 Gaston Plante vynalezl olověný článek, předchůdce moderních autobaterií. Planteho zařízení bylo schopno produkovat neobvykle velký proud, ale téměř dvě desetiletí sloužilo pouze k experimentům v laboratořích.
- 1895-1905 let. Vynález alkalických prvků nikl-kadmium a nikl-železo. To umožnilo vytvořit systémy se značným počtem cyklů nabíjení-vybíjení.
- Od 30. let 20. století začal vývoj stříbrno-zinkových a rtuť-zinkových alkalických baterií, které poskytovaly vysokou hustotu energie na jednotku hmotnosti a objemu.
- Od poloviny 20. století vedly pokroky ve výrobní technologii a nástup nových materiálů k ještě výkonnějším a kompaktnějším bateriím. Nejpozoruhodnější bylo uvedení nikl-metal hydridových a lithiových baterií na trh.
Nabíjení baterií
Hlavní článek: Nabíječka
S vyčerpáním chemické energie klesá napětí a proud a baterie přestává fungovat. Baterii (baterii baterií) můžete nabíjet z libovolného stejnosměrného zdroje s vyšším napětím při omezení proudu. Nejběžnější je nabíjecí proud (v ampérech), úměrný 1/10 podmíněné jmenovité kapacity baterie (v ampérhodinách).
Na základě technického popisu distribuovaného výrobci široce používaných elektrobaterií (NiMH, NiCd) lze však předpokládat, že tento režim nabíjení, běžně označovaný jako Standard, se vypočítává na základě délky osmihodinového pracovního dne, kdy se baterie vybitá na konci pracovního dne připojí k síťové nabíječce před začátkem nového pracovního dne. Použití takového režimu nabíjení pro tyto typy baterií se systematickým používáním umožňuje udržovat rovnováhu mezi kvalitou a náklady při provozu produktu. Na návrh výrobce lze tedy tento režim použít pouze pro nikl-kadmiové a nikl-metal hydridové baterie.
Mnoho typů baterií má různá omezení, se kterými je nutné počítat při nabíjení a následném používání, například NiMH baterie jsou citlivé na přebíjení, lithiové baterie jsou citlivé na přebití, napětí a teplotu. Baterie NiCd a NiMH mají tzv. paměťový efekt, který spočívá v poklesu kapacity při nabíjení, kdy baterie není zcela vybitá. Také tyto typy baterií mají znatelné samovybíjení, to znamená, že postupně ztrácejí náboj, aniž by byly připojeny k zátěži. Pro boj s tímto efektem lze použít kapkové dobíjení.
Způsoby nabíjení baterie
K nabíjení baterií se používá několik metod; Obecně platí, že způsob nabíjení závisí na typu baterie.
- Pomalé stejnosměrné nabíjení
Nabíjejte stejnosměrným proudem úměrným 0,1-0,2 podmíněné jmenovité kapacity Q po dobu asi 15-7 hodin, resp.
Nejdelší a nejbezpečnější způsob nabíjení. Vhodné pro většinu typů baterií.
- rychlé nabíjení
Nabíjejte stejnosměrným proudem úměrným 1/3 Q po dobu asi 3-5 hodin.
- Zrychlené nebo "delta-V" nabíjení
Nabíjení s počátečním nabíjecím proudem úměrným jmenovité kapacitě baterie, při kterém se neustále měří napětí baterie a nabíjení končí po úplném nabití baterie. Doba nabíjení je asi hodinu a půl. Baterie se může přehřát a dokonce ji zničit.
- reverse charge
Provádí se střídáním dlouhých nabíjecích impulsů s krátkými vybíjecími impulsy. Reverzní metoda je nejužitečnější pro nabíjení NiCd a NiMH akumulátorů, které se vyznačují tkz.n. „paměťový efekt“.