Μέθοδοι παραγωγής υδρογόνου σε βιομηχανικές συνθήκες
Εκχύλιση με μετατροπή μεθανίου
. Το εξατμισμένο νερό, προθερμασμένο στους 1000 βαθμούς Κελσίου, αναμιγνύεται με μεθάνιο υπό πίεση και παρουσία καταλύτη. Αυτή η μέθοδος είναι ενδιαφέρουσα και αποδεδειγμένη, πρέπει επίσης να σημειωθεί ότι βελτιώνεται συνεχώς: βρίσκεται σε εξέλιξη αναζήτηση νέων καταλυτών που είναι φθηνότεροι και πιο αποτελεσματικοί.
Εξετάστε την πιο αρχαία μέθοδο απόκτησης υδρογόνου - αεριοποίηση άνθρακα
. Σε περίπτωση απουσίας πρόσβασης αέρα και θερμοκρασίας 1300 βαθμών Κελσίου, θερμαίνονται ο άνθρακας και οι υδρατμοί. Έτσι, το υδρογόνο εκτοπίζεται από το νερό και λαμβάνεται διοξείδιο του άνθρακα (το υδρογόνο θα βρίσκεται στην κορυφή, το διοξείδιο του άνθρακα, που λαμβάνεται επίσης ως αποτέλεσμα της αντίδρασης, θα είναι στο κάτω μέρος). Αυτός θα είναι ο διαχωρισμός του μείγματος αερίων, όλα είναι πολύ απλά.
Λήψη υδρογόνου από ηλεκτρόλυση νερού
θεωρείται η πιο εύκολη επιλογή. Για την εφαρμογή του, είναι απαραίτητο να χύσετε ένα διάλυμα σόδας στο δοχείο και επίσης να τοποθετήσετε δύο ηλεκτρικά στοιχεία εκεί. Το ένα θα είναι θετικά φορτισμένο (άνοδος) και το άλλο αρνητικά (κάθοδος). Όταν εφαρμόζεται ρεύμα, το υδρογόνο θα πάει στην κάθοδο και το οξυγόνο στην άνοδο.
Λήψη υδρογόνου σύμφωνα με τη μέθοδο μερική οξείδωση
. Για αυτό, χρησιμοποιείται ένα κράμα αλουμινίου και γαλλίου. Τοποθετείται σε νερό, το οποίο οδηγεί στο σχηματισμό υδρογόνου και οξειδίου του αργιλίου κατά την αντίδραση. Το γάλλιο είναι απαραίτητο για να πραγματοποιηθεί πλήρως η αντίδραση (αυτό το στοιχείο δεν θα επιτρέψει στο αλουμίνιο να οξειδωθεί πρόωρα).
Πρόσφατα απέκτησε συνάφεια μέθοδος χρήσης βιοτεχνολογιών
: υπό την προϋπόθεση της έλλειψης οξυγόνου και θείου, η χλαμυδομόνα αρχίζει να απελευθερώνει εντατικά υδρογόνο. Ένα πολύ ενδιαφέρον αποτέλεσμα, το οποίο τώρα μελετάται ενεργά.
Μην ξεχνάτε μια άλλη παλιά, αποδεδειγμένη μέθοδο παραγωγής υδρογόνου, η οποία είναι η χρήση διαφορετικών αλκαλικά στοιχεία
και νερό. Καταρχήν, αυτή η τεχνική είναι εφικτή σε εργαστηριακές συνθήκες με τα απαραίτητα μέτρα ασφαλείας. Έτσι, κατά τη διάρκεια της αντίδρασης (προχωρά όταν θερμαίνεται και με καταλύτες), σχηματίζεται οξείδιο μετάλλου και υδρογόνο. Μένει μόνο να το συλλέξουμε.
Πάρτε υδρογόνο με αλληλεπιδράσεις νερού και μονοξειδίου του άνθρακα
είναι δυνατή μόνο σε βιομηχανικό περιβάλλον. Σχηματίζονται διοξείδιο του άνθρακα και υδρογόνο, η αρχή του διαχωρισμού τους περιγράφεται παραπάνω.
Η ΕΦΕΥΡΕΣΗ ΕΧΕΙ ΤΑ ΠΑΡΑΚΑΤΩ ΠΛΕΟΝΕΚΤΗΜΑΤΑ
Η θερμότητα που λαμβάνεται από την οξείδωση των αερίων μπορεί να χρησιμοποιηθεί απευθείας επί τόπου και το υδρογόνο και το οξυγόνο λαμβάνονται από τη διάθεση του ατμού των καυσαερίων και του νερού επεξεργασίας.
Χαμηλή κατανάλωση νερού κατά την παραγωγή ηλεκτρικής ενέργειας και θερμότητας.
Η απλότητα της μεθόδου.
Σημαντική εξοικονόμηση ενέργειας, όπως δαπανάται μόνο για το ζέσταμα του εκκινητή σε ένα σταθερό θερμικό καθεστώς.
Υψηλή παραγωγικότητα διαδικασίας, γιατί Η διάσταση των μορίων του νερού διαρκεί δέκατα του δευτερολέπτου.
Έκρηξη και πυρασφάλεια της μεθόδου, γιατί στην εφαρμογή του, δεν υπάρχει ανάγκη για δεξαμενές για τη συλλογή υδρογόνου και οξυγόνου.
Κατά τη λειτουργία της εγκατάστασης, το νερό καθαρίζεται επανειλημμένα, μετατρέποντας σε απεσταγμένο νερό. Αυτό εξαλείφει τη βροχόπτωση και την κλίμακα, γεγονός που αυξάνει τη διάρκεια ζωής της εγκατάστασης.
Η εγκατάσταση είναι κατασκευασμένη από συνηθισμένο χάλυβα. με εξαίρεση τους λέβητες από ανθεκτικούς στη θερμότητα χάλυβες με επένδυση και θωράκιση των τοίχων τους. Δηλαδή δεν απαιτούνται ειδικά ακριβά υλικά.
Η εφεύρεση μπορεί να βρει εφαρμογή σε
βιομηχανία με την αντικατάσταση των υδρογονανθράκων και των πυρηνικών καυσίμων σε σταθμούς ηλεκτροπαραγωγής με φθηνό, ευρέως διαδεδομένο και φιλικό προς το περιβάλλον νερό, διατηρώντας παράλληλα την ισχύ αυτών των σταθμών.
ΑΠΑΙΤΗΣΗ
Μέθοδος παραγωγής υδρογόνου και οξυγόνου από υδρατμούς
, που περιλαμβάνει τη διέλευση αυτού του ατμού μέσω ενός ηλεκτρικού πεδίου, που χαρακτηρίζεται από το ότι χρησιμοποιείται υπερθερμασμένος υδρατμός με θερμοκρασία 500 - 550 o C
, διέρχεται από ένα ηλεκτρικό πεδίο συνεχούς ρεύματος υψηλής τάσης για να διαχωρίσει τον ατμό και να τον χωρίσει σε άτομα υδρογόνου και οξυγόνου.
Ήθελα να κάνω κάτι τέτοιο εδώ και πολύ καιρό. Αλλά περαιτέρω πειράματα με μια μπαταρία και ένα ζεύγος ηλεκτροδίων δεν έφτασαν. Ήθελα να φτιάξω μια πλήρη συσκευή για την παραγωγή υδρογόνου, σε ποσότητες για να φουσκώσει το μπαλόνι. Πριν φτιάξετε μια πλήρη συσκευή για ηλεκτρόλυση νερού στο σπίτι, αποφάσισα να ελέγξω τα πάντα στο μοντέλο.
Το γενικό σχήμα του ηλεκτρολύτη μοιάζει με αυτό.
Αυτό το μοντέλο δεν είναι κατάλληλο για πλήρη καθημερινή χρήση. Όμως η ιδέα δοκιμάστηκε.
Έτσι, για τα ηλεκτρόδια, αποφάσισα να χρησιμοποιήσω γραφίτη. Μια εξαιρετική πηγή γραφίτη για ηλεκτρόδια είναι ο συλλέκτης ρεύματος τρόλεϊ. Υπάρχουν πολλά από αυτά ξαπλωμένα στις τελευταίες στάσεις. Πρέπει να θυμόμαστε ότι ένα από τα ηλεκτρόδια θα καταστραφεί.
Πριόνισμα και φινίρισμα με λίμα. Η ένταση της ηλεκτρόλυσης εξαρτάται από την ισχύ του ρεύματος και την περιοχή των ηλεκτροδίων.
Τα καλώδια συνδέονται στα ηλεκτρόδια. Τα καλώδια πρέπει να είναι προσεκτικά μονωμένα.
Τα πλαστικά μπουκάλια είναι αρκετά κατάλληλα για το σώμα του μοντέλου ηλεκτρολύτη. Γίνονται τρύπες στο καπάκι για σωλήνες και σύρματα.
Όλα επικαλύπτονται προσεκτικά με σφραγιστικό.
Οι κομμένοι λαιμοί μπουκαλιών είναι κατάλληλοι για τη σύνδεση δύο δοχείων.
Πρέπει να συνδεθούν μεταξύ τους και να λιώσουν τη ραφή.
Οι ξηροί καρποί κατασκευάζονται από καπάκια μπουκαλιών.
Στο κάτω μέρος δύο μπουκαλιών γίνονται τρύπες. Όλα συνδέονται και γεμίζονται προσεκτικά με στεγανωτικό.
Θα χρησιμοποιήσουμε ένα οικιακό δίκτυο 220V ως πηγή τάσης. Θέλω να σας προειδοποιήσω ότι αυτό είναι ένα αρκετά επικίνδυνο παιχνίδι. Έτσι, εάν δεν υπάρχουν επαρκείς δεξιότητες ή υπάρχουν αμφιβολίες, τότε είναι καλύτερα να μην επαναλάβετε. Στο οικιακό δίκτυο έχουμε εναλλασσόμενο ρεύμα, για ηλεκτρόλυση πρέπει να ισιώσει. Μια γέφυρα διόδου είναι ιδανική για αυτό. Αυτό στη φωτογραφία δεν ήταν αρκετά δυνατό και γρήγορα κάηκε. Η καλύτερη επιλογή ήταν η κινεζική γέφυρα διόδου MB156 σε θήκη αλουμινίου.
Η γέφυρα διόδου θερμαίνεται πολύ. Απαιτεί ενεργή ψύξη. Ένα ψυγείο για έναν επεξεργαστή υπολογιστή θα ταιριάζει τέλεια. Για τη θήκη, μπορείτε να χρησιμοποιήσετε ένα κουτί συγκόλλησης κατάλληλου μεγέθους. Πωλείται σε ηλεκτρικά είδη.
Κάτω από τη γέφυρα διόδου είναι απαραίτητο να τοποθετήσετε πολλά στρώματα χαρτονιού.
Στο καπάκι του κουτιού συγκόλλησης γίνονται οι απαραίτητες τρύπες.
Έτσι μοιάζει η συναρμολογημένη μονάδα. Ο ηλεκτρολύτης τροφοδοτείται από το δίκτυο, ο ανεμιστήρας από μια γενική πηγή ρεύματος. Ένα διάλυμα μαγειρικής σόδας χρησιμοποιείται ως ηλεκτρολύτης. Εδώ πρέπει να θυμόμαστε ότι όσο μεγαλύτερη είναι η συγκέντρωση του διαλύματος, τόσο μεγαλύτερη είναι η ταχύτητα αντίδρασης. Αλλά ταυτόχρονα, η θέρμανση είναι υψηλότερη. Επιπλέον, η αντίδραση της αποσύνθεσης νατρίου στην κάθοδο θα συμβάλει στη θέρμανση. Αυτή η αντίδραση είναι εξώθερμη. Ως αποτέλεσμα, θα σχηματιστεί υδρογόνο και υδροξείδιο του νατρίου.
Η συσκευή στην παραπάνω φωτογραφία ήταν πολύ ζεστή. Έπρεπε να σβήνει περιοδικά και να περιμένει μέχρι να κρυώσει. Το πρόβλημα με τη θέρμανση λύθηκε εν μέρει με την ψύξη του ηλεκτρολύτη. Για αυτό, χρησιμοποίησα μια επιτραπέζια αντλία σιντριβάνι. Ένας μακρύς σωλήνας περνά από το ένα μπουκάλι στο άλλο μέσω μιας αντλίας και ενός κουβά με κρύο νερό.
Η συνάφεια αυτού του ζητήματος σήμερα είναι αρκετά υψηλή λόγω του γεγονότος ότι το εύρος της χρήσης του υδρογόνου είναι εξαιρετικά εκτεταμένο και στην καθαρή του μορφή πρακτικά δεν βρίσκεται πουθενά στη φύση. Αυτός είναι ο λόγος για τον οποίο έχουν αναπτυχθεί διάφορες μέθοδοι για την εξαγωγή αυτού του αερίου από άλλες ενώσεις μέσω χημικών και φυσικών αντιδράσεων. Αυτό είναι που συζητείται σε αυτό το άρθρο.
Παραγωγή υδρογόνου στο νοικοκυριό
Επιλογή ηλεκτρολυτικού στοιχείου
Για να αποκτήσετε ένα στοιχείο του σπιτιού, χρειάζεται μια ειδική συσκευή - μια συσκευή ηλεκτρολύτη.Υπάρχουν πολλές επιλογές για τέτοιο εξοπλισμό στην αγορά, οι συσκευές προσφέρονται τόσο από γνωστές εταιρείες τεχνολογίας όσο και από μικρούς κατασκευαστές. Οι επώνυμες μονάδες είναι πιο ακριβές, αλλά η ποιότητα κατασκευής τους είναι υψηλότερη.
Η οικιακή συσκευή είναι μικρή σε μέγεθος και εύκολη στη χρήση. Οι κύριες λεπτομέρειες του είναι:
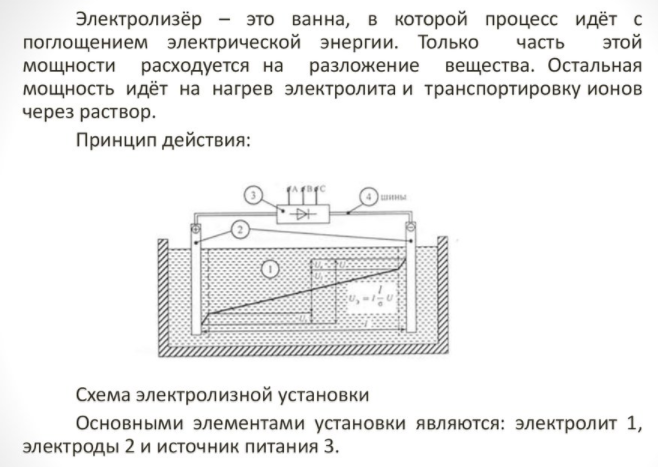
- αναμορφωτής;
- σύστημα καθαρισμού?
- Κυψέλες καυσίμου?
- εξοπλισμός συμπιεστή?
- δεξαμενή αποθήκευσης υδρογόνου.
Το απλό νερό της βρύσης λαμβάνεται ως πρώτη ύλη και η ηλεκτρική ενέργεια προέρχεται από μια συνηθισμένη πρίζα. Οι ηλιακές μονάδες εξοικονομούν ηλεκτρική ενέργεια.
Το «οικιακό» υδρογόνο χρησιμοποιείται σε συστήματα θέρμανσης ή μαγειρέματος. Εμπλουτίζουν επίσης το μείγμα αέρα-καυσίμου για να αυξήσουν την ισχύ των κινητήρων των αυτοκινήτων.
Φτιάχνοντας τη συσκευή με τα χέρια σας
Είναι ακόμη φθηνότερο να φτιάξετε τη συσκευή μόνοι σας στο σπίτι. Ένα ξηρό στοιχείο μοιάζει με ένα σφραγισμένο δοχείο, το οποίο αποτελείται από δύο πλάκες ηλεκτροδίων σε ένα δοχείο με ένα ηλεκτρολυτικό διάλυμα. Το World Wide Web προσφέρει μια ποικιλία σχεδίων για τη συναρμολόγηση συσκευών διαφορετικών μοντέλων:
- με δύο φίλτρα?
- με την επάνω ή την κάτω διάταξη του δοχείου.
- με δυο τρεις βαλβίδες?
- με γαλβανισμένη σανίδα?
- στα ηλεκτρόδια.
Είναι εύκολο να δημιουργηθεί μια απλή συσκευή για την παραγωγή υδρογόνου. Θα απαιτήσει:
- φύλλο ανοξείδωτου χάλυβα?
- διαφανής σωλήνας?
- Εξαρτήματα?
- πλαστικό δοχείο (1,5 l);
- φίλτρο νερού και βαλβίδα ελέγχου.
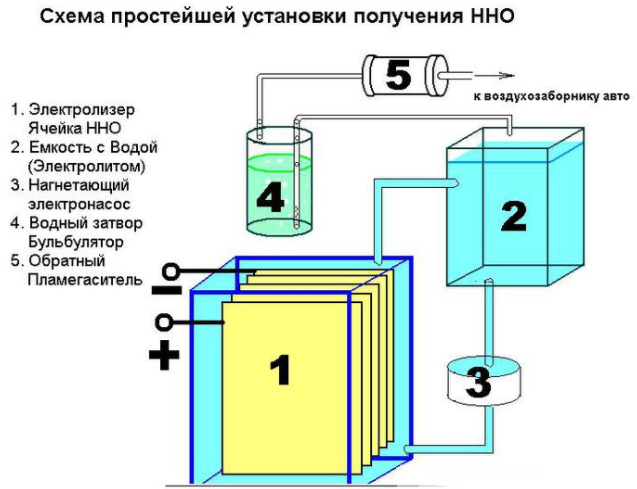
Επιπλέον, θα χρειαστούν διάφορα υλικά: παξιμάδια, ροδέλες, μπουλόνια. Πρώτα απ 'όλα, πρέπει να κόψετε το φύλλο σε 16 τετράγωνα διαμερίσματα, να κόψετε μια γωνία από καθένα από αυτά. Στην αντίθετη γωνία από αυτό, απαιτείται να τρυπήσετε μια τρύπα για να βιδώσετε τις πλάκες. Για να εξασφαλιστεί σταθερό ρεύμα, οι πλάκες πρέπει να συνδέονται σύμφωνα με το σχήμα: συν-πλην-συν-πλην. Αυτά τα μέρη είναι απομονωμένα μεταξύ τους με σωλήνα και στη σύνδεση με μπουλόνι και ροδέλες (τρία κομμάτια μεταξύ των πλακών). 8 πιάτα τοποθετούνται στα συν και πλην.
Με σωστή συναρμολόγηση, οι άκρες των πλακών δεν θα αγγίζουν τα ηλεκτρόδια. Τα συλλεγμένα μέρη κατεβαίνουν σε ένα πλαστικό δοχείο. Στο σημείο που εφάπτονται οι τοίχοι, γίνονται δύο οπές στερέωσης με μπουλόνια. Τοποθετήστε μια βαλβίδα ασφαλείας για να αφαιρέσετε το υπερβολικό αέριο. Τα εξαρτήματα τοποθετούνται στο καπάκι του δοχείου και οι ραφές σφραγίζονται με σιλικόνη.
Δοκιμή συσκευής
Για να ελέγξετε τη συσκευή, εκτελέστε διάφορες ενέργειες:
- Γεμίστε με υγρό.
- Καλύπτοντας με ένα καπάκι, συνδέστε το ένα άκρο του σωλήνα στο εξάρτημα.
- Το δεύτερο κατεβαίνει στο νερό.
- Συνδέστε σε πηγή ρεύματος.
Αφού συνδέσετε τη συσκευή στην πρίζα, μετά από λίγα δευτερόλεπτα, η διαδικασία ηλεκτρόλυσης και η καθίζηση θα είναι αισθητές.
Το καθαρό νερό δεν έχει καλή ηλεκτρική αγωγιμότητα. Για να βελτιώσετε αυτόν τον δείκτη, πρέπει να δημιουργήσετε ένα ηλεκτρολυτικό διάλυμα με την προσθήκη αλκαλίου - υδροξειδίου του νατρίου. Είναι σε συνθέσεις καθαρισμού σωλήνων όπως το "Mole".
Μέθοδοι παραγωγής υδρογόνου
Το υδρογόνο είναι ένα άχρωμο και άοσμο αέριο στοιχείο με πυκνότητα 1/14 σε σχέση με τον αέρα. Σπάνια βρίσκεται σε ελεύθερη κατάσταση. Συνήθως το υδρογόνο συνδυάζεται με άλλα χημικά στοιχεία: οξυγόνο, άνθρακα.
Η παραγωγή υδρογόνου για βιομηχανικές ανάγκες και ενέργεια πραγματοποιείται με διάφορες μεθόδους. Τα πιο δημοφιλή είναι:
- ηλεκτρόλυση νερού?
- μέθοδος συγκέντρωσης;
- συμπύκνωση χαμηλής θερμοκρασίας.
- προσρόφηση.
Το υδρογόνο μπορεί να απομονωθεί όχι μόνο από ενώσεις αερίου ή νερού. Το υδρογόνο παράγεται με την έκθεση του ξύλου και του άνθρακα σε υψηλές θερμοκρασίες, καθώς και με την επεξεργασία βιοαποβλήτων.
Το ατομικό υδρογόνο για ηλεκτρομηχανική λαμβάνεται με τη μέθοδο της θερμικής διάστασης μιας μοριακής ουσίας σε ένα σύρμα από πλατίνα, βολφράμιο ή παλλάδιο. Θερμαίνεται σε περιβάλλον υδρογόνου σε πίεση μικρότερη από 1,33 Pa.Τα ραδιενεργά στοιχεία χρησιμοποιούνται επίσης για την παραγωγή υδρογόνου.
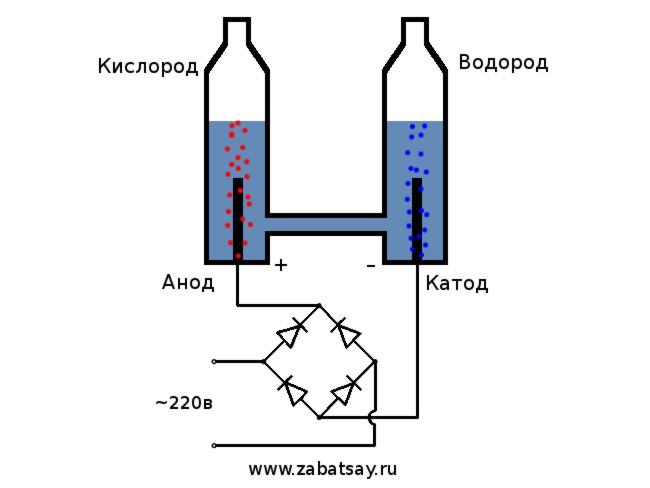
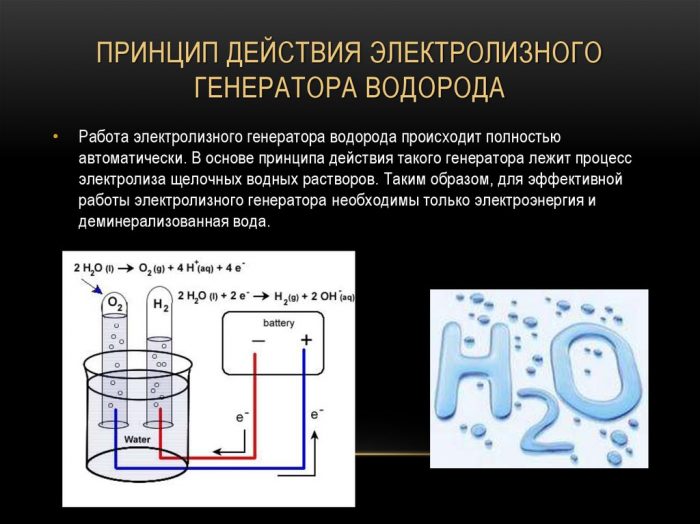
μέθοδος ηλεκτρόλυσης
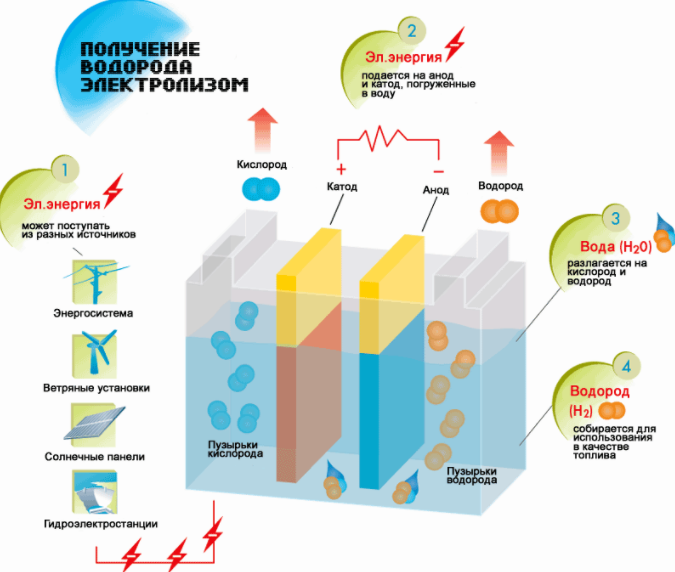
Η απλούστερη και πιο δημοφιλής μέθοδος εξαγωγής υδρογόνου είναι η ηλεκτρόλυση νερού. Επιτρέπει τη λήψη πρακτικά καθαρού υδρογόνου. Άλλα πλεονεκτήματα αυτής της μεθόδου είναι:
- διαθεσιμότητα πρώτων υλών·
- λήψη ενός στοιχείου υπό πίεση.
- η δυνατότητα αυτοματοποίησης της διαδικασίας λόγω έλλειψης κινούμενων μερών.
Η διαδικασία για τη διάσπαση ενός υγρού με ηλεκτρόλυση είναι η αντίστροφη της καύσης του υδρογόνου. Η ουσία του είναι ότι υπό την επίδραση συνεχούς ρεύματος, οξυγόνο και υδρογόνο απελευθερώνονται σε ηλεκτρόδια που βυθίζονται σε ένα υδατικό διάλυμα ηλεκτρολύτη.
Επιπλέον πλεονέκτημα είναι η παραγωγή υποπροϊόντων με βιομηχανική αξία. Έτσι, το οξυγόνο σε μεγάλο όγκο είναι απαραίτητο για την κατάλυση τεχνολογικών διεργασιών στον ενεργειακό τομέα, τον καθαρισμό του εδάφους και των υδάτινων σωμάτων και τη διάθεση των οικιακών απορριμμάτων. Το βαρύ νερό που παράγεται με ηλεκτρόλυση χρησιμοποιείται στη βιομηχανία ηλεκτρικής ενέργειας σε πυρηνικούς αντιδραστήρες.
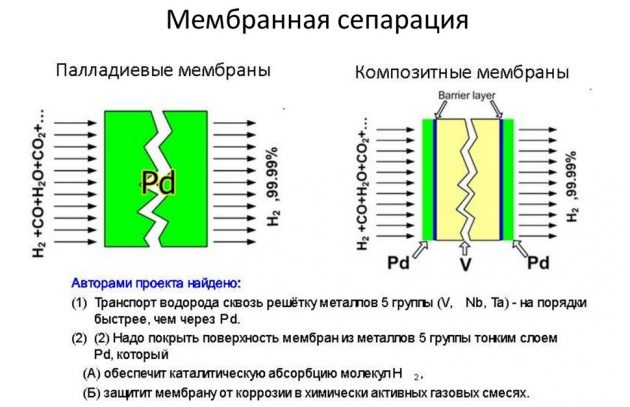
Παραγωγή υδρογόνου με συγκέντρωση
Αυτή η μέθοδος βασίζεται στον διαχωρισμό του στοιχείου από τα μείγματα αερίων που το περιέχουν. Έτσι, το μεγαλύτερο μέρος της ουσίας που παράγεται σε βιομηχανικούς όγκους εξάγεται με αναμόρφωση μεθανίου με ατμό. Το υδρογόνο που παράγεται σε αυτή τη διαδικασία χρησιμοποιείται στην ενέργεια, τη διύλιση πετρελαίου, τη βιομηχανία πυραύλων, καθώς και για την παραγωγή αζωτούχων λιπασμάτων. Η διαδικασία λήψης Η2 πραγματοποιείται με διάφορους τρόπους:
- σύντομος κύκλος?
- κρυογονικο?
- μεμβράνη.
Η τελευταία μέθοδος θεωρείται η πιο αποτελεσματική και λιγότερο δαπανηρή.
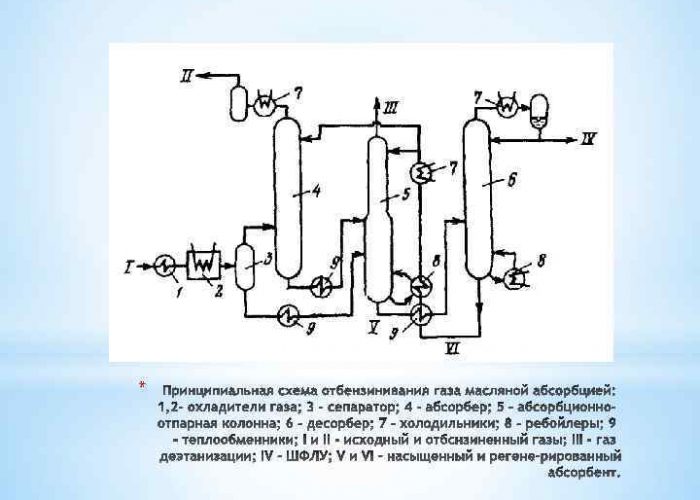
Συμπύκνωση σε χαμηλές θερμοκρασίες
Αυτή η τεχνική για τη λήψη Η2 συνίσταται στην ισχυρή ψύξη των ενώσεων αερίων υπό πίεση. Ως αποτέλεσμα, μετατρέπονται σε ένα σύστημα δύο φάσεων, το οποίο στη συνέχεια διαχωρίζεται από έναν διαχωριστή σε ένα υγρό συστατικό και ένα αέριο. Τα υγρά μέσα χρησιμοποιούνται για ψύξη:
- νερό;
- υγροποιημένο αιθάνιο ή προπάνιο.
- υγρή αμμωνία.
Αυτή η διαδικασία δεν είναι τόσο απλή όσο φαίνεται. Δεν θα είναι δυνατός ο καθαρός διαχωρισμός των αερίων υδρογονανθράκων κάθε φορά. Μέρος των εξαρτημάτων θα φύγει με το αέριο που λαμβάνεται από το διαμέρισμα διαχωρισμού, κάτι που δεν είναι οικονομικό. Το πρόβλημα μπορεί να λυθεί με βαθιά ψύξη της πρώτης ύλης πριν από τον διαχωρισμό. Αλλά αυτό απαιτεί πολλή ενέργεια.
Στα σύγχρονα συστήματα συμπυκνωτών χαμηλής θερμοκρασίας, παρέχονται επιπλέον στήλες απομεθανίωσης ή αποαιθανοποίησης. Η αέρια φάση αφαιρείται από το τελευταίο στάδιο διαχωρισμού και το υγρό αποστέλλεται στην αποστακτική στήλη με τη ροή ακατέργαστου αερίου μετά την ανταλλαγή θερμότητας.
Μέθοδος προσρόφησης
Κατά τη διάρκεια της προσρόφησης, τα προσροφητικά χρησιμοποιούνται για την απελευθέρωση υδρογόνου - στερεών ουσιών που απορροφούν τα απαραίτητα συστατικά του μείγματος αερίων. Ως προσροφητικά χρησιμοποιούνται ενεργός άνθρακας, πυριτική γέλη, ζεόλιθοι. Για να πραγματοποιηθεί αυτή η διαδικασία, χρησιμοποιούνται ειδικές συσκευές - κυκλικοί προσροφητές ή μοριακά κόσκινα. Όταν εφαρμόζεται υπό πίεση, αυτή η μέθοδος μπορεί να ανακτήσει 85 τοις εκατό υδρογόνο.
Εάν συγκρίνουμε την προσρόφηση με τη συμπύκνωση χαμηλής θερμοκρασίας, μπορούμε να σημειώσουμε το χαμηλότερο κόστος υλικού και λειτουργίας της διαδικασίας - κατά μέσο όρο, κατά 30 τοις εκατό. Η μέθοδος προσρόφησης παράγει υδρογόνο για ενέργεια και με τη χρήση διαλυτών. Αυτή η μέθοδος επιτρέπει την εξαγωγή του 90 τοις εκατό του Η2 από το μείγμα αερίων και την παραγωγή του τελικού προϊόντος με συγκέντρωση υδρογόνου έως και 99,9%.