Τι καθορίζει την αλατότητα του θαλασσινού νερού
Βλέποντας λίγο υψηλότερο αριθμό 3,5 ppm
, μπορεί να σκεφτείτε ότι αυτό είναι μια σταθερά για οποιοδήποτε θαλάσσιο νερό στον πλανήτη μας. Αλλά όλα δεν είναι τόσο απλά, η αλατότητα εξαρτάται από την περιοχή. Έτυχε, όσο πιο βόρεια βρίσκεται η περιοχή, τόσο μεγαλύτερη είναι αυτή η τιμή.
Ο νότος, αντίθετα, μπορεί να υπερηφανεύεται για όχι και τόσο αλμυρές θάλασσες και ωκεανούς. Φυσικά, όλοι οι κανόνες έχουν τις εξαιρέσεις τους. Τα επίπεδα αλατιού στις θάλασσες είναι συνήθως ελαφρώς χαμηλότερα από ό,τι στους ωκεανούς.
Ποια είναι γενικά η γεωγραφική διαίρεση; Δεν είναι γνωστό, οι ερευνητές το θεωρούν δεδομένο, υπάρχουν τα πάντα. Ίσως η απάντηση θα έπρεπε να αναζητηθεί στις παλαιότερες περιόδους ανάπτυξης του πλανήτη μας. Όχι την εποχή που γεννήθηκε η ζωή - πολύ νωρίτερα.
Γνωρίζουμε ήδη ότι η αλατότητα του νερού εξαρτάται από την παρουσία:
- χλωριούχο μαγνήσιο.
- χλωριούχο νάτριο.
- άλλα άλατα.
Ίσως, σε ορισμένα μέρη του φλοιού της γης, τα κοιτάσματα αυτών των ουσιών ήταν κάπως μεγαλύτερα από ό,τι σε γειτονικές περιοχές. Από την άλλη, κανείς δεν ακύρωσε τα θαλάσσια ρεύματα, αργά ή γρήγορα το γενικό επίπεδο έπρεπε να ισοπεδωθεί.
Έτσι, πιθανότατα, μια μικρή διαφορά σχετίζεται με τα κλιματικά χαρακτηριστικά του πλανήτη μας. Όχι η πιο αβάσιμη γνώμη, αν θυμάστε τους παγετούς και σκεφτείτε τι ακριβώς το νερό με υψηλή περιεκτικότητα σε αλάτι παγώνει πιο αργά.
Στάδια κατάψυξης
Είναι πολύ ενδιαφέρον να παρακολουθήσετε πώς παγώνει το θαλασσινό νερό. Δεν καλύπτεται αμέσως με ομοιόμορφη κρούστα πάγου, όπως το γλυκό νερό. Όταν μέρος του μετατρέπεται σε πάγο (και είναι φρέσκο), ο υπόλοιπος όγκος γίνεται ακόμα πιο αλμυρός και απαιτείται ακόμα πιο δυνατός παγετός για να παγώσει.
Τύποι πάγου
Καθώς η θάλασσα κρυώνει, σχηματίζονται διάφοροι τύποι πάγου:
- χιονοθύελλα;
- λάσπη;
- βελόνες?
- Salo;
- νίλας.
Εάν η θάλασσα δεν έχει παγώσει ακόμα, αλλά είναι πολύ κοντά της, και εκείνη τη στιγμή πέφτει χιόνι, δεν λιώνει όταν έρθει σε επαφή με την επιφάνεια, αλλά είναι κορεσμένη με νερό και σχηματίζει μια παχύρρευστη χυλώδη μάζα που ονομάζεται χιόνι. Με την κατάψυξη, αυτός ο χυλός μετατρέπεται σε λάσπη, η οποία είναι πολύ επικίνδυνη για τα πλοία που πιάνονται σε μια καταιγίδα. Εξαιτίας αυτού, το κατάστρωμα καλύπτεται αμέσως με κρούστα πάγου.
Όταν το θερμόμετρο φτάσει στο σημείο που είναι απαραίτητο για την κατάψυξη, αρχίζουν να σχηματίζονται βελόνες πάγου στη θάλασσα - κρύσταλλοι με τη μορφή πολύ λεπτών εξαγωνικών πρισμάτων. Μαζεύοντάς τα με ένα δίχτυ, ξεπλένοντας το αλάτι και λιώνοντάς τα, θα διαπιστώσετε ότι είναι άτοπα.
Όταν κάνει ακόμα πιο κρύο, το λίπος αρχίζει να παγώνει και σχηματίζει μια κρούστα πάγου, διάφανη και εύθραυστη σαν το γυαλί. Αυτός ο πάγος ονομάζεται nilas, ή μπουκάλι. Είναι αλμυρό, αν και σχηματίζεται από άζυμες βελόνες. Το γεγονός είναι ότι κατά την κατάψυξη, οι βελόνες συλλαμβάνουν τις μικρότερες σταγόνες του περιβάλλοντος αλμυρού νερού.
Μόνο στις θάλασσες υπάρχει ένα τέτοιο φαινόμενο όπως ο πλωτός πάγος. Προκύπτει επειδή το νερό εδώ κρυώνει πιο γρήγορα από την ακτή. Ο πάγος που σχηματίζεται εκεί παγώνει μέχρι την άκρη της ακτής, γι' αυτό και ονομάστηκε γρήγορος πάγος. Καθώς ο παγετός εντείνεται όταν ο καιρός είναι ήρεμος, καταλαμβάνει γρήγορα νέα εδάφη, φτάνοντας μερικές φορές σε πλάτος δεκάδων χιλιομέτρων. Όμως μόλις σηκωθεί δυνατός άνεμος, ο γρήγορος πάγος αρχίζει να σπάει σε κομμάτια διαφόρων μεγεθών. Αυτοί οι πάγοι, συχνά τεράστιοι (πεδία πάγου), μεταφέρονται από τον άνεμο και το ρεύμα σε όλη τη θάλασσα, προκαλώντας προβλήματα στα πλοία.
Αφαλάτωση θαλασσινού νερού.
Όσον αφορά την αφαλάτωση, όλοι έχουν ακούσει τουλάχιστον λίγο, κάποιοι θυμούνται τώρα ακόμη και την ταινία «Water World». Πόσο ρεαλιστικό είναι να βάζεις έναν τέτοιο φορητό αποστακτήρα σε κάθε σπίτι και να ξεχνάς για πάντα το πρόβλημα του πόσιμου νερού για την ανθρωπότητα; Ακόμα φαντασία, όχι πραγματικότητα.
Όλα έχουν να κάνουν με την ενέργεια που δαπανάται, γιατί για αποτελεσματική λειτουργία χρειάζονται τεράστιες χωρητικότητες, όχι λιγότερες από έναν πυρηνικό αντιδραστήρα. Μια μονάδα αφαλάτωσης στο Καζακστάν λειτουργεί με αυτήν την αρχή.Η ιδέα υποβλήθηκε και στην Κριμαία, αλλά η ισχύς του αντιδραστήρα της Σεβαστούπολης δεν ήταν αρκετή για τέτοιους όγκους.
Πριν από μισό αιώνα, πριν από πολυάριθμες πυρηνικές καταστροφές, ήταν ακόμα δυνατό να υποθέσουμε ότι ένα ειρηνικό άτομο θα έμπαινε σε κάθε σπίτι. Υπήρχε ακόμη και ένα σύνθημα. Αλλά είναι ήδη ξεκάθαρο ότι δεν γίνεται χρήση πυρηνικών μικροαντιδραστήρων:
- Σε οικιακές συσκευές.
- Σε βιομηχανικές επιχειρήσεις.
- Στην κατασκευή αυτοκινήτων και αεροσκαφών.
- Και ναι, εντός των ορίων της πόλης.
Δεν αναμένεται τον επόμενο αιώνα. Η επιστήμη μπορεί να κάνει άλλο ένα άλμα και να μας εκπλήξει, αλλά μέχρι στιγμής αυτές είναι μόνο οι φαντασιώσεις και οι ελπίδες των απρόσεκτων ρομαντικών.
Σημείο πήξης απεσταγμένου νερού
Παγώνει το απεσταγμένο νερό; Θυμηθείτε ότι για να παγώσει το νερό, είναι απαραίτητο να υπάρχουν κάποια κέντρα κρυστάλλωσης σε αυτό, τα οποία μπορεί να είναι φυσαλίδες αέρα, αιωρούμενα σωματίδια, καθώς και ζημιά στα τοιχώματα του δοχείου στο οποίο βρίσκεται.
Το απεσταγμένο νερό, εντελώς απαλλαγμένο από ακαθαρσίες, δεν έχει πυρήνες κρυστάλλωσης και επομένως η κατάψυξή του αρχίζει σε πολύ χαμηλές θερμοκρασίες. Το αρχικό σημείο πήξης του απεσταγμένου νερού είναι -42 βαθμοί. Οι επιστήμονες κατάφεραν να επιτύχουν υπερψύξη του απεσταγμένου νερού στους -70 βαθμούς.
Το νερό που έχει εκτεθεί σε πολύ χαμηλές θερμοκρασίες αλλά δεν έχει κρυσταλλωθεί ονομάζεται «υπερψυγμένο». Μπορείτε να τοποθετήσετε ένα μπουκάλι απεσταγμένο νερό στην κατάψυξη, να επιτύχετε υποθερμία και στη συνέχεια να επιδείξετε ένα πολύ αποτελεσματικό κόλπο - δείτε το βίντεο:
Χτυπώντας απαλά ένα μπουκάλι που έχει αφαιρεθεί από το ψυγείο ή ρίχνοντας ένα μικρό κομμάτι πάγου μέσα σε αυτό, μπορείτε να δείξετε πόσο αμέσως μετατρέπεται σε πάγο, που μοιάζει με επιμήκεις κρυστάλλους.
Απεσταγμένο νερό: αυτή η καθαρισμένη ουσία παγώνει ή όχι υπό πίεση; Μια τέτοια διαδικασία είναι δυνατή μόνο σε ειδικά δημιουργημένες εργαστηριακές συνθήκες.
ÑаÑÑолÑемпеÑаÑÑÑа
Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð¾¾ñð ° ° ° ° ° ðð¾ñð ° ° ° °ñððð¾ñð ° ° ° °ñððð¾ñð ° ° ° °ñðð¾¾ñð ° ° ° ð ð¾¾¾ð ° ° ° °ñðð¾¾ñð ° ° °ñððð¾¾ñð ÑиÑÑÑ. Ð Ð Ð Ð Ð Ð Ð Ð ² Ð ² Ð Ð Ð Ð Ð ² Ð Ð Ð Ð Ð Ð Ο ñññ Ð ÐμÐ D D D D Ð Ðμ D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D n »Ð ²Ðððð ооо²²²²²² Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ² Ð ²Ð Ð Ð ² DND »δ ÑоÐ'ÐμÑжР° ниÐμ Ñол δ в ND ° ÑÑоР»Ðμ мÐμнÑÑÐμ, ÑÐμм ÑÑÐμÐ ± ÑÐμмоÐμ Ð'л Ñ ÑвÑÐμкÑиÑÐμÑкого ND ° ÑÑвоÑÐ °, воÐ'Ð ° ÑÑкоÑÐ¸Ñ Ð¾Ð ±Ñазование кÑиÑÑаллов лÑда пÑи пÑи оÑи ¸ оÑлажденÑÑаиоиии Τρέξιμο - ñ ¾ ¾ ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð 𸸸 ð ð ° ° ° ° ° ° ° ð Ðμñ ð ðºð¾ð½ñðμð½½ññ ° °¸¸¸ ¸¸¸ ð¾ññð °ð¼ ñññ½¸¾ð ð¾ñ¾¸¸ ð¾ññ½¸ ° ð »½½ °¾ð ðñ ñ½ ° ð ñññ¾¸¸ ð¾ññð ° ð »ñññð ð¸ 𸸸¸ Ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ñ ñ ñ ñ ñ Ð ° Ð ° ñ °
Ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð Α Ð Ð 'Ð ° Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð μ Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð μñ DD ° мÐμÑÐ · Π ° ниÐμ ÑвÑÐμкÑиÑÐμÑкого ΝΔ ° ÑÑвоÑÐ ° â ÑÑо пÑоÑÐμÑÑ Ñ NND ° ÑÑиÐμм ÑкÑÑÑой ÑÐμпР»Ð¾ÑÑ, поÑÑÐ¾Ð¼Ñ ÑÐμмпÐμÑÐ ° ÑÑÑÐ ° оÑÑÐ ° ÐμÑÑÑ Ð½ÐμиР· менной. Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ¿Ñипонижении Ð Ð · ñ ñ ñ ñ Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ñ ññÐ Ð ° Ð ° Ð Ð Ð Ð'Ð ° Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ° ¸ поÑÑоÑннойР° ° ° ð½ ½ññð¹¹ ð¿¿¿¾¸¼ ðμ ðñ¸¸¸½ñð ° ° °ññ μ½¿ ° ° ¸ñ¸¸μ¿¿ ° ° ¸¸¸¸μ¿¿ ° ¸¸ °¸μ¸¸ ðð .
« ¸Ñ и ÑлоÑида наÑÑиÑ. Ð ð ° °ð »ð¾ñ »¸¸'ð ° ° ðºð ° ð» ññ¿ðμ¸ ¿¿¿μμμ¶ð'¾ ¸¸¸¿¿¿³ð¾ ¸¸ ·¿¿¿¾ðð »· · ¾ð¼ððñð» ¾¾ð¼¼ññ ° ° ½ð¼μñð ° ð¼μñð ° ððμ¾ð¼¼ñ ¸ замоÑаживании пÑодÑкÑов, ÑÑаиÐÐÐÐÐ. 17,8 °Ð¡. Ð ° Ð Ð Ð ° Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð 55 °C Α Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð (μ Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ð ð ð ð ð ð ð ð ¿ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ðññ¾¾ °ð𺠰 ° °ñ °¾¾ñðñ ° DD D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D ÑÑÑонÑÐ °ÐºÑ ÑаÑÑооа ÑоÑлаждаемÑм пÑодÑкÑом.
Ð ð ° °ð »» 𾸠»¸¸'ð ° ½½ ° ° ¸ð ° ½½ ° ° ñððð¾ð¹ ñð¾ð »ð¸¸¾ð¹ ñð¾ð» ¸¸ ð½ ð¿¿¾ññ¸ оñððð Ð ° Ð ° ND Δ Δ Δ ðñððÐ D D D D D D D D D D D D D D D D D D D D D D D D D D РоÐμ D D D D D D D D D D Ð ° Ð Ð Ð Ð Ð Ð ° Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ° Ð Ð Ð ° Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð. 1 °Ð¡. Ð Ð Ð Ð Ð Ð Ð Ð Ð ² Ð ² Ð ² Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ·
Ο ΚΥΚΛΟΣ ΤΟΥ ΝΕΡΟΥ ΣΤΟΝ ΠΑΓΚΟΣΜΙΟ ΩΚΕΑΝΟ
Στις πολικές περιοχές, το νερό, κρυώνοντας, γίνεται πιο πυκνό και βυθίζεται στον πυθμένα. Από εκεί γλιστράει αργά προς τον ισημερινό. Επομένως, σε όλα τα γεωγραφικά πλάτη, τα βαθιά νερά είναι κρύα. Ακόμη και στον ισημερινό, τα νερά του βυθού έχουν θερμοκρασία μόνο 1-2 ° πάνω από το μηδέν.
Δεδομένου ότι τα ρεύματα μεταφέρουν ζεστό νερό από τον ισημερινό σε εύκρατα γεωγραφικά πλάτη, το κρύο νερό ανεβαίνει πολύ αργά από τα βάθη για να πάρει τη θέση του. Στην επιφάνεια, ζεσταίνεται ξανά, πηγαίνει στις υποπολικές ζώνες, όπου κρυώνει, βυθίζεται στον πυθμένα και πάλι κινείται κατά μήκος του πυθμένα στον ισημερινό.
Έτσι, στους ωκεανούς υπάρχει ένα είδος κύκλου νερού: στην επιφάνεια, το νερό μετακινείται από τον ισημερινό στις υποπολικές ζώνες και κατά μήκος του πυθμένα των ωκεανών - από τις υποπολικές ζώνες στον ισημερινό. Αυτή η διαδικασία ανάμειξης του νερού, μαζί με άλλα φαινόμενα που αναφέρθηκαν παραπάνω, δημιουργεί την ενότητα των ωκεανών.
Εάν βρείτε κάποιο σφάλμα, επισημάνετε ένα κομμάτι κειμένου και κάντε κλικ Ctrl+Enter
.
Στην ενότητα σχετικά με το ερώτημα ποια μπορεί να επιτευχθεί η χαμηλότερη θερμοκρασία ενός διαλύματος νερού-αλατιού συνηθισμένου (επιτραπέζιου, NaCl) αλατιού, που δίνεται από τον συγγραφέα ευρωπαϊκός
η καλύτερη απάντηση είναι Με την προσθήκη αλατιού στο νερό, ο ρυθμός τήξης του πάγου αυξάνεται και η θερμοκρασία τήξης του πάγου πέφτει χαμηλότερα. Αυτό συμβαίνει γιατί η προσθήκη αλατιού προκαλεί εξασθένηση της μοριακής συνοχής και καταστροφή των κρυσταλλικών δικτυωμάτων του πάγου. Η τήξη του μίγματος πάγου-αλατιού προχωρά με την απομάκρυνση της θερμότητας από το περιβάλλον, με αποτέλεσμα να ψύχεται ο περιβάλλοντας αέρας και να μειώνεται η θερμοκρασία του. Με την αύξηση της περιεκτικότητας σε αλάτι στο μείγμα πάγου-αλατιού, το σημείο τήξης του μειώνεται. Το διάλυμα άλατος με το χαμηλότερο σημείο τήξης ονομάζεται ευτηκτική και η θερμοκρασία τήξης του ονομάζεται κρυοϋδρικό σημείο. Το σημείο κρυοένυδρου για ένα μείγμα πάγου-άλατος με επιτραπέζιο αλάτι είναι -21,2°C, σε συγκέντρωση άλατος στο διάλυμα 23,1% σε σχέση με τη συνολική μάζα του μείγματος, η οποία είναι περίπου ίση με 30 kg αλατιού ανά 100 kg πάγος.Με περαιτέρω αύξηση της συγκέντρωσης αλατιού, δεν πρόκειται για μείωση της θερμοκρασίας τήξης του μείγματος πάγου-αλατιού, αλλά για αύξηση της θερμοκρασίας τήξης (σε συγκέντρωση άλατος 25% στο διάλυμα στη συνολική μάζα, η θερμοκρασία τήξης αυξάνεται έως -8 ° C). Κατά την κατάψυξη ενός υδατικού διαλύματος επιτραπέζιου αλατιού σε συγκέντρωση που αντιστοιχεί σε κρυοένυδρο σημείο, λαμβάνεται ένα ομοιογενές μίγμα κρυστάλλων πάγου και αλατιού, το οποίο ονομάζεται ευτηκτικό στερεό διάλυμα. Το σημείο τήξης ενός ευτηκτικού στερεού διαλύματος του χλωριούχου νατρίου είναι -21,2 ° C και η θερμότητα της σύντηξης είναι 236 kJ / kg. Το ευτηκτικό διάλυμα χρησιμοποιείται για ψύξη με μηδενική ροπή. Για να γίνει αυτό, ένα ευτηκτικό διάλυμα επιτραπέζιου αλατιού χύνεται σε μηδενικά - ερμητικά σφραγισμένες μορφές - και καταψύχονται. Τα παγωμένα μηδενικά χρησιμοποιούνται για την ψύξη πάγκων, ντουλαπιών, φορητών σακουλών ψύξης κ.λπ. (ανοίξτε την κατάψυξη ενός οικιακού ψυγείου - θα βρείτε ένα τέτοιο δοχείο). με ψύξη μηχανής.
Απάντηση από στεγνώσει
η χαμηλότερη θερμοκρασία από οποιαδήποτε θερμοκρασία είναι το απόλυτο μηδέν, γύρω στους -273 βαθμούς Κελσίου
Απάντηση από Olya
η θερμοκρασία εξαρτάται από τη συγκέντρωση άλατος στο διάλυμα, όσο υψηλότερη είναι η συγκέντρωση, τόσο χαμηλότερο είναι το σημείο πήξης. το βιβλίο αναφοράς μου αφαιρέθηκε για λίγο)) αλλά αν προχωρήσουμε από το γεγονός ότι το θαλασσινό νερό είναι αλατούχο διάλυμα, τότε μπορούμε να συμπεράνουμε ότι η θερμοκρασία παγώματος είναι πολύ χαμηλότερη από το μηδέν .... βαθμοί -15-20
Απάντηση από ικανός
Υδατικό διάλυμα NaCl 22,4% παγώνει στους 21,2 °C
στο ερώτημα Υδατικό διάλυμα NaCl «θερμοκρασία κρυστάλλωσης»
Απάντηση από Yergey Neznamov
Πίνακας 10.8. Σημείο κατάψυξης της περιεκτικότητας σε NaCl SolutionNacl, G σε 100 g νερού 5 - -4.4 9.0 - -5.4 10.6 - -6.4 12.3-7.5 14.0 - -8.6 15.7 - -9.8 17,5 - -11,0 19,3 - 12,2 21,2 - -13,6 23,1 - - 15,1 25,0 - - 16,0 26,9 - -18,2 29,0 - -20 ,0 30,1 — -21,2
Σημείο πήξης αλμυρού νερού
Τα πειράματα με πάγο για παιδιά είναι πάντα ενδιαφέροντα. Ενώ έκανα πειράματα με τον Vlad, έκανα αρκετές ανακαλύψεις για τον εαυτό μου.
Σήμερα θα βρούμε απαντήσεις στα ακόλουθα ερωτήματα:
- Πώς συμπεριφέρεται το νερό όταν είναι παγωμένο;
- Τι θα συμβεί αν παγώσετε το αλμυρό νερό;
- παλτό θα ζεστάνει τον πάγο;
- και κάποιοι άλλοι…
παγωμένο νερό

Παγώνει το αλμυρό νερό;
Όσο πιο αλμυρό είναι το νερό, τόσο χαμηλότερο είναι το σημείο πήξης. Για το πείραμα, πήραμε δύο ποτήρια - στο ένα γλυκό νερό (με το γράμμα Β), στο άλλο πολύ αλμυρό νερό (με τα γράμματα B + C).
Αφού έμεινε στην κατάψυξη όλη τη νύχτα, το αλμυρό νερό δεν πάγωσε, αλλά σχηματίστηκαν κρύσταλλοι πάγου στο ποτήρι. Το γλυκό νερό έγινε πάγος. Ενώ χειριζόμουν με φλιτζάνια και διαλύματα αλατιού, ο Vladik δημιούργησε το απρογραμμάτιστο πείραμά του.
Έριξε νερό, φυτικό λάδι σε μια κούπα και διακριτικά το έβαλε στην κατάψυξη. 
Το αλατόνερο στην κατάψυξη δεν πάγωσε, αλλά τι θα συμβεί αν ρίξετε αλάτι στον πάγο; Ας ελέγξουμε.
Εμπειρία με πάγο και αλάτι
Πάρτε δύο παγάκια. Πασπαλίστε το ένα με αλάτι και αφήστε το δεύτερο για σύγκριση. 
Παγώσαμε ένα μεγάλο παγάκι και το πασπαλίσαμε με αλάτι, πήραμε πινέλα και 
Η έμπειρη δημιουργικότητά μας ενώνει όλη την οικογένεια, έτσι το στυλό του Makarushkin μπήκε στον φωτογραφικό φακό!
Ο Makar και ο Vlad είναι πολύ σε όλους αρέσει να παγώνουν
. Μερικές φορές υπάρχουν εντελώς απροσδόκητα αντικείμενα στην κατάψυξη.
Ονειρευόμουν να κάνω αυτή την εμπειρία από παιδί, αλλά η μητέρα μου δεν είχε γούνινο παλτό και πολλά

Πόσο υπέροχο είναι να είσαι ενήλικας, να έχεις γούνινο παλτό και να κάνεις κάθε είδους παιδικά πειράματα!
Η Galina Kuzmina σου
Ο πίνακας δείχνει τις θερμοφυσικές ιδιότητες ενός διαλύματος χλωριούχου ασβεστίου CaCl 2 ανάλογα με τη θερμοκρασία και τη συγκέντρωση άλατος: ειδική θερμότητα του διαλύματος, θερμική αγωγιμότητα, ιξώδες υδατικών διαλυμάτων, θερμική διάχυση και ο αριθμός Prandtl. Η συγκέντρωση του άλατος CaCl 2 στο διάλυμα είναι από 9,4 έως 29,9%. Η θερμοκρασία στην οποία δίνονται οι ιδιότητες καθορίζεται από την περιεκτικότητα του διαλύματος σε αλάτι και κυμαίνεται από -55 έως 20°C.
χλωριούχο ασβέστιο Το CaCl 2 δεν μπορεί να παγώσει μέχρι μείον 55°С
. Για να επιτευχθεί αυτό το αποτέλεσμα, η συγκέντρωση του αλατιού στο διάλυμα θα πρέπει να είναι 29,9%, και η πυκνότητά του θα είναι 1286 kg/m 3 .
Με την αύξηση της συγκέντρωσης άλατος σε ένα διάλυμα, όχι μόνο αυξάνεται η πυκνότητά του, αλλά και τέτοιες θερμοφυσικές ιδιότητες όπως το δυναμικό και κινηματικό ιξώδες των υδατικών διαλυμάτων, καθώς και ο αριθμός Prandtl. Για παράδειγμα, δυναμικό ιξώδες διαλύματος CaCl 2
με συγκέντρωση άλατος 9,4% σε θερμοκρασία 20°C είναι 0,001236 Pa s και με αύξηση της συγκέντρωσης χλωριούχου ασβεστίου στο διάλυμα στο 30%, το δυναμικό του ιξώδες αυξάνεται σε τιμή 0,003511 Pa s.
Πρέπει να σημειωθεί ότι η θερμοκρασία έχει την ισχυρότερη επίδραση στο ιξώδες των υδατικών διαλυμάτων αυτού του άλατος. Όταν ένα διάλυμα χλωριούχου ασβεστίου ψύχεται από τους 20 στους -55°C, το δυναμικό του ιξώδες μπορεί να αυξηθεί κατά 18 φορές και το κινηματικό κατά 25 φορές.
Δεδομένων των παρακάτω Θερμοφυσικές ιδιότητες του διαλύματος CaCl 2
:
- , kg / m 3;
- σημείο πήξης °С;
- δυναμικό ιξώδες υδατικών διαλυμάτων, Pa s;
- Αριθμός Prandtl.
ÑаÑÑолÑемпеÑаÑÑÑа
Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð¾¾ñð ° ° ° ° ° ðð¾ñð ° ° ° °ñððð¾ñð ° ° ° °ñððð¾ñð ° ° ° °ñðð¾¾ñð ° ° ° ð ð¾¾¾ð ° ° ° °ñðð¾¾ñð ° ° °ñððð¾¾ñð ÑиÑÑÑ. Ð Ð Ð Ð Ð Ð Ð Ð ² Ð ² Ð Ð Ð Ð Ð ² Ð Ð Ð Ð Ð Ð Ο ñññ Ð ÐμÐ D D D D Ð Ðμ D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D n »Ð ²Ðððð ооо²²²²²² Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ² Ð ²Ð Ð Ð ² DND »δ ÑоÐ'ÐμÑжР° ниÐμ Ñол δ в ND ° ÑÑоР»Ðμ мÐμнÑÑÐμ, ÑÐμм ÑÑÐμÐ ± ÑÐμмоÐμ Ð'л Ñ ÑвÑÐμкÑиÑÐμÑкого ND ° ÑÑвоÑÐ °, воÐ'Ð ° ÑÑкоÑÐ¸Ñ Ð¾Ð ±Ñазование кÑиÑÑаллов лÑда пÑи пÑи оÑи ¸ оÑлажденÑÑаиоиии Τρέξιμο - ñ ¾ ¾ ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð 𸸸 ð ð ° ° ° ° ° ° ° ð Ðμñ ð ðºð¾ð½ñðμð½½ññ ° °¸¸¸ ¸¸¸ ð¾ññð °ð¼ ñññ½¸¾ð ð¾ñ¾¸¸ ð¾ññ½¸ ° ð »½½ °¾ð ðñ ñ½ ° ð ñññ¾¸¸ ð¾ññð ° ð »ñññð ð¸ 𸸸¸Ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ñ ñ ñ ñ ñ Ð ° Ð ° ñ °
Ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð Α Ð Ð 'Ð ° Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð μ Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð μñ DD ° мÐμÑÐ · Π ° ниÐμ ÑвÑÐμкÑиÑÐμÑкого ΝΔ ° ÑÑвоÑÐ ° â ÑÑо пÑоÑÐμÑÑ Ñ NND ° ÑÑиÐμм ÑкÑÑÑой ÑÐμпР»Ð¾ÑÑ, поÑÑÐ¾Ð¼Ñ ÑÐμмпÐμÑÐ ° ÑÑÑÐ ° оÑÑÐ ° ÐμÑÑÑ Ð½ÐμиР· менной. Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ¿Ñипонижении Ð Ð · ñ ñ ñ ñ Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ñ ññÐ Ð ° Ð ° Ð Ð Ð Ð'Ð ° Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ° ¸ поÑÑоÑнной Ð ° ° ° ð½ ½ññð¹¹ ð¿¿¿¾¸¼ ðμ ðñ¸¸¸½ñð ° ° °ññ μ½¿ ° ° ¸ñ¸¸μ¿¿ ° ° ¸¸¸¸μ¿¿ ° ¸¸ °¸μ¸¸ ðð .
« ¸Ñ и ÑлоÑида наÑÑиÑ. Ð ð ° °ð »ð¾ñ »¸¸'ð ° ° ðºð ° ð» ññ¿ðμ¸ ¿¿¿μμμ¶ð'¾ ¸¸¸¿¿¿³ð¾ ¸¸ ·¿¿¿¾ðð »· · ¾ð¼ððñð» ¾¾ð¼¼ññ ° ° ½ð¼μñð ° ð¼μñð ° ððμ¾ð¼¼ñ ¸ замоÑаживании пÑодÑкÑов, ÑÑаиÐÐÐÐÐ. 17,8 °Ð¡. Ð ° Ð Ð Ð ° Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð 55 °C Α Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð (μ Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ð ð ð ð ð ð ð ð ¿ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ð ðññ¾¾ °ð𺠰 ° °ñ °¾¾ñðñ ° DD D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D D ÑÑÑонÑÐ °ÐºÑ ÑаÑÑооа ÑоÑлаждаемÑм пÑодÑкÑом.
Ð ð ° °ð »» 𾸠»¸¸'ð ° ½½ ° ° ¸ð ° ½½ ° ° ñððð¾ð¹ ñð¾ð »ð¸¸¾ð¹ ñð¾ð» ¸¸ ð½ ð¿¿¾ññ¸ оñððð Ð ° Ð ° ND Δ Δ Δ ðñððÐ D D D D D D D D D D D D D D D D D D D D D D D D D D РоÐμ D D D D D D D D D D Ð ° Ð Ð Ð Ð Ð Ð ° Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ° Ð Ð Ð ° Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð. 1 °Ð¡. Ð Ð Ð Ð Ð Ð Ð Ð Ð ² Ð ² Ð ² Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ·
Σε ποια θερμοκρασία μπορεί να παγώσει το θαλασσινό νερό;
Όμως το βασικό ερώτημα δεν έχει απαντηθεί ακόμη. Έχουμε ήδη μάθει ότι το αλάτι επιβραδύνει την κατάψυξη του νερού, η θάλασσα θα καλυφθεί με μια κρούστα πάγου όχι σε θερμοκρασίες μηδέν, αλλά κάτω από το μηδέν. Πόσο μακριά όμως πρέπει να πάνε στο μείον οι ενδείξεις του θερμομέτρου ώστε οι κάτοικοι των παράκτιων περιοχών να μην ακούνε τον συνηθισμένο ήχο του σερφ όταν φεύγουν από τα σπίτια τους;
Για τον προσδιορισμό αυτής της τιμής, υπάρχει μια ειδική φόρμουλα, πολύπλοκη και κατανοητή μόνο για ειδικούς. Εξαρτάται από τον κύριο δείκτη - επίπεδο αλατότητας
. Επειδή όμως έχουμε μια μέση τιμή για αυτόν τον δείκτη, μπορούμε να βρούμε και το μέσο σημείο πήξης; Α, καλά.
Εάν δεν χρειάζεται να υπολογίσετε τα πάντα μέχρι το ένα εκατοστό, για μια συγκεκριμένη περιοχή, θυμηθείτε τη θερμοκρασία στους -1,91 βαθμούς
.
Μπορεί να φαίνεται ότι η διαφορά δεν είναι τόσο μεγάλη, μόνο δύο βαθμούς. Αλλά κατά τις εποχιακές διακυμάνσεις της θερμοκρασίας, αυτό μπορεί να παίξει τεράστιο ρόλο όταν το θερμόμετρο πέφτει τουλάχιστον 0. Θα ήταν μόνο 2 βαθμούς πιο ψυχρό, οι κάτοικοι της ίδιας Αφρικής ή της Νότιας Αμερικής θα μπορούσαν να δουν πάγο κοντά στην ακτή, αλλά δυστυχώς. Ωστόσο, δεν πιστεύουμε ότι τους στεναχωρεί πολύ μια τέτοια απώλεια.
Θερμοφυσικές ιδιότητες διαλύματος NaCl
Ο πίνακας δείχνει τις θερμοφυσικές ιδιότητες ενός διαλύματος χλωριούχου νατρίου NaCl ανάλογα με τη θερμοκρασία και τη συγκέντρωση άλατος. Η συγκέντρωση του χλωριούχου νατρίου NaCl στο διάλυμα είναι από 7 έως 23,1%. Πρέπει να σημειωθεί ότι όταν ένα υδατικό διάλυμα χλωριούχου νατρίου ψύχεται, η ειδική θερμοχωρητικότητα του αλλάζει ελαφρώς, η θερμική αγωγιμότητα μειώνεται και το ιξώδες του διαλύματος αυξάνεται.
Λαμβάνοντας υπόψη τα ακόλουθα Θερμοφυσικές ιδιότητες του διαλύματος NaCl
:
- πυκνότητα διαλύματος, kg/m 3;
- σημείο πήξης °С;
- ειδική (μάζα) θερμοχωρητικότητα, kJ/(kg deg);
- συντελεστής θερμικής αγωγιμότητας, W/(m deg);
- δυναμικό ιξώδες του διαλύματος, Pa s;
- κινηματικό ιξώδες του διαλύματος, m 2 /s;
- θερμική διάχυση, m 2 /s;
- Αριθμός Prandtl.
Από τι αποτελείται το θαλασσινό νερό;
Σε τι διαφέρει το περιεχόμενο των θαλασσών από το γλυκό νερό; Η διαφορά δεν είναι τόσο μεγάλη, αλλά και πάλι:
- Πολύ περισσότερο αλάτι.
- Τα άλατα μαγνησίου και νατρίου κυριαρχούν.
- Η πυκνότητα διαφέρει ελαφρώς, μέσα σε λίγα τοις εκατό.
- Το υδρόθειο μπορεί να σχηματιστεί σε βάθος.
Το κύριο συστατικό του θαλασσινού νερού, όσο προβλέψιμο κι αν ακούγεται, είναι το νερό. Αλλά σε αντίθεση με το νερό των ποταμών και των λιμνών, αυτό περιέχει μεγάλες ποσότητες χλωριούχου νατρίου και μαγνησίου
.
Η αλατότητα υπολογίζεται σε 3,5 ppm, αλλά για να γίνει πιο σαφές - στα 3,5 χιλιοστά του τοις εκατό της συνολικής σύνθεσης.
Και ακόμη και αυτή, όχι η πιο εντυπωσιακή φιγούρα, παρέχει νερό όχι μόνο με συγκεκριμένη γεύση, αλλά το κάνει και μη πόσιμο. Δεν υπάρχουν απόλυτες αντενδείξεις, το θαλασσινό νερό δεν είναι δηλητήριο ή τοξική ουσία και τίποτα κακό δεν θα συμβεί από μερικές γουλιές. Θα είναι δυνατό να μιλήσουμε για τις συνέπειες εάν ένα άτομο είναι τουλάχιστον όλη την ημέρα. Επίσης, η σύνθεση του θαλασσινού νερού περιλαμβάνει:
- Φθόριο.
- Βρώμιο.
- Ασβέστιο.
- Κάλιο.
- Χλώριο.
- θειικά.
- Χρυσός.
Είναι αλήθεια ότι σε ποσοστιαία βάση, όλα αυτά τα στοιχεία είναι πολύ λιγότερα από τα άλατα.
Πολιτεία και είδη νερού
Το νερό στον πλανήτη Γη μπορεί να λάβει τρεις κύριες καταστάσεις συσσώρευσης: υγρό, στερεό και αέριο, που μπορεί να μετατραπεί σε διαφορετικές μορφές που συνυπάρχουν ταυτόχρονα μεταξύ τους (παγόβουνα στο θαλασσινό νερό, υδρατμοί και κρύσταλλοι πάγου στα σύννεφα στον ουρανό, παγετώνες και δωρεάν - ρέοντα ποτάμια).
Ανάλογα με τα χαρακτηριστικά της προέλευσης, του σκοπού και της σύνθεσης, το νερό μπορεί να είναι:
- φρέσκο;
- ορυκτό;
- ναυτικός;
- πόσιμο (εδώ συμπεριλαμβάνουμε το νερό της βρύσης).
- βροχή;
- ξεπαγωμένο?
- υφάλμυρος;
- δομημένος;
- αποσταγμένο?
- απιονισμένος.
Η παρουσία ισοτόπων υδρογόνου κάνει το νερό:
- φως;
- βαρύ (δευτέριο);
- υπερβαρύ (τρίτιο).
Όλοι γνωρίζουμε ότι το νερό μπορεί να είναι μαλακό και σκληρό: αυτός ο δείκτης καθορίζεται από την περιεκτικότητα σε κατιόντα μαγνησίου και ασβεστίου.
Καθένας από τους τύπους και τις αθροιστικές καταστάσεις νερού που παραθέσαμε έχει το δικό του σημείο πήξης και τήξης.
Βίντεο με παγωμένο αλμυρό νερό

 Τι γνωρίζετε για το σημείο βρασμού του νερού;
Τι γνωρίζετε για το σημείο βρασμού του νερού;

Το καθεστώς θερμοκρασίας καθορίζει, πρώτα απ 'όλα, το ρυθμό της διαδικασίας κατάψυξης.
Η θερμοκρασία στο εύρος των θετικών και αρνητικών τιμών επηρεάζει τον ρυθμό των αντιδράσεων, τη διαλυτότητα των ενώσεων, τον ρυθμό διάλυσης, την πήξη, καθώς και τη συγκέντρωση των αδιάσπαστων ζευγών ιόντων. Υπάρχουν διάφοροι τύποι θερμοκρασίας στα διαλύματα: δομική, σημείο πήξης. Θερμοκρασία έναρξης κρυστάλλωσης (σημείο πήξης) - η θερμοκρασία στην οποία, ως αποτέλεσμα της ψύξης του διαλύματος, αρχίζει ο σχηματισμός κρυστάλλων. Κατάθλιψη σημείου πήξης ΔTz είναι η διαφορά μεταξύ του σημείου πήξης ενός καθαρού διαλύτη και ενός διαλύματος. Το σημείο πήξης της άλμης είναι πάντα κάτω από το σημείο πήξης του καθαρού νερού και εξαρτάται από τη συγκέντρωση των διαλυμένων αλάτων. Αυτή η εξάρτηση για τις άλμη μπορεί να εκφραστεί με την εξίσωση:
που ΠΡΟΣ ΤΟ
- συντελεστής αναλογικότητας. ΜΕ
είναι η συγκέντρωση της διαλυμένης ουσίας στο διάλυμα.
Σε λιγότερο αραιά διαλύματα, η θερμοκρασία έναρξης κρυστάλλωσης προσδιορίζεται από το διάγραμμα κατάστασης του αντίστοιχου συστήματος. Δεδομένου ότι η θερμοκρασία πήξης των θαλασσινών υδάτων και των φυσικών άλμης με υψηλή ανοργανοποίηση θα είναι διαφορετική, υποθέτουμε ότι αυτή η θερμοκρασία πρέπει να υπολογιστεί χρησιμοποιώντας διαφορετικούς τύπους.
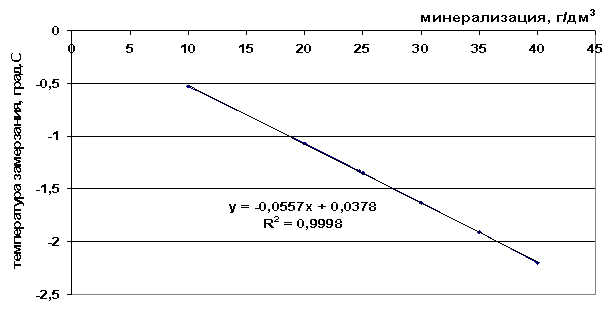
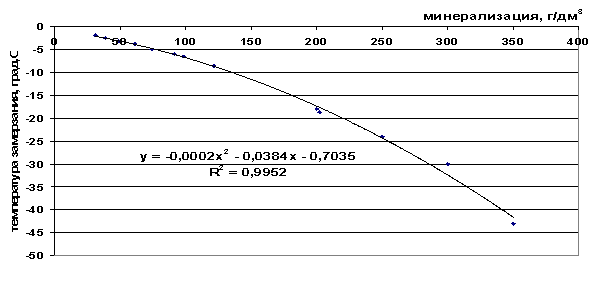
Έχουμε κάνει μια προσέγγιση των πειραματικών δεδομένων σχετικά με τα σημεία πήξης των διαλυμάτων επιτραπέζιου αλατιού, θαλασσινού νερού και φυσικών αλμυρών που χρησιμοποιούνται στην εργασία. Οι εξαρτήσεις των μεταβολών της θερμοκρασίας κατάψυξης σε γραφικές και αναλυτικές μορφές παρουσιάζονται στα Σχήματα 41-43.
Ρύζι. 41. Η εξάρτηση του σημείου πήξης από την αλατότητα ενός διαλύματος άλατος
Ρύζι. 42. Εξάρτηση του σημείου πήξης του θαλασσινού νερού από την αλατότητα
Ρύζι. 43. Εξάρτηση του σημείου πήξης της άλμης από την αλατότητα
Από τις παρουσιαζόμενες τιμές σημείου πήξης (Πίνακας 9), μπορεί να φανεί ότι το σημείο πήξης μειώνεται καθώς αυξάνεται η συνολική αλατότητα του διαλύματος και καθώς αυξάνεται ο αριθμός των συστατικών που περιλαμβάνονται στο κατεψυγμένο σύστημα - ΔТз(NaCl)
Πίνακας 9. Ανάλυση των κατασκευασμένων γραφικών εξαρτήσεων
|
Ctot, g/dm 3 |
Σημείο πήξης, °С |
||
|
Διάλυμα NaCl |
θαλασσινό νερό |
||
|
t=8∙10 -5 M 2 -0,0945M+1,0595, |
0,0557M+0,0378, |
t=-2∙10 -4 M 2 -0,0384M-0,7035, |
|
*
R 2 - αξιοπιστία προσέγγισης
Είναι γνωστό ότι η κατάψυξη μεμονωμένων αλάτων από αφαλατωμένο νερό συμβαίνει σε διαφορετικές θερμοκρασίες, για παράδειγμα, σε θερμοκρασία -2°C, καθιζάνει ανθρακικό ασβέστιο. Στους - 3,5 ° C θειικό νάτριο. Όταν η θερμοκρασία πέσει στους -20 ° C, κατακρημνίζεται επιτραπέζιο αλάτι, χλωριούχο μαγνήσιο στους -25,5-26 ° C και σε πολύ χαμηλές θερμοκρασίες - 40-55 ° C, κατακρημνίζεται χλωριούχο κάλιο και ασβέστιο. Για τις αρνητικές θερμοκρασίες, η διαδικασία σχηματισμού κρυσταλλικών υδριτών, που είναι ασταθείς σε θερμοκρασίες κάτω των 0°C, είναι ειδική. Για παράδειγμα, ο υδροαλίτης NaCl * 2H 2 O σχηματίζεται στους -0,15 ° C, το MgCl 2 * 12H 2 O είναι σταθερό στους -15 ° C και το MgCl 2 * 8H 2 O είναι κάτω από 0 ° C, το Na 2 CO 3 * 7H Το 2 O σχηματίζεται μόνο στους -10°C. Το KCl κρυσταλλώνεται στους 0°С με τη μορφή KCl, στους -6,6°С συνυπάρχουν ήδη δύο φάσεις - KCl και KCl*H 2 O, στους -10,6°С κατακρημνίζεται μόνο KCl*H 2 O. Σε αρνητικές θερμοκρασίες, μεμονωμένα κρυσταλλικά ένυδρα με τον μέγιστο δυνατό αριθμό μορίων νερού κρυστάλλωσης, σύμφωνα με τους αριθμούς συντονισμού σε μια δεδομένη τιμή, και τα μείγματά τους (αλλά όχι μεικτούς κρυστάλλους). Θα πρέπει να σημειωθεί μια ανώμαλη μείωση του σημείου πήξης των συμπυκνωμένων διαλυμάτων.
Εφιστούμε στην προσοχή σας τα περιοδικά που εκδίδονται από τον εκδοτικό οίκο "Academy of Natural History"
Σε ποια θερμοκρασία παγώνει το νερό; Φαίνεται - η απλούστερη ερώτηση που μπορεί να απαντήσει ακόμη και ένα παιδί: το σημείο πήξης του νερού σε κανονική ατμοσφαιρική πίεση 760 mmHg είναι μηδέν βαθμοί Κελσίου.
Ωστόσο, το νερό (παρά την εξαιρετικά ευρεία κατανομή του στον πλανήτη μας) είναι η πιο μυστηριώδης και μη πλήρως κατανοητή ουσία, επομένως η απάντηση σε αυτό το ερώτημα απαιτεί μια λεπτομερή και αιτιολογημένη συζήτηση.
- Στη Ρωσία και την Ευρώπη, η θερμοκρασία μετράται στην κλίμακα Κελσίου, η υψηλότερη τιμή της οποίας είναι 100 βαθμοί.
- Ο Αμερικανός επιστήμονας Φαρενάιτ ανέπτυξε τη δική του κλίμακα με 180 τμήματα.
- Υπάρχει μια άλλη μονάδα μέτρησης θερμοκρασίας - Κέλβιν, που πήρε το όνομά του από τον Άγγλο φυσικό Τόμσον, ο οποίος έλαβε τον τίτλο του Λόρδου Κέλβιν.
Γιατί δεν πρέπει να πίνετε θαλασσινό νερό
Έχουμε ήδη θίξει εν συντομία αυτό το θέμα, ας το δούμε λίγο πιο αναλυτικά. Μαζί με το θαλασσινό νερό, δύο ιόντα εισέρχονται στο σώμα - μαγνήσιο και νάτριο.
|
Νάτριο |
Μαγνήσιο |
|
Συμμετέχει στη διατήρηση της ισορροπίας νερού-αλατιού, ένα από τα κύρια ιόντα μαζί με το κάλιο. |
Η κύρια επίδραση είναι στο κεντρικό νευρικό σύστημα. |
|
Με αύξηση του αριθμού Να |
Πολύ αργά απεκκρίνεται από το σώμα. |
|
Όλες οι βιολογικές και βιοχημικές διεργασίες διαταράσσονται. |
Μια περίσσεια στο σώμα οδηγεί σε διάρροια, η οποία επιδεινώνει την αφυδάτωση. |
|
Τα ανθρώπινα νεφρά δεν είναι σε θέση να αντιμετωπίσουν τόσο πολύ αλάτι στο σώμα. |
Ίσως η ανάπτυξη νευρικών διαταραχών, ανεπαρκής κατάσταση. |
Δεν μπορεί να ειπωθεί ότι ένα άτομο δεν χρειάζεται όλες αυτές τις ουσίες, αλλά οι ανάγκες ταιριάζουν πάντα σε ορισμένα όρια. Αφού πιείτε μερικά λίτρα τέτοιου νερού, θα ξεπεράσετε πολύ τα όριά τους.
Ωστόσο, σήμερα η επείγουσα ανάγκη χρήσης του θαλασσινού νερού μπορεί να προκύψει μόνο μεταξύ των θυμάτων των ναυαγίων.