A sósav használata
A sósavat széles körben használják az iparban fémek ércekből való kinyerésére, fémek pácolására stb. Forrasztófolyadék gyártásánál, ezüst leválasztásánál, valamint az aqua regia szerves részeként is használják.
A sósav ipari felhasználásának mértéke kisebb, mint a salétromsavé. Ez annak a ténynek köszönhető, hogy a sósav az acélberendezések korrózióját okozza. Ezenkívül illékony gőzei meglehetősen károsak, és a fémtermékek korrózióját is okozzák. Ezt figyelembe kell venni a sósav tárolásánál. A sósavat gumiborítású tartályokban és hordókban tárolják és szállítják, i.e. edényekben, amelyek belső felületét saválló gumi borítja, valamint üvegpalackokban és polietilén edényekben.
A sósavat cink, mangán, vas és más fémek kloridjainak, valamint ammónium-kloridnak a előállítására használják. A sósavat fémek, edények, kutak felületeinek tisztítására használják karbonátoktól, oxidoktól és egyéb üledékektől és szennyeződésektől. Ebben az esetben speciális adalékokat használnak - inhibitorokat, amelyek megvédik a fémet az oldódástól és a korróziótól, de nem késleltetik az oxidok, karbonátok és más hasonló vegyületek feloldódását.
A HCl-t szintetikus gyanták, gumik ipari előállításához használják. Nyersanyagként használják metil-alkoholból metil-klorid, etilénből etil-klorid, acetilénből vinil-klorid előállítása során.
Elsősegélynyújtás és kezelési módszerek
Ha mérgezésre utaló jeleket találunk, mentőt kell hívni. Otthon megengedett az áldozat állapotának javítását célzó tevékenységek végzése. A sósavmérgezés elsősegélynyújtását gyorsan kell elvégezni a negatív következmények kockázatának csökkentése érdekében.
Események:
- Ha a sóvegyület a bőrre kerül, a sérült területeket bő hideg vízzel lemossuk. A feldolgozási idő legalább fél óra.
- Gőzmérgezés esetén az áldozatot friss levegőhöz kell juttatni, kinyitják az ablakokat, kigombolják a szűk ruhákat.
- Javasoljuk a beteg állapotának figyelemmel kísérését, életjelek hiányában újraélesztést kell végezni.
- A gőzök áldozata meleg teát, vizet inni. Az orrot és a szájat ajánlatos hideg vízzel öblíteni.
- Sav lenyeléséből eredő túladagolás esetén jégcsomagot helyeznek a hasra, hogy megakadályozzák vagy csökkentsék az esetleges vérzést.
- Gyógyszerkészítmények nem megengedettek. Megengedett, hogy a beteg egy pohár vizet (lehet ásványi lúgos). A folyadékot kis kortyokban kell inni.
- Nem szabad gyomrot mosni, otthon próbálja meg hányni. Az ilyen elsősegélynyújtás a torok égési sérüléséhez, vérzéshez vezethet.
A kezelést egészségügyi intézményben végzik szakemberek felügyelete mellett.
Terápia:
- Gyomortisztítás szondával,
- Cseppentő használata gyógyászati oldatokkal,
- Fájdalomcsillapító gyógyszerek felírása
- A szervek és rendszerek működésének helyreállítását célzó gyógyszerek alkalmazása,
- Szükség esetén oxigén inhaláció és mesterséges lélegeztetés,
- Újraélesztési terápia végzése életjelek hiányában,
- Vitaminok és speciális táplálkozás kiválasztása.
A kezelést intenzív osztályon, majd kórházban végzik. Az időtartam a beteg állapotától és a mérgezés mértékétől függ.
Égési sérülések és mérgezés
Bármennyire is hatékony ez a gyógymód, olyan veszélyes is. A sósav a koncentrációtól függően négy fokos kémiai égési sérülést okozhat:
- Csak bőrpír és fájdalom van.
- Tiszta folyadékkal és duzzadt buborékok vannak.
- A bőr felső rétegeinek kialakult nekrózisa.A hólyagok vérrel vagy zavaros tartalommal telnek meg.
- Az elváltozás eléri az inakat és az izmokat.
Ha az anyag valamilyen módon a szemébe került, vízzel, majd szódaoldattal ki kell öblíteni. De mindenesetre az első dolog, hogy mentőt kell hívni.
A belső sav lenyelése akut mellkasi és hasi fájdalmakkal, a gége duzzanatával, véres tömegek hányásával jár. Ennek eredményeként a máj és a vesék súlyos patológiái.
A páros mérgezés első jelei közé tartozik a száraz, gyakori köhögés, fulladás, a fogak károsodása, a nyálkahártya égése és a hasi fájdalom. Az első sürgősségi segítség a száj mosása és vízzel való öblítése, valamint a friss levegőhöz való hozzáférés. Csak egy toxikológus tud valódi segítséget nyújtani.
A kémiai spektrum tulajdonságai
A sav számos fémmel, sóval kölcsönhatásba lép. Meglehetősen erősnek tekinthető, és egy szinten van a zergével. A fő reakció a hidrogéntől balra található összes fémcsoportban (magnézium, vas, cink - elektromos potenciálok) nyilvánul meg.
A hidrogén-klorid oldat híg formában reakcióba lép a sókkal, de csak a kevésbé erős savak által képzett sóval. Az összes nátrium- és kalcium-karbonát ismert, a vele való kölcsönhatás után vízzé és szén-monoxiddá bomlik.
Salétromsav
- minőségi reakció sóoldattal. Megszerzéséhez ezüst-nitrátot kell hozzáadni ehhez a reagenshez, ennek eredményeként fehér csapadék képződik, amelyből nitrogénanyagot kapunk.
A víz és hidrogén keverékének segítségével számos érdekes kísérletet hajtanak végre. Például hígítsa fel ammóniával. Ennek eredményeként fehér füstöt kap, sűrű, kis kristályok állaga. A metil-amin, anilin, mangán-dioxid, kálium-karbonát olyan reagensek, amelyekre a sav is hatással van.
Hogyan és miért használják
Talán joggal ez az egyik fontos anyag, amely az emberi élet szinte minden ágában megtalálható és szükséges.
Alkalmazási terület lokalizációja:
- Kohászat. Felülettisztítás oxidált területekről, rozsdaoldás, forrasztás előtti kezelés, ónozás. A sósav segít kivonni a kis fémzárványokat az ércekből. A cirkóniumot és a titánt az oxidok kloridokká történő átalakításának módszerével állítják elő.
- Élelmiszer-technológiai ipar. Élelmiszer-adalékanyagként alacsony koncentrációjú oldatot használnak. A cukorbetegeknek szánt zselatin, fruktóz tiszta emulgeálószert tartalmaz. A közönséges szódában is magas ez az anyag. Az áru csomagolásán E507 néven láthatja.
- Az orvostudomány területe. A gyomor savas környezetének elégtelen mutatója és a belek problémái. Az alacsony pH rákhoz vezet. Még megfelelő táplálkozás, bőséges vitamin mellett sem szűnik meg a veszély, vizsgálatokat kell végezni a gyomornedv kinyerésére, mert nem kellően savas környezetben a hasznos anyagok gyakorlatilag nem szívódnak fel, az emésztés megzavarodik.
- A sóoldatot gátlószerként használják - védelem a szennyeződések és fertőzések ellen, antiszeptikus hatás. Ragasztókeverékek, kerámiatermékek gyártásához. Öblíti a hőcserélőket.
- Az ivóvíz tisztításának eljárása sem teljes a klór részvétele nélkül.
- Gumigyártás, szövetalapok fehérítése.
- Ezzel a megoldással gondoskodhat lencséiről.
- Szájvíz otthon
- Az anyag kiváló elektromos vezető.
Hogyan történik a mérgezés
A sósav színtelen folyadék, jellegzetes szúrós szaggal. Az egyik legerősebb sav, amely képes egyes fémeket feloldani. Könnyen gázzá alakul.
A hidrogén-kloridot a textiliparban, a bőriparban, a nemesfémkohászatban, ragasztók, savak gyártásában használják.
Az anyag minimális koncentrációban van jelen a gyomorban. A sav hozzájárul az emésztési folyamat normalizálásához, védi a szervezetet a káros baktériumoktól és mikroorganizmusoktól.
24%-ot meghaladó koncentrációban a sósav visszafordíthatatlan károkat okozhat az emberi szervezetben. A levegővel érintkezve képződő gőzök irritálják a látó- és légzőrendszer szerveit.
Számos tényező provokálhatja a mérgezés kialakulását.
Tényezők:
Gőzmérgezés lehetséges rossz szellőzésű helyiségekben,
Gondatlanságból történő lenyelés, gyakrabban gyermekeknél,
Sósav bejutása az epidermiszbe, a nyálkahártyákba a reagens használatára vonatkozó szabályok be nem tartása esetén.
Felnőtteknél otthoni anyagmérgezés a bőr, a szem és a légzőszervek védőfelszerelés nélküli használatának eredményeként következik be. Mérgezés léphet fel, ha a sav pontatlanul kerül át egyik tartályból a másikba.
Farmakodinamika és farmakokinetika
Mi a gyomor savassága? Ez a gyomor sósavkoncentrációjának jellemzője. A savasság mértékegysége pH
. Normális esetben savat kell termelni a gyomornedv összetételében, és aktívan részt kell venni az emésztési folyamatokban. A sósav képlete: HCl
. A fundus mirigyekben található parietális sejtek termelik, részvételével H+/K+-ATPáz
. Ezek a sejtek borítják a gyomor fundusát és testét. Maga a gyomornedv savassága változó, és a parietális sejtek számától és az anyagnak a gyomornedv lúgos komponensei általi semlegesítési folyamatainak intenzitásától függ. A termelt koncentráció - Ön stabil és 160 mmol/l. Egy egészséges ember általában legfeljebb 7 és legalább 5 mmol anyagot termelhet óránként.
A sósav elégtelen vagy túlzott termelésével az emésztőrendszer betegségei lépnek fel, romlik bizonyos mikroelemek, például vas felszívódásának képessége. A gyógyszer serkenti a gyomornedv kiválasztását, csökkenti pH
. Aktiválja pepszinogén
, aktív enzimmé alakítja át pepszin
. Az anyag jótékony hatással van a gyomor savas reflexére, lelassítja a nem teljesen megemésztett tápláléknak a belekbe való átjutását. Az emésztőrendszer tartalmának fermentációs folyamatai lelassulnak, a fájdalom és a böfögés megszűnik, a vas jobban felszívódik.
Szájon át történő beadás után a gyógyszert részben a nyál és a gyomornyálka metabolizálja, a duodenum tartalma 12. A meg nem kötött anyag behatol a nyombélbe, ahol lúgos tartalma teljesen semlegesíti.
A sav újabb felhasználása a mindennapi életben
Savas összetételével könnyedén eltávolíthatja a vízkő- és rozsdakövet a fajansz vízvezetékről, eltávolíthatja a húgykövet és egyéb szennyeződéseket. A nagyobb hatás érdekében inhibitort (például urotropint) adnak a szerhez, ami lelassítja a kémiai reakciót.
Az eljárást a következőképpen hajtjuk végre: a savat vízzel hígítjuk 5%-os koncentráció eléréséig, majd 0,5 g/1 liter folyadék mennyiségben inhibitort adunk hozzá. A felületet a kapott készítménnyel kezeljük, és 30-40 percig hagyjuk állni (a szennyeződés mértékétől függően), majd vízzel mossuk.
Enyhe savas oldatot is használnak a bogyófoltok, tinta- vagy rozsdafoltok eltávolítására a szövetekről. Ehhez az anyagot egy ideig áztatják a készítményben, majd alaposan leöblítik és a szokásos módon mossák.
A vízkő eltávolítása a vízforralóban
Erre a célra 3-5%-os sósavoldatot használnak, amit egy vízforralóba öntenek és 60-80 fokra melegítenek.°
C-on 1-2 órán át, vagy amíg a vízkőlerakódások fel nem bomlanak. Ezt követően a pikkely meglazul, és egy fa spatulával könnyen eltávolítható.
A módszer hatékonysága annak köszönhető, hogy a reagens reakcióba lép magnézium- és kalcium-karbonátokkal, és azokat oldható sókká alakítja. Az egyidejűleg felszabaduló szén-dioxid tönkreteszi a vízkőréteget, fellazítja azt. A sólerakódások eltávolítása után az edényeket tiszta vízzel alaposan elmossák.
Fontos pont!
Ez a módszer nem alkalmas töredezett és repedezett zománcozott vagy alumínium vízforralók vízkőmentesítésére: ez korrodálja a fémet és súlyosan károsítja azt.
Anyag beszerzése
Most beszélhetünk arról, hogy mit tesznek a sósav előállítására.
Először a hidrogén klórban való elégetésével a fő komponenst, a gáz halmazállapotú hidrogén-kloridot kapják. amelyet azután vízben oldunk. Ennek az egyszerű reakciónak az eredménye egy szintetikus sav.
Ez az anyag távozó gázokból is nyerhető. Ezek vegyi hulladék (mellék)gázok. Különféle folyamatok révén jönnek létre. Például szénhidrogének klórozásánál. Az összetételükben lévő hidrogén-kloridot füstgáznak nevezik. És az így kapott sav, ill.
Meg kell jegyezni, hogy az elmúlt években a füstgáz részaránya a teljes termelési mennyiségben nőtt. A hidrogén klórban való elégetése következtében keletkező sav pedig kiszorul. Az igazságosság kedvéért azonban meg kell jegyezni, hogy kevesebb szennyeződést tartalmaz.
Termelési felhasználás
Széles körben alkalmazható a kohászati, élelmiszer- és orvosi iparban.
- Kohászat. Fémek forrasztására, ónozására és tisztítására használható.
- Élelmiszeripar. Alkalmazás élelmiszerek savasságát szabályozó anyagok, például E507 gyártásában.
- Elektrotípia. Pácoláshoz használják.
- Orvosság. Alkalmazását mesterséges gyomornedv előállításában találja meg.
Szintetikus színezékek közé tartozik. Tisztító- és tisztítószerek gyártásához használják. De a háztartási használatra szánt folyadékokban a kénsav koncentrációja elhanyagolható.
Hogyan állítják elő a sósavat a laboratóriumban
Az anyag előállítása nagyüzemi, értékesítése ingyenes. Laboratóriumi kísérletek körülményei között nagy koncentrációjú kénsav közönséges konyhasó (nátrium-klorid) hatására oldatot állítanak elő.
A hidrogén-klorid vízben való feloldására két módszer létezik:
- A hidrogént klórban égetik (szintetikus).
- Kapcsolódó (üreggáz). Lényege a szerves klórozás, dehidroklórozás végrehajtása.
Az anyag jól alkalmas a szintézisre a szerves klórból származó hulladék pirolízise során. Ez a szénhidrogének teljes oxigénhiányos lebomlásának eredményeként következik be. Használhat fém-kloridokat is, amelyek szervetlen anyagok alapanyagai. Ha nincs tömény kénsav (elektrolit), hígítva vegye be.
Ami a reagens természetes körülmények közötti extrakcióját illeti, ez a kémiai keverék leggyakrabban a vulkáni hulladék vizében található. A hidrogén-klorid a szilvin (kálium-klorid, úgy néz ki, mint a játékokhoz való csont), a bischofit ásványi anyag összetevője. Mindezek az anyagok ipari kinyerésének módszerei.
Emberben ez az enzim a gyomorban található. Az oldat lehet sav vagy bázis. Az egyik leggyakoribb extrakciós módszer a szulfát.
Kémiai tulajdonságok
Sósav, hidrogén-klorid vagy sósav - oldat Hcl
vízben. A Wikipédia szerint az anyag a szervetlen erős egybázisú to-t csoportjába tartozik. A vegyület teljes neve latinul: sósav.
A sósav képlete a kémiában: HCl
. Egy molekulában a hidrogénatomok halogénatomokkal egyesülnek - Cl
. Ha figyelembe vesszük ezeknek a molekuláknak az elektronikus konfigurációját, akkor megállapítható, hogy a vegyületek részt vesznek a molekulapályák kialakításában. 1s
-hidrogénpályák és mindkettő 3s
és 3p
-az atom pályái Cl
. A sósav kémiai képletében 1s-
, 3s-
és 3p
- az atompályák átfedik egymást, és 1, 2, 3 pályát alkotnak. Ahol 3s
-orbital nem kötelező. Az elektronsűrűség eltolódik az atom felé Cl
és a molekula polaritása csökken, de a molekulapályák kötési energiája nő (ha másokkal együtt vesszük hidrogén-halogenidek
).
A hidrogén-klorid fizikai tulajdonságai. Tiszta, színtelen folyadék, amely levegővel érintkezve füstölög. Egy kémiai vegyület moláris tömege = 36,6 gramm/mol. Normál körülmények között, 20 Celsius fokos levegőhőmérséklet mellett az anyag maximális koncentrációja 38 tömeg%. A tömény sósav sűrűsége ebben az oldatban 1,19 g/cm3. Általában a fizikai tulajdonságok és jellemzők, mint például a sűrűség, molaritás, viszkozitás, hőkapacitás, forráspont és pH
, erősen függ az oldat koncentrációjától. Ezeket az értékeket részletesebben a sűrűségtáblázat tárgyalja. Például a 10%-os sósav sűrűsége = 1,048 kg literenként. Megszilárdulva az anyag képződik kristályos hidrátok
különböző kompozíciók.
A sósav kémiai tulajdonságai. Mivel reagál a sósav? Az anyag kölcsönhatásba lép a fémekkel, amelyek a hidrogén előtt állnak egy sor elektrokémiai potenciálban (vas, magnézium, cink és mások). Ebben az esetben sók képződnek és gáz halmazállapotúak H
. Az ólom, réz, arany, ezüst és más fémek a hidrogéntől jobbra nem lépnek reakcióba a sósavval. Az anyag reakcióba lép fém-oxidokkal, vizet és oldható sót képezve. Nátrium-hidroxid formák és víz hatására. A semlegesítési reakció jellemző erre a vegyületre.
A híg sósav reakcióba lép fémsókkal, amelyeket gyengébb savak képeznek. Például, propionsav
gyengébb, mint a só. Az anyag nem lép reakcióba erősebb savakkal. és nátrium-karbonát
reakció után képződik HCl
klorid, szén-monoxid és víz.
Egy kémiai vegyületre jellemzőek az erős oxidálószerekkel való reakciók, a mangán-dioxid
, kálium-permanganát
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. Az anyag reakcióba lép ammónia
, amely sűrű fehér füstöt termel, amely nagyon kicsi ammónium-klorid kristályokból áll. Az ásványi piroluzit a sósavval is reakcióba lép, mivel tartalmaz mangán-dioxid
: MnO2+4HCl=Cl2+MnO2+2H2O
(oxidációs reakció).
A sósavval és sóival minőségi reakció lép fel. Amikor egy anyag kölcsönhatásba lép ezüst nitrát
fehér csapadék ezüst-klorid
és kialakult salétromsav
. Kölcsönhatási reakció egyenlete metil-amin
hidrogén-kloriddal így néz ki: HCl + CH3NH2 = (CH3NH3)Cl
.
Egy anyag reagál gyenge bázissal anilin
. Az anilin vízben való feloldása után sósavat adunk az elegyhez. Ennek eredményeként az alap feloldódik és kialakul anilin-hidroklorid
(fenil-ammónium-klorid
): (С6Н5NH3)Cl
. Az alumínium-karbid és a sósav kölcsönhatásának reakciója: Al4C3+12HCL=3CH4+4AICl3
. Reakcióegyenlet Kálium-karbonát
amivel így néz ki: K2CO3 + 2HCl = 2KCl + H2O + CO2.
Alkalmazás
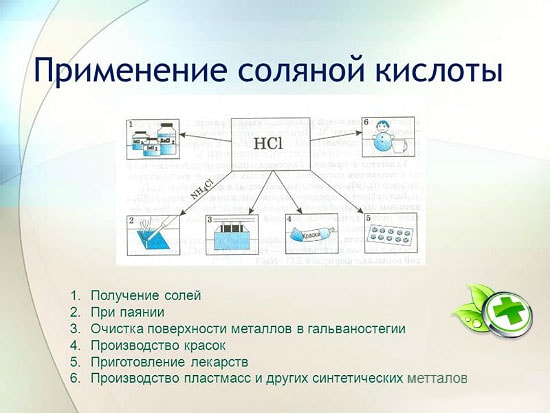
a kohászatban ércek kitermelése, rozsda, vízkő, szennyeződés és oxidok eltávolítása, forrasztás és ónozás;
szintetikus gumik és gyanták gyártása során;
galvanizálásban;
savasságszabályozóként az élelmiszeriparban;
fém-kloridok előállítása;
klór kinyerésére;
a gyógyászatban a gyomornedv elégtelen savasságának kezelésére;
tisztító- és fertőtlenítőszerként.
- (HCl), hidrogén-klorid vizes oldata, színtelen, szúrós szagú gáz. Kénsav konyhasó hatására, szénhidrogének klórozásának melléktermékeként, vagy hidrogén és klór reakciójával nyerik. A sósavat használják ... ... Tudományos és műszaki enciklopédikus szótárhoz
Sósav
- - A HCl (SC) (sósav, sósav, hidrogén-klorid) hidrogén-klorid (HCl) vizes oldata, fagyálló adalék. Színtelen, szúrós szagú folyadék, lebegő részecskék nélkül ... ... Építőanyagok kifejezések, definíciók és magyarázatok enciklopédiája
SÓSAV
- (sósav) hidrogén-klorid vizes oldata; erős sav. Levegőben füstölgő színtelen folyadék (a műszaki sósav sárgás színű a vas-, klór-, stb. szennyeződések miatt). A maximális koncentráció (20 °C-on) 38 tömegszázalék, ... ... Big Encyclopedic Dictionary
SÓSAV
- (Acidum muriaticum, Acid, hydrochloricum), hidrogén-klorid (HC1) vizes oldata. A természetben előfordul bizonyos vulkáni eredetű források vizében, és megtalálható a gyomornedvben is (legfeljebb 0,5%). A hidrogén-klorid beszerezhető ... Big Medical Encyclopedia
SÓSAV
- (sósav, sósav) erős egybázisú, szúrós szagú illékony sav, vizes hidrogén-klorid oldat; a maximális koncentráció 38 tömeg%, az ilyen oldat sűrűsége 1,19 g/cm3. Használt ... ... orosz munkavédelmi enciklopédiában
SÓSAV
- (sósav) HCl vizes hidrogén-klorid oldat, erős egybázisú sav, illékony, szúrós szagú; a vas szennyeződései, klór sárgássá festik. Az eladandó koncentrált S. 37% ... ... Big Polytechnic Encyclopedia
sósav
— főnév, szinonimák száma: 1 sav (171) ASIS Szinonimszótár. V.N. Trishin. 2013 ... Szinonim szótár
SÓSAV
Modern Enciklopédia
Sósav
- HIDROGÉN SAV, hidrogén-klorid vizes oldata HCl; szúrós szagú füstölgő folyadék. A sósavat különféle kloridok előállítására, fémek pácolására, ércek feldolgozására, klór, szóda, gumi stb. előállítására használják. ... ... Illusztrált enciklopédikus szótár
sósav
- (sósav), hidrogén-klorid vizes oldata; erős sav. Levegőben "füstölgő" színtelen folyadék (a műszaki sósav sárgás színű a vas-, klór-, stb. szennyeződések miatt). Maximális koncentráció (20 °C-on) 38 tömeg%, ... ... Enciklopédiai szótár
Mi a mérgezés veszélye
A sósav különösen veszélyes az emberi szervezetre. Ilyen anyaggal való mérgezés esetén súlyos szövődmények és a szervezet működésének megsértése alakulhat ki.
Komplikációk:
- A máj megsértése toxikus hepatitis következtében,
- Gyomorvérzés a szerv tönkrement falai miatt,
- Fájdalomból eredő sokkos állapot, amikor a sav nagy területre kerül,
- Szembe kerülés esetén látásromlás,
- Súlyos veseműködési zavar,
- Légzési elégtelenség, fulladás, légszomj,
- A kóma kialakulása.
Hasonló következmények fokozatosan alakulnak ki a mérgezés mértékétől függően.
Következtetés
Ha betartja az óvintézkedéseket és a biztonsági szabályokat, a sósav nélkülözhetetlen asszisztenssé válik a mindennapi életben. Cégünknél pedig a legkedvezőbb áron vásárolhatja meg.
Mint a savak. Az oktatási program előírja, hogy a tanulók memorizálják e csoport hat képviselőjének nevét és képletét. És átnézve a tankönyvben található táblázatot, észreveszi a savak listáján azt, amelyik az első helyen áll, és elsősorban érdekli Önt - a sósavat. Sajnos az iskola osztálytermében nem tanulmányozzák sem az ingatlant, sem az ezzel kapcsolatos egyéb információkat. Ezért azok, akik az iskolai tananyagon kívül szeretnek ismereteket szerezni, mindenféle forrásban keresnek további információkat. De gyakran sokan nem találják meg a szükséges információkat. Ezért a mai cikk témája ennek a savnak szól.
Meghatározás
A sósav egy erős egybázisú sav. Egyes forrásokban sósavnak és sósavnak, valamint hidrogén-kloridnak is nevezik.
Fizikai tulajdonságok
Ez egy színtelen és füstölgő maró folyadék a levegőben (fotó a jobb oldalon). A műszaki sav azonban sárgás színű a benne lévő vas, klór és egyéb adalékanyagok miatt. Legnagyobb koncentrációja 20 °C hőmérsékleten 38%. A sósav sűrűsége ilyen paraméterekkel 1,19 g/cm 3. De ennek a különböző telítettségi fokú vegyületnek teljesen eltérő adatai vannak.A koncentráció csökkenésével csökken a molaritás, a viszkozitás és az olvadáspont számértéke, de nő a fajlagos hőkapacitás és a forráspont. Bármilyen koncentrációjú sósav megszilárdulása különféle kristályos hidrátokat eredményez.
Kémiai tulajdonságok
Minden fém, amely feszültségük elektrokémiai sorozatában a hidrogén előtt van, kölcsönhatásba léphet ezzel a vegyülettel, sókat képezve és hidrogéngázt szabadítva fel. Ha ezeket fém-oxidokkal helyettesítjük, akkor a reakciótermékek oldható só és víz lesz. Ugyanez a hatás lesz a sósav és a hidroxidok kölcsönhatásában. Ha azonban fémsót (például nátrium-karbonátot) adunk hozzá, amelynek maradékát egy gyengébb savból (szén) vették, akkor ennek a fémnek a kloridját (nátrium), vizet és a savnak megfelelő gázt. maradék (jelen esetben szén-dioxid) képződik.
Nyugta
A most tárgyalt vegyület akkor keletkezik, amikor a hidrogén klórban való elégetésével nyerhető hidrogén-klorid gázt vízben oldunk. Az ezzel a módszerrel előállított sósavat szintetikusnak nevezik. A füstgázok forrásként is szolgálhatnak ennek az anyagnak a kinyeréséhez. És az ilyen sósavat füstgáznak nevezik. A közelmúltban a sósav termelési szintje ezzel a módszerrel sokkal magasabb, mint a szintetikus módszerrel történő előállítás szintje, bár ez utóbbi tisztább formában adja a vegyületet. Ezek mind az iparban való megszerzésének módjai. A laboratóriumokban azonban a sósavat háromféleképpen állítják elő (az első kettő csak a hőmérsékletben és a reakciótermékekben különbözik), különféle típusú kémiai kölcsönhatások segítségével, például:
- Telített kénsav hatása nátrium-kloridra 150°C-on.
- A fenti anyagok kölcsönhatása 550 ° C és annál magasabb hőmérsékletű körülmények között.
- Alumínium- vagy magnézium-kloridok hidrolízise.
Alkalmazás
A hidrometallurgia és az elektroformázás nem nélkülözheti a sósav felhasználását, ahol szükséges, a fémek felületének tisztítására ónozás és forrasztás során, valamint mangán, vas, cink és más fémek kloridjainak előállítása. Az élelmiszeriparban ezt a vegyületet E507 élelmiszer-adalékanyagként ismerik – ott egy savanyúságot szabályozó anyag, amely a seltzer (szóda)víz előállításához szükséges. A tömény sósav minden ember gyomornedvében is megtalálható, és segíti az élelmiszerek emésztését. Ennek során a telítettségi foka csökken, mert. ezt a készítményt étellel hígítják. Azonban hosszan tartó koplalás esetén a sósav koncentrációja a gyomorban fokozatosan növekszik. És mivel ez a vegyület nagyon maró hatású, gyomorfekélyhez vezethet.
Következtetés
A sósav hasznos és káros is lehet az emberre. Bőrrel való érintkezése súlyos kémiai égési sérüléseket okoz, és ennek a vegyületnek a gőzei irritálják a légutakat és a szemet.
De ha óvatosan kezeli ezt az anyagot, többször is jól jöhet