Vandenilio chlorido rūgšties naudojimas
Vandenilio chlorido rūgštis plačiai naudojama pramonėje metalams iš rūdų išgauti, metalams ėsdinti ir kt. Ji taip pat naudojama litavimo skysčio gamyboje, sidabro nusodinimui ir kaip neatskiriama vandens regio dalis.
Pramonėje druskos rūgštis naudojama mažesnė nei azoto rūgšties. Taip yra dėl to, kad druskos rūgštis sukelia plieno įrangos koroziją. Be to, jo lakieji garai yra gana kenksmingi ir taip pat sukelia metalo gaminių koroziją. Į tai reikia atsižvelgti laikant druskos rūgštį. Vandenilio chlorido rūgštis laikoma ir gabenama guma išklotose talpyklose ir statinėse, t.y. induose, kurių vidinis paviršius padengtas rūgštims atsparia guma, taip pat stikliniuose buteliuose ir polietileniniuose induose.
Vandenilio chlorido rūgštis naudojama cinko, mangano, geležies ir kitų metalų chloridams, taip pat amonio chloridui gaminti. Druskos rūgštis naudojama metalų, indų, šulinių paviršiams valyti nuo karbonatų, oksidų ir kitų nuosėdų bei teršalų. Šiuo atveju naudojami specialūs priedai – inhibitoriai, apsaugantys metalą nuo tirpimo ir korozijos, tačiau nevilkinantys oksidų, karbonatų ir kitų panašių junginių tirpimo.
HCl naudojamas pramoninėje sintetinių dervų, kaučiuko gamyboje. Jis naudojamas kaip žaliava gaminant metilchloridą iš metilo alkoholio, etilo chloridą iš etileno ir vinilchloridą iš acetileno.
Pirmosios pagalbos ir gydymo metodai
Jei aptinkami apsinuodijimo požymiai, reikia kviesti greitąją pagalbą. Namuose leidžiama vykdyti veiklą, kuria siekiama pagerinti nukentėjusiojo būklę. Pirmoji pagalba apsinuodijus druskos rūgštimi turėtų būti suteikta greitai, kad sumažėtų neigiamų pasekmių rizika.
Renginiai:
- Jei druskos junginio pateko ant odos, pažeistos vietos nuplaunamos dideliu kiekiu vėsaus vandens. Apdorojimo laikas yra mažiausiai pusvalandis.
- Apsinuodijus garais, nukentėjusiajam suteikiama galimybė patekti į gryną orą, atidaromi langai, atsegami aptempti drabužiai.
- Rekomenduojama stebėti paciento būklę, nesant gyvybės požymių, atliekamas gaivinimas.
- Aukai nuo garų leidžiama atsigerti šiltos arbatos, vandens. Rekomenduojama išskalauti nosį ir burną vėsiu vandeniu.
- Perdozavus nurijus rūgšties, ant pilvo uždedamas ledo paketas, kad būtų išvengta arba sumažintas galimas kraujavimas.
- Neleidžiami jokie vaistiniai preparatai. Leidžiama pacientui duoti stiklinę vandens (galite mineralinio šarminio). Skystį reikia gerti mažais gurkšneliais.
- Neleidžiama plauti skrandžio, bandyti sukelti vėmimą namuose. Tokia pirmoji pagalba gali sukelti gerklės nudegimus, kraujavimą.
Gydymas atliekamas gydymo įstaigoje, prižiūrint specialistams.
Terapija:
- Skrandžio valymas zondu,
- Lašintuvų naudojimas su vaistiniais tirpalais,
- Vaistų skyrimas skausmui malšinti
- Vaistų, skirtų organų ir sistemų veiklai atkurti, naudojimas;
- Jei reikia, deguonies įkvėpimas ir dirbtinė plaučių ventiliacija,
- Atliekant gaivinimo terapiją, kai nėra gyvybės ženklų,
- Vitaminų ir specialios mitybos pasirinkimas.
Gydymas atliekamas intensyviosios terapijos skyriuje, o vėliau - ligoninėje. Trukmė priklauso nuo paciento būklės ir apsinuodijimo laipsnio.
Nudegimai ir apsinuodijimas
Kad ir kaip ši priemonė būtų veiksminga, ji pavojinga. Vandenilio chlorido rūgštis, priklausomai nuo koncentracijos, gali sukelti keturių laipsnių cheminį nudegimą:
- Yra tik paraudimas ir skausmas.
- Yra pūslių su skaidriu skysčiu ir patinimu.
- Susiformavo viršutinių odos sluoksnių nekrozė.Pūslelės prisipildo kraujo arba drumsto turinio.
- Pažeidimas pasiekia sausgysles ir raumenis.
Jei medžiaga kažkaip pateko į akis, jas reikia nuplauti vandeniu, o po to - sodos tirpalu. Bet kokiu atveju pirmiausia reikia iškviesti greitąją pagalbą.
Rūgšties nurijimas viduje yra kupinas ūmių krūtinės ir pilvo skausmų, gerklų patinimo, vėmimo kruvinomis masėmis. Dėl to sunkios kepenų ir inkstų patologijos.
O pirmieji apsinuodijimo požymiai poromis – sausas dažnas kosulys, užspringimas, dantų pažeidimai, gleivinės deginimas ir pilvo skausmas. Pirmoji skubi pagalba – burnos plovimas ir skalavimas vandeniu, taip pat galimybė patekti į gryną orą. Tik toksikologas gali suteikti realią pagalbą.
Cheminio spektro savybės
Rūgštis sąveikauja su daugeliu metalų, druskų. Jis laikomas gana stipriu ir prilygsta zomšai. Pagrindinė reakcija pasireiškia visose metalų grupėse, esančiose kairėje nuo vandenilio (magnis, geležis, cinkas – elektriniai potencialai).
Atskiestas vandenilio chlorido tirpalas reaguoja su druskomis, bet tik su tomis, kurias sudaro mažiau stiprios rūgštys. Žinomas visiems natrio ir kalcio karbonatams, po sąveikos su juo jie skyla į vandenį ir anglies monoksidą.
Azoto rūgštis
- kokybinė reakcija į druskos tirpalą. Norint jį gauti, į šį reagentą reikia įpilti sidabro nitrato, dėl to susidarys baltos nuosėdos, iš kurių gaunama azoto medžiaga.
Šio vandens ir vandenilio mišinio pagalba atliekama daug įdomių eksperimentų. Pavyzdžiui, praskieskite jį amoniaku. Dėl to gausite baltus, tirštus, mažų kristalų konsistencijos dūmus. Metilaminas, anilinas, mangano dioksidas, kalio karbonatas yra reagentai, kuriuos taip pat veikia rūgštis.
Kaip ir kodėl jis naudojamas
Galbūt tai pagrįstai viena iš svarbių medžiagų, randamų ir reikalingų beveik visose žmogaus gyvenimo srityse.
Taikymo srities lokalizacija:
- Metalurgija. Paviršių valymas nuo oksiduotų vietų, rūdžių tirpinimas, apdorojimas prieš litavimą, skardinimas. Druskos rūgštis padeda iš rūdų išgauti nedidelius metalų intarpus. Cirkonis ir titanas gaunami naudojant oksidų pavertimo chloridais metodą.
- Maisto technologijų pramonė. Mažos koncentracijos tirpalas naudojamas kaip maisto priedas. Želatina, fruktozė diabetikams turi gryno emulsiklio. Įprastoje soda taip pat yra daug šios medžiagos. Ant prekių pakuotės jį matysite pavadinimu E507.
- Medicinos sritis. Su nepakankamu rūgštinės aplinkos skrandyje rodikliu ir žarnyno problemomis. Žemas Ph sukelia vėžį. Net ir tinkamai maitinantis, vitaminų gausa, pavojus neišnyksta, būtina atlikti tyrimus, norint gauti sulčių iš skrandžio trakto, nes nepakankamai rūgščioje aplinkoje naudingosios medžiagos praktiškai nepasisavinamos, sutrinka virškinimas.
- Druskos tirpalas naudojamas kaip inhibitorius – apsauga nuo nešvarumų ir infekcijų, veikia antiseptiškai. Klijų mišinių, keramikos gaminių gamybai. Jis išplauna šilumokaičius.
- Geriamojo vandens valymo procedūra taip pat neapsieina be chloro.
- Gumos gamyba, audinių pagrindų balinimas.
- Naudodami šį sprendimą galite pasirūpinti savo lęšiais.
- Burnos skalavimo skystis namuose
- Medžiaga yra puikus elektros laidininkas.
Kaip įvyksta apsinuodijimas
Vandenilio chlorido rūgštis yra bespalvis skystis, turintis būdingą aštrų kvapą. Viena stipriausių rūgščių, galinti ištirpinti kai kuriuos metalus. Lengvai virsta dujomis.
Vandenilio chloridas naudojamas tekstilės pramonėje, odos versle, tauriųjų metalų metalurgijoje, klijų, rūgščių gamyboje.
Skrandyje medžiagos yra minimalioje koncentracijoje. Rūgštis prisideda prie virškinimo proceso normalizavimo, apsaugo organizmą nuo kenksmingų bakterijų ir mikroorganizmų.
Kai koncentracija viršija 24%, druskos rūgštis gali padaryti negrįžtamą žalą žmogaus organizmui. Sąlytyje su oru susidarę garai dirgina regos ir kvėpavimo sistemos organus.
Yra keletas veiksnių, galinčių išprovokuoti apsinuodijimo vystymąsi.
Faktoriai:
Apsinuodijimas garais galimas dirbant patalpose su bloga ventiliacija,
Prarijus dėl neatsargumo, dažniau vaikams,
Vandenilio chlorido rūgšties patekimas į epidermį, gleivines, jei nesilaikoma reagento naudojimo taisyklių.
Apsinuodijimas medžiaga namuose suaugusiems įvyksta vartojant be odos, akių ir kvėpavimo sistemos organų apsaugos priemonių. Apsinuodijimas gali atsirasti, kai rūgštis netiksliai perkeliama iš vienos talpos į kitą.
Farmakodinamika ir farmakokinetika
Kas yra skrandžio rūgštingumas? Tai būdinga druskos rūgšties koncentracijai skrandyje. Rūgštingumas išreiškiamas pH
. Paprastai rūgštis turi būti gaminama skrandžio sulčių sudėtyje ir aktyviai dalyvauti virškinimo procesuose. Vandenilio chlorido rūgšties formulė: HCl
. Jį gamina parietalinės ląstelės, esančios dugno liaukose, dalyvaujant H+/K+-ATPazė
. Šios ląstelės iškloja skrandžio dugną ir kūną. Pačios skrandžio sulčių rūgštingumas yra įvairus ir priklauso nuo parietalinių ląstelių skaičiaus ir medžiagos neutralizavimo procesų, vykstančių skrandžio sulčių šarminiais komponentais, intensyvumo. Koncentracija pagaminta iki – esate stabilus ir lygi 160 mmol/l. Sveikas žmogus paprastai turi pagaminti ne daugiau kaip 7 ir ne mažiau kaip 5 mmol medžiagos per valandą.
Nepakankamai arba per daug gaminant druskos rūgštį, susergama virškinamojo trakto ligomis, pablogėja gebėjimas pasisavinti tam tikrus mikroelementus, pavyzdžiui, geležį. Vaistas skatina skrandžio sulčių išsiskyrimą, mažina pH
. Suaktyvina pepsinogenas
, paverčia jį aktyviu fermentu pepsinas
. Medžiaga teigiamai veikia skrandžio rūgšties refleksą, lėtina nevisiškai suvirškinto maisto perėjimą į žarnyną. Sulėtėja virškinamojo trakto turinio rūgimo procesai, išnyksta skausmas, raugėjimas, geriau pasisavinama geležis.
Išgėrus, vaistas iš dalies metabolizuojamas su seilėmis ir skrandžio gleivėmis, dvylikapirštės žarnos turinys 12. Nesusijusi medžiaga prasiskverbia į dvylikapirštę žarną, kur ją visiškai neutralizuoja šarminis turinys.
Kitas rūgšties panaudojimas kasdieniame gyvenime
Rūgščios sudėties dėka lengvai nuvalysite kalkių nuosėdas ir rūdis nuo fajanso santechnikos, pašalinsite šlapimo akmenį ir kitus teršalus. Siekiant didesnio poveikio, prie agento pridedamas inhibitorius (pavyzdžiui, urotropinas), kuris sulėtina cheminę reakciją.
Procedūra atliekama taip: rūgštis skiedžiama vandeniu, kol pasiekiama 5% koncentracija, ir pridedama inhibitorių 0,5 g 1 litrui skysčio. Paviršius apdorojamas gauta kompozicija ir paliekamas 30-40 minučių (priklausomai nuo užterštumo laipsnio), po to nuplaunamas vandeniu.
Švelnios rūgšties tirpalas taip pat naudojamas uogų dėmėms, rašalo ar rūdžių dėmėms iš audinių pašalinti. Norėdami tai padaryti, medžiaga kurį laiką mirkoma kompozicijoje, po to ji kruopščiai nuplaunama ir nuplaunama įprastu būdu.
Atsikratykite nuosėdų virdulyje
Tam naudojamas 3-5% druskos rūgšties tirpalas, kuris supilamas į virdulį ir pašildomas iki 60-80°
C 1-2 valandas arba tol, kol nuosėdos suirs. Po to apnašos atsilaisvina ir lengvai pašalinamos medine mentele.
Metodo efektyvumą lemia tai, kad reagentas reaguoja su magnio ir kalcio karbonatais ir paverčia juos tirpiomis druskomis. Tuo pačiu metu išsiskiriantis anglies dioksidas ardo apnašų sluoksnį ir daro jį purią. Pašalinus druskos nuosėdas, indai kruopščiai nuplaunami švariu vandeniu.
Svarbus punktas!
Šis metodas netinka nukalkinimui nuo nuskilusių ir įtrūkusių emalio ar aliuminio virdulių: tai sugadins metalą ir smarkiai sugadins.
Medžiagos gavimas
Dabar galime kalbėti apie tai, ką jie daro, kad susidarytų druskos rūgštis.
Pirma, deginant vandenilį chlore, gaunamas pagrindinis komponentas – dujinis vandenilio chloridas. kuris vėliau ištirpinamas vandenyje. Šios paprastos reakcijos rezultatas yra sintetinės rūgšties susidarymas.
Šią medžiagą taip pat galima gauti iš išmetamųjų dujų. Tai yra cheminių atliekų (šoninės) dujos. Jie susidaro vykstant įvairiems procesams. Pavyzdžiui, chloruojant angliavandenilius. Jų sudėtyje esantis vandenilio chloridas vadinamas išmetamosiomis dujomis. Ir atitinkamai gauta rūgštis.
Pažymėtina, kad pastaraisiais metais išmetamųjų dujų dalis bendroje jos gamybos apimtyje didėja. O rūgštis, susidariusi deginant vandenilį chlore, išstumiama. Tačiau teisingumo dėlei reikia pažymėti, kad jame yra mažiau priemaišų.
Gamybos naudojimas
Jis plačiai naudojamas metalurgijos, maisto ir medicinos pramonėje.
- Metalurgija. Naudojamas lituojant, skardinant ir valant metalus.
- Maisto pramone. Taikymas gaminant maisto rūgštingumą reguliuojančias medžiagas, pavyzdžiui, E507.
- Elektrotipas. Naudojamas marinavimui.
- Vaistas. Jis naudojamas gaminant dirbtines skrandžio sultis.
Įeina į sintetinius dažus. Jis naudojamas valymo ir plovimo priemonių gamyboje. Tačiau buitiniam naudojimui skirtuose skysčiuose sieros rūgšties koncentracija yra nereikšminga.
Kaip laboratorijoje gaminama druskos rūgštis
Medžiagos gamyba yra didelė, pardavimas nemokamas. Laboratorinių eksperimentų sąlygomis tirpalas gaunamas veikiant didelės koncentracijos sieros rūgštį įprastą virtuvinę druską (natrio chloridą).
Yra 2 vandenilio chlorido ištirpinimo vandenyje būdai:
- Vandenilis deginamas chloru (sintetinis).
- Susijusios (išmetamos dujos). Jo esmė yra organinis chlorinimas, dehidrochlorinimas.
Medžiaga puikiai tinka sintezei pirolizės metu atliekas iš organinio chloro. Taip nutinka dėl angliavandenilių skilimo, kai visiškai trūksta deguonies. Taip pat galite naudoti metalų chloridus, kurie yra neorganinių medžiagų žaliavos. Jei nėra koncentruotos sieros rūgšties (elektrolito), paimkite praskiestą.
Kalbant apie reagento išgavimą natūraliomis sąlygomis, dažniausiai šio cheminio mišinio galima rasti vulkaninių atliekų vandenyse. Vandenilio chloridas yra mineralų silvinas (kalio chloridas, atrodo kaip kaulai žaidimams), bischofitas. Visa tai yra medžiagos išgavimo pramonėje metodai.
Žmonėms šis fermentas randamas skrandyje. Tirpalas gali būti rūgštis arba bazė. Vienas iš labiausiai paplitusių ekstrahavimo būdų vadinamas sulfatu.
Cheminės savybės
Vandenilio chlorido rūgštis, vandenilio chloridas arba druskos rūgštis - tirpalas HCl
vandenyje. Anot Vikipedijos, medžiaga priklauso neorganinių stiprių vienbazių to-t grupei. Visas junginio pavadinimas lotynų kalba: vandenilio chlorido rūgštis.
Vandenilio chlorido rūgšties formulė chemijoje: HCl
. Molekulėje vandenilio atomai susijungia su halogeno atomais - Cl
. Jei atsižvelgsime į šių molekulių elektroninę konfigūraciją, galima pastebėti, kad junginiai dalyvauja formuojant molekulines orbitas. 1s
-vandenilio orbitalės ir tiek 3s
ir 3p
- atomo orbitalės Cl
. Cheminėje druskos rūgšties formulėje 1s-
, 3s-
ir 3r
-atominės orbitalės persidengia ir sudaro 1, 2, 3 orbitales. Kuriame 3s
-orbita nėra privaloma. Vyksta elektronų tankio poslinkis į atomą Cl
ir molekulės poliškumas mažėja, bet didėja molekulinių orbitalių surišimo energija (jei svarstysime kartu su kitomis vandenilio halogenidai
).
Vandenilio chlorido fizinės savybės. Tai skaidrus, bespalvis skystis, kuris rūko veikiamas oro. Cheminio junginio molinė masė = 36,6 gramai vienam moliui. Standartinėmis sąlygomis, esant 20 laipsnių Celsijaus oro temperatūrai, maksimali medžiagos koncentracija yra 38 % masės. Koncentruotos druskos rūgšties tankis tokio tipo tirpale yra 1,19 g/cm³. Apskritai, fizinės savybės ir charakteristikos, tokios kaip tankis, moliškumas, klampumas, šiluminė talpa, virimo temperatūra ir pH
, labai priklauso nuo tirpalo koncentracijos. Šios vertės išsamiau aptariamos tankių lentelėje. Pavyzdžiui, 10% druskos rūgšties tankis = 1,048 kg litre. Kietėjant susidaro medžiaga kristaliniai hidratai
skirtingos kompozicijos.
Cheminės druskos rūgšties savybės. Su kuo reaguoja druskos rūgštis? Medžiaga sąveikauja su metalais, kurie stovi prieš vandenilį elektrocheminių potencialų serijoje (geležis, magnis, cinkas ir kt.). Tokiu atveju susidaro druskos ir dujinės H
. Švinas, varis, auksas, sidabras ir kiti metalai, esantys dešinėje nuo vandenilio, nereaguoja su druskos rūgštimi. Medžiaga reaguoja su metalų oksidais, sudarydama vandenį ir tirpią druską. Natrio hidroksidas, veikiamas to-you formų ir vandens. Šiam junginiui būdinga neutralizacijos reakcija.
Praskiesta druskos rūgštis reaguoja su metalų druskomis, kurias sudaro silpnesnės rūgštys. Pavyzdžiui, propiono rūgštis
silpnesnis už druską. Medžiaga nereaguoja su stipresnėmis rūgštimis. ir natrio karbonatas
susidarys po reakcijos su HCl
chloridas, anglies monoksidas ir vanduo.
Cheminiam junginiui būdingos reakcijos su stipriais oksidatoriais, su mangano dioksidas
, kalio permanganatas
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. Medžiaga reaguoja su amoniako
, iš kurio susidaro tiršti balti dūmai, susidedantys iš labai smulkių amonio chlorido kristalų. Mineralinis piroliusitas taip pat reaguoja su druskos rūgštimi, nes joje yra mangano dioksidas
: MnO2+4HCl=Cl2+MnO2+2H2O
(oksidacijos reakcija).
Vyksta kokybinė reakcija į druskos rūgštį ir jos druskas. Kai medžiaga sąveikauja su sidabro nitratas
baltos nuosėdos sidabro chloridas
ir susiformavo azoto rūgštis
. Sąveikos reakcijos lygtis metilaminas
su vandenilio chloridu atrodo taip: HCl + CH3NH2 = (CH3NH3)Cl
.
Medžiaga reaguoja su silpna baze anilino
. Aniliną ištirpinus vandenyje, į mišinį įpilama druskos rūgšties. Dėl to pagrindas ištirpsta ir susidaro anilino hidrochloridas
(fenilamonio chloridas
): (С6Н5NH3)Cl
. Aliuminio karbido sąveikos su druskos rūgštimi reakcija: Al4C3+12HCL=3CH4+4AlCl3
. Reakcijos lygtis kalio karbonatas
su kuria tai atrodo taip: K2CO3 + 2HCl = 2KCl + H2O + CO2.
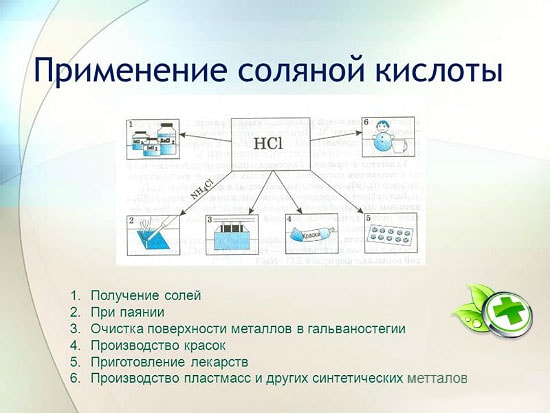
Taikymas
metalurgijoje rūdų gavybai, rūdžių, nuosėdų, nešvarumų ir oksidų šalinimui, litavimui ir alavavimui;
sintetinių kaučiukų ir dervų gamyboje;
galvanizuojant;
kaip rūgštingumą reguliuojanti medžiaga maisto pramonėje;
gauti metalų chloridus;
chlorui gauti;
medicinoje, gydant nepakankamą skrandžio sulčių rūgštingumą;
kaip valiklis ir dezinfekantas.
- (HCl), vandeninis vandenilio chlorido tirpalas, bespalvės aštraus kvapo dujos. Gaunamas sieros rūgštimi veikiant valgomąją druską, kaip angliavandenilių chlorinimo šalutinis produktas arba vandenilio ir chloro reakcijos metu. Druskos rūgštis naudojama ... ... Mokslinis ir techninis enciklopedinis žodynas
Vandenilio chlorido rūgštis
- - HCl (SC) (vandenilio chlorido rūgštis, druskos rūgštis, vandenilio chloridas) yra vandenilio chlorido (HCl) tirpalas vandenyje, antifrizo priedas. Tai bespalvis, aštraus kvapo skystis, be skendinčių dalelių ... ... Statybinių medžiagų terminų, apibrėžimų ir paaiškinimų enciklopedija
VANDENILIO CHLORIDO RŪGŠTIS
- (vandenilio chlorido rūgštis) vandenilio chlorido tirpalas vandenyje; stipri rūgštis. Bespalvis skystis, rūkantis ore (techninė druskos rūgštis yra gelsva dėl Fe, Cl2 ir kt. priemaišų). Didžiausia koncentracija (esant 20 °C) yra 38% masės, ... ... Didysis enciklopedinis žodynas
VANDENILIO CHLORIDO RŪGŠTIS
- (Acidum muriaticum, Acid, hydrochloricum), vandenilio chlorido (HC1) tirpalas vandenyje. Gamtoje jo pasitaiko tam tikrų vulkaninės kilmės šaltinių vandenyje, taip pat yra skrandžio sultyse (iki 0,5%). Vandenilio chlorido galima gauti ... Didžioji medicinos enciklopedija
VANDENILIO CHLORIDO RŪGŠTIS
- (vandenilio chlorido rūgštis, vandenilio chlorido rūgštis) stipri vienbazė lakioji rūgštis, turinti aštrų kvapą, vandeninis vandenilio chlorido tirpalas; didžiausia koncentracija 38 % masės, tokio tirpalo tankis 1,19 g/cm3. Naudojamas ... ... Rusijos darbo apsaugos enciklopedijoje
VANDENILIO CHLORIDO RŪGŠTIS
- (vandenilio chlorido rūgštis) HCl vandeninis vandenilio chlorido tirpalas, stipri vienbazinė rūgštis, lakus, aštraus kvapo; geležies priemaišos, chloras nudažo ją gelsvai. Koncentruotame S. parduoti yra 37% ... ... Didžioji politechnikos enciklopedija
vandenilio chlorido rūgštis
— daiktavardis, sinonimų skaičius: 1 rūgštis (171) ASIS Sinonimų žodynas. V.N. Trišinas. 2013 ... Sinonimų žodynas
VANDENILIO CHLORIDO RŪGŠTIS
Šiuolaikinė enciklopedija
Vandenilio chlorido rūgštis
- VANDENILIO RŪGŠTIS, vandeninis vandenilio chlorido HCl tirpalas; rūkantis skystis su aštriu kvapu. Vandenilio chlorido rūgštis naudojama įvairiems chloridams gauti, metalams ėsdinti, rūdoms apdirbti, chlorui, sodai, kaučiukams ir kt. gaminti ... ... Iliustruotas enciklopedinis žodynas
vandenilio chlorido rūgštis
- (vandenilio chlorido rūgštis), vandenilio chlorido tirpalas vandenyje; stipri rūgštis. Bespalvis skystis, „rūkstanti“ ore (techninė druskos rūgštis yra gelsva dėl Fe, Cl2 ir kt. priemaišų). Didžiausia koncentracija (esant 20 ° C) 38% masės, ... ... Enciklopedinis žodynas
Koks yra apsinuodijimo pavojus
Vandenilio chlorido rūgštis yra ypatingas pavojus žmogaus organizmui. Apsinuodijus tokia medžiaga, gali išsivystyti rimtos komplikacijos ir organizmo funkcionalumo sutrikimai.
Komplikacijos:
- Kepenų pažeidimas dėl toksinio hepatito,
- Kraujavimas skrandyje dėl sunaikintų organo sienelių,
- Šokas nuo skausmo, kai rūgštis patenka į didelį plotą,
- Patekus į akis, pablogėjus regėjimui,
- Sunkus inkstų funkcijos sutrikimas,
- Kvėpavimo nepakankamumas, uždusimas, dusulys,
- Komos išsivystymas.
Panašios pasekmės vystosi palaipsniui, priklausomai nuo apsinuodijimo laipsnio.
Išvada
Jei laikysitės atsargumo priemonių ir saugos taisyklių, druskos rūgštis taps nepakeičiamu asistentu kasdieniame gyvenime. O mūsų įmonėje galite įsigyti pačiomis prieinamiausiomis kainomis.
Kaip rūgštys. Ugdymo programoje numatyta mokiniams įsiminti šešių šios grupės atstovų vardus ir formules. Ir, vartydamas vadovėlyje pateiktą lentelę, rūgščių sąraše pastebi tą, kuri yra pirmoje vietoje ir tave domina pirmiausia – druskos rūgštį. Deja, mokyklos klasėje nei turtas, nei kita informacija apie tai nėra tyrinėjama. Todėl norintys įgyti žinių ne pagal mokyklos programą, papildomos informacijos ieško įvairiausiuose šaltiniuose. Tačiau dažnai daugelis neranda jiems reikalingos informacijos. Taigi šiandienos straipsnio tema yra skirta būtent šiai rūgščiai.
Apibrėžimas
Vandenilio chlorido rūgštis yra stipri monobazinė rūgštis. Kai kuriuose šaltiniuose jis gali būti vadinamas vandenilio chloridu ir vandenilio chloridu, taip pat vandenilio chloridu.
Fizinės savybės
Tai bespalvis ir rūkantis kaustinis skystis ore (nuotrauka dešinėje). Tačiau techninė rūgštis yra gelsvos spalvos, nes joje yra geležies, chloro ir kitų priedų. Didžiausia jo koncentracija 20 ° C temperatūroje yra 38%. Vandenilio chlorido rūgšties tankis su tokiais parametrais yra 1,19 g/cm 3 . Tačiau šis įvairaus soties laipsnio junginys turi visiškai skirtingus duomenis.Sumažėjus koncentracijai, mažėja moliškumo, klampumo ir lydymosi temperatūros skaitinė reikšmė, tačiau didėja savitoji šiluminė talpa ir virimo temperatūra. Kietinant bet kokios koncentracijos druskos rūgštį gaunami įvairūs kristaliniai hidratai.
Cheminės savybės
Visi metalai, esantys prieš vandenilį savo įtampos elektrocheminėje serijoje, gali sąveikauti su šiuo junginiu, sudarydami druskas ir išskirdami vandenilio dujas. Jei jie bus pakeisti metalų oksidais, tada reakcijos produktai bus tirpi druska ir vanduo. Toks pat poveikis bus ir druskos rūgšties sąveikai su hidroksidais. Tačiau jei į jį dedama kokia nors metalų druska (pavyzdžiui, natrio karbonatas), kurios likutis buvo paimtas iš silpnesnės rūgšties (anglies), tai šio metalo chloridas (natris), vanduo ir rūgštį atitinkančios dujos. susidaro likučiai (šiuo atveju anglies dioksidas).
Kvitas
Dabar aptariamas junginys susidaro, kai vandenilio chlorido dujos, kurias galima gauti deginant vandenilį chlore, ištirpsta vandenyje. Vandenilio chlorido rūgštis, gauta naudojant šį metodą, vadinama sintetine. Išmetamosios dujos taip pat gali būti šios medžiagos šaltinis. Ir tokia druskos rūgštis bus vadinama išmetamosiomis dujomis. Pastaruoju metu druskos rūgšties gamybos lygis naudojant šį metodą yra daug didesnis nei jos gamybos sintetiniu metodu, nors pastarasis suteikia junginį grynesne forma. Tai yra visi būdai, kaip tai pasiekti pramonėje. Tačiau laboratorijose druskos rūgštis gaminama trimis būdais (pirmieji du skiriasi tik temperatūra ir reakcijos produktais), naudojant įvairias chemines sąveikas, pavyzdžiui:
- Sočiosios sieros rūgšties poveikis natrio chloridui 150 o C temperatūroje.
- Pirmiau minėtų medžiagų sąveika esant 550 ° C ir aukštesnei temperatūrai.
- Aliuminio arba magnio chloridų hidrolizė.
Taikymas
Hidrometalurgija ir elektroformavimas neapsieina be druskos rūgšties panaudojimo ten, kur jos reikia, norint nuvalyti metalų paviršių skardinimo ir litavimo metu bei gauti mangano, geležies, cinko ir kitų metalų chloridus. Maisto pramonėje šis junginys žinomas kaip maisto priedas E507 – ten jis yra rūgštingumą reguliuojanti medžiaga, reikalinga seltzerio (sodos) vandeniui gaminti. Koncentruotos druskos rūgšties taip pat yra bet kurio žmogaus skrandžio sultyse ir ji padeda virškinti maistą. Šio proceso metu jo prisotinimo laipsnis mažėja, nes. ši kompozicija skiedžiama maistu. Tačiau ilgai nevalgius, druskos rūgšties koncentracija skrandyje palaipsniui didėja. Ir kadangi šis junginys yra labai šarminis, jis gali sukelti skrandžio opas.
Išvada
Vandenilio chlorido rūgštis gali būti naudinga ir kenksminga žmonėms. Jo sąlytis su oda sukelia sunkius cheminius nudegimus, o šio junginio garai dirgina kvėpavimo takus ir akis.
Tačiau jei su šia medžiaga elgsitės atsargiai, ji gali praversti ne vieną kartą