Išnaudojimas

Vanadžio srauto baterijose abu etaloniniai elektrodai papildomai prijungiami prie akumuliacinių rezervuarų ir siurblių, kad per elementą būtų galima cirkuliuoti labai didelius elektrolito kiekius. Skysto elektrolito cirkuliacija yra šiek tiek sudėtinga ir riboja vanadžio srauto baterijų naudojimą pramonės šakose, kurioms reikalingas mobilumas, todėl jos yra veiksmingos dideliuose stacionariuose pastatuose.
Įkraunant vanadžio bateriją, elektronams atsijungus nuo teigiamo akumuliatoriaus gnybto, teigiamai įkrautame etaloniniame elektrode esantys VO2+ jonai virsta VO2+ jonais. Panašiai neigiamame atskaitos elektrode elektronai V3+ jonus paverčia V2+. Iškrovimo metu šis procesas yra atvirkštinis, todėl 25 °C temperatūroje susidaro 1,41 V atviros grandinės įtampa.
Kitos naudingos vanadžio srauto baterijų savybės – labai greita reakcija į apkrovos pokyčius ir itin didelė perkrovos talpa. Naujojo Pietų Velso universiteto tyrimai parodė, kad jie gali pasiekti trumpesnį nei pusės milisekundės atsako laiką, kai keičiasi 100 % apkrovos, ir atlaiko 400 % perkrovą ilgiau nei 10 sekundžių. Reagavimo laiką daugeliu atvejų riboja elektros įranga. Sieros rūgšties pagrindu pagamintos vanadžio baterijos veikia tik 10-40C temperatūroje. Jei temperatūra yra žemesnė už šį diapazoną, sieros rūgšties jonai kristalizuojasi. Kasdieninio naudojimo judesių efektyvumas išlieka 65–75%.
Įkrovimo ir iškrovimo ypatybės
Įkrovimo algoritmai tiesiogiai priklauso nuo to, kaip baterija yra išdėstyta ir kokiam tipui ji priklauso. Pavyzdžiui, kai kurios baterijos gali saugiai papildyti savo talpą iš nuolatinės įtampos šaltinių. Kiti veikia tik su reguliuojamu srovės šaltiniu, kuris gali keisti parametrus priklausomai nuo įkrovimo lygio.
Neteisingai organizuotas įkrovimo procesas gali sugadinti akumuliatorių. Ypatingais atvejais baterija gali užsidegti arba sprogti. Yra išmaniųjų baterijų su įtampos stebėjimo įrenginiais. Pagrindiniai parametrai, į kuriuos reikia atsižvelgti eksploatuojant grįžtamąsias galvanines baterijas, yra šie:
- Gyvenimo trukmė. Net ir tinkamai naudojant, akumuliatoriaus įkrovimo ciklų skaičius yra ribotas. Skirtingos akumuliatorių sistemos ne visada susidėvi dėl tų pačių priežasčių. Tačiau apskritai akumuliatoriaus veikimo laiką riboja visų pirma viso įkrovimo-iškrovimo ciklų skaičius ir, antra, projektinis tarnavimo laikas, neatsižvelgiant į naudojimo intensyvumą.
- Įkrovimo laikas. Pagrindinė akumuliatoriaus konstrukcija nereiškia įkrovimo savavališkai dideliu greičiu: galvaninio elemento vidinė varža lems perteklinę įkrovimo srovę paversti šiluma, o tai gali negrįžtamai sugadinti įrenginį. Fiziniu požiūriu įkrovimo laiką riboja didžiausias aktyviosios medžiagos difuzijos greitis per elektrolitą.Paprasčiau tariant, galima daryti prielaidą, kad viso pajėgumo atkūrimas per vieną valandą yra geras rodiklis.
- Iškrovimo gylis. Nurodoma procentais nuo vardinės galios. Apibūdina naudojamą talpą. Skirtingų tipų akumuliatoriams rekomenduojamas veikimo iškrovos lygis gali skirtis. Dėl veikimo pokyčių ar senėjimo didžiausio gylio indikatorius praranda savo pradinę vertę.
difuzijos procesas.
Dėl difuzijos proceso, elektrolito tankio išsilyginimo akumuliatoriaus korpuso ertmėje ir plokščių aktyviosios masės porose elektrodo poliarizacija gali būti palaikoma akumuliatoriuje, kai išorinė grandinė yra išjungta.
Difuzijos greitis tiesiogiai priklauso nuo elektrolito temperatūros, kuo aukštesnė temperatūra, tuo procesas vyksta greičiau ir gali labai kisti laike, nuo dviejų valandų iki paros. Dviejų elektrodo potencialo komponentų buvimas trumpalaikėmis sąlygomis lėmė akumuliatoriaus padalijimą į pusiausvyrinį ir nepusiausvyrinį EML. Akumuliatoriaus pusiausvyros EML įtakoja aktyviųjų medžiagų jonų kiekis ir koncentracija elektrolite, taip pat veikliųjų medžiagų cheminės ir fizinės savybės. Pagrindinį vaidmenį EML dydžiui vaidina elektrolito tankis, o temperatūra jam praktiškai neturi įtakos. EML priklausomybę nuo tankio galima išreikšti formule:
Akumuliatoriaus emf nėra lygi akumuliatoriaus įtampai, kuri priklauso nuo jo gnybtų apkrovos buvimo ar nebuvimo.
admin25/07/2011
Komentaras
Vardas *
Svetainė
Ši svetainė naudoja Akismet kovai su šiukšlėmis. Sužinokite, kaip apdorojami jūsų komentarų duomenys.
„Mechaninis tachometras
Akumuliatoriaus įtampa »
Žymos
VAZ, VAZ gedimai Jutikliai Degimo Purkštukai Prietaisai Starteris Schemos Elektromobiliai Maitinimo blokas vaz 2110 gazelė gazelė verslo registratoriai automobilių remontas
Naujausi įrašai
- Jutikliai automobilyje: tipai ir paskirtis
- Didžiausias pasaulyje elektromobilis EDumper,
- Lazeriniai žibintai.
- Halogeninių lempų privalumai ir trūkumai
- Parkavimo daviklių įtaisas ir veikimo principas
Archyvai
Archyvai 2019 m. Rugpjūčio mėn. 2017 m. Birželio mėn. 2017 m. Birželio 2017 2017 m. Balandžio mėn. 2016 m. Balandžio mėn. 2016 m. Lapkričio 2016 2016 m. Rugpjūtis 2016 2016 m. Liepos mėn. 2016 m. Birželio mėn. 2016 m. Balandžio mėn 2015 m. sausis 2014 m. gruodis 2014 m. lapkritis 2014 m. lapkritis 2014 m. spalis 2014 m. rugsėjis 2014 m. rugpjūtis 2014 m. liepa 2014 m. birželis 2014 m. gegužė 2014 m. balandis 2014 vasaris 2014 sausis 2014 gruodis 2013 m. lapkričio mėn. 2012, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2012 m., 2011 m., 2011 m., 2011 m., 2011 m., 2011 m., 2011 m.
Kategorijos
- Akumuliatoriaus baterija
- Vaizdo įrašas
- Generatorius
- Jutikliai
- Diagnostika
- Uždegimas
- žinios
- Įranga
- Prietaisų
- Remontas
- Uždegimo žvakė
- Starteris
- Schema
- Prietaisų
- elektromobiliai
- Maitinimas
Esame socialiniuose tinkluose
Auto elektrikas@ Visos teisės saugomos. Kopijuodami svetainės medžiagą turite pateikti nuorodą į svetainę.
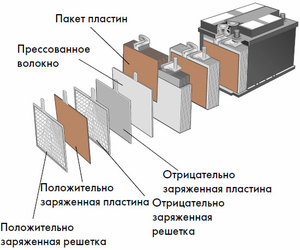
Įrenginys ir veikimo principas
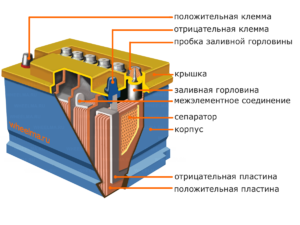
Kiekvienas toks elementas turi katodą (teigiamą elektrodą) ir anodą (neigiamą). Šie elektrodai yra atskirti elektrolitu, kuris užtikrina jonų mainus tarp jų. Elektrodų medžiagos ir elektrolitų sudėtis parenkamos taip, kad tarp akumuliatoriaus gnybtų būtų pakankamai elektrovaros jėgos.
Kadangi elektroduose yra ribotas cheminės energijos potencialas, veikimo metu baterija išsikraus. Galvaninių elementų tipas, kuris yra pritaikytas papildymui po dalinio ar visiško išsikrovimo, vadinamas akumuliatoriumi. Tokių tarpusavyje sujungtų elementų mazgas yra baterija.Baterijos veikimas apima ciklinį dviejų būsenų pasikeitimą:
- Įkrovimas - akumuliatorius veikia kaip elektros imtuvas, elementų viduje elektros energija realizuojama cheminių pokyčių metu.
- Iškrovimas – prietaisas veikia kaip elektros srovės šaltinis, paversdamas cheminių reakcijų energiją į elektros energiją.
Naudojimo sritys
Dėl itin didelės vanadžio redokso baterijų talpos jie puikiai tinka naudoti pramonės šakose, kuriose reikia daug energijos kaupti. Pavyzdžiui, padėti subalansuoti tokių energijos šaltinių, kaip vėjo ar saulės, gamybos apimtį arba padėti generatoriams prireikus sugerti didelius energijos antplūdžius arba subalansuoti energijos pasiūlą ir paklausą atokiose vietovėse.
Ribotos vanadžio redokso baterijų savaiminio išsikrovimo charakteristikos leidžia jas naudoti pramonės šakose, kuriose akumuliatoriai turi būti laikomi ilgą laiką, reikalaujant minimalios priežiūros ir parengties. Dėl to jie buvo naudojami kai kuriose karinės elektronikos rūšyse, pavyzdžiui, GATOR kasybos sistemos jutikliuose. Dėl savo gebėjimo judėti ir išlikti ties nuliu, jie tinka naudoti saulės energijai ir pramonės šakoms, kur baterijos turi prasidėti tuščiomis ir įkrauti, atsižvelgiant į apkrovą ir oro sąlygas. Pavyzdžiui, ličio jonų akumuliatoriai dažnai sugenda, kai jiems leidžiama išsikrauti mažiau nei 20 % tūrio, todėl dažniausiai jie veikia nuo 20 iki 100 %, o tai reiškia, kad gali išnaudoti tik 20 % vardinės talpos.
Dėl itin greito reakcijos laiko jie taip pat praktiškai nepakeičiami nepertraukiamo maitinimo šaltiniuose, kur juos galima naudoti vietoj švino-rūgštinių baterijų ir net dyzelinių generatorių. Be to, dėl greito atsako laiko jie tinka dažnio valdymui. Šiuo metu nei UPS, nei dažnių valdymo priemonės savaime nėra veiksmingos, tačiau tikėtina, kad baterija galės rasti pritaikymą šiose pramonės šakose, kai bus kapitalizuojama iš įvairių finansavimo šaltinių. Be to, dėl šių savybių vanadžio redokso akumuliatoriai yra efektyvus „vientisas“ sprendimas mažiems elektros tinklams, kurie priklauso nuo patikimo veikimo, dažnio valdymo ir apkrovos perjungimo poreikių (pvz., didelės atsinaujinančių energijos šaltinių skverbties, labai svyruojančios apkrovos ar noro optimizuoti generatoriaus efektyvumą perkeliant atsako laiką).
Didžiausios veikiančios vanadžio redokso baterijos
Pastotė "Minami Hyakita":
- Paleidimo data: 2015 m. gruodžio mėn
- Energija: 60 MWh
- Galia: 15 MW
- Darbo laikas: 4 valandos
- Šalis: Japonija
Smirdžius, Liaoningo provincija
- Paleidimo data: N/A
- Energija: 10 MWh
- Galia: 5 MW
- Darbo laikas: 2 valandos
- Šalis: Kinija
Tomamae vėjo jėgainių parkas
- Paleidimo data: 2005 m
- Energija: 6 MWh
- Galia: 4 MW
- Darbo laikas: 1 valanda 30 minučių
- Šalis: Japonija
Zhangbei projektas
- Paleidimo data 2016 m
- Energija: 8 MWh
- Galia: 2 MW
- Darbo laikas: 4 valandos.
- Šalis: Kinija
SnoPUD MESA 2 projektas
- Paleidimo data: 2017 m. kovo mėn
- Energija: 8 MWh
- Galia: 2 MW
- Darbo laikas: 4 valandos.
- Šalis: JAV
Pastotė Escondido mieste
- Paleidimo data: 2017 m
- Energija: 8 MWh
- Galia: 2 MW
- Darbo laikas: 4 valandos.
- Šalis: JAV
Pastotė Pulmane, Vašingtone
- Paleidimo data: 2015 m. balandžio mėn
- Energija: 4 MWh
- Galia: 1 MW
- Darbo laikas: 4 valandos
- Šalis: JAV
Tikimasi, kad iki 2018 m. Kinijoje bus baigtas vanadžio redokso akumuliatoriaus kūrimas. Jo energija bus 800 MWh, galia - 200 MW, o veikimo laikas - 4 valandos.
Sąlygos
- Nuoseklus – elementai seka vienas po kito.
- Elektrovaros jėga (EMF) – tai akumuliatoriaus arba magnetinės jėgos generuojama įtampa pagal Faradėjaus dėsnį.
- Lygiagretus – elektriniai komponentai išdėstyti taip, kad srovė teka dviem ar daugiau takų.
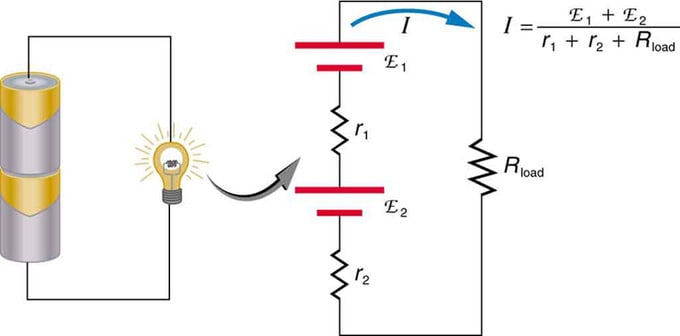
Jei naudojate kelis įtampos šaltinius, juos galima jungti nuosekliai arba lygiagrečiai. Serijinėje versijoje jos derinamos ta pačia kryptimi, padidinama vidinė varža, algebriškai pridedama elektrovaros jėga. Panašūs tipai būdingi žibintuvėms, žaislams ir įvairiems kitiems prietaisams. Ląstelės dedamos nuosekliai, kad padidėtų bendras emf.
Nuoseklus dviejų įtampos šaltinių prijungimas ta pačia kryptimi. Diagramoje pavaizduotas žibintas su dviem celėmis ir viena lempa
Baterija – daugkartinis voltų elementų sujungimas. Tačiau yra vienas nuoseklaus ryšio trūkumas, nes pridedamos vidinės varžos. Kartais tai sukelia problemų. Tarkime, kad turite dvi 6 V baterijas, kurias įdedate vietoj įprastų 12 V. Dėl to pridėjote ne tik EMF, bet ir kiekvienos baterijos vidinę varžą.
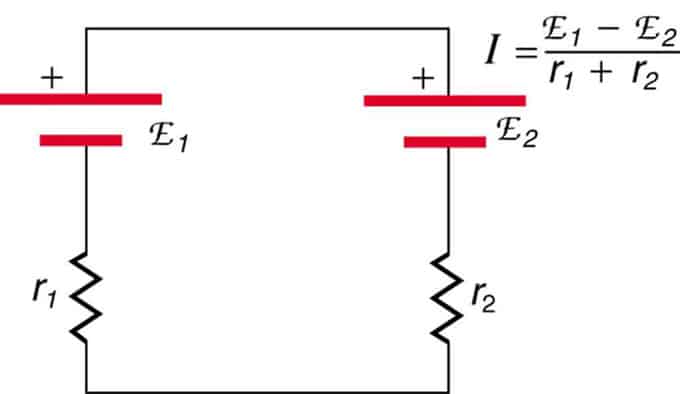
Jei ląstelės yra opozicijoje (viena yra už kitos), tada bendras EML sumažės.
Tai yra du įtampos šaltiniai, sujungti nuosekliai su priešingomis emisijomis. Srovė teka didesnio EML kryptimi ir yra ribojama vidinių varžų sumavimo. Pavyzdys yra įkroviklis. Jame turi būti daugiau emf nei akumuliatoriuje
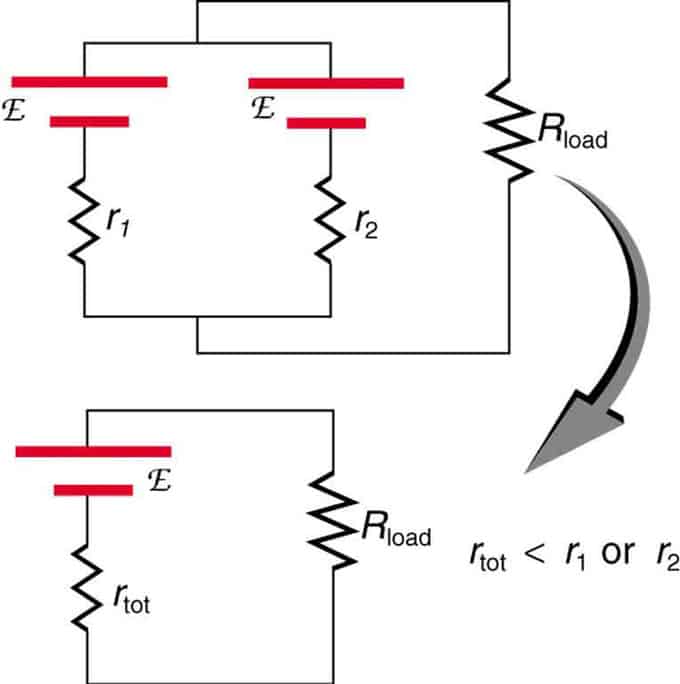
Jei du šaltiniai, turintys tą pačią elektrovaros jėgą, yra lygiagrečiai ir prijungti prie apkrovos pasipriešinimo, tada bendras EML išlieka toks pat kaip ir atskirų. Tačiau bendras vidinis pasipriešinimas sumažės. Pasirodo, lygiagreti versija gali generuoti daugiau srovės.
Lygiagrečiai sujungti du įtampos šaltiniai su vienu EMF. Jie sudaro vieną EML, bet turi mažesnį bendrą atsparumą nei atskirai. Panašūs deriniai naudojami, jei reikia pasiekti daugiau srovės.
| Apžvalga |
|
| Lygiagretusis ir nuoseklus rezistorių jungimas |
|
| Kirchhoff taisyklės |
|
| Voltmetrai ir ampermetrai |
|
| RC grandinės |
|
Istorinė apžvalga
Pirmojo galvaninio elemento sukūrimas priskiriamas italų fizikui Alessandro Voltai. 1790-aisiais jis atliko daugybę eksperimentų su elektrocheminiais reiškiniais, o apie 1800 m. sukūrė pirmąją bateriją, kurią jo amžininkai vadino „volto kolona“. Prietaisą sudarė kintami cinko ir sidabro diskai, atskirti popieriaus arba audinio sluoksniais, kurie buvo mirkomi natrio hidroksido tirpale.
Šie eksperimentai tapo Michaelo Faradėjaus darbų, susijusių su kiekybiniais elektrochemijos dėsniais, pagrindu. Jis apibūdino akumuliatoriaus veikimo principą ir, remiantis mokslininko darbais, buvo sukurti pirmieji komerciniai elektros elementai. Tolesnė evoliucija atrodė taip:
- 1836 m. britų chemikas Johnas Danielis pristatė patobulintą ląstelės modelį, sudarytą iš vario ir cinko elektrodų, panardintų į druskos rūgštį. Danielio elementas nuolatinę įtampą sugebėjo tiekti nepalyginamai efektyviau nei Volto įrenginiai.
- 1839 m Tolesnę pažangą padarė fizikas Grove'as, naudodamas savo dviejų skysčių ląstelę, kurią sudaro cinkas, panardintas į praskiestą sieros rūgštį porėtame inde. Pastarasis atskyrė sieros rūgštį iš indo, kuriame buvo azoto rūgšties, į kurį įdėtas platinos katodas. Azoto rūgštis tarnavo kaip oksidatorius, apsaugantis nuo įtampos praradimo dėl vandenilio kaupimosi katode.Vokiečių chemikas Robertas Bunsenas pakeitė platiną nebrangia anglimi Grove ląstelėje ir taip paskatino platų tokio tipo akumuliatorių pripažinimą.
- 1859 m. Gastonas Plante'as išrado švino rūgšties elementą – šiuolaikinio automobilio akumuliatoriaus pirmtaką. Plante prietaisas sugebėjo sukurti neįprastai didelę srovę, tačiau beveik du dešimtmečius buvo naudojamas tik eksperimentams laboratorijose.
- 1895-1905 metai. Nikelio-kadmio ir nikelio-geležies šarminių elementų išradimas. Tai leido sukurti sistemas su dideliu įkrovimo-iškrovimo ciklų skaičiumi.
- Nuo 1930-ųjų buvo pradėtos kurti sidabro-cinko ir gyvsidabrio-cinko šarminės baterijos, kurios užtikrino didelį energijos tankį svorio ir tūrio vienetui.
- Nuo XX amžiaus vidurio gamybos technologijų pažanga ir naujų medžiagų atsiradimas leido sukurti dar galingesnius ir kompaktiškesnius akumuliatorius. Labiausiai pastebimas buvo nikelio-metalo hidrido ir ličio baterijų pristatymas į rinką.
Baterijų įkrovimas
Pagrindinis straipsnis: Įkroviklis
Kai cheminė energija išsenka, įtampa ir srovė krenta, o baterija nustoja veikti. Galite įkrauti akumuliatorių (baterijų bateriją) iš bet kurio nuolatinės srovės šaltinio su didesne įtampa, ribodami srovę. Labiausiai paplitusi yra įkrovimo srovė (amperais), proporcinga 1/10 sąlyginės vardinės akumuliatoriaus talpos (ampervalandomis).
Tačiau remiantis plačiai naudojamų elektros baterijų (NiMH, NiCd) gamintojų platinamu techniniu aprašymu, galima daryti prielaidą, kad šis įkrovimo režimas, dažniausiai vadinamas standartinis, skaičiuojamas pagal aštuonių valandų darbo dienos trukmę, kai darbo dienos pabaigoje išsikrovęs akumuliatorius prijungiamas prie maitinimo tinklo įkroviklio prieš prasidedant naujai darbo dienai. Tokio tipo baterijų įkrovimo režimo naudojimas sistemingai leidžia išlaikyti kokybės ir sąnaudų balansą gaminio veikimo metu. Taigi, gamintojo siūlymu, šis režimas gali būti naudojamas tik nikelio-kadmio ir nikelio-metalo hidrido akumuliatoriams.
Daugelio tipų baterijos turi skirtingus apribojimus, į kuriuos reikia atsižvelgti kraunant ir vėliau naudojant, pavyzdžiui, NiMH baterijos jautrios perkrovimui, ličio baterijos jautrios perkrovimui, įtampai ir temperatūrai. NiCd ir NiMH baterijos turi vadinamąjį atminties efektą, kurį sudaro talpos sumažėjimas, kai įkraunama, kai baterija nėra visiškai išsikrovusi. Be to, tokio tipo akumuliatoriai turi pastebimą savaiminį išsikrovimą, tai yra, jie palaipsniui praranda įkrovą neprisijungę prie apkrovos. Siekiant kovoti su šiuo efektu, galima naudoti lašelinį įkrovimą.
Akumuliatoriaus įkrovimo būdai
Akumuliatoriams įkrauti naudojami keli būdai; Paprastai įkrovimo būdas priklauso nuo akumuliatoriaus tipo.
- Lėtas nuolatinės srovės įkrovimas
Įkraukite nuolatine srove, proporcinga 0,1-0,2 sąlyginei vardinei galiai Q, atitinkamai apie 15-7 valandas.
Ilgiausias ir saugiausias įkrovimo būdas. Tinka daugeliui baterijų tipų.
- greitas įkrovimas
Kraukite nuolatine srove, proporcinga 1/3 Q maždaug 3-5 valandas.
- Pagreitintas arba „delta-V“ įkrovimas
Įkrovimas su pradine įkrovimo srove, proporcinga vardinei vardinei akumuliatoriaus talpai, kuriai esant nuolat matuojama akumuliatoriaus įtampa ir įkrovimas baigiamas visiškai įkrovus akumuliatorių. Įkrovimo laikas yra apie pusantros valandos. Akumuliatorius gali perkaisti ir net sugadinti.
- atvirkštinio apmokestinimo
Jis atliekamas kaitaliojant ilgus įkrovimo impulsus su trumpais iškrovimo impulsais. Atvirkštinis metodas naudingiausias įkraunant NiCd ir NiMH baterijas, kurioms būdingas vadinamasis.n. „atminties efektas“.