Metodes ūdeņraža iegūšanai rūpnieciskos apstākļos
Ekstrakcija, pārvēršot metānu
. Iztvaicētu ūdeni, kas iepriekš uzsildīts līdz 1000 grādiem pēc Celsija, sajauc ar metānu zem spiediena un katalizatora klātbūtnē. Šī metode ir interesanta un pārbaudīta, jāatzīmē arī tas, ka tā tiek nepārtraukti pilnveidota: notiek jaunu lētāku un efektīvāku katalizatoru meklēšana.
Apsveriet senāko ūdeņraža iegūšanas metodi - ogļu gazifikācija
. Ja nav gaisa piekļuves un temperatūras 1300 grādi pēc Celsija, ogles un ūdens tvaiki tiek uzkarsēti. Tādējādi no ūdens tiek izspiests ūdeņradis, un tiek iegūts oglekļa dioksīds (ūdeņradis būs augšpusē, ogļskābā gāze, kas arī iegūta reakcijas rezultātā, būs apakšā). Tā būs gāzu maisījuma atdalīšana, viss ir ļoti vienkārši.
Ūdeņraža iegūšana ar ūdens elektrolīze
uzskatīts par vienkāršāko variantu. Lai to īstenotu, traukā ir jāielej sodas šķīdums, kā arī jānovieto divi elektriskie elementi. Viens būs pozitīvi uzlādēts (anods), bet otrs negatīvi (katods). Kad tiek pielietota strāva, ūdeņradis nonāks katodā un skābeklis uz anodu.
Ūdeņraža iegūšana saskaņā ar metodi daļēja oksidēšana
. Šim nolūkam tiek izmantots alumīnija un gallija sakausējums. To ievieto ūdenī, kas reakcijas laikā izraisa ūdeņraža un alumīnija oksīda veidošanos. Gallijs ir nepieciešams, lai reakcija noritētu pilnībā (šis elements neļaus alumīnijam priekšlaicīgi oksidēties).
Nesen ieguvis aktualitāti biotehnoloģiju izmantošanas metode
: skābekļa un sēra trūkuma apstākļos hlamidomonas sāk intensīvi izdalīt ūdeņradi. Ļoti interesants efekts, kas šobrīd tiek aktīvi pētīts.
Neaizmirstiet par citu vecu, pārbaudītu ūdeņraža iegūšanas metodi, kas ir izmantot citu sārma elementi
un ūdens. Principā šī tehnika ir iespējama laboratorijas apstākļos ar nepieciešamajiem drošības pasākumiem. Tādējādi reakcijas laikā (tā notiek karsējot un ar katalizatoriem) veidojas metāla oksīds un ūdeņradis. Atliek tikai to savākt.
Iegūstiet ūdeņradi ūdens un oglekļa monoksīda mijiedarbība
iespējams tikai rūpnieciskā vidē. Veidojas oglekļa dioksīds un ūdeņradis, to atdalīšanas princips ir aprakstīts iepriekš.
IZgudrojumam ir TĀKĀS PRIEKŠROCĪBAS
Gāzu oksidēšanas rezultātā iegūto siltumu var izmantot tieši uz vietas, savukārt ūdeņradi un skābekli iegūst no izplūdes tvaiku un rūpnieciskā ūdens apglabāšanas.
Zems ūdens patēriņš, ražojot elektrību un siltumu.
Metodes vienkāršība.
Ievērojams enerģijas ietaupījums, kā tas tiek tērēts tikai startera iesildīšanai līdz vienmērīgam termiskam režīmam.
Augsta procesa produktivitāte, jo ūdens molekulu disociācija ilgst sekundes desmitdaļas.
Metodes sprādzienbīstamība un ugunsdrošība, jo tā īstenošanā nav nepieciešamas tvertnes ūdeņraža un skābekļa savākšanai.
Iekārtas darbības laikā ūdens tiek atkārtoti attīrīts, pārvēršoties destilētā ūdenī. Tas novērš nokrišņus un katlakmens veidošanos, kas pagarina iekārtas kalpošanas laiku.
Instalācija ir izgatavota no parastā tērauda; izņemot apkures katlus, kas izgatavoti no karstumizturīga tērauda ar oderējumu un to sienu ekranējumu. Tas ir, īpaši dārgi materiāli nav nepieciešami.
Izgudrojums var tikt pielietots
rūpniecību, elektrostacijās aizstājot ogļūdeņražus un kodoldegvielu ar lētu, plaši izplatītu un videi draudzīgu ūdeni, vienlaikus saglabājot šo staciju jaudu.
PRETENZIJA
Metode ūdeņraža un skābekļa iegūšanai no ūdens tvaikiem
, kas ietver šī tvaika izvadīšanu caur elektrisko lauku, kas raksturīgs ar to, ka tiek izmantoti pārkarsēti ūdens tvaiki ar temperatūru 500 - 550 o C
, izvadīts caur augstsprieguma līdzstrāvas elektrisko lauku, lai atdalītu tvaikus un sadalītu tos ūdeņraža un skābekļa atomos.
Es jau sen gribēju kaut ko tādu izdarīt. Taču turpmākie eksperimenti ar akumulatoru un elektrodu pāri nesasniedza. Gribēju uztaisīt pilnvērtīgu aparātu ūdeņraža ražošanai, tādos daudzumos, lai piepūstu balonu. Pirms pilnvērtīga ūdens elektrolīzes aparāta izgatavošanas mājās, es nolēmu pārbaudīt visu modelī.
Elektrolīzera vispārējā shēma izskatās šādi.
Šis modelis nav piemērots pilnai ikdienas lietošanai. Bet ideja tika pārbaudīta.
Tāpēc elektrodiem es nolēmu izmantot grafītu. Lielisks grafīta avots elektrodiem ir trolejbusa strāvas savācējs. Viņu ir daudz, kas guļ gala pieturās. Jāatceras, ka viens no elektrodiem tiks iznīcināts.
Zāģēšana un apdare ar vīli. Elektrolīzes intensitāte ir atkarīga no strāvas stipruma un elektrodu laukuma.
Uz elektrodiem ir piestiprināti vadi. Vadiem jābūt rūpīgi izolētiem.
Plastmasas pudeles ir diezgan piemērotas elektrolīzera modeļa korpusam. Vāciņā ir izveidoti caurumi caurulēm un vadiem.
Viss ir rūpīgi pārklāts ar hermētiķi.
Nogriezti pudeļu kakliņi ir piemēroti divu konteineru savienošanai.
Tie ir jāsavieno kopā un jāizkausē šuve.
Rieksti ir izgatavoti no pudeļu korķiem.
Divu pudeļu apakšā ir izveidoti caurumi. Viss ir savienots un rūpīgi piepildīts ar hermētiķi.
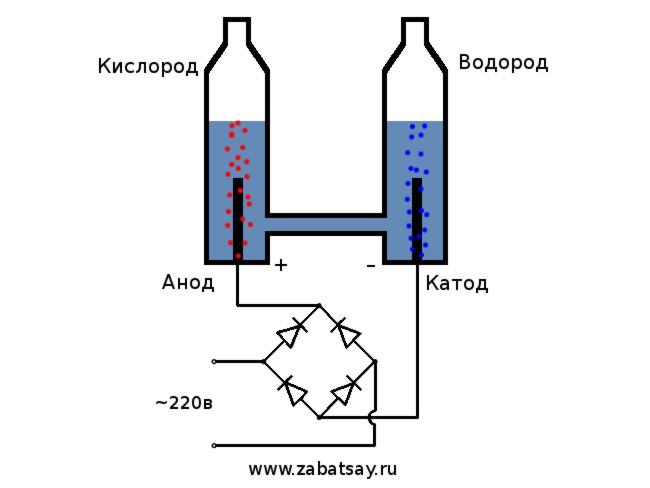
Kā sprieguma avotu izmantosim 220V sadzīves tīklu. Es gribu jūs brīdināt, ka šī ir diezgan bīstama rotaļlieta. Tātad, ja nav pietiekamu prasmju vai ir šaubas, tad labāk neatkārtoties. Sadzīves tīklā mums ir maiņstrāva, elektrolīzei tā ir jāiztaisno. Diodes tilts tam ir lieliski piemērots. Fotogrāfijā redzamais nebija pietiekami jaudīgs un ātri izdega. Labākais variants bija Ķīnas MB156 diodes tilts alumīnija korpusā.
Diodes tilts kļūst ļoti karsts. Nepieciešama aktīva dzesēšana. Ideāli derēs dzesētājs datora procesoram. Korpusam varat izmantot piemērota izmēra lodēšanas kārbu. Pārdod elektroprecēs.
Zem diodes tilta ir nepieciešams ievietot vairākus kartona slāņus.
Lodēšanas kastes vākā tiek izveidoti nepieciešamie caurumi.
Šādi izskatās saliktā vienība. Elektrolizators tiek darbināts no elektrotīkla, ventilators no universāla barošanas avota. Kā elektrolītu izmanto cepamās sodas šķīdumu. Šeit jāatceras, ka jo augstāka ir šķīduma koncentrācija, jo lielāks ir reakcijas ātrums. Bet tajā pašā laikā apkure ir augstāka. Turklāt nātrija sadalīšanās reakcija pie katoda dos savu ieguldījumu karsēšanā. Šī reakcija ir eksotermiska. Tā rezultātā veidosies ūdeņradis un nātrija hidroksīds.
Augšējā fotoattēlā redzamā ierīce bija ļoti karsta. Tas bija periodiski jāizslēdz un jāgaida, līdz tas atdziest. Problēma ar apkuri daļēji tika atrisināta, atdzesējot elektrolītu. Šim nolūkam es izmantoju galda strūklakas sūkni. Gara caurule iet no vienas pudeles uz otru caur sūkni un auksta ūdens spaini.
Šī jautājuma aktualitāte mūsdienās ir diezgan augsta, jo ūdeņraža izmantošanas joma ir ārkārtīgi plaša, un tīrā veidā tas dabā praktiski nav atrodams. Tāpēc ir izstrādātas vairākas metodes, kā ķīmisko un fizikālo reakciju ceļā iegūt šo gāzi no citiem savienojumiem. Tas ir tas, kas tiek apspriests šajā rakstā.
Ūdeņraža ražošana mājas apstākļos
Elektrolīzera izvēle
Lai iegūtu mājas elementu, ir nepieciešams īpašs aparāts - elektrolizators.Tirgū ir daudz iespēju šādām iekārtām, ierīces piedāvā gan pazīstamas tehnoloģiju korporācijas, gan mazie ražotāji. Zīmolu vienības ir dārgākas, taču to uzbūves kvalitāte ir augstāka.
Sadzīves tehnika ir maza izmēra un ērti lietojama. Tās galvenās detaļas ir:
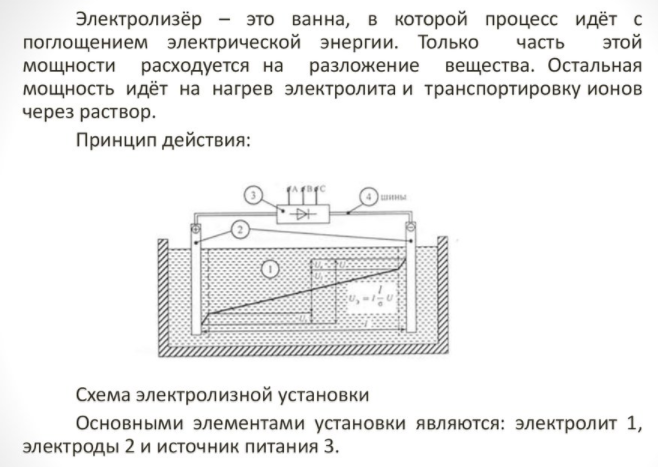
- reformators;
- tīrīšanas sistēma;
- degvielas šūnas;
- kompresoru iekārtas;
- ūdeņraža uzglabāšanas tvertne.
Kā izejvielu tiek ņemts vienkāršs krāna ūdens, un elektrība nāk no parastas kontaktligzdas. Ar saules enerģiju darbināmās vienības ietaupa elektrību.
"Mājas" ūdeņradis tiek izmantots apkures vai ēdiena gatavošanas sistēmās. Tie arī bagātina gaisa un degvielas maisījumu, lai palielinātu automašīnu dzinēju jaudu.
Ierīces izgatavošana ar savām rokām
Vēl lētāk ir izgatavot ierīci pašam mājās. Sausā šūna izskatās kā noslēgts konteiners, kas sastāv no divām elektrodu plāksnēm traukā ar elektrolītisko šķīdumu. Globālais tīmeklis piedāvā dažādas shēmas dažādu modeļu ierīču montāžai:
- ar diviem filtriem;
- ar konteinera augšējo vai apakšējo izvietojumu;
- ar diviem vai trim vārstiem;
- ar cinkotu plāksni;
- uz elektrodiem.
Vienkāršu ierīci ūdeņraža ražošanai ir viegli izveidot. Tam būs nepieciešams:
- nerūsējošā tērauda loksnes;
- caurspīdīga caurule;
- armatūra;
- plastmasas trauks (1,5 l);
- ūdens filtrs un pretvārsts.
Turklāt būs nepieciešama dažāda aparatūra: uzgriežņi, paplāksnes, skrūves. Pirmkārt, jums ir jāsagriež loksne 16 kvadrātveida nodalījumos, no katra no tiem jāizgriež stūris. Pretējā stūrī ir jāizurbj caurums plākšņu pieskrūvēšanai. Lai nodrošinātu pastāvīgu strāvu, plāksnes jāsavieno saskaņā ar shēmu: plus-mīnus-plus-mīnus. Šīs daļas ir izolētas viena no otras ar cauruli, bet savienojuma vietā ar skrūvi un paplāksnēm (trīs gabali starp plāksnēm). Uz plusa un mīnusa uzliek 8 plāksnes.
Pareizi montējot, plākšņu malas nepieskaras elektrodiem. Savāktās detaļas tiek nolaistas plastmasas traukā. Vietā, kur pieskaras sienas, ar skrūvēm tiek izveidoti divi montāžas caurumi. Uzstādiet drošības vārstu, lai noņemtu lieko gāzi. Armatūra ir uzstādīta konteinera vākā un šuves ir noslēgtas ar silikonu.
Ierīces pārbaude
Lai pārbaudītu ierīci, veiciet vairākas darbības:
- Piepildiet ar šķidrumu.
- Pārklājot ar vāku, savienojiet vienu caurules galu ar savienotājelementu.
- Otrais tiek nolaists ūdenī.
- Pievienojiet strāvas avotam.
Pēc ierīces pievienošanas kontaktligzdai pēc dažām sekundēm būs manāms elektrolīzes process un nokrišņi.
Tīram ūdenim nav labas elektrovadītspējas. Lai uzlabotu šo rādītāju, jums ir jāizveido elektrolītisks šķīdums, pievienojot sārmu - nātrija hidroksīdu. Tas ir kompozīcijās cauruļu tīrīšanai, piemēram, "Mole".
Ūdeņraža iegūšanas metodes
Ūdeņradis ir bezkrāsains un bez smaržas gāzveida elements, kura blīvums ir 1/14 attiecībā pret gaisu. Brīvā stāvoklī tas ir reti sastopams. Parasti ūdeņradis tiek kombinēts ar citiem ķīmiskajiem elementiem: skābekli, oglekli.
Ūdeņraža ražošana rūpnieciskām vajadzībām un enerģijai tiek veikta ar vairākām metodēm. Populārākie ir:
- ūdens elektrolīze;
- koncentrācijas metode;
- zemas temperatūras kondensāts;
- adsorbcija.
Ūdeņradi var izolēt ne tikai no gāzes vai ūdens savienojumiem. Ūdeņradis rodas, pakļaujot koksni un ogles augstām temperatūrām, kā arī apstrādājot bioatkritumus.
Atomu ūdeņradis energotehnikai tiek iegūts, izmantojot molekulārās vielas termiskās disociācijas metodi uz stieples, kas izgatavota no platīna, volframa vai pallādija. To silda ūdeņraža vidē ar spiedienu, kas mazāks par 1,33 Pa.Radioaktīvos elementus izmanto arī ūdeņraža ražošanai.
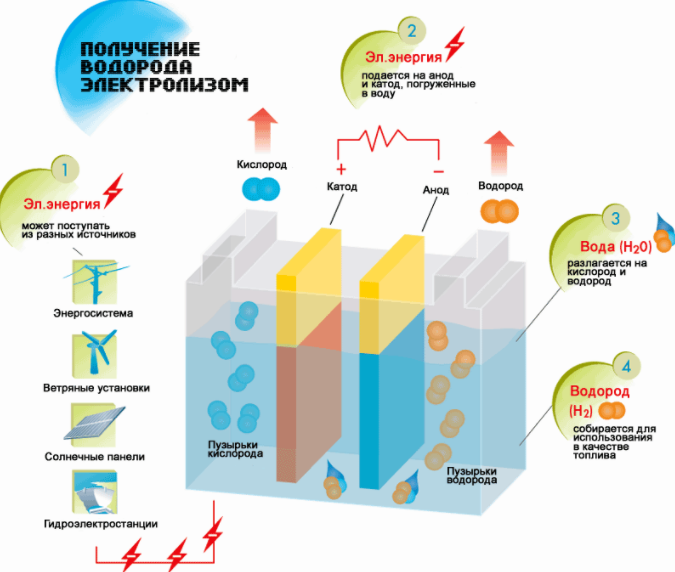
elektrolīzes metode
Vienkāršākā un populārākā ūdeņraža ekstrakcijas metode ir ūdens elektrolīze. Tas ļauj iegūt praktiski tīru ūdeņradi. Citas šīs metodes priekšrocības ir:
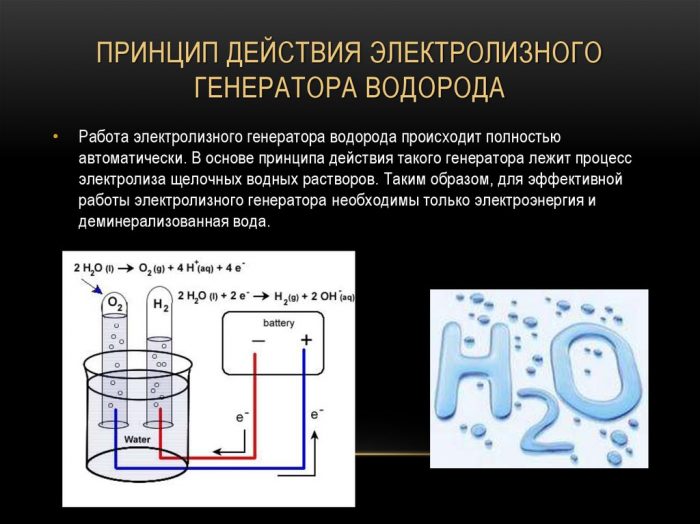
- izejvielu pieejamība;
- elementa iegūšana zem spiediena;
- iespēja automatizēt procesu kustīgu daļu trūkuma dēļ.
Šķidruma sadalīšanas procedūra ar elektrolīzi ir pretēja ūdeņraža sadegšanai. Tās būtība ir tāda, ka līdzstrāvas ietekmē uz elektrodiem, kas iemērc ūdens elektrolīta šķīdumā, izdalās skābeklis un ūdeņradis.
Papildu priekšrocība ir blakusproduktu ražošana ar rūpniecisku vērtību. Tādējādi skābeklis lielā apjomā ir nepieciešams enerģētikas tehnoloģisko procesu katalizēšanai, augsnes un ūdenstilpņu attīrīšanai un sadzīves atkritumu izvešanai. Smago ūdeni, kas iegūts ar elektrolīzi, izmanto enerģētikā kodolreaktoros.
Ūdeņraža ražošana pēc koncentrācijas
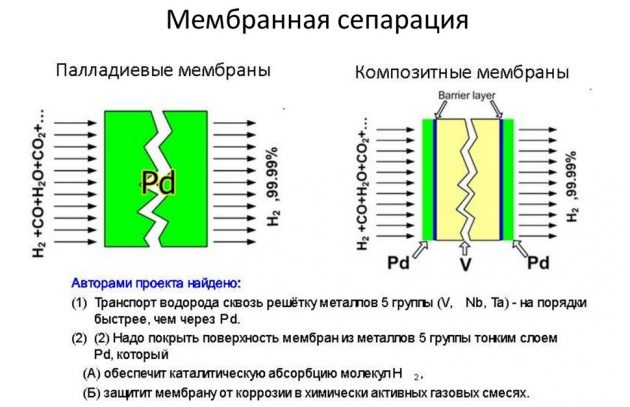
Šīs metodes pamatā ir elementa atdalīšana no to saturošiem gāzu maisījumiem. Tādējādi lielākā daļa rūpnieciskos apjomos saražotās vielas tiek iegūta, izmantojot metāna tvaika riformingu. Šajā procesā iegūtais ūdeņradis tiek izmantots enerģētikā, naftas pārstrādē, raķešu rūpniecībā, kā arī slāpekļa mēslošanas līdzekļu ražošanā. H2 iegūšanas process tiek veikts dažādos veidos:
- īss cikls;
- kriogēns;
- membrāna.
Pēdējā metode tiek uzskatīta par visefektīvāko un lētāko.
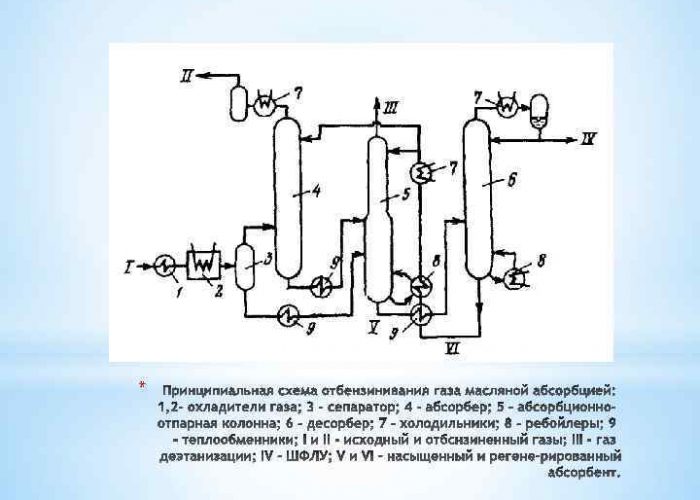
Kondensācija zemā temperatūrā
Šis paņēmiens H2 iegūšanai sastāv no spēcīgas gāzes savienojumu dzesēšanas zem spiediena. Rezultātā tie tiek pārveidoti par divfāžu sistēmu, ko pēc tam ar separatoru atdala šķidrā komponentā un gāzē. Dzesēšanai tiek izmantoti šķidrie līdzekļi:
- ūdens;
- sašķidrināts etāns vai propāns;
- šķidrs amonjaks.
Šī procedūra nav tik vienkārša, kā šķiet. Vienlaicīgi nebūs iespējams tīri atdalīt ogļūdeņraža gāzes. Daļa komponentu aizies ar gāzi, kas paņemta no atdalīšanas nodalījuma, kas nav ekonomiski. Problēmu var atrisināt, dziļi atdzesējot izejmateriālu pirms atdalīšanas. Bet tas prasa daudz enerģijas.
Mūsdienu zemas temperatūras kondensatoru sistēmās papildus tiek nodrošinātas demetanizācijas vai deetanizācijas kolonnas. Gāzes fāze tiek noņemta no pēdējās atdalīšanas stadijas, un pēc siltuma apmaiņas šķidrums tiek nosūtīts uz destilācijas kolonnu ar neapstrādātas gāzes plūsmu.
Adsorbcijas metode
Adsorbcijas laikā ūdeņraža izdalīšanai tiek izmantoti adsorbenti - cietas vielas, kas absorbē nepieciešamās gāzu maisījuma sastāvdaļas. Kā adsorbenti izmanto aktivēto ogli, silikāta gēlu, ceolītus. Lai veiktu šo procesu, tiek izmantotas īpašas ierīces - cikliskie adsorberi vai molekulārie sieti. Lietojot zem spiediena, šī metode var atgūt 85 procentus ūdeņraža.
Ja salīdzina adsorbciju ar zemas temperatūras kondensāciju, var atzīmēt zemākas procesa materiālu un ekspluatācijas izmaksas - vidēji par 30 procentiem. Adsorbcijas metode rada ūdeņradi enerģijas iegūšanai un ar šķīdinātāju izmantošanu. Šī metode ļauj no gāzu maisījuma iegūt 90 procentus H2 un iegūt galaproduktu ar ūdeņraža koncentrāciju līdz 99,9%.