Exploitatie

In vanadiumstroombatterijen zijn beide referentie-elektroden bovendien verbonden met opslagtanks en pompen, zodat zeer grote hoeveelheden elektrolyt door de cel kunnen worden gecirculeerd. De circulatie van vloeibare elektrolyt is enigszins moeilijk en beperkt het gebruik van vanadiumstroombatterijen in industrieën die mobiliteit vereisen, waardoor ze effectief zijn in grote stationaire gebouwen.
Wanneer een vanadiumbatterij wordt opgeladen, veranderen de VO2+-ionen in de positief geladen referentie-elektrode in VO2+-ionen wanneer de elektronen worden losgemaakt van de positieve batterijpool. Evenzo zetten elektronen in de negatieve referentie-elektrode V3+-ionen om in V2+. Tijdens het ontladen wordt dit proces omgekeerd, wat resulteert in een nullastspanning van 1,41 V bij 25°C.
Andere nuttige eigenschappen van vanadiumstroombatterijen zijn onder meer een zeer snelle reactie op veranderingen in de belasting en een extreem hoge overbelastingscapaciteit. Onderzoek aan de Universiteit van New South Wales heeft aangetoond dat ze responstijden van minder dan een halve milliseconde kunnen bereiken bij 100% belastingveranderingen en 400% overbelasting kunnen weerstaan gedurende meer dan 10 seconden. De reactietijd wordt in de meeste gevallen beperkt door de elektrische apparatuur. Vanadiumbatterijen op basis van zwavelzuur werken alleen bij temperaturen van 10-40C. Als de temperatuur onder dit bereik ligt, kristalliseren zwavelzuurionen. De efficiëntie in heen en weer gaande beweging bij dagelijks gebruik blijft op het niveau van 65-75%.
Kenmerken van opladen en ontladen
Oplaadalgoritmen zijn direct afhankelijk van hoe de batterij is gerangschikt en tot welk type deze behoort. Sommige batterijen kunnen bijvoorbeeld veilig hun capaciteit aanvullen uit bronnen met constante spanning. Anderen werken alleen met een instelbare stroombron die parameters kan veranderen afhankelijk van het laadniveau.
Een verkeerd georganiseerd laadproces kan de accu beschadigen. In extreme gevallen kan de batterij ontbranden of exploderen. Er zijn slimme batterijen die zijn uitgerust met spanningsbewakingsapparatuur. De belangrijkste parameters waarmee rekening moet worden gehouden bij het gebruik van omkeerbare galvanische batterijen zijn:
- Levensduur. Zelfs met de juiste behandeling is het aantal oplaadcycli voor een batterij beperkt. Verschillende batterijsystemen verslijten niet altijd om dezelfde redenen. Maar over het algemeen wordt de levensduur van de batterij voornamelijk beperkt door het aantal volledige laad-ontlaadcycli en ten tweede door de levensduur van het ontwerp, ongeacht de gebruiksintensiteit.
- Oplaadtijd. Het fundamentele ontwerp van de batterij houdt niet in dat de batterij met een willekeurig hoge snelheid moet worden opgeladen: de interne weerstand van de galvanische cel zal leiden tot de omzetting van overtollige laadstroom in warmte, die het apparaat onomkeerbaar kan beschadigen. Fysiek gezien wordt de oplaadtijd beperkt door de maximale diffusiesnelheid van het actieve materiaal door de elektrolyt.Simpel gezegd kunnen we aannemen dat het herstel van de volledige capaciteit in één uur een goede indicator is.
- Afvoer diepte. Gespecificeerd als een percentage van het nominale vermogen. Beschrijft de bruikbare capaciteit. Voor verschillende soorten batterijen kan het aanbevolen ontlaadniveau bij gebruik variëren. Door veranderingen in werking of veroudering verliest de maximale diepte-indicator zijn oorspronkelijke waarde.
diffusie proces.
Vanwege het diffusieproces, de uitlijning van de elektrolytdichtheid in de holte van de batterijbehuizing en in de poriën van de actieve massa van de platen, kan de elektrodepolarisatie in de batterij worden gehandhaafd wanneer het externe circuit is uitgeschakeld.
De diffusiesnelheid is direct afhankelijk van de temperatuur van het elektrolyt, hoe hoger de temperatuur, hoe sneller het proces verloopt en kan sterk variëren in de tijd, van twee uur tot een dag. De aanwezigheid van twee componenten van de elektrodepotentiaal in voorbijgaande omstandigheden leidde tot de verdeling in evenwicht en niet-evenwicht EMF van de batterij. De evenwichts-EMV van de batterij wordt beïnvloed door het gehalte en de concentratie van ionen van actieve stoffen in de elektrolyt, evenals door de chemische en fysische eigenschappen van actieve stoffen. De hoofdrol in de grootte van de EMF wordt gespeeld door de dichtheid van de elektrolyt en de temperatuur heeft er praktisch geen invloed op. De afhankelijkheid van EMV van de dichtheid kan worden uitgedrukt door de formule:
De batterij-emf is niet gelijk aan de batterijspanning, die afhangt van de aan- of afwezigheid van een belasting op de polen.
admin25/07/2011
Een reactie
Naam *
site
Deze site gebruikt Akismet om spam te bestrijden. Ontdek hoe uw reactiegegevens worden verwerkt.
« Mechanische toerenteller
Batterij voltage "
Tags
VAZ, VAZ storingen Sensoren Ontsteking Injector Apparaten Startschema Elektrische auto's Stroomvoorziening vaz 2110 gazelle gazelle zakelijke registrars autoreparatie
Recente inzendingen
- Sensoren in de auto: soorten en doel
- 's Werelds grootste elektrische auto EDumper,
- Laserlichten.
- Voor- en nadelen van halogeenlampen
- Het apparaat en het werkingsprincipe van parkeersensoren
Archieven
Archief Select SEPTEMBER 2019 Augustus 2017 Juli 2017 Juni 2017 Mei 2017 April 2017 Maart 2017 December 2016 November 2016 Oktober 2016 September 2016 Augustus 2016 Juli 2016 Juni 2016 Mei 2016 April 2016 Maart 2016 Februari 2016 November 2015 Oktober 2015 Augustus 2015 Juli 2015 Juni 2015 Mei 2015 januari 2015 december 2014 november 2014 oktober 2014 september 2014 augustus 2014 juli 2014 juni 2014 mei 2014 april 2014 februari 2014 januari 2014 december 2013 november 2013 oktober 2013 augustus 2013 juni 2013 mei 2013 maart september 2012, 2013, 2012, 2012, 2012, 2012, 2012, 2012, 2011, 2012, 2011, 2012, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, September 2012, 2011, 2011, 2011, 2011, 2011, 2011
Categorieën
- Accumulator batterij
- Video
- Generator
- Sensoren
- Diagnostiek
- Ontsteking
- nieuws
- Apparatuur
- Apparaten
- Reparatie
- Bougie
- Beginner
- Schema
- Apparaten
- elektrische auto's
- Stroomvoorziening
We zijn in sociale netwerken
Auto-elektricien@ Alle rechten voorbehouden. Bij het kopiëren van sitemateriaal moet u een link naar de site verstrekken.
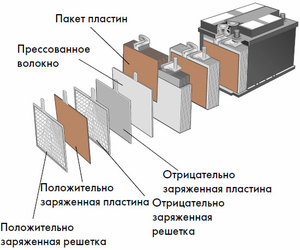
Apparaat en werkingsprincipe
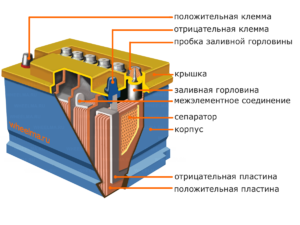
Elke cel heeft een kathode (positieve elektrode) en een anode (negatief). Deze elektroden worden gescheiden door een elektrolyt dat zorgt voor de uitwisseling van ionen ertussen. Elektrodematerialen en elektrolytsamenstelling zijn gekozen om voldoende elektromotorische kracht tussen de accupolen te verschaffen.
Omdat de elektroden een beperkt potentieel aan chemische energie bevatten, zal de batterij tijdens bedrijf leeg raken. Het type galvanische cellen, dat is aangepast voor aanvulling na een gedeeltelijke of volledige ontlading, wordt een batterij genoemd. Een samenstel van dergelijke onderling verbonden cellen is een batterij.De werking van de batterij omvat een cyclische verandering van twee toestanden:
- Opladen - de batterij werkt als een ontvanger van elektriciteit, in de cellen wordt de elektrische energie gerealiseerd in chemische veranderingen.
- Ontladen - het apparaat functioneert als een bron van elektrische stroom door de energie van chemische reacties om te zetten in elektrische energie.
Toepassingsgebieden
De ultrahoge capaciteitskarakteristiek van vanadium-redoxbatterijen maakt ze zeer geschikt voor gebruik in industrieën die een hoge energieopslag vereisen. Bijvoorbeeld helpen om het productievolume van dergelijke energiebronnen zoals wind of zon in evenwicht te brengen, of generatoren helpen om grote energiepieken op te vangen wanneer dat nodig is, of vraag en aanbod van energie voor afgelegen gebieden in evenwicht te brengen.
De beperkte zelfontladingskenmerken van vanadium-redoxbatterijen maken ze nuttig in industrieën waar batterijen voor lange tijd moeten worden opgeslagen met minimaal onderhoud en gereedheid. Dit leidde tot hun gebruik in sommige soorten militaire elektronica, bijvoorbeeld in de sensoren van het GATOR-mijnsysteem. Hun vermogen om door te fietsen en op nul te blijven, maakt ze geschikt voor zonne-energietoepassingen en industrieën waar batterijen de dag leeg moeten beginnen en moeten opladen op basis van belasting en weer. Lithium-ionbatterijen raken bijvoorbeeld vaak beschadigd wanneer ze minder dan 20% van hun volume mogen ontladen, dus werken ze meestal in het bereik van 20 tot 100%, wat betekent dat ze slechts 20% van hun nominale capaciteit kunnen gebruiken.
Hun extreem snelle responstijd maakt ze ook praktisch onmisbaar voor noodstroomvoorzieningen, waar ze kunnen worden gebruikt in plaats van loodzuuraccu's en zelfs dieselgeneratoren. Ook de snelle responstijd maakt ze geschikt voor frequentieregeling. Op dit moment zijn noch UPS, noch frequentiebeheermaatregelen op zichzelf effectief, maar het is waarschijnlijk dat de batterij toepassingen in deze industrieën zal kunnen vinden wanneer ze uit verschillende financieringsbronnen worden gekapitaliseerd. Bovendien maken deze mogelijkheden vanadium-redoxbatterijen tot een effectieve oplossing uit één stuk voor kleine elektriciteitsnetten die afhankelijk zijn van een betrouwbare werking, frequentieregeling en belastingomschakelingsbehoeften (zoals een hoge penetratie van hernieuwbare energiebronnen, sterk fluctuerende belastingen of de wens om optimaliseer de efficiëntie van de generator door de responstijd te verschuiven).
De grootste werkende vanadium redox batterijen
Onderstation "Minami Hyakita":
- Introductiedatum: december 2015
- Energie: 60 MWh
- Vermogen: 15 MW
- Werktijd: 4 uur
- Land: Japan
Stinky, provincie Liaoning
- Lanceringsdatum: nvt
- Energie: 10 MWh
- Vermogen: 5 MW
- Werktijd: 2 uur
- Land: China
Tomamae Windpark
- Lanceringsdatum: 2005
- Energie: 6 MWh
- Vermogen: 4 MW
- Werktijd: 1 uur 30 minuten
- Land: Japan
Zhangbei-project
- Lanceringsdatum 2016
- Energie: 8 MWh
- Vermogen: 2 MW
- Werktijd: 4 uur.
- Land: China
SnoPUD MESA 2-project
- Lanceringsdatum: maart 2017
- Energie: 8 MWh
- Vermogen: 2 MW
- Werktijd: 4 uur.
- Land: VS
Onderstation in Escondido
- Lanceringsdatum: 2017
- Energie: 8 MWh
- Vermogen: 2 MW
- Werktijd: 4 uur.
- Land: VS
Onderstation in Pullman, Washington
- Lanceringsdatum: april 2015
- Energie: 4 MWh
- Vermogen: 1 MW
- Werktijd: 4 uur
- Land: VS
Naar verwachting zal in 2018 de ontwikkeling van een vanadium-redoxbatterij in China zijn voltooid. De energie zal 800 MWh zijn, het vermogen - 200 MW en de bedrijfstijd - 4 uur.
voorwaarden
- Sequentieel - elementen volgen elkaar op.
- Elektromotorische kracht (EMF) is de spanning die wordt gegenereerd door een batterij of magnetische kracht in overeenstemming met de wet van Faraday.
- Parallel - Elektrische componenten zijn zo gerangschikt dat de stroom langs twee of meer paden vloeit.
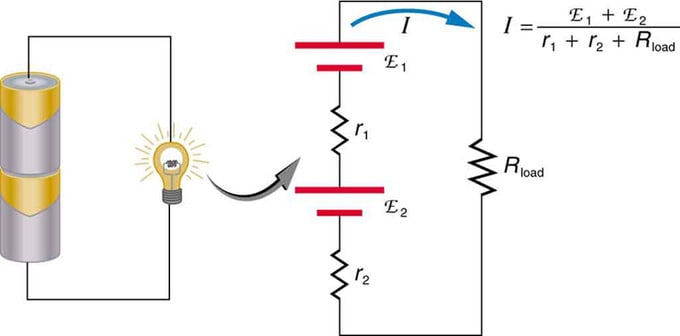
Als u meerdere spanningsbronnen gebruikt, kunnen deze in serie of parallel worden aangesloten. Bij de serieversie zijn ze in dezelfde richting afgestemd, wordt de interne weerstand verhoogd en wordt de elektromotorische kracht algebraïsch opgeteld. Soortgelijke typen komen veel voor in zaklampen, speelgoed en een verscheidenheid aan andere apparaten. Cellen worden in serie geplaatst om de totale emf te vergroten.
Seriële aansluiting van twee spanningsbronnen in dezelfde richting. Het diagram toont een lantaarn met twee cellen en één lamp
Batterij - meervoudige aansluiting van voltelementen. Maar er is één nadeel aan seriële verbinding, omdat interne weerstanden worden toegevoegd. Soms levert dit problemen op. Laten we zeggen dat je twee 6V-batterijen hebt die je erin stopt in plaats van de gebruikelijke 12V. Als resultaat heb je niet alleen de EMF toegevoegd, maar ook de interne weerstand van elke batterij.
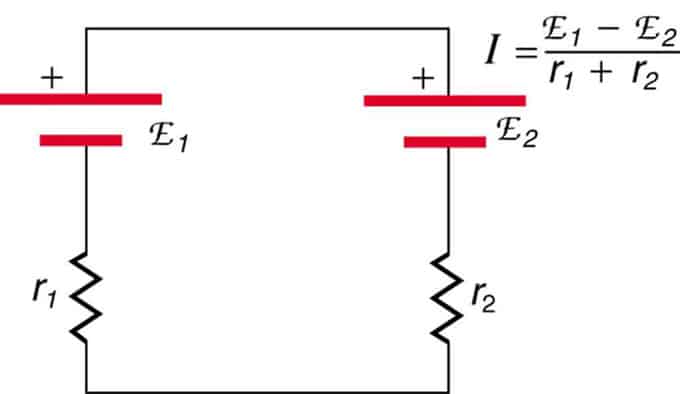
Als de cellen tegenover elkaar liggen (de ene bevindt zich achter de andere), dan zal de totale EMF afnemen.
Dit zijn twee spanningsbronnen die in serie zijn geschakeld met tegengestelde emissies. De stroom vloeit in de richting van een grotere EMF en wordt beperkt door de optelling van interne weerstanden. Een voorbeeld is een oplader. Het moet meer emf hebben dan de batterij
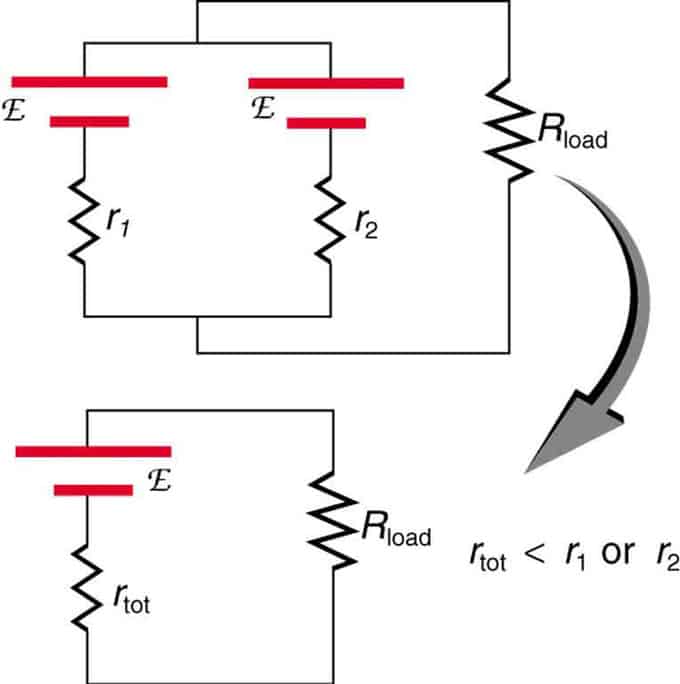
Als twee bronnen met dezelfde elektromotorische kracht parallel zijn geplaatst en verbonden met de belastingsweerstand, blijft de totale EMF hetzelfde als de afzonderlijke. De totale interne weerstand wordt echter verminderd. Het blijkt dat de parallelle versie meer stroom kan genereren.
Twee spanningsbronnen met een enkele EMF worden gecombineerd in een parallelle verbinding. Ze vormen één EMF, maar hebben minder totale weerstand dan afzonderlijk. Soortgelijke combinaties worden gebruikt als u meer stroom wilt halen.
| Overzicht |
|
| Parallelle en serieschakeling van weerstanden |
|
| Kirchhoff regels |
|
| Voltmeters en ampèremeters |
|
| RC-circuits |
|
Historisch overzicht
De ontwikkeling van de eerste galvanische cel wordt toegeschreven aan de Italiaanse natuurkundige Alessandro Volta. Hij voerde een reeks experimenten uit met elektrochemische verschijnselen in de jaren 1790 en rond 1800 creëerde hij de eerste batterij, die zijn tijdgenoten de "voltaïsche kolom" noemden. Het apparaat bestond uit afwisselende schijven van zink en zilver, gescheiden door lagen papier of doek die waren gedrenkt in een natriumhydroxide-oplossing.
Deze experimenten werden de basis voor het werk van Michael Faraday over de kwantitatieve wetten van de elektrochemie. Hij beschreef het werkingsprincipe van de batterij en op basis van het werk van de wetenschapper werden de eerste commerciële elektrische cellen gemaakt. Verdere evolutie zag er als volgt uit:
- In 1836 presenteerde de Britse chemicus John Daniel een verbeterd model van de cel, bestaande uit koper- en zinkelektroden ondergedompeld in zoutzuur. Het element van Daniel was in staat om constante spanning onvergelijkbaar efficiënter te leveren dan de apparaten van Volt.
- 1839 Verdere vooruitgang werd geboekt door de natuurkundige Grove met zijn twee-vloeistofcel, bestaande uit zink ondergedompeld in verdund zwavelzuur in een poreuze houder. De laatste scheidde zwavelzuur af uit een vat dat salpeterzuur bevatte met daarin een platinakathode. Het salpeterzuur diende als oxidatiemiddel om spanningsverlies door waterstofophoping aan de kathode te voorkomen.De Duitse chemicus Robert Bunsen verving het platina door goedkope koolstof in de Grove-cel en bevorderde daarmee de wijdverbreide acceptatie van dit type batterij.
- In 1859 vond Gaston Plante de loodzuurcel uit, de voorloper van de moderne auto-accu. Het apparaat van Plante was in staat om een ongewoon grote stroom te produceren, maar werd bijna twee decennia alleen gebruikt voor experimenten in laboratoria.
- 1895-1905 jaar. Uitvinding van nikkel-cadmium en nikkel-ijzer alkalische elementen. Dit maakte het mogelijk om systemen te creëren met een aanzienlijk aantal laad-ontlaadcycli.
- Sinds de jaren dertig begon de ontwikkeling van zilver-zink- en kwik-zink-alkalinebatterijen, die een hoge energiedichtheid per gewichts- en volume-eenheid opleverden.
- Sinds het midden van de 20e eeuw hebben de vooruitgang in de productietechnologie en de komst van nieuwe materialen geleid tot nog krachtigere en compactere batterijen. Het meest opvallend was de introductie van nikkel-metaalhydride- en lithiumbatterijen op de markt.
Batterijen opladen
Hoofd artikel: Oplader
Naarmate de chemische energie opraakt, nemen de spanning en stroom af en houdt de batterij op te functioneren. U kunt de batterij (batterij van batterijen) opladen vanaf elke gelijkstroombron met een hogere spanning en tegelijkertijd de stroom beperken. De meest voorkomende is de laadstroom (in ampère), evenredig met 1/10 van de voorwaardelijke nominale capaciteit van de accu (in ampère-uren).
Op basis van de technische beschrijving die wordt verspreid door fabrikanten van veelgebruikte elektrische batterijen (NiMH, NiCd), kan echter worden aangenomen dat deze laadmodus, gewoonlijk aangeduid als standaard-, wordt berekend op basis van de duur van een werkdag van acht uur, wanneer de batterij, ontladen aan het einde van de werkdag, voor het begin van een nieuwe werkdag wordt aangesloten op het lichtnet. Het gebruik van een dergelijke oplaadmodus voor dit soort batterijen met systematisch gebruik stelt u in staat om een kwaliteit-kostenbalans te behouden bij de werking van het product. Op aanraden van de fabrikant kan deze modus dus alleen worden gebruikt voor nikkel-cadmium- en nikkel-metaalhydridebatterijen.
Veel soorten batterijen hebben verschillende beperkingen waarmee rekening moet worden gehouden tijdens het opladen en het daaropvolgende gebruik, bijvoorbeeld NiMH-batterijen zijn gevoelig voor overladen, lithiumbatterijen zijn gevoelig voor overontlading, spanning en temperatuur. NiCd- en NiMH-batterijen hebben een zogenaamd geheugeneffect, dat bestaat uit een capaciteitsvermindering bij het opladen wanneer de batterij niet volledig ontladen is. Ook hebben dit soort batterijen een merkbare zelfontlading, dat wil zeggen dat ze geleidelijk hun lading verliezen zonder verbonden te zijn met de belasting. Om dit effect tegen te gaan, kan druppeloplading worden toegepast.
Oplaadmethoden voor batterijen
Er worden verschillende methoden gebruikt om batterijen op te laden; Over het algemeen is de oplaadmethode afhankelijk van het type batterij.
- Langzame DC-lading
Laad met een gelijkstroom evenredig met 0,1-0,2 van de voorwaardelijke nominale capaciteit Q voor respectievelijk ongeveer 15-7 uur.
De langste en veiligste oplaadmethode. Geschikt voor de meeste soorten batterijen.
- snel opladen
Laad ongeveer 3-5 uur op met gelijkstroom evenredig met 1/3 Q.
- Versnelde of "delta-V" lading
Een lading met een initiële laadstroom die evenredig is met de nominale nominale capaciteit van de batterij, waarbij de batterijspanning constant wordt gemeten en de lading stopt nadat de batterij volledig is opgeladen. De oplaadtijd is ongeveer anderhalf uur. De batterij kan oververhit raken en zelfs kapot gaan.
- omgekeerde lading
Het wordt uitgevoerd door lange laadpulsen af te wisselen met korte ontladingspulsen. De omgekeerde methode is het handigst voor het opladen van NiCd- en NiMH-batterijen, die worden gekenmerkt door de zogenaamde.N. "geheugeneffect".