Moet ik de verwarmde handdoekhouder aarden?
Eerst moet u weten dat aarding (de constructie van aardlussen met uw eigen handen) niet vereist is als:
- 1. U gebruikt een elektrisch verwarmd handdoekenrek (dergelijke verwarmde handdoekrekken zijn meestal voorzien van speciale stekkers waarin een aarddraad zit, dit alles is aangesloten op een stopcontact, en de stopcontacten zelf moeten al aangesloten zijn op de aardlus) .
- 2. U woont in een eigen woning of appartement en heeft een aparte verwarmingsinstallatie.
Het aarden van de handdoekradiator is verplicht in de volgende gevallen:
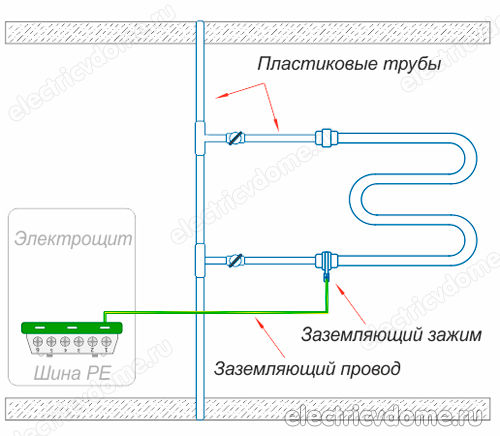
- 1. Als uw droger is aangesloten op het verwarmingssysteem met een kunststof buis. In de metaal-kunststof buis bevindt zich aluminium, dat elektrische stroom geleidt: op de kruispunten waar de fittingen zich bevinden, is het elektrische circuit onderbroken. Dienovereenkomstig moet een dergelijke verwarmde handdoekhouder worden aangesloten op de aardlus, of op de warmwaterstijgleiding.
- 2. Als uw warmwatersysteem is gemaakt van kunststof leidingen.
Een verwarmd handdoekenrek aarden
Alle elektrisch verwarmde handdoekrekken, zoals hierboven vermeld, zijn aangesloten op een geaard stopcontact, terwijl dergelijke drogers een aardingsdraad hebben met een apart contact op de stekker. Aangezien verwarmde handdoekrekken meestal in de badkamer worden geïnstalleerd, moet u het stopcontact waarop het wordt aangesloten inspecteren. Een dergelijke uitlaat moet zich in een speciale beschermende hoes bevinden die voorkomt dat vocht de uitlaat zelf binnendringt.
Er zijn 2 manieren om een verwarmd handdoekenrek te aarden:
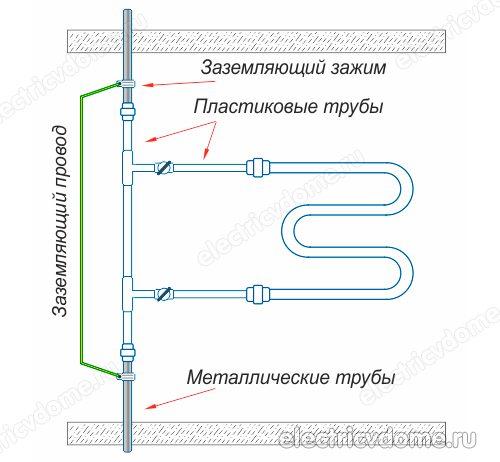
- 1. Gebruik een potentiaalvereffeningssysteem, dat met de hand moet worden geïnstalleerd, en aard dit systeem vervolgens met de gemeenschappelijke aarde van het elektrische paneel. Dit moet worden gedaan als communicatie gemaakt van polymeren (metaal-kunststof buizen) wordt gebruikt in plaats van metalen communicatie in een huis of appartement.
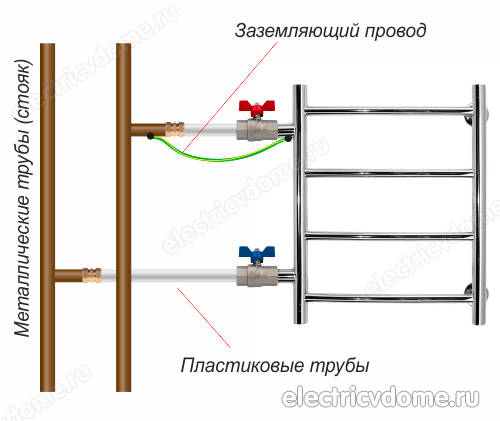
- 2. Aard de buis van het lichaam van de verwarmde handdoekhouder direct met een conventionele draad naar een stalen stijgbuis.
Om de aarding van de handdoekverwarming op de tweede manier uit te voeren, moet u eerst een klem krijgen, nadat u alle isolatiematerialen ervan hebt verwijderd. Deze klem moet een klem hebben om de draad aan te sluiten. Vervolgens wordt de klem aan de buis van het verwarmde handdoekreklichaam bevestigd.
Er wordt een gewone koperdraad genomen, die een doorsnede van 4 mm2 moet hebben. Deze draad wordt aan de ene kant aangesloten op de klem, het andere uiteinde moet worden aangesloten op de aarde van het elektrische paneel of op een stalen stijgbuis. Vergeet daarnaast niet om andere apparaten in je badkamer op de aardlus aan te sluiten.
| Dergelijke methoden vergen niet veel tijd voor hun implementatie, maar in ruil daarvoor krijgen ze een lange en ononderbroken werking van de verwarmde handdoekhouder, en in de toekomst zal de vraag "hoe de verwarmde handdoekhouder te aarden" geen problemen veroorzaken. |
Vrienden bekijken ook de video voor wat je nodig hebt om de verwarmde handdoekhouder te aarden.
Gerelateerde inhoud op de site:
- Over aarden in eenvoudige woorden
- Waarom is het bad geaard?
- Het ontwerp van het aardingsapparaat:
Oorzaken van elektrocorrosie
Het verschijnen van Foucault-wervelstromen is een nogal complex en onvoorspelbaar fenomeen. In warmwatervoorzieningssystemen en soms in het verwarmingssysteem verschijnen dergelijke stromen om vele redenen die niets met elkaar te maken lijken te hebben.
In het algemeen worden wervelstromen gevormd met een potentiaalverschil. Bij het bouwen van een huis zijn alle metalen constructies verbonden met een gemeenschappelijke aardlus en eerder in de bouw gebruikten ze aarding langs de lus, maar nu zijn ze tevreden met de potentiaalvereffeningsmethode.
Wanneer in een appartement kunststof systemen worden geïnstalleerd in plaats van het bestaande metalen systeem, ontstaat het potentiaalverschil door een grondbreuk (er is bijvoorbeeld één potentiaal op een verwarmd handdoekenrek en een geheel andere op een stijgleiding). Vandaar het potentiaalverschil, vandaar de zwerfstromen. Ze kunnen ook optreden als gevolg van kortsluiting, gebrek aan aarding van nabijgelegen elektrische huishoudelijke apparaten, of het nu een wasmachine is, enzovoort.
Zelfs de aan-/afwezigheid van tramsporen in de directe omgeving speelt een rol. Zwerfstromen treden ook op wanneer er sprake is van een schending van de isolatie van de elektrische bedrading, een netwerkonderbreking of aarding naar het verwarmingssysteem.
Dit alles leidt tot elektrische corrosie van sanitair, het wordt ook veroorzaakt door de nabijheid van twee verschillende materialen, met name roestvrij staal en zwart staal. De plaats waardoor de lading in de verwarmde handdoekhouder terechtkomt, ondergaat daardoor een elektrochemische reactie, waardoor daar schade ontstaat. Dergelijke problemen worden meestal opgelost door de verwarmde handdoekhouder zelf direct te aarden.
Bij het kopen van een met water verwarmd handdoekenrek, is het noodzakelijk om vertrouwd te raken met de regels voor de werking ervan, in het bijzonder aandacht besteden aan of het nodig is om het verwarmde handdoekrek te aarden of niet, om hiermee rekening te houden tijdens de reparatie, en niet nadat de reparatie is voltooid
Waarom een met water verwarmd handdoekenrek aarden?
Nadat plastic buizen gewone metalen begonnen te vervangen, begonnen ze hun aarding te negeren, ten onrechte in de veronderstelling dat een metalen buis en een metalen kunststof buis dezelfde elektrische geleidbaarheid hebben. Dit is niet waar. Er is geen contact tussen de metaal-kunststof buis en aluminium: ze zijn niet verbonden.
De praktijk leert dat 90 procent van de verwarmde handdoekrekken begint te lekken, juist in het geval van vervanging van metalen warmwatersystemen door hun plastic tegenhangers (bijvoorbeeld polypropyleen). Oude metalen buizen worden vervangen door moderne plastic buizen om wervelstromen te verminderen. Corrosie blijft zich echter vertonen.
De eerste symptomen van elektrische corrosie zijn het verschijnen van roestvlekken op de verwarmde handdoekhouder, en roest verschijnt zelfs op apparaten van roestvrij staal. Over het algemeen zijn alle metalen elektrische producten die in contact komen met water onderhevig aan zowel elektrochemische als galvanische corrosie. Elektrocorrosie treedt op in aanwezigheid van zwerfstromen. Als gevolg hiervan wordt het metaal tegelijkertijd blootgesteld aan elektrische stroom en water, waarna metaalstoringen optreden en corrosie zich vanaf daar begint te verspreiden.
Wanneer twee verschillende metalen met elkaar in contact komen, waarvan de ene reactiever is dan de andere, gaan beide metalen een chemische reactie aan. Zuiver water is een zeer slechte geleider van elektrische stroom (diëlektricum), maar door de hoge concentratie van verschillende onzuiverheden verandert water in een soort elektrolyt.
Vergeet niet dat temperatuur een grote invloed heeft op de elektrische geleidbaarheid: hoe hoger de watertemperatuur, hoe beter deze elektriciteit geleidt. Dit fenomeen staat bekend als "galvanische corrosie", zij is het die de verwarmde handdoekhouder methodisch onbruikbaar maakt.
De behoefte aan anti-corrosiebescherming
Het beschermen van metaal tegen invloeden die een destructief effect hebben op het oppervlak is een van de belangrijkste taken voor mensen die werken met mechanismen, eenheden en machines, schepen en constructieprocessen.

Hoe actiever een apparaat of onderdeel wordt gebruikt, hoe groter de kans dat het wordt blootgesteld aan de destructieve effecten van atmosferische omstandigheden, vloeistoffen die men tijdens het gebruik tegenkomt.Veel takken van wetenschap en industriële productie werken aan het beschermen van metaal tegen corrosie, maar de belangrijkste methoden blijven ongewijzigd en bestaan uit het maken van beschermende coatings:
- metaal;
- niet-metalen;
- chemisch.
Niet-metalen coatings worden gemaakt met behulp van organische en anorganische verbindingen, hun werkingsprincipe is vrij effectief en verschilt van andere soorten bescherming. Om niet-metalen bescherming te creëren in de industriële en bouwproductie, worden verven en vernissen, beton en bitumen en hoogmoleculaire verbindingen gebruikt, die vooral actief zijn toegepast in de afgelopen jaren, toen de polymeerchemie grote hoogten heeft bereikt.

Chemie heeft bijgedragen aan het creëren van beschermende coatings door methoden:
- oxidatie (vorming van een beschermende film op het metaal met behulp van oxidefilms);
- fosfateren (fosfaatfilms);
- nitreren (verzadiging van het staaloppervlak met stikstof);
- cementeren (verbindingen met koolstof);
- blauwing (verbindingen met organische stoffen);
- het veranderen van de samenstelling van het metaal door toevoeging van anticorrosieadditieven);
- wijziging van de omringende corrosieve omgeving door de introductie van remmers die deze beïnvloeden.
Elektrochemische corrosiebescherming is het omgekeerde proces van elektrochemische corrosie. Afhankelijk van de verschuiving van de potentiaal van het metaal naar de positieve of negatieve kant, is er anode- en kathodische bescherming. Door een beschermer of een gelijkstroombron aan te sluiten op een metalen product ontstaat kathodische polarisatie op het metalen oppervlak, waardoor de vernietiging van het metaal door de anode wordt voorkomen.
Elektrochemische beschermingsmethoden bestaan uit twee opties:
- de metalen coating wordt beschermd door een ander metaal, dat een negatiever potentieel heeft (dat wil zeggen, het beschermende metaal is minder stabiel dan het beschermde), en dit wordt anodiseren genoemd;
- de coating wordt aangebracht van een minder actief metaal, en dan is en wordt het kathodisch genoemd.

Anodecorrosiebescherming is bijvoorbeeld gegalvaniseerd ijzer. Totdat al het zink uit de beschermlaag is opgebruikt, is het ijzer relatief veilig.
Kathodische bescherming is vernikkelen of koperplaten. In dit geval leidt de vernietiging van de beschermende laag tot de vernietiging van de laag die het beschermt. Het aanbrengen van een beschermer om een metalen product te beschermen is niet anders dan de reactie in andere gevallen. De beschermer fungeert als een anode en wat zich onder zijn protectoraat bevindt, blijft intact, gebruikmakend van de voorwaarden die ervoor zijn gecreëerd.
Wat is corrosie?
Het proces van vernietiging van de bovenste laag van een metallisch materiaal onder invloed van externe invloeden wordt in brede zin corrosie genoemd.

De term corrosie is in dit geval slechts een kenmerk van het feit dat het metalen oppervlak een chemische reactie aangaat en onder invloed daarvan zijn oorspronkelijke eigenschappen verliest.
4 hoofdsignalen waaraan u kunt zien dat dit proces bestaat:
- een proces dat zich aan de oppervlakte ontwikkelt en uiteindelijk doordringt in het metalen product;
- de reactie ontstaat spontaan doordat de stabiliteit van het thermodynamische evenwicht tussen de omgeving en het systeem van atomen in de legering of monoliet wordt verstoord;
- de scheikunde ziet dit proces niet alleen als een vernietigingsreactie, maar als een reactie van reductie en oxidatie: bij het aangaan van een reactie vervangen sommige atomen andere;
- de eigenschappen en kenmerken van het metaal tijdens een dergelijke reactie ondergaan significante veranderingen, of gaan verloren waar het zich voordoet.
Methoden voor metaalbescherming
Elektrochemische corrosie is een van de belangrijkste obstakels die de menselijke activiteit tegenkomt. Bescherming tegen de impact van destructieve processen en hun stroming op het oppervlak van structuren en structuren is een van de permanente en dringende taken van elke industriële productie en elke huishoudelijke activiteit van een persoon.

Er zijn verschillende methoden voor dergelijke bescherming ontwikkeld en ze worden allemaal actief gebruikt in de dagelijkse levenscyclus:
- Elektrochemische bescherming - elektrolytisch volgens het werkingsprincipe, het gebruik van chemische wetten, beschermt het metaal met behulp van het anode-, kathode- en loopvlakprincipe.
- Electrospark-verwerking met behulp van verschillende installaties - contactloos, contact, anode-mechanisch.
- Spuiten met elektrische boog is het belangrijkste voordeel in de dikte van de aangebrachte laag en de relatieve goedkoopheid van het proces.
- Effectieve anti-corrosiebehandeling is het verwijderen van verontreinigingen en het reinigen van het behandelde oppervlak, gevolgd door het aanbrengen van een anti-corrosie en vervolgens een extra beschermende laag op het oppervlak.
Al deze methoden zijn ontwikkeld in het proces van menselijke activiteit om gereedschappen, voertuigen en transport te beschermen op de kruising van verschillende industriële sectoren, en met behulp van wetenschappelijke prestaties.
Elektrochemische corrosie, een natuurlijk proces van vernietiging van het metaaloppervlak onder invloed van neutrale of agressieve omgevingsfactoren, is een complex probleem. Machinebouw, transport en industriële ondernemingen, voertuigen lijden er verliezen door. En dit is een probleem dat een dagelijkse oplossing vereist.
Soorten corrosie
Afhankelijk van het type metaal en de redoxreactie die daarbij optreedt, kan corrosie zijn:
- uniform of ongelijk;
- lokaal en punt (sommige secties reageerden om de een of andere reden, terwijl andere dat niet deden);
- ulceratief, ook bekend als pitting;
- ondergrond;
- kraken;
- interkristallijn, ontstaan langs de grenzen van het metaalkristal.
Afhankelijk van wat voor soort externe factoren het oppervlak beïnvloeden, kan corrosie ook chemisch en elektrochemisch zijn. Chemische corrosie treedt op als gevolg van sommige reacties onder invloed van chemische interacties, maar zonder de deelname van elektrische stroom, en kan zelfs inherent zijn aan olie en gas. Elektrochemisch onderscheidt zich door bepaalde processen, het is complexer dan chemisch.

Op de video: corrosie van metalen.
Oorzaken en tekenen van elektrochemische corrosie
Elektrochemische corrosie verschilt van chemische corrosie doordat het vernietigingsproces plaatsvindt in het elektrolytsysteem, waardoor er een elektrische stroom in dit systeem ontstaat. Twee geconjugeerde processen, anodisch en kathodisch, leiden tot de verwijdering van onstabiele atomen uit het kristalrooster van het metaal. Tijdens het anodische proces gaan ionen in oplossing en elektronen van het anodische proces vallen in een val voor een oxiderende stof en worden gebonden door een depolarisator.
Depolarisatie is dus de verwijdering van vrije elektronen van de kathodeplaatsen en de depolarisator is de stof die verantwoordelijk is voor dit proces. De belangrijkste reacties vinden plaats met de deelname van waterstof en zuurstof als depolarisatoren.
Er zijn veel voorbeelden van elektrochemische corrosie van verschillende typen, die metalen oppervlakken in de natuur en onder invloed van verschillende omstandigheden aantast. Waterstof werkt in een zure omgeving, terwijl zuurstof in een neutrale omgeving werkt.
Bijna alle metalen ondergaan elektrochemische corrosie en op basis hiervan zijn ze verdeeld in 4 groepen, de waarde van hun elektrodepotentiaal wordt bepaald:
- actieve stoffen corroderen zelfs in een omgeving waar geen oxidatiemiddelen aanwezig zijn;
- medium-actief een oxidatiereactie aangaan in een zure omgeving;
- inactieve reageren niet in afwezigheid van oxidatiemiddelen in zowel neutrale als zure omgevingen;
- niet reageren - hoge stabiliteit (edele metalen, palladium, goud, platina, iridium).
Maar dezelfde reactie kan ook plaatsvinden in water, in oplossingen van basen, zouten en zuren. In het zeer specialistische verschil in atmosferische corrosie, bodem en beluchting, worden marien en biologisch (optredend onder invloed van bacteriën) onderscheiden.
Er is zelfs sprake van elektrische corrosie, die optreedt onder invloed van elektrische stroom, en het gevolg is van zwerfstromen die optreden waar elektrische stroom door een persoon wordt gebruikt om bepaalde activiteiten uit te voeren.
In dit geval wordt het homogene metalen oppervlak vernietigd als gevolg van thermodynamische instabiliteit voor de omgeving. En heterogeen - vanwege de samenstelling van het kristalrooster, waarin de atomen van één metaal strakker worden vastgehouden dan de atomen van vreemde insluitsels.Deze reacties verschillen in de snelheid van ionisatie van ionen en de reductie van oxidatieve componenten van de omgeving.
De vernietiging van metalen oppervlakken tijdens elektrochemische corrosie bestaat uit het gelijktijdig optreden van twee processen: anodisch en kathodisch, en de verschillen tussen de processen zijn dat het oplossen plaatsvindt aan de anoden, die in contact staan met de omgeving via vele micro-elektroden die deel uitmaken van het oppervlak van elk metaal en zijn voor mezelf gesloten.