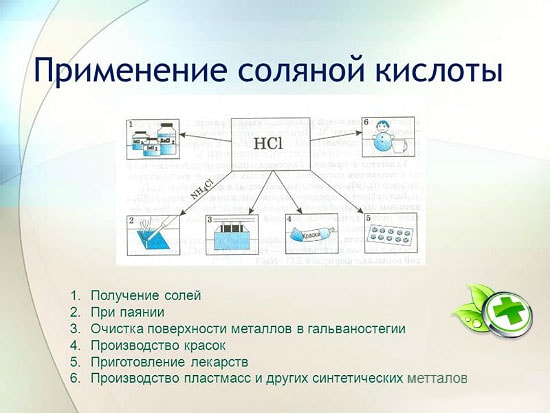
Utilizarea acidului clorhidric
Acidul clorhidric este utilizat pe scară largă în industrie pentru extragerea metalelor din minereuri, decaparea metalelor etc. Este utilizat și la fabricarea lichidului de lipit, la depunerea argintului și ca parte integrantă a acva regiei.
Amploarea utilizării acidului clorhidric în industrie este mai mică decât cea a acidului azotic. Acest lucru se datorează faptului că acidul clorhidric provoacă coroziunea echipamentelor din oțel. În plus, vaporii săi volatili sunt destul de nocivi și provoacă, de asemenea, coroziunea produselor metalice. Acest lucru trebuie luat în considerare la depozitarea acidului clorhidric. Acidul clorhidric este depozitat și transportat în rezervoare și butoaie căptușite cu cauciuc, de ex. în vase, a căror suprafață interioară este acoperită cu cauciuc rezistent la acizi, precum și în sticle de sticlă și ustensile din polietilenă.
Acidul clorhidric este folosit pentru a produce cloruri de zinc, mangan, fier și alte metale, precum și clorură de amoniu. Acidul clorhidric este utilizat pentru curățarea suprafețelor metalelor, vaselor, puțurilor de carbonați, oxizi și alte sedimente și contaminanți. În acest caz, se folosesc aditivi speciali - inhibitori care protejează metalul de dizolvare și coroziune, dar nu întârzie dizolvarea oxizilor, carbonaților și a altor compuși similari.
HCI este utilizat în producția industrială de rășini sintetice, cauciucuri. Este folosit ca materie primă în producția de clorură de metil din alcool metilic, clorură de etil din etilenă și clorură de vinil din acetilenă.
Primul ajutor și metode de tratament
Dacă se găsesc semne de otrăvire, trebuie chemată o ambulanță. La domiciliu, este permisă desfășurarea activităților care vizează îmbunătățirea stării victimei. Primul ajutor pentru otrăvirea cu acid clorhidric trebuie efectuat rapid pentru a reduce riscul de consecințe negative.
Evenimente:
- Dacă compusul de sare ajunge pe piele, zonele deteriorate sunt spălate cu multă apă rece. Timpul de procesare este de cel puțin o jumătate de oră.
- În caz de intoxicație cu vapori, victimei i se asigură acces la aer curat, se deschid ferestrele, se deschid hainele strâmte.
- Se recomandă monitorizarea stării pacientului, în absența semnelor de viață, se efectuează resuscitarea.
- Victima de la vapori are voie să bea ceai cald, apă. Se recomandă clătirea nasului și a gurii cu apă rece.
- În caz de supradozaj rezultat din ingestia de acid, pe abdomen se pune o pungă de gheață pentru a preveni sau a reduce posibila sângerare.
- Nu sunt permise medicamente. Este permis să se dea pacientului un pahar cu apă (se poate minerală alcalină). Este necesar să bei lichid în înghițituri mici.
- Nu este permis să spălați stomacul, încercați să induceți vărsăturile acasă. Un astfel de prim ajutor poate duce la dezvoltarea de arsuri ale gâtului, sângerări.
Tratamentul se efectuează într-o instituție medicală sub supravegherea specialiștilor.
Terapie:
- Curățarea stomacului cu o sondă,
- Utilizarea picăturilor cu soluții medicinale,
- Prescrierea de medicamente pentru ameliorarea durerii
- Utilizarea medicamentelor care vizează restabilirea funcționării organelor și sistemelor,
- Dacă este necesar, inhalarea de oxigen și ventilația artificială a plămânilor,
- Efectuarea terapiei de resuscitare în absența semnelor de viață,
- Selecție de vitamine și nutriție specială.
Tratamentul se efectuează în terapie intensivă și apoi într-un spital. Durata depinde de starea pacientului și de gradul de otrăvire.
Arsuri și otrăviri
Oricât de eficient este acest remediu, este periculos. Acidul clorhidric, în funcție de concentrație, poate provoca arsuri chimice de patru grade:
- Există doar roșeață și durere.
- Există vezicule cu un lichid limpede și umflături.
- Necroza formată a straturilor superioare ale pielii.Blisterele se umplu cu sânge sau conținut tulbure.
- Leziunea ajunge la tendoane si muschi.
Dacă substanța a intrat cumva în ochi, este necesar să le clătiți cu apă și apoi cu o soluție de sifon. Dar, în orice caz, primul lucru de făcut este să chemați o ambulanță.
Ingestia de acid în interior este plină de dureri acute în piept și abdomen, umflarea laringelui, vărsături de mase sângeroase. Ca urmare, patologii severe ale ficatului și rinichilor.
Și primele semne de otrăvire în perechi includ tuse uscată frecventă, sufocare, deteriorarea dinților, arsuri în mucoasele și dureri abdominale. Primul ajutor de urgență este spălarea și clătirea gurii cu apă, precum și accesul la aer proaspăt. Doar un toxicolog poate oferi un ajutor real.
Proprietățile spectrului chimic
Acidul interacționează cu multe metale, săruri. Este considerat destul de puternic și este la egalitate cu caprisul. Reacția principală se manifestă în toate grupele de metale situate în stânga hidrogenului (magneziu, fier, zinc - potențiale electrice).
Soluția de acid clorhidric în formă diluată reacționează cu sărurile, dar numai cu cele formate din acizi mai puțin puternici. Cunoscuți pentru toți carbonatul de sodiu și calciu, după interacțiunea cu acesta, se descompun în apă și monoxid de carbon.
Acid azotic
- o reacție calitativă la soluția salină. Pentru a-l obține, este necesar să adăugați azotat de argint la acest reactiv, ca urmare, se va forma un precipitat alb, din care se obține o substanță de azot.
Cu ajutorul acestui amestec de apă și hidrogen se realizează multe experimente interesante. De exemplu, diluați-l cu amoniac. Ca urmare, vei obține un fum alb, gros, având consistența unor cristale mici. Metilamina, anilina, dioxidul de mangan, carbonatul de potasiu sunt reactivi care sunt afectati si de acid.
Cum și de ce se folosește
Poate că aceasta este pe bună dreptate una dintre substanțele importante care se găsesc și sunt necesare în aproape toate ramurile vieții umane.
Localizarea zonei de aplicare:
- Metalurgie. Curățarea suprafețelor din zonele oxidate, dizolvarea ruginei, tratament de pre-lipire, cositorire. Acidul clorhidric ajută la extragerea micilor incluziuni de metale din minereuri. Zirconiul și titanul sunt obținute prin metoda de transformare a oxizilor în cloruri.
- Industria tehnologiei alimentare. O soluție cu concentrație scăzută este utilizată ca aditiv alimentar. Gelatina, fructoza pentru diabetici contin un emulgator pur. Sifonul obișnuit are și un conținut ridicat din această substanță. Pe ambalajul mărfurilor îl veți vedea sub numele E507.
- Domeniul medicinei. Cu un indicator insuficient al mediului acid din stomac și probleme cu intestinele. Ph scăzut duce la cancer. Chiar și cu o alimentație adecvată, vitamine din abundență, pericolul nu dispare, este necesar să se efectueze teste pentru a obține suc din tractul gastric, deoarece într-un mediu insuficient acid, substanțele utile nu sunt practic absorbite, digestia este perturbată.
- Soluția de sare este folosită ca inhibitor - protecție împotriva murdăriei și infecțiilor, acțiune antiseptică. Pentru fabricarea de amestecuri adezive, produse ceramice. Spălește schimbătoarele de căldură.
- De asemenea, procedura de purificare a apei potabile nu este completă fără participarea clorului.
- Producția de cauciuc, albirea bazelor de țesături.
- Vă puteți îngriji lentilele cu această soluție.
- Apa de gura acasa
- Substanța este un excelent conductor de electricitate.
Cum apare otrăvirea
Acidul clorhidric este un lichid incolor cu un miros înțepător caracteristic. Unul dintre cei mai puternici acizi, capabil să dizolve unele metale. Se transformă cu ușurință într-un gaz.
Clorura de hidrogen este utilizată în industria textilă, afacerile din piele, metalurgia metalelor prețioase, în producția de lipici, acizi.
Substanța este prezentă în stomac în concentrație minimă. Acidul contribuie la normalizarea procesului digestiv, protejează organismul de bacteriile și microorganismele dăunătoare.
La o concentrație care depășește 24%, acidul clorhidric poate provoca vătămări ireversibile organismului uman. Vaporii formați la contactul cu aerul provoacă iritații ale organelor sistemului vizual și respirator.
Există mai mulți factori care pot provoca dezvoltarea otrăvirii.
Factori:
Intoxicarea cu vapori este posibilă atunci când se lucrează în încăperi cu ventilație slabă,
Ingerarea din neglijență, mai frecventă la copii,
Pătrunderea acidului clorhidric pe epidermă, mucoase în caz de nerespectare a regulilor de utilizare a reactivului.
Otrăvirea cu o substanță acasă la adulți apare ca urmare a utilizării fără echipament de protecție a pielii, ochilor și organelor sistemului respirator. Intoxicarea poate apărea atunci când acidul este transferat incorect dintr-un recipient în altul.
Farmacodinamica si farmacocinetica
Ce este aciditatea gastrică? Aceasta este o caracteristică a concentrației de acid clorhidric din stomac. Aciditatea se exprimă în pH
. În mod normal, acidul ar trebui să fie produs în compoziția sucului gastric și să participe activ la procesele de digestie. Formula acidului clorhidric: acid clorhidric
. Este produs de celulele parietale situate în glandele fundice, cu participarea H+/K+-ATPaza
. Aceste celule căptușesc fundul și corpul stomacului. Aciditatea sucului gastric în sine este variabilă și depinde de numărul de celule parietale și de intensitatea proceselor de neutralizare a substanței de către componentele alcaline ale sucului gastric. Concentrația produsă la - sunteți stabil și egal cu 160 mmol/l. O persoană sănătoasă ar trebui să producă în mod normal nu mai mult de 7 și cel puțin 5 mmol dintr-o substanță pe oră.
Cu producția insuficientă sau excesivă de acid clorhidric, apar boli ale tractului digestiv, capacitatea de a absorbi anumite microelemente, cum ar fi fierul, se deteriorează. Medicamentul stimulează secreția de suc gastric, reduce pH
. Se activează pepsinogen
, îl transformă într-o enzimă activă pepsină
. Substanța are un efect benefic asupra reflexului acid al stomacului, încetinește tranziția alimentelor incomplet digerate în intestine. Procesele de fermentare a conținutului tractului digestiv încetinesc, durerea și eructația dispar, fierul este mai bine absorbit.
După administrarea orală, medicamentul este parțial metabolizat de saliva și mucusul gastric, conținutul duodenului 12. Substanța nelegată pătrunde în duoden, unde este complet neutralizată de conținutul său alcalin.
O altă utilizare a acidului în viața de zi cu zi
Cu o compoziție acidă, puteți curăța cu ușurință calcarul și rugina de la instalațiile de faianță, puteți îndepărta pietrele urinare și alți contaminanți. Pentru un efect mai mare, la agent se adaugă un inhibitor (de exemplu, urotropină), care încetinește reacția chimică.
Procedura se efectuează după cum urmează: acidul este diluat cu apă până când se atinge o concentrație de 5% și se adaugă un inhibitor la o rată de 0,5 g la 1 litru de lichid. Suprafața se tratează cu compoziția rezultată și se lasă timp de 30-40 de minute (în funcție de gradul de contaminare), după care se spală cu apă.
O soluție de acid ușor este, de asemenea, utilizată pentru a îndepărta petele de fructe de pădure, petele de cerneală sau de rugină de pe țesături. Pentru a face acest lucru, materialul este înmuiat în compoziție pentru un timp, după care este clătit bine și spălat în mod obișnuit.
A scăpa de solmul din ibric
În acest scop, se folosește o soluție de acid clorhidric 3-5%, care se toarnă într-un ibric și se încălzește la 60-80°
C timp de 1-2 ore sau până când depunerile de calcar se dezintegrează. După aceea, cântarul se slăbește și este ușor îndepărtat cu o spatulă de lemn.
Eficacitatea metodei se datorează faptului că reactivul reacționează cu carbonați de magneziu și calciu și le transformă în săruri solubile. Dioxidul de carbon eliberat în același timp distruge stratul de sol și îl slăbește. După îndepărtarea depunerilor de sare, vasele se spală bine cu apă curată.
Punct important!
Această metodă nu este potrivită pentru detartrarea smalțului ciobit și crăpat sau a ibricurilor din aluminiu: aceasta va coroda metalul și îl va deteriora grav.
Obținerea unei substanțe
Acum putem vorbi despre ce fac ei pentru a forma acid clorhidric.
În primul rând, prin arderea hidrogenului în clor, se obține componenta principală, acid clorhidric gazos. care se dizolvă apoi în apă. Rezultatul acestei reacții simple este formarea unui acid sintetic.
Această substanță poate fi obținută și din gazele reziduale. Acestea sunt gaze reziduale chimice (laterale). Ele sunt formate printr-o varietate de procese. De exemplu, la clorurarea hidrocarburilor. Clorura de hidrogen din compoziția lor se numește gaz rezidual. Și acidul astfel obținut, respectiv.
De menționat că în ultimii ani ponderea substanței reziduale în volumul total al producției sale a crescut. Iar acidul format ca urmare a arderii hidrogenului din clor este deplasat. Cu toate acestea, pentru dreptate, trebuie remarcat faptul că conține mai puține impurități.
Utilizarea în producție
Are o largă aplicație în industria metalurgică, alimentară și medicală.
- Metalurgie. Utilizare la lipirea, cositorirea și curățarea metalelor.
- Industria alimentară. Aplicație în producția de regulatori de aciditate alimentară, de exemplu, E507.
- Electrotip. Folosit pentru decapare.
- Medicament. Își găsește aplicația în producerea sucului gastric artificial.
Inclus în coloranții sintetici. Este utilizat în producția de produse de curățare și detergenți. Dar în lichidele destinate uzului casnic, concentrația de acid sulfuric este neglijabilă.
Cum se produce acidul clorhidric în laborator
Producția substanței este pe scară largă, vânzarea este gratuită. În condițiile experimentelor de laborator, o soluție este produsă prin acțiunea acidului sulfuric de concentrație mare asupra sării obișnuite de bucătărie (clorura de sodiu).
Există 2 metode de dizolvare a clorurii de hidrogen în apă:
- Hidrogenul este ars în clor (sintetic).
- Asociat (gaz rezidual). Esența sa este în efectuarea clorării organice, a dehidroclorării.
Substanța se pretează bine sintezei în timpul pirolizei deșeurilor din organocloru. Acest lucru se întâmplă ca urmare a defalcării hidrocarburilor cu o lipsă completă de oxigen. Puteți folosi și clorurile metalice, care sunt materiile prime ale substanțelor anorganice. Dacă nu există acid sulfuric concentrat (electrolit), luați diluat.
În ceea ce privește extracția reactivului în condiții naturale, cel mai adesea acest amestec chimic se găsește în apele deșeurilor vulcanice. Clorura de hidrogen este o componentă a mineralelor silvin (clorura de potasiu, arată ca oase pentru jocuri), bischofit. Toate acestea sunt metode de extragere a substanței în industrie.
La om, această enzimă se găsește în stomac. O soluție poate fi fie un acid, fie o bază. Una dintre cele mai comune metode de extracție este numită sulfat.
Proprietăți chimice
Acid clorhidric, acid clorhidric sau acid clorhidric - soluție acid clorhidric
in apa. Potrivit Wikipedia, substanța aparține grupului de anorganice puternice monobazice to-t. Numele complet al compusului în latină: acid clorhidric.
Formula acidului clorhidric în chimie: acid clorhidric
. Într-o moleculă, atomii de hidrogen se combină cu atomii de halogen - Cl
. Dacă luăm în considerare configurația electronică a acestor molecule, se poate observa că compușii participă la formarea orbitalilor moleculari. 1s
-orbitalii de hidrogen si ambii 3s
și 3p
-orbitalii unui atom Cl
. În formula chimică a acidului clorhidric 1s-
, 3s-
și 3r
-orbitalii atomici se suprapun si formeaza 1, 2, 3 orbitali. în care 3s
-orbital nu este obligatoriu. Există o schimbare a densității electronilor către atom Cl
iar polaritatea moleculei scade, dar energia de legare a orbitalilor moleculari crește (dacă o luăm în considerare împreună cu alte halogenuri de hidrogen
).
Proprietățile fizice ale clorurii de hidrogen. Este un lichid limpede, incolor, care fumează atunci când este expus la aer. Masa molară a unui compus chimic = 36,6 grame pe mol. În condiții standard, la o temperatură a aerului de 20 de grade Celsius, concentrația maximă a unei substanțe este de 38% din greutate. Densitatea acidului clorhidric concentrat în acest tip de soluție este de 1,19 g/cm³. În general, proprietățile și caracteristicile fizice precum densitatea, molaritatea, vâscozitatea, capacitatea termică, punctul de fierbere și pH
, depind puternic de concentrația soluției. Aceste valori sunt discutate mai detaliat în tabelul densităților. De exemplu, densitatea acidului clorhidric 10% = 1,048 kg pe litru. Când se solidifică, substanța se formează hidraţii cristalini
diferite compoziții.
Proprietățile chimice ale acidului clorhidric. Cu ce reacționează acidul clorhidric? Substanța interacționează cu metalele care stau în fața hidrogenului într-o serie de potențiale electrochimice (fier, magneziu, zinc și altele). În acest caz, se formează săruri și sunt gazoase H
. Plumbul, cuprul, aurul, argintul și alte metale din dreapta hidrogenului nu reacționează cu acidul clorhidric. Substanța reacționează cu oxizii metalici producând apă și o sare solubilă. Hidroxidul de sodiu sub acțiunea formelor și apei. Reacția de neutralizare este caracteristică acestui compus.
Acidul clorhidric diluat reacționează cu sărurile metalice, care sunt formate de acizi mai slabi. De exemplu, acid propionic
mai slab decât sarea. Substanța nu reacționează cu acizii mai puternici. și bicarbonat de sodiu
se va forma după reacția cu acid clorhidric
clorura, monoxidul de carbon si apa.
Pentru un compus chimic sunt caracteristice reacțiile cu agenți oxidanți puternici, cu dioxid de mangan
, permanganat de potasiu
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. Substanța reacționează cu amoniac
, care produce fum alb gros, care este format din cristale foarte mici de clorură de amoniu. Mineralul piroluzit reacționează și cu acidul clorhidric, deoarece conține dioxid de mangan
: MnO2+4HCI=Cl2+MnO2+2H2O
(reacție de oxidare).
Există o reacție calitativă la acidul clorhidric și sărurile sale. Când o substanță interacționează cu nitrat de argint
un precipitat alb clorura de argint
si format acid azotic
. Ecuația reacției de interacțiune metilamină
cu clorură de hidrogen arată astfel: HCI + CH3NH2 = (CH3NH3)CI
.
O substanță reacționează cu o bază slabă anilină
. După dizolvarea anilinei în apă, la amestec se adaugă acid clorhidric. Ca rezultat, baza se dizolvă și se formează clorhidrat de anilină
(clorură de fenilamoniu
): (С6Н5NH3)Cl
. Reacția de interacțiune a carburii de aluminiu cu acidul clorhidric: Al4C3+12HCl=3CH4+4AlCI3
. Ecuația reacției carbonat de potasiu
cu care arata asa: K2CO3 + 2HCl = 2KCl + H2O + CO2.
Aplicație
în metalurgie pentru extragerea minereurilor, îndepărtarea ruginii, a depunerilor, a murdăriei și a oxizilor, lipirea și cositorirea;
la fabricarea cauciucurilor și rășinilor sintetice;
în galvanizare;
ca regulator de aciditate în industria alimentară;
pentru a obține cloruri metalice;
pentru a obține clor;
în medicină pentru tratamentul acidității insuficiente a sucului gastric;
ca agent de curatare si dezinfectant.
- (HCl), o soluție apoasă de acid clorhidric, un gaz incolor cu miros înțepător. Obținut prin acțiunea acidului sulfuric asupra sării comune, ca produs secundar al clorării hidrocarburilor, sau prin reacția hidrogenului și clorului. Acidul clorhidric este folosit pentru ... ... Dicționar enciclopedic științific și tehnic
Acid clorhidric
- - HCl (SC) (acid clorhidric, acid clorhidric, acid clorhidric) este o soluție de acid clorhidric (HCl) în apă, un aditiv antigel. Este un lichid incolor, cu miros înțepător, fără particule în suspensie. ... ... Enciclopedie de termeni, definiții și explicații ale materialelor de construcție
ACID CLORHIDRIC
- (acid clorhidric) soluție de acid clorhidric în apă; acid puternic. Un lichid incolor care fumează în aer (acidul clorhidric tehnic este gălbui din cauza impurităților de Fe, Cl2 etc.). Concentrația maximă (la 20 ° C) este de 38% din masă, ... ... Marele Dicționar Enciclopedic
ACID CLORHIDRIC
- (Acidum muriaticum, Acid, hydrochloricum), o soluție de acid clorhidric (HC1) în apă. În natură, se găsește în apa anumitor surse de origine vulcanică și se găsește și în sucul gastric (până la 0,5%). Clorura de hidrogen poate fi obținută... Marea Enciclopedie Medicală
ACID CLORHIDRIC
- (acid clorhidric, acid clorhidric) un acid volatil monobazic puternic cu miros înțepător, o soluție apoasă de acid clorhidric; concentrația maximă este de 38% din masă, densitatea unei astfel de soluții este de 1,19 g/cm3. Folosit în ... ... Enciclopedia rusă de protecție a muncii
ACID CLORHIDRIC
- (acid clorhidric) HCI soluție apoasă de acid clorhidric, acid monobazic puternic, volatil, cu miros înțepător; impuritățile de fier, clorul îl pătează gălbui. S. concentrat pentru a vinde conține 37% ... ... Marea Enciclopedie Politehnică
acid clorhidric
— substantiv, număr de sinonime: 1 acid (171) Dicționar de sinonime ASIS. V.N. Trishin. 2013 ... Dicţionar de sinonime
ACID CLORHIDRIC
Enciclopedia modernă
Acid clorhidric
- ACID HIDROGEN, soluție apoasă de acid clorhidric HCI; un lichid fumos cu un miros înțepător. Acidul clorhidric este folosit la obtinerea diverselor cloruri, decaparea metalelor, prelucrarea minereurilor, in productia de clor, soda, cauciucuri etc. ... ... Dictionar Enciclopedic Ilustrat
acid clorhidric
- (acid clorhidric), o soluție de acid clorhidric în apă; acid puternic. Un lichid incolor „fumând” în aer (acidul clorhidric tehnic este gălbui din cauza impurităților de Fe, Cl2 etc.). Concentrație maximă (la 20 ° C) 38% din masă, ... ... Dicționar Enciclopedic
Care este pericolul intoxicației
Acidul clorhidric este un pericol deosebit pentru organismul uman. În caz de otrăvire cu o astfel de substanță, se pot dezvolta complicații grave și încălcări ale funcționalității corpului.
Complicatii:
- Încălcarea ficatului, ca urmare a hepatitei toxice,
- Sângerare în stomac din cauza pereților distruși ai organului,
- O stare de șoc din cauza durerii când acidul intră într-o zonă mare,
- În caz de contact cu ochii, tulburări de vedere,
- Funcționare defectuoasă gravă a rinichilor,
- Insuficiență respiratorie, sufocare, dificultăți de respirație,
- Dezvoltarea unei coma.
Consecințe similare se dezvoltă treptat, în funcție de gradul de otrăvire.
Concluzie
Dacă respectați precauțiile și regulile de siguranță, acidul clorhidric va deveni un asistent indispensabil în viața de zi cu zi. Și îl puteți cumpăra la cele mai accesibile prețuri din compania noastră.
Ca acizii. Programul educațional prevede memorarea de către elevi a numelor și formulelor a șase reprezentanți ai acestui grup. Și, uitându-te prin tabelul oferit de manual, îl observi în lista de acizi pe cel care vine pe primul loc și te-a interesat în primul rând - acidul clorhidric. Din păcate, în sala de clasă de la școală nu se studiază nici proprietatea, nici alte informații despre aceasta. Prin urmare, cei care sunt dornici să dobândească cunoștințe în afara programului școlar caută informații suplimentare în tot felul de surse. Dar adesea, mulți nu găsesc informațiile de care au nevoie. Și astfel subiectul articolului de astăzi este dedicat acestui acid special.
Definiție
Acidul clorhidric este un acid monobazic puternic. În unele surse, poate fi numit clorhidric și clorhidric, precum și clorură de hidrogen.
Proprietăți fizice
Este un lichid caustic incolor și fumos în aer (foto din dreapta). Cu toate acestea, acidul tehnic are o culoare gălbuie din cauza prezenței fierului, clorului și a altor aditivi în el. Cea mai mare concentrație la o temperatură de 20 ° C este de 38%. Densitatea acidului clorhidric cu astfel de parametri este de 1,19 g/cm3. Dar acest compus în diferite grade de saturație are date complet diferite.Odată cu scăderea concentrației, valoarea numerică a molarității, vâscozității și punctului de topire scade, dar capacitatea termică specifică și punctul de fierbere cresc. Solidificarea acidului clorhidric de orice concentrație dă diferiți hidrați cristalini.
Proprietăți chimice
Toate metalele care vin înaintea hidrogenului în seria electrochimică a tensiunii lor pot interacționa cu acest compus, formând săruri și eliberând hidrogen gazos. Dacă sunt înlocuiți cu oxizi metalici, atunci produsele de reacție vor fi sare solubilă și apă. Același efect va fi în interacțiunea acidului clorhidric cu hidroxizi. Dacă, totuși, i se adaugă orice sare de metale (de exemplu, carbonat de sodiu), al cărei reziduu a fost luat dintr-un acid mai slab (carbonic), atunci clorura acestui metal (sodiu), apă și gaz corespunzătoare acidului se formează reziduuri (în acest caz, dioxid de carbon).
chitanta
Compusul discutat acum se formează atunci când gazul clorhidric, care poate fi obținut prin arderea hidrogenului în clor, este dizolvat în apă. Acidul clorhidric, care a fost obținut prin această metodă, se numește sintetic. Gazele reziduale pot servi și ca sursă pentru obținerea acestei substanțe. Și un astfel de acid clorhidric va fi numit acid de evacuare. Recent, nivelul de producție de acid clorhidric prin această metodă este mult mai mare decât producerea acestuia printr-o metodă sintetică, deși aceasta din urmă dă compusul într-o formă mai pură. Toate acestea sunt modalități de a le obține în industrie. Cu toate acestea, în laboratoare, acidul clorhidric este produs în trei moduri (primele două diferă doar prin temperatură și produși de reacție) folosind diferite tipuri de interacțiuni chimice, cum ar fi:
- Efectul acidului sulfuric saturat asupra clorurii de sodiu la o temperatură de 150 o C.
- Interacțiunea substanțelor de mai sus în condiții cu o temperatură de 550 ° C și peste.
- Hidroliza clorurilor de aluminiu sau magneziu.
Aplicație
Hidrometalurgia și electroformarea nu se pot descurca fără utilizarea acidului clorhidric, acolo unde este necesar, pentru curățarea suprafeței metalelor în timpul cositoririi și lipirii și pentru a obține cloruri de mangan, fier, zinc și alte metale. În industria alimentară, acest compus este cunoscut sub numele de aditiv alimentar E507 - acolo este un regulator de aciditate necesar pentru a face apă seltzer (sodă). Acidul clorhidric concentrat se găsește și în sucul gastric al oricărei persoane și ajută la digerarea alimentelor. În timpul acestui proces, gradul său de saturație scade, deoarece. această compoziție se diluează cu alimente. Cu toate acestea, cu postul prelungit, concentrația de acid clorhidric din stomac crește treptat. Și deoarece acest compus este foarte caustic, poate duce la ulcere gastrice.
Concluzie
Acidul clorhidric poate fi atât benefic, cât și dăunător pentru oameni. Contactul său cu pielea duce la arsuri chimice severe, iar vaporii acestui compus irită tractul respirator și ochii.
Dar dacă manipulați această substanță cu atenție, poate fi utilă de mai multe ori