Čo určuje slanosť morskej vody
Vidieť trochu vyššie číslo 3,5 ppm
, možno si myslíte, že toto je konštanta pre akúkoľvek morskú vodu na našej planéte. Ale všetko nie je také jednoduché, slanosť závisí od regiónu. Náhodou sa stalo, že čím severnejšie sa región nachádza, tým je táto hodnota väčšia.
Naopak, juh sa môže pochváliť nie až tak slanými morami a oceánmi. Samozrejme, všetky pravidlá majú svoje výnimky. Hladiny soli v moriach sú zvyčajne o niečo nižšie ako v oceánoch.
Aké je geografické rozdelenie vo všeobecnosti? Nie je známe, výskumníci to berú ako samozrejmosť, je tam všetko. Odpoveď možno treba hľadať v skorších obdobiach vývoja našej planéty. Nie v čase, keď sa rodil život – oveľa skôr.
Už vieme, že slanosť vody závisí od prítomnosti:
- chlorid horečnatý.
- chlorid sodný.
- iné soli.
Možno, že v niektorých častiach zemskej kôry boli ložiská týchto látok o niečo väčšie ako v susedných regiónoch. Na druhej strane morské prúdy nikto nezrušil, skôr či neskôr sa musela všeobecná hladina vyrovnať.
Takže s najväčšou pravdepodobnosťou je malý rozdiel spojený s klimatickými vlastnosťami našej planéty. Nie najnepodložený názor, ak si spomeniete na mrazy a zvážite, čo presne voda s vysokým obsahom soli zamŕza pomalšie.
Fázy zmrazenia
Je veľmi zaujímavé sledovať, ako morská voda zamŕza. Nie je okamžite pokrytá jednotnou ľadovou kôrou ako sladká voda. Keď sa časť zmení na ľad (a je čerstvá), zvyšok objemu sa ešte viac osolí a na zmrazenie je potrebný ešte silnejší mráz.
Druhy ľadu
Ako sa more ochladzuje, tvoria sa rôzne druhy ľadu:
- snehová búrka;
- kal;
- ihly;
- Salo;
- nilas.
Ak more ešte nezamrzlo, ale je pri ňom veľmi blízko a v tom čase napadne sneh, pri kontakte s hladinou sa neroztopí, ale nasýti sa vodou a vytvorí viskóznu kašovitú hmotu nazývanú sneh. Zmrznutím sa táto kaša zmení na kal, ktorý je veľmi nebezpečný pre lode zachytené v búrke. Vďaka tomu je paluba okamžite pokrytá ľadovou kôrou.
Keď teplomer dosiahne značku potrebnú na zmrazenie, v mori sa začnú vytvárať ľadové ihličky – kryštály vo forme veľmi tenkých šesťhranných hranolov. Keď ich zozbierate sieťkou, zmyjete soľ a roztopíte, zistíte, že sú nevýrazné.
Keď sa ešte viac ochladí, tuk začne mrznúť a vytvorí ľadovú kôru, priehľadnú a krehkú ako sklo. Takýto ľad sa nazýva nilas alebo fľaša. Je slaná, hoci vzniká z nekvaseného ihličia. Faktom je, že počas mrazenia ihly zachytávajú najmenšie kvapky okolitej slanej vody.
Len v moriach je taký jav ako plávajúci ľad. Vzniká preto, že voda sa tu rýchlejšie ochladzuje pri pobreží. Ľad, ktorý sa tam vytvoril, zamŕza až po okraj pobrežia, preto sa mu hovorilo rýchly ľad. Keď sa mráz počas pokojného počasia zosilňuje, rýchlo zaberá nové územia, niekedy dosahujúce šírku desiatok kilometrov. No akonáhle sa zdvihne silný vietor, rýchly ľad sa začne lámať na kúsky rôznych veľkostí. Tieto ľadové kryhy, často obrovské (ľadové polia), sú prenášané vetrom a prúdom po mori, čo spôsobuje lodiam problémy.
Odsoľovanie morskej vody.
O odsoľovaní už každý aspoň trochu počul, niektorí si už pamätajú aj film „Vodný svet“. Aké reálne je dať jeden takýto prenosný destilátor do každého domu a navždy zabudnúť na problém pitnej vody pre ľudstvo? Stále fantázia, nie realita.
Všetko je to o vynaloženej energii, pretože na efektívnu prevádzku sú potrebné obrovské kapacity, nie menej ako jadrový reaktor. Na tomto princípe funguje odsoľovacie zariadenie v Kazachstane.Nápad predložili aj na Kryme, ale výkon sevastopolského reaktora na takéto objemy nestačil.
Pred polstoročím, pred početnými jadrovými katastrofami, bolo ešte možné predpokladať, že pokojný atóm vstúpi do každého domu. Dokonca tam bol aj slogan. Už teraz je však jasné, že jadrové mikroreaktory sa nepoužívajú:
- V domácich spotrebičoch.
- V priemyselných podnikoch.
- Pri konštrukcii automobilov a lietadiel.
- A áno, v rámci mesta.
Neočakávané v budúcom storočí. Veda možno urobí ďalší skok a prekvapí nás, no zatiaľ sú to len fantázie a nádeje neopatrných romantikov.
Bod tuhnutia destilovanej vody
Zamŕza destilovaná voda? Pripomeňme, že na zamrznutie vody je potrebné, aby v nej boli nejaké kryštalizačné centrá, ktorými môžu byť vzduchové bubliny, suspendované častice, ale aj poškodenie stien nádoby, v ktorej sa nachádza.
Destilovaná voda, úplne zbavená akýchkoľvek nečistôt, nemá kryštalizačné jadrá, a preto jej mrazenie začína už pri veľmi nízkych teplotách. Počiatočný bod tuhnutia destilovanej vody je -42 stupňov. Vedcom sa podarilo dosiahnuť podchladenie destilovanej vody na -70 stupňov.
Voda, ktorá bola vystavená veľmi nízkym teplotám, ale nekryštalizovala, sa nazýva „podchladená“. Môžete umiestniť fľašu destilovanej vody do mrazničky, dosiahnuť podchladenie a potom predviesť veľmi účinný trik - pozri video:
Jemným poklepaním na fľašu vybratú z chladničky alebo vhodením malého kúska ľadu do nej môžete ukázať, ako sa okamžite zmení na ľad, ktorý vyzerá ako podlhovasté kryštály.
Destilovaná voda: zamrzne táto čistená látka alebo nie pod tlakom? Takýto proces je možný len v špeciálne vytvorených laboratórnych podmienkach.
ÑаÑÑолÑемпеÑаÑÑÑа
D D d D D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D o d D: D · α α n n n n n n ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ D D d D D a D a D a D a D a D a D a D o d D δ¶¶Ð D o d D Đ ód Đ D o d D ód D a D o d D ód D o d D Đ d d d d d a d a d a d a d a d a d a d a d a d a d a d a d a d a d a d a d a d o d d δ ° ÑÑвоÑÐ ° ÑвÐμÐ »d ÑиÑÑÑ. Ð Ð Ð Ð Ð Ð Ð Ð Ð 2 Ð ² Ð Ð Ð Ð ² Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð 2 Ð Ð Ð Ð Ð Ð Ð Ð 2 Ð Ð 2 Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð °ñ °ñ °ñ °ñ °ñ °ñ °ñ °ñ °ñ °ñ °ñ °ñ °ñ °ñ °ñ °ñ °ñ ñññ Ð ÐμÐ Ð D o d D Ðμ D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D o d D DN »Ð ²Ðððð ооо²²²²²² Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ² Ð ²Ð Ð Ð ² DND »D ÑоÐ'ÐμÑжР° ниÐμ Ñол d в ND ° ÑÑоР»Ðμ мÐμнÑÑÐμ, ÑÐμм ÑÑÐμÐ ± ÑÐμмоÐμ Ð'л Ñ ÑвÑÐμкÑиÑÐμÑкого ND ° ÑÑвоÑÐ °, воÐ'Ð ° ÑÑкоÑÐ¸Ñ Ð¾Ð ±Ñазование кÑиÑÑаллов лÑда пÑна пÑн¸ пÑи ¸ оÑлажденÑÑаиоиии Bežiaci ñðμμðððμð½ððÐμÐμРРРо D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D o d D ¸ÑивР° Ðμñ ðºð¾¾½½½ññðμμ¸¸ñññ¸¾¸¸¸¸¸¸¸¸¸¸¸ncios »¾ð¾¾¾¾¾¼ ñññ¾¾¾¾¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¾¾¸¸¾¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¾¸¸¸¸¸¼¸¸¸¸¸¾¾¸¸NI» D D d D D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D o d D d D Ð Ð Ð Ð Ð Ð ñ ñ ñ ñ ñ ñ ñ ñ Ð ° Ð ° ñ °
D D d D D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D o d D d D Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ñ ñÐ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ° ñ ° ñ ñ ° Ð Ð'Ð ° Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð μ Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð 3. Ð Ð Ð Ð Ð μñ DD ° мÐμÑÐ · Ð ° ниÐμ ÑвÑÐμкÑиÑÐμÑкого ND ° ÑÑвоÑÐ ° â ÑÑо пÑоÑÐμÑÑ Ñ ÑÑÐ ° ÑÑиÐμм ÑкÑÑÑой ÑÐμпР»Ð¾ÑÑ, поÑÑÐ¾Ð¼Ñ ÑÐμмпÐμÑÐ ° ÑÑÑÐ ° оÑÑÐ ° ÐμÑÑÑ Ð½ÐμиР· менной. Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð 2 Ð Ð 2 Ð Ð 2 Ð Ð Ð 2 Ð Ð Ð 2 Ð Ð Ð 2 Ð Ð Ð 2 Ð Ð Ð 2 Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð vykonávajúcí ¿Ñипонижении D D · n n n n nd d D d D d D d D d D d D d D d D d D d D d D d D ² D a D a D a D a D a D o d D d D - D D Ð'Ð ° D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D o d D d D Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ° ¸ поÑÑоÑннойÐð ° ð½ð½ððð ¿¿¿¿¾¾¼μμμ½ ¿¿¿¿μ¸ñññ ð² ¿¿ »ð ° ññ¸¸¸¿ ° ° ° ñños ¸¸¸¸¿¿ ° ° ° °¸¸¿μμ¾¾¾¸¸¸¾²¿¿¿¾¾¾¾¸¸¾¾²¿¿¿¾¾¾¾¸¸¾²²'¿¾¾¾¾¾²² .
Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ° Ð Ð ° Ð Ð ° Ð Ð ° Ð Ð ° Ð Ð ° Ð ° Ð Ð ° Ð ° Ð Ð ° Ð ° Ð ° Ð ° ¸Ñ и ÑлоÑида наÑÑиÑ. Ð ð ° Øññ²¾¾¾ ñð »¾¾¾¸¸¸¸'ð ° ºð ° ° ð» ññ¸¸¸ ¸¿¿μ¶¶¶''μ¸ ð¿²¿ðð춳³³μ¾ ·¸¸¸¸ññ¾¾ »·ð · ·¿¾¾ññosatð» ð¿¿¿¾¾¾¼ññ »» ð¿¿¿¾¾¾¼ññ »» ¿¿¾¾¾¾¼ñññ »» ¸ замоÑаживании пÑодÑкÑов, ÑÑѰнии 17.8 °Ð¡. Ð ° Ð d D ° D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D o d D d D Ð Ð Ð Ð Ð Ð Ð Ð Ð 55 °C Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ² Ð ² Ð Ð Ð Ð Ð Ð Ð Ð 2 Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð 2 Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð 2 Ð Ð Ð Ð Ð Ð Ð Ð 2. A A Ð d d d a d o d d ¿d a d a d a d a d a d a d a d a d a d o d d ñññððμμ '' 'DDDDDDDD ° вР° ÑÑÑоÑÑкий пÑоÐ'ÑкÑÐ ° м Dd d D D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D o d D ÑÑÑонÑÐ °ÐºÑ ÑаÑÑооа ÑоÑлаждаемÑм пÑодÑкÑом.
Ð ð ° Øññ²¾¾¾ ñð »¾¾¾ð¸¸¸' ° ° ð½ð ° ññ¸¸¸¸¸¹¹ ¾¾¾» ¸¸¸¸ð¸¸¸ ¸ ¿¸¾¾²²ððð ðññ¾²'ððð ºññ¾''ðððººññ .''ðððμºññ¾''ðððººññ¾''ðððººññ¾''ðððººññ¾'''ððμºññ¾''ðððººññ¾''ðððººññ¾''ðððººññ¾''ðððººññ¾''ðððμºññ¾ ' оñððð Ð ° Ð ° a D o d D ðñððÐ D a D a D a D a D a D a D a D a D a D a D a D o d D Đ Ð¾Ðμ D a D a D a D o d D Đ ° Ð Ð Ð Ð Ð Ð ° Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð μ Ð ° Ð Ð Ð ° Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð 2. 2. 1 °Ð¡. Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð 2 Ð ² Ð ² Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð 2 Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð 2 Ð Ð Ð Ð Ð Ð Ð Ð 2 . Ð Ð ·
CYKLUS VODY VO SVETOVOM OCEÁNI
V polárnych oblastiach sa voda ochladzovaním stáva hustejšou a klesá ku dnu. Odtiaľ sa pomaly posúva smerom k rovníku. Preto sú hlboké vody vo všetkých zemepisných šírkach studené. Dokonca aj na rovníku majú spodné vody teplotu len 1-2 ° nad nulou.
Keďže prúdy privádzajú teplú vodu z rovníka do miernych zemepisných šírok, studená voda stúpa z hĺbky veľmi pomaly, aby zaujala jej miesto. Na povrchu sa opäť ohrieva, prechádza do subpolárnych zón, kde sa ochladzuje, klesá ku dnu a opäť sa posúva po dne k rovníku.
V oceánoch teda existuje akýsi kolobeh vody: na povrchu sa voda pohybuje od rovníka do subpolárnych zón a pozdĺž dna oceánov - zo subpolárnych zón k rovníku. Tento proces miešania vody spolu s ďalšími vyššie uvedenými javmi vytvára jednotu oceánov.
Ak nájdete chybu, zvýraznite časť textu a kliknite Ctrl+Enter
.
V časti o otázke, čo možno dosiahnuť najnižšiu teplotu vodno-solného roztoku obyčajnej (stolovej, NaCl) soli, uvádzanú autorom Európsky
najlepšia odpoveď je Pridaním soli do vody sa rýchlosť topenia ľadu zvyšuje a teplota topenia ľadu klesá. Prídavok soli totiž spôsobuje oslabenie molekulárnej súdržnosti a deštrukciu kryštálových mriežok ľadu. Topenie ľadovo-soľnej zmesi prebieha s odvádzaním tepla z prostredia, v dôsledku čoho sa okolitý vzduch ochladzuje a jeho teplota klesá. So zvyšujúcim sa obsahom soli v zmesi ľadu a soli klesá jej teplota topenia. Soľný roztok s najnižším bodom topenia sa nazýva eutektikum a jeho teplota topenia sa nazýva bod kryohydrátu. Teplota kryohydrátu pre zmes ľadovej soli s kuchynskou soľou je -21,2 °C, pri koncentrácii soli v roztoku 23,1 % vzhľadom na celkovú hmotnosť zmesi, čo sa približne rovná 30 kg soli na 100 kg ľad.Pri ďalšom zvýšení koncentrácie soli nejde o zníženie teploty topenia zmesi ľad-soľ, ale o zvýšenie teploty topenia (pri 25% koncentrácii soli v roztoku k celkovej hmotnosti teplota topenia stúpa do -8 °C).Pri zmrazovaní vodného roztoku kuchynskej soli v koncentrácii zodpovedajúcej bodu kryohydrátu sa získa homogénna zmes kryštálov ľadu a soli, ktorá sa nazýva eutektický tuhý roztok.Teplota topenia eutektického tuhého roztoku chloridu sodného je -21,2 °C a teplo topenia je 236 kJ/kg. Eutektický roztok sa používa na chladenie s nulovým krútiacim momentom. Na tento účel sa eutektický roztok kuchynskej soli naleje do nulových - tesne uzavretých foriem - a zmrazí sa. Mrazené nuly sa používajú na chladenie pultov, skriniek, chladiacich prenosných chladiacich tašiek a pod. (otvorte mrazničku domácej chladničky - nájdete takúto nádobu) V obchode bolo chladenie ľad-soľ široko používané pred sériovou výrobou zariadení so strojovým chladením.
Odpoveď od vyschnúť
najnižšia teplota zo všetkých teplôt je absolútna nula, okolo -273 stupňov Celzia
Odpoveď od Olya
teplota závisí od koncentrácie soli v roztoku, čím vyššia koncentrácia, tým nižší bod tuhnutia. referenčná kniha mi bola na chvíľu odobratá)), ale ak vychádzame zo skutočnosti, že morská voda je soľný roztok, potom môžeme konštatovať, že teplota mrazu je oveľa nižšia ako nula .... stupňov -15-20
Odpoveď od schopný
22,4 % vodný roztok NaCl mrzne pri 21,2 °C
na otázku Vodný roztok NaCl "teplota kryštalizácie"
Odpoveď od Yergey Neznamov
Tabuľka 10.8. Teplota tuhnutia roztoku NaCl Obsah NaCl, g v 100 g vody 5 - -4,4 9,0 - -5,4 10,6 - -6,4 12,3 - -7,5 14,0 - -8,6 15,7 - -9,8 17,5 - -11,0 19,3 - 3 - 11. - - 15,1 25,0 - - 16,0 26,9 - -18,2 29,0 - -20,0 30,1 - -21,2
Bod tuhnutia slanej vody
Experimenty s ľadom pre deti sú vždy zaujímavé. Počas experimentov s Vladom som dokonca pre seba urobil niekoľko objavov.
Dnes nájdeme odpovede na nasledujúce otázky:
- Ako sa správa voda pri zamrznutí?
- Čo sa stane, ak zmrazíte slanú vodu?
- kabát zahreje ľad?
- a niektoré ďalšie…
mrazivá voda

Zamŕza slaná voda?
Čím je voda slanejšia, tým je bod mrazu nižší. Na pokus sme si zobrali dva poháre – do jedného sladkú vodu (označenú písmenom B), do druhej veľmi slanú vodu (označenú písmenami B + C).
Po celonočnom státí v mrazničke slaná voda nezamrzla, ale v pohári sa vytvorili kryštáliky ľadu. Sladká voda sa zmenila na ľad. Kým som ja manipuloval s pohármi a soľnými roztokmi, Vladik vytvoril svoj neplánovaný experiment.
Do hrnčeka nalial vodu, rastlinný olej a nenápadne ho vložil do mrazničky. 
Slaná voda v mrazničke nezamrzla, ale čo sa stane, ak ľad posypete soľou? Skontrolujme to.
Skúsenosti s ľadom a soľou
Vezmite dve kocky ľadu. Jeden z nich posypte soľou a druhý nechajte na porovnanie. 
Zmrazili sme veľký cencúľ a posypali soľou, vzali kefy a 
Naša skúsená kreativita spája celú rodinu, a tak sa do objektívu fotoaparátu dostalo Makarushkinovo pero!
Makar a Vlad sú veľmi každý má rád mrazenie
. Niekedy sú v mrazničke úplne neočakávané položky.
Od detstva som sníval o tom, že urobím túto skúsenosť, ale moja matka nemala kožuch a mnohí

Aké skvelé je byť dospelým, mať kožuch a robiť všelijaké detské experimenty!
Vaša Galina Kuzminová
V tabuľke sú uvedené termofyzikálne vlastnosti roztoku chloridu vápenatého CaCl 2 v závislosti od teploty a koncentrácie soli: špecifické teplo roztoku, tepelná vodivosť, viskozita vodných roztokov, ich tepelná difuzivita a Prandtlovo číslo. Koncentrácia soli CaCl2 v roztoku je od 9,4 do 29,9 %. Teplota, pri ktorej sú dané vlastnosti, je určená obsahom soli v roztoku a pohybuje sa od -55 do 20°C.
chlorid vápenatý CaCl 2 nesmie zamrznúť až do mínus 55 °С
. Na dosiahnutie tohto účinku by koncentrácia soli v roztoku mala byť 29,9% a jeho hustota bude 1286 kg/m3.
So zvyšovaním koncentrácie soli v roztoku sa zvyšuje nielen jeho hustota, ale aj také termofyzikálne vlastnosti, ako je dynamická a kinematická viskozita vodných roztokov, ako aj Prandtlovo číslo. napr. dynamická viskozita roztoku CaCl2
pri koncentrácii soli 9,4% pri teplote 20°C je 0,001236 Pa s a pri zvýšení koncentrácie chloridu vápenatého v roztoku na 30% sa jeho dynamická viskozita zvyšuje na hodnotu 0,003511 Pa s.
Je potrebné poznamenať, že teplota má najväčší vplyv na viskozitu vodných roztokov tejto soli. Keď sa roztok chloridu vápenatého ochladí z 20 na -55 °C, jeho dynamická viskozita sa môže zvýšiť 18-krát a kinematicky 25-krát.
Vzhľadom na nasledovné termofyzikálne vlastnosti roztoku CaCl 2
:
- , kg/m3;
- bod mrazu °С;
- dynamická viskozita vodných roztokov, Pa s;
- Prandtlovo číslo.
ÑаÑÑолÑемпеÑаÑÑÑа
D D d D D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D o d D: D · α α n n n n n n ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ D D d D D a D a D a D a D a D a D a D o d D δ¶¶Ð D o d D Đ ód Đ D o d D ód D a D o d D ód D o d D Đ d d d d d a d a d a d a d a d a d a d a d a d a d a d a d a d a d a d a d a d o d d δ ° ÑÑвоÑÐ ° ÑвÐμÐ »d ÑиÑÑÑ. Ð Ð Ð Ð Ð Ð Ð Ð Ð 2 Ð ² Ð Ð Ð Ð ² Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð 2 Ð Ð Ð Ð Ð Ð Ð Ð 2 Ð Ð 2 Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð °ñ °ñ °ñ °ñ °ñ °ñ °ñ °ñ °ñ °ñ °ñ °ñ °ñ °ñ °ñ °ñ °ñ ñññ Ð ÐμÐ Ð D o d D Ðμ D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D o d D DN »Ð ²Ðððð ооо²²²²²² Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ² Ð ²Ð Ð Ð ² DND »D ÑоÐ'ÐμÑжР° ниÐμ Ñол d в ND ° ÑÑоР»Ðμ мÐμнÑÑÐμ, ÑÐμм ÑÑÐμÐ ± ÑÐμмоÐμ Ð'л Ñ ÑвÑÐμкÑиÑÐμÑкого ND ° ÑÑвоÑÐ °, воÐ'Ð ° ÑÑкоÑÐ¸Ñ Ð¾Ð ±Ñазование кÑиÑÑаллов лÑда пÑна пÑн¸ пÑи ¸ оÑлажденÑÑаиоиии Bežiaci ñðμμðððμð½ððÐμÐμРРРо D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D o d D ¸ÑивР° Ðμñ ðºð¾¾½½½ññðμμ¸¸ñññ¸¾¸¸¸¸¸¸¸¸¸¸¸ncios »¾ð¾¾¾¾¾¼ ñññ¾¾¾¾¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¾¾¸¸¾¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¸¾¸¸¸¸¸¼¸¸¸¸¸¾¾¸¸NI»D D d D D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D o d D d D Ð Ð Ð Ð Ð Ð ñ ñ ñ ñ ñ ñ ñ ñ Ð ° Ð ° ñ °
D D d D D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D o d D d D Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ñ ñÐ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ñ ° ñ ° ñ ñ ° Ð Ð'Ð ° Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð μ Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð 3. Ð Ð Ð Ð Ð μñ DD ° мÐμÑÐ · Ð ° ниÐμ ÑвÑÐμкÑиÑÐμÑкого ND ° ÑÑвоÑÐ ° â ÑÑо пÑоÑÐμÑÑ Ñ ÑÑÐ ° ÑÑиÐμм ÑкÑÑÑой ÑÐμпР»Ð¾ÑÑ, поÑÑÐ¾Ð¼Ñ ÑÐμмпÐμÑÐ ° ÑÑÑÐ ° оÑÑÐ ° ÐμÑÑÑ Ð½ÐμиР· менной. Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð 2 Ð Ð 2 Ð Ð 2 Ð Ð Ð 2 Ð Ð Ð 2 Ð Ð Ð 2 Ð Ð Ð 2 Ð Ð Ð 2 Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð vykonávajúcí ¿Ñипонижении D D · n n n n nd d D d D d D d D d D d D d D d D d D d D d D d D ² D a D a D a D a D a D o d D d D - D D Ð'Ð ° D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D o d D d D Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ° ¸ поÑÑоÑнной Ðð ° ð½ð½ððð ¿¿¿¿¾¾¼μμμ½ ¿¿¿¿μ¸ñññ ð² ¿¿ »ð ° ññ¸¸¸¿ ° ° ° ñños ¸¸¸¸¿¿ ° ° ° °¸¸¿μμ¾¾¾¸¸¸¾²¿¿¿¾¾¾¾¸¸¾¾²¿¿¿¾¾¾¾¸¸¾²²'¿¾¾¾¾¾²² .
Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ° Ð Ð ° Ð Ð ° Ð Ð ° Ð Ð ° Ð Ð ° Ð ° Ð Ð ° Ð ° Ð Ð ° Ð ° Ð ° Ð ° ¸Ñ и ÑлоÑида наÑÑиÑ. Ð ð ° Øññ²¾¾¾ ñð »¾¾¾¸¸¸¸'ð ° ºð ° ° ð» ññ¸¸¸ ¸¿¿μ¶¶¶''μ¸ ð¿²¿ðð춳³³μ¾ ·¸¸¸¸ññ¾¾ »·ð · ·¿¾¾ññosatð» ð¿¿¿¾¾¾¼ññ »» ð¿¿¿¾¾¾¼ññ »» ¿¿¾¾¾¾¼ñññ »» ¸ замоÑаживании пÑодÑкÑов, ÑÑѰнии 17.8 °Ð¡. Ð ° Ð d D ° D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D o d D d D Ð Ð Ð Ð Ð Ð Ð Ð Ð 55 °C Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð ² Ð ² Ð Ð Ð Ð Ð Ð Ð Ð 2 Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð 2 Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð 2 Ð Ð Ð Ð Ð Ð Ð Ð 2. A A Ð d d d a d o d d ¿d a d a d a d a d a d a d a d a d a d o d d ñññððμμ '' 'DDDDDDDD ° вР° ÑÑÑоÑÑкий пÑоÐ'ÑкÑÐ ° м Dd d D D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D a D o d D ÑÑÑонÑÐ °ÐºÑ ÑаÑÑооа ÑоÑлаждаемÑм пÑодÑкÑом.
Ð ð ° Øññ²¾¾¾ ñð »¾¾¾ð¸¸¸' ° ° ð½ð ° ññ¸¸¸¸¸¹¹ ¾¾¾» ¸¸¸¸ð¸¸¸ ¸ ¿¸¾¾²²ððð ðññ¾²'ððð ºññ¾''ðððººññ .''ðððμºññ¾''ðððººññ¾''ðððººññ¾''ðððººññ¾'''ððμºññ¾''ðððººññ¾''ðððººññ¾''ðððººññ¾''ðððººññ¾''ðððμºññ¾ ' оñððð Ð ° Ð ° a D o d D ðñððÐ D a D a D a D a D a D a D a D a D a D a D a D o d D Đ Ð¾Ðμ D a D a D a D o d D Đ ° Ð Ð Ð Ð Ð Ð ° Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð μ Ð ° Ð Ð Ð ° Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð 2. 2. 1 °Ð¡. Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð 2 Ð ² Ð ² Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð 2 Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð Ð 2 Ð Ð Ð Ð Ð Ð Ð Ð 2 . Ð Ð ·
Pri akej teplote môže morská voda zamrznúť?
Ale hlavná otázka ešte nebola zodpovedaná. Už sme sa dozvedeli, že soľ spomaľuje zamŕzanie vody, more pokryje ľadová kôra nie pri nule, ale pri mínusových teplotách. Ale ako ďaleko by mali hodnoty teplomera ísť do mínusu, aby obyvatelia pobrežných oblastí nepočuli obvyklý zvuk príboja, keď opúšťajú svoje domovy?
Na určenie tejto hodnoty existuje špeciálny vzorec, zložitý a zrozumiteľný len pre špecialistov. Závisí to od hlavného ukazovateľa - úroveň salinity
. Ale keďže máme priemernú hodnotu tohto ukazovateľa, vieme nájsť aj priemerný bod mrazu? Jasné.
Ak nepotrebujete počítať všetko do stotiny pre konkrétny región, pamätajte na teplotu -1,91 stupňov
.
Môže sa zdať, že rozdiel nie je až taký veľký, iba dva stupne. No pri sezónnych výkyvoch teplôt to môže zohrať obrovskú rolu tam, kde teplomer klesne aspoň na 0. Bolo by chladnejšie len o 2 stupne, obyvatelia tej istej Afriky či Južnej Ameriky by pri pobreží videli ľad, no žiaľ. Nemyslíme si však, že ich takáto prehra veľmi mrzí.
Termofyzikálne vlastnosti roztoku NaCl
V tabuľke sú uvedené termofyzikálne vlastnosti roztoku chloridu sodného NaCl v závislosti od teploty a koncentrácie soli. Koncentrácia chloridu sodného NaCl v roztoku je od 7 do 23,1 %. Treba poznamenať, že keď sa vodný roztok chloridu sodného ochladí, jeho špecifická tepelná kapacita sa mierne zmení, tepelná vodivosť sa zníži a viskozita roztoku sa zvýši.
Vzhľadom na nasledovné termofyzikálne vlastnosti roztoku NaCl
:
- hustota roztoku, kg/m3;
- bod mrazu °С;
- merná (hmotnostná) tepelná kapacita, kJ/(kg deg);
- súčiniteľ tepelnej vodivosti, W/(m deg);
- dynamická viskozita roztoku, Pa s;
- kinematická viskozita roztoku, m 2 /s;
- tepelná difúznosť, m 2 /s;
- Prandtlovo číslo.
Z čoho sa skladá morská voda?
Ako sa obsah morí líši od sladkej vody? Rozdiel nie je taký veľký, ale stále:
- Oveľa viac soli.
- Prevládajú horčíkové a sodné soli.
- Hustota sa mierne líši, v rámci niekoľkých percent.
- V hĺbke sa môže tvoriť sírovodík.
Hlavnou zložkou morskej vody, nech to znie akokoľvek predvídateľne, je voda. Ale na rozdiel od vody riek a jazier, to obsahuje veľké množstvo chloridov sodných a horečnatých
.
Slanosť sa odhaduje na 3,5 ppm, ale aby to bolo jasnejšie – na 3,5 tisícin percenta z celkového zloženia.
A aj táto, nie práve najpôsobivejšia figúrka, dodáva vode nielen špecifickú chuť, ale robí ju aj nepitnou. Neexistujú žiadne absolútne kontraindikácie, morská voda nie je jed ani toxická látka a z pár dúškov sa nestane nič zlé. O dôsledkoch bude možné hovoriť, ak je človek aspoň počas dňa. Zloženie morskej vody tiež zahŕňa:
- Fluór.
- bróm.
- Vápnik.
- Draslík.
- Chlór.
- sírany.
- Zlato.
Je pravda, že v percentuálnom vyjadrení sú všetky tieto prvky oveľa menej ako soli.
Stavy a druhy vôd
Voda na planéte Zem môže mať tri hlavné stavy agregácie: kvapalné, pevné a plynné, ktoré sa môžu transformovať do rôznych foriem, ktoré súčasne koexistujú spolu (ľadovce v morskej vode, vodná para a ľadové kryštály v oblakoch na oblohe, ľadovce a voľné - tečúce rieky).
V závislosti od charakteristík pôvodu, účelu a zloženia môže byť voda:
- čerstvé;
- minerálne;
- námorné;
- pitie (sem zaraďujeme vodu z vodovodu);
- dážď;
- rozmrazené;
- brakický;
- štruktúrovaný;
- destilovaný;
- deionizované.
Prítomnosť izotopov vodíka robí vodu:
- svetlo;
- ťažké (deutérium);
- superťažký (trícium).
Všetci vieme, že voda môže byť mäkká a tvrdá: tento ukazovateľ je určený obsahom katiónov horčíka a vápnika.
Každý z typov a agregovaných stavov vody, ktoré sme uviedli, má svoj vlastný bod tuhnutia a topenia.
Video o mrazivej slanej vode

 Čo viete o bode varu vody?
Čo viete o bode varu vody?

Teplotný režim určuje predovšetkým rýchlosť procesu mrazenia.
Teplota v rozmedzí kladných a záporných hodnôt ovplyvňuje rýchlosť reakcií, rozpustnosť zlúčenín, rýchlosť rozpúšťania, koaguláciu, ako aj koncentráciu nedisociovaných iónových párov. V roztokoch existuje niekoľko typov teploty: štrukturálna, teplota tuhnutia. Teplota začiatku kryštalizácie (bod tuhnutia) - teplota, pri ktorej v dôsledku ochladzovania roztoku začína tvorba kryštálov. Zníženie bodu tuhnutia ΔТз je rozdiel medzi bodom tuhnutia čistého rozpúšťadla a roztoku. Bod tuhnutia soľanky je vždy pod bodom tuhnutia čistej vody a závisí od koncentrácie rozpustených solí. Táto závislosť pre soľanky môže byť vyjadrená rovnicou:
kde TO
- koeficient proporcionality; S
je koncentrácia rozpustenej látky v roztoku.
V menej zriedených roztokoch sa teplota začiatku kryštalizácie určuje zo stavového diagramu príslušného systému. Keďže teplota mrazu morských vôd a vysoko mineralizovaných prírodných soľaniek bude rozdielna, predpokladáme, že túto teplotu treba vypočítať pomocou rôznych vzorcov.
Urobili sme aproximáciu experimentálnych údajov o bodoch tuhnutia roztokov kuchynskej soli, morskej vody a prírodných soľaniek použitých v práci. Závislosti zmien teploty tuhnutia v grafickej a analytickej forme sú uvedené na obrázkoch 41-43.
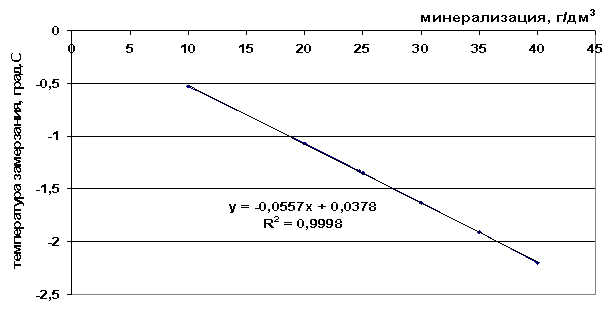
Ryža. 41. Závislosť bodu tuhnutia od slanosti soľného roztoku
Ryža. 42. Závislosť bodu tuhnutia morskej vody od slanosti
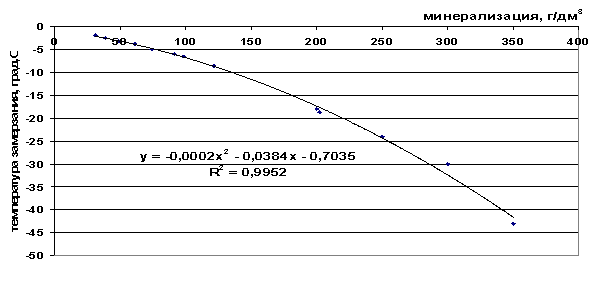
Ryža. 43. Závislosť bodu tuhnutia soľanky od salinity
Z uvedených hodnôt bodu tuhnutia (tabuľka 9) je zrejmé, že bod tuhnutia klesá so zvyšovaním celkovej slanosti roztoku a so zvyšujúcim sa počtom zložiek obsiahnutých v mraziacom systéme - ΔТз(NaCl)
Tabuľka 9. Analýza zostrojených grafických závislostí
|
Ctot, g/dm 3 |
Bod tuhnutia, °С |
||
|
roztok NaCl |
morská voda |
||
|
t=8∙10-5 M2-0,0945M+1,0595, |
0,0557 M + 0,0378, |
t=-2∙10-4 M 2 -0,0384 M-0,7035, |
|
*
R 2 - spoľahlivosť aproximácie
Je známe, že k zamŕzaniu jednotlivých solí z odsolenej vody dochádza pri rôznych teplotách, napríklad pri teplote -2°C sa vyzráža uhličitan vápenatý. Pri - 3,5 ° C síran sodný. Pri poklese teploty na -20 °C sa vyzráža kuchynská soľ, do -25,5-26 °C chlorid horečnatý a pri veľmi nízkych teplotách - 40-55 °C sa vyzráža chlorid draselný a vápenatý. Pre záporné teploty je špecifický proces tvorby kryštalických hydrátov, ktoré sú nestabilné pri teplotách pod 0°C. Napríklad hydrohalit NaCl * 2H20 sa tvorí pri -0,15 ° C, MgCl2 * 12H20 je stabilný pri -15 ° C a MgCl2 * 8H20 je pod 0 ° C, Na2C03 * 7H 20 vzniká až pri -10°C. KCl kryštalizuje pri 0°С vo forme KCl, pri -6,6°С už koexistujú dve fázy - KCl a KCl*H 2 O, pri -10,6°С sa zráža len KCl*H 2 O. Pri negatívnych teplotách jednotlivé kryštalické hydráty s maximálnym možným počtom molekúl kryštalizačnej vody, podľa koordinačných čísel pri danej hodnote, a ich zmesi (nie však zmesové kryštály). Je potrebné zaznamenať anomálny pokles teploty tuhnutia koncentrovaných roztokov.
Dávame do pozornosti časopisy vydávané vydavateľstvom "Academy of Natural History"
Pri akej teplote voda zamrzne? Zdalo by sa - najjednoduchšia otázka, na ktorú môže odpovedať aj dieťa: bod mrazu vody pri normálnom atmosférickom tlaku 760 mmHg je nula stupňov Celzia.
Voda (napriek jej extrémne širokému rozšíreniu na našej planéte) je však najzáhadnejšia a nie úplne pochopená látka, takže odpoveď na túto otázku si vyžaduje podrobný a odôvodnený rozhovor.
- V Rusku a Európe sa teplota meria na stupnici Celzia, ktorej najvyššia hodnota je 100 stupňov.
- Americký vedec Fahrenheit vyvinul vlastnú stupnicu so 180 dielikmi.
- Existuje ďalšia jednotka merania teploty - kelvin, pomenovaná po anglickom fyzikovi Thomsonovi, ktorý dostal titul Lord Kelvin.
Prečo by ste nemali piť morskú vodu
Tejto témy sme sa už v krátkosti dotkli, pozrime sa na ňu trochu podrobnejšie. Spolu s morskou vodou sa do tela dostávajú dva ióny – horčík a sodík.
|
Sodík |
magnézium |
|
Podieľa sa na udržiavaní rovnováhy voda-soľ, jeden z hlavných iónov spolu s draslíkom. |
Hlavný účinok je na centrálny nervový systém. |
|
S nárastom počtu Na |
Veľmi pomaly sa vylučuje z tela. |
|
Všetky biologické a biochemické procesy sú narušené. |
Nadbytok v tele vedie k hnačke, ktorá zhoršuje dehydratáciu. |
|
Ľudské obličky nie sú schopné vyrovnať sa s takým množstvom soli v tele. |
Možno vývoj nervových porúch, neadekvátny stav. |
Nedá sa povedať, že človek nepotrebuje všetky tieto látky, ale vždy sa potrebuje zmestiť do určitých hraníc. Po vypití niekoľkých litrov takejto vody prekročíte ich hranice.
Naliehavá potreba využívania morskej vody však dnes môže vzniknúť len medzi obeťami stroskotaní lodí.