Utnyttjande

I vanadinflödesbatterier är båda referenselektroderna dessutom anslutna till lagringstankar och pumpar så att mycket stora volymer elektrolyt kan cirkuleras genom cellen. Cirkulationen av flytande elektrolyt är något svår och begränsar användningen av vanadinflödesbatterier i industrier som kräver rörlighet, vilket gör dem effektiva i stora stationära byggnader.
När ett vanadinbatteri laddas förvandlas VO2+-jonerna i den positivt laddade referenselektroden till VO2+-joner när elektronerna lösgörs från den positiva batteripolen. På liknande sätt, i den negativa referenselektroden, omvandlar elektroner V3+-joner till V2+. Under urladdning är denna process omvänd, vilket resulterar i en öppen kretsspänning på 1,41 V vid 25°C.
Andra användbara egenskaper hos vanadinflödesbatterier inkluderar ett mycket snabbt svar på belastningsförändringar och en extremt hög överbelastningskapacitet. Forskning vid University of New South Wales har visat att de kan uppnå svarstider på mindre än en halv millisekund vid 100 % belastningsförändringar och motstå 400 % överbelastning i över 10 sekunder. Svarstiden är i de flesta fall begränsad av den elektriska utrustningen. Vanadinbatterier baserade på svavelsyra fungerar endast vid temperaturer på 10-40C. Om temperaturen är under detta intervall kristalliseras svavelsyrajoner. Effektiviteten i fram- och återgående rörelse i dagligt bruk förblir på nivån 65-75%.
Funktioner för laddning och urladdning
Laddningsalgoritmer beror direkt på hur batteriet är uppbyggt och vilken typ det tillhör. Till exempel kan vissa batterier på ett säkert sätt fylla på sin kapacitet från konstantspänningskällor. Andra fungerar bara med en justerbar strömkälla som kan ändra parametrar beroende på laddningsnivån.
En felaktigt organiserad laddningsprocess kan skada batteriet. I extrema fall kan batteriet antändas eller explodera. Det finns smarta batterier utrustade med spänningsövervakningsenheter. De viktigaste parametrarna som bör beaktas vid drift av reversibla galvaniska batterier är:
- Livslängd. Även med korrekt hantering är antalet laddningscykler för ett batteri begränsat. Olika batterisystem slits inte alltid ut av samma anledningar. Men i allmänhet begränsas batteriets livslängd främst av antalet fulla laddnings-urladdningscykler, och för det andra av designlivslängden utan hänvisning till användningsintensiteten.
- Laddningstid. Batteriets grundläggande design innebär inte laddning med en godtyckligt hög hastighet: den galvaniska cellens inre motstånd kommer att leda till omvandling av överskottsladdningsström till värme, vilket kan skada enheten oåterkalleligt. Ur en fysisk synvinkel begränsas laddningstiden av den maximala diffusionshastigheten för det aktiva materialet genom elektrolyten.Förenklat kan vi anta att återställandet av full kapacitet på en timme är en bra indikator.
- Utsläppsdjup. Anges som en procentandel av märkeffekten. Beskriver användbar kapacitet. För olika typer av batterier kan den rekommenderade urladdningsnivån variera. På grund av förändringar i drift eller åldrande förlorar den maximala djupindikatorn sitt ursprungliga värde.
diffusionsprocess.
På grund av diffusionsprocessen, inriktningen av elektrolytdensiteten i hålrummet i batterihöljet och i porerna i den aktiva massan av plattorna, kan elektrodpolariseringen bibehållas i batteriet när den externa kretsen är avstängd.
Diffusionshastigheten beror direkt på elektrolytens temperatur, ju högre temperatur desto snabbare går processen och kan variera mycket i tiden, från två timmar till ett dygn. Närvaron av två komponenter av elektrodpotentialen under transienta förhållanden ledde till uppdelningen i jämvikts- och icke-jämvikts-EMK för batteriet. Batteriets jämvikts-EMK påverkas av innehållet och koncentrationen av joner av aktiva ämnen i elektrolyten, såväl som de kemiska och fysikaliska egenskaperna hos aktiva ämnen. Huvudrollen i EMF:s storlek spelas av elektrolytens densitet och temperaturen påverkar den praktiskt taget inte. EMFs beroende av densitet kan uttryckas med formeln:
Batteriets emf är inte lika med batterispänningen, vilket beror på närvaron eller frånvaron av en belastning på dess terminaler.
admin25/07/2011
En kommentar
Namn *
Webbplats
Den här sidan använder Akismet för att bekämpa spam. Ta reda på hur din kommentarsdata behandlas.
« Mekanisk varvräknare
Batterivolt "
Taggar
VAZ, VAZ funktionsfel Sensorer Tändning Injektorenheter Startschema Elbilar Strömförsörjning vaz 2110 gasell gasell företagsregistratorer bilreparationer
Senaste inlägg
- Sensorer i bilen: typer och syfte
- Världens största elbil EDumper,
- Laserljus.
- Fördelar och nackdelar med halogenlampor
- Enheten och principen för drift av parkeringssensorer
Arkiv
Arkiv Välja september 2019 augusti 2017 juli 2017 juni 2017 maj 2017 april 2017 mars 2017 december 2016 november 2016 oktober 2016 september 2016 augusti 2016 juli 2016 februari 2016 november 2015 oktober 2015 augusti 2015 juli 2015 juni 2015 maj 2015 januari 2015 december 2014 november 2014 oktober 2014 september 2014 augusti 2014 juli 2014 juni 2014 maj 2014 april 2014 februari 2014 januari 2014 december 2013 november 2013 oktober 2013 augusti 2013 augusti 2013 12 augusti 2013 12 2013 12 2013 12 2013 12 2013 12 2013 12, 2013 12, 12, 12, 12, 12, 12, 2013, 12, 12, 12, 12, 2013, 12, 2013 2012, 2012, 2011, 2012, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, September 2012, 2011, 2011, 2011, 2011, 2011, 2011
Kategorier
- Ackumulatorbatteri
- Video
- Generator
- Sensorer
- Diagnostik
- Tändning
- Nyheter
- Utrustning
- Enheter
- Reparera
- Tändstift
- Förrätt
- Schema
- Enheter
- elbilar
- Strömförsörjning
Vi är i sociala nätverk
Auto Electrician@ Alla rättigheter förbehålls. När du kopierar webbplatsmaterial måste du tillhandahålla en länk till webbplatsen.
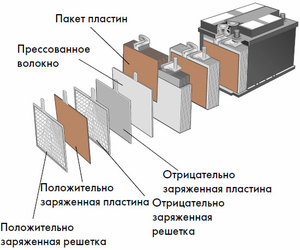
Enhet och funktionsprincip
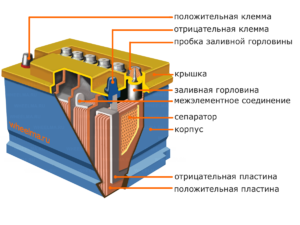
Varje sådan cell har en katod (positiv elektrod) och en anod (negativ). Dessa elektroder är åtskilda av en elektrolyt som säkerställer utbytet av joner mellan dem. Elektrodmaterial och elektrolytsammansättning är valda för att ge tillräcklig elektromotorisk kraft mellan batteripolerna.
Eftersom elektroderna innehåller en begränsad potential för kemisk energi, kommer batteriet att ta slut under drift. Den typ av galvaniska celler, som är anpassad för påfyllning efter en delvis eller fullständig urladdning, kallas batteri. En sammansättning av sådana sammankopplade celler är ett batteri.Batteridrift innebär en cyklisk förändring av två tillstånd:
- Laddning - batteriet fungerar som en mottagare av elektricitet, inuti cellerna realiseras den elektriska energin i kemiska förändringar.
- Urladdning - enheten fungerar som en källa för elektrisk ström genom att omvandla energin från kemiska reaktioner till elektrisk energi.
Användningsområden
Den ultrahöga kapacitetsegenskapen hos vanadin redoxbatterier gör dem väl lämpade för användning i industrier som kräver hög energilagring. Till exempel hjälpa till att balansera produktionsvolymen av sådana energikällor som vind eller sol, eller hjälpa generatorer att absorbera stora strömmar av energi när det behövs, eller balansera utbud och efterfrågan på energi för avlägsna områden.
De begränsade självurladdningsegenskaperna hos vanadinredoxbatterier gör dem användbara i industrier där batterier måste förvaras under långa tidsperioder med minimalt underhåll och beredskap. Detta ledde till att de användes i vissa typer av militärelektronik, till exempel i sensorerna i GATOR-gruvsystemet. Deras förmåga att cykla igenom och hålla sig på noll gör dem lämpliga för solenergiapplikationer och industrier där batterier måste börja dagen tomma och ladda om baserat på belastning och väder. Till exempel skadas litiumjonbatterier ofta när de får laddas ur under 20 % av sin volym, så de fungerar oftast i intervallet 20 till 100 %, vilket innebär att de bara kan använda 20 % av sin nominella kapacitet.
Deras extremt snabba svarstid gör dem också praktiskt taget oumbärliga för avbrottsfri strömförsörjning, där de kan användas i stället för blybatterier och till och med dieselgeneratorer. Den snabba svarstiden gör dem också lämpliga för frekvenskontroll. För närvarande är varken UPS eller frekvenshanteringsåtgärder effektiva på egen hand, men det är troligt att batteriet kommer att kunna hitta applikationer i dessa branscher när det kapitaliseras från olika finansieringskällor. Dessutom gör dessa möjligheter vanadin-redox-batterier till en effektiv lösning i ett stycke för små elnät som är beroende av tillförlitlig drift, frekvensstyrning och belastningsomkopplingsbehov (såsom hög penetration av förnybara energikällor, starkt fluktuerande belastningar eller önskan att optimera generatorns effektivitet genom att ändra svarstiden).
De största fungerande vanadin redoxbatterierna
Transformatorstation "Minami Hyakita":
- Lanseringsdatum: december 2015
- Energi: 60 MWh
- Effekt: 15 MW
- Arbetstid: 4 timmar
- Land: Japan
Stinky, Liaoningprovinsen
- Lanseringsdatum: N/A
- Energi: 10 MWh
- Effekt: 5 MW
- Arbetstid: 2 timmar
- Land: Kina
Tomamae vindkraftspark
- Lanseringsdatum: 2005
- Energi: 6 MWh
- Effekt: 4 MW
- Arbetstid: 1 timme 30 minuter
- Land: Japan
Zhangbei-projektet
- Lanseringsdatum 2016
- Energi: 8 MWh
- Effekt: 2 MW
- Arbetstid: 4 timmar.
- Land: Kina
SnoPUD MESA 2-projekt
- Lanseringsdatum: mars 2017
- Energi: 8 MWh
- Effekt: 2 MW
- Arbetstid: 4 timmar.
- Land: USA
Transformatorstation i Escondido
- Lanseringsdatum: 2017
- Energi: 8 MWh
- Effekt: 2 MW
- Arbetstid: 4 timmar.
- Land: USA
Transformatorstation i Pullman, Washington
- Lanseringsdatum: april 2015
- Energi: 4 MWh
- Effekt: 1 MW
- Arbetstid: 4 timmar
- Land: USA
Till 2018 förväntas utvecklingen av ett vanadin-redoxbatteri vara slutfört i Kina. Dess energi kommer att vara 800 MWh, effekt - 200 MW och drifttid - 4 timmar.
Villkor
- Sekventiella - element följer efter varandra.
- Elektromotorisk kraft (EMF) är den spänning som genereras av ett batteri eller magnetisk kraft i enlighet med Faradays lag.
- Parallell - Elektriska komponenter är anordnade så att ström flyter längs två eller flera banor.
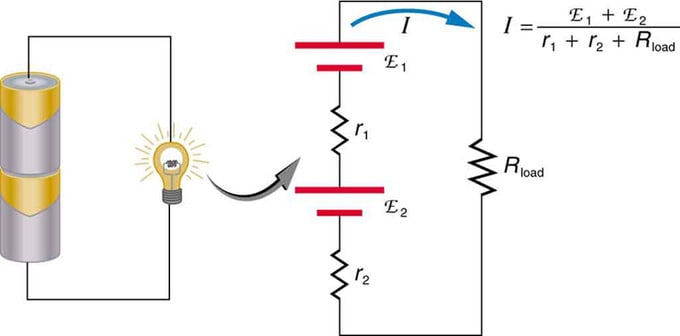
Om du använder flera spänningskällor kan de kopplas i serie eller parallellt. Med serieversionen är de inställda i samma riktning, det interna motståndet plusseras och den elektromotoriska kraften adderas algebraiskt. Liknande typer är vanliga i ficklampor, leksaker och en mängd andra apparater. Celler placeras i serie för att öka den totala emk.
Seriekoppling av två spänningskällor i samma riktning. Diagrammet visar en lykta med två celler och en lampa
Batteri - multipelanslutning av voltelement. Men det finns en nackdel med seriekoppling, eftersom interna resistanser läggs till. Ibland skapar detta problem. Låt oss säga att du har två 6V-batterier som du sätter i istället för de vanliga 12V. Som ett resultat har du lagt till inte bara EMF, utan också det interna motståndet från varje batteri.
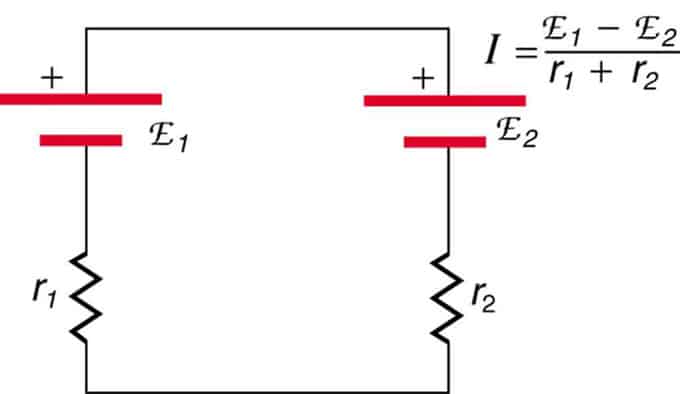
Om cellerna är placerade i opposition (den ena är placerad bakom den andra), kommer den totala EMF att minska.
Dessa är två spänningskällor kopplade i serie med motsatta emissioner. Strömmen flyter i riktning mot större EMF och begränsas av summeringen av interna resistanser. Ett exempel är en laddare. Den måste ha mer emk än batteriet
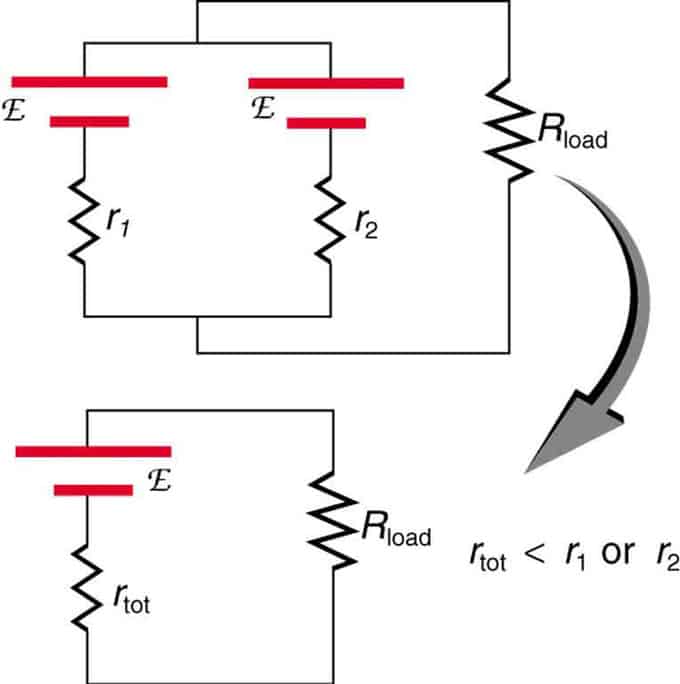
Om två källor med samma elektromotoriska kraft är placerade parallellt och anslutna till belastningsmotståndet, förblir den totala EMF densamma som de individuella. Det totala inre motståndet kommer dock att minska. Det visar sig att den parallella versionen kan generera mer ström.
Två spänningskällor med en enda EMF kombineras i en parallell anslutning. De bildar en EMF, men har mindre totalt motstånd än var för sig. Liknande kombinationer används om du behöver uppnå mer ström.
| Översikt |
|
| Parallell- och seriekoppling av motstånd |
|
| Kirchhoff styr |
|
| Voltmetrar och amperemetrar |
|
| RC-kretsar |
|
Historisk översikt
Utvecklingen av den första galvaniska cellen krediteras den italienske fysikern Alessandro Volta. Han genomförde en rad experiment med elektrokemiska fenomen under 1790-talet och runt 1800 skapade han det första batteriet, som hans samtida kallade "voltaiska kolonnen". Anordningen bestod av omväxlande zink- och silverskivor åtskilda av lager av papper eller tyg som blötlades i en natriumhydroxidlösning.
Dessa experiment blev grunden för Michael Faradays arbete med elektrokemins kvantitativa lagar. Han beskrev principen för batteriets drift och, baserat på forskarens arbete, skapades de första kommersiella elektriska cellerna. Den fortsatta utvecklingen såg ut så här:
- 1836 presenterade den brittiske kemisten John Daniel en förbättrad modell av cellen, bestående av koppar- och zinkelektroder nedsänkta i saltsyra. Daniels element kunde ge konstant spänning ojämförligt mer effektivt än Volts enheter.
- 1839 Ytterligare framsteg gjordes av fysikern Grove med sin tvåvätskecell, bestående av zink nedsänkt i utspädd svavelsyra i en porös behållare. Den senare separerade svavelsyra från ett kärl innehållande salpetersyra med en platinakatod placerad i den. Salpetersyran tjänade som ett oxidationsmedel för att förhindra spänningsförlust på grund av väteackumulering vid katoden.Den tyske kemisten Robert Bunsen ersatte platina med billigt kol i Grove-cellen och främjade därigenom den utbredda acceptansen av denna typ av batteri.
- 1859 uppfann Gaston Plante bly-syracellen, föregångaren till det moderna bilbatteriet. Plantes apparat kunde producera en ovanligt stor ström, men användes endast för experiment i laboratorier i nästan två decennier.
- 1895-1905 år. Uppfinningen av nickel-kadmium och nickel-järn alkaliska grundämnen. Detta gjorde det möjligt att skapa system med ett betydande antal laddnings-urladdningscykler.
- Sedan 1930-talet började utvecklingen av silver-zink och kvicksilver-zink alkaliska batterier, som gav hög energitäthet per vikt- och volymenhet.
- Sedan mitten av 1900-talet har framstegen inom tillverkningsteknik och tillkomsten av nya material lett till ännu mer kraftfulla och kompakta batterier. Mest anmärkningsvärt var introduktionen av nickel-metallhydrid- och litiumbatterier på marknaden.
Laddar batterier
Huvudartikel: Laddare
När den kemiska energin förbrukas sjunker spänningen och strömmen, och batteriet slutar fungera. Du kan ladda batteriet (batteri av batterier) från vilken likströmskälla som helst med högre spänning samtidigt som strömmen begränsas. Den vanligaste är laddningsströmmen (i ampere), proportionell mot 1/10 av batteriets villkorade nominella kapacitet (i amperetimmar).
Baserat på den tekniska beskrivningen som distribueras av tillverkare av allmänt använda elektriska batterier (NiMH, NiCd), kan det dock antas att detta laddningsläge, vanligen kallat standard-, beräknas utifrån längden på en åtta timmars arbetsdag, då batteriet, urladdat i slutet av arbetsdagen, ansluts till nätladdaren innan en ny arbetsdag börjar. Användningen av ett sådant laddningsläge för dessa typer av batterier med systematisk användning gör att du kan upprätthålla en kvalitets-kostnadsbalans i driften av produkten. På tillverkarens förslag kan detta läge endast användas för nickel-kadmium- och nickel-metallhydridbatterier.
Många typer av batterier har olika begränsningar som måste beaktas vid laddning och efterföljande användning, till exempel är NiMH-batterier känsliga för överladdning, litiumbatterier är känsliga för överladdning, spänning och temperatur. NiCd- och NiMH-batterier har en så kallad minneseffekt, som består i en minskning av kapaciteten när laddningen utförs när batteriet inte är helt urladdat. Dessa typer av batterier har också en märkbar självurladdning, det vill säga de tappar gradvis laddningen utan att vara anslutna till lasten. För att bekämpa denna effekt kan droppuppladdning användas.
Batteriladdningsmetoder
Flera metoder används för att ladda batterier; Generellt sett beror laddningsmetoden på batteritypen.
- Långsam likströmsladdning
Ladda med en likström proportionell mot 0,1-0,2 av den villkorade nominella kapaciteten Q under cirka 15-7 timmar, respektive.
Den längsta och säkraste laddningsmetoden. Lämplig för de flesta typer av batterier.
- snabbladdning
Ladda med likström proportionell mot 1/3 Q i ca 3-5 timmar.
- Accelererad eller "delta-V" laddning
En laddning med en initial laddningsström proportionell mot batteriets nominella nominella kapacitet, vid vilken batterispänningen konstant mäts och laddningen slutar efter att batteriet är fulladdat. Laddningstiden är cirka en och en halv timme. Batteriet kan överhettas och till och med förstöra det.
- omvänd laddning
Den utförs genom att varva långa laddningspulser med korta urladdningspulser. Den omvända metoden är mest användbar för att ladda NiCd- och NiMH-batterier, som kännetecknas av den sk.n. "minneseffekt".