การเอารัดเอาเปรียบ

ในแบตเตอรี่วาเนเดียมโฟลว์ อิเล็กโทรดอ้างอิงทั้งสองจะเชื่อมต่อเพิ่มเติมกับถังเก็บและปั๊ม เพื่อให้สามารถหมุนเวียนอิเล็กโทรไลต์ปริมาณมากผ่านเซลล์ได้ การหมุนเวียนของอิเล็กโทรไลต์เหลวค่อนข้างยากและจำกัดการใช้แบตเตอรี่วาเนเดียมโฟลว์ในอุตสาหกรรมที่ต้องการความคล่องตัว ทำให้มีประสิทธิภาพในอาคารที่อยู่กับที่ขนาดใหญ่
เมื่อชาร์จแบตเตอรี่วานาเดียม ไอออน VO2+ ในอิเล็กโทรดอ้างอิงที่มีประจุบวกจะเปลี่ยนเป็นไอออน VO2+ เมื่ออิเล็กตรอนถูกถอดออกจากขั้วแบตเตอรี่บวก ในทำนองเดียวกัน ในอิเล็กโทรดอ้างอิงเชิงลบ อิเล็กตรอนแปลงไอออน V3+ เป็น V2+ ในระหว่างการคายประจุ กระบวนการนี้จะกลับกัน ทำให้เกิดแรงดันไฟฟ้าวงจรเปิดที่ 1.41 V ที่อุณหภูมิ 25°C
คุณสมบัติที่มีประโยชน์อื่นๆ ของแบตเตอรี่วาเนเดียมโฟลว์ ได้แก่ การตอบสนองอย่างรวดเร็วต่อการเปลี่ยนแปลงโหลดและความจุเกินพิกัดที่สูงมาก การวิจัยที่มหาวิทยาลัยนิวเซาธ์เวลส์ได้แสดงให้เห็นว่าพวกเขาสามารถบรรลุเวลาตอบสนองน้อยกว่าครึ่งมิลลิวินาทีที่การเปลี่ยนแปลงโหลด 100% และทนต่อการโอเวอร์โหลด 400% นานกว่า 10 วินาที เวลาตอบสนองโดยส่วนใหญ่จำกัดโดยอุปกรณ์ไฟฟ้า แบตเตอรี่วาเนเดียมที่ใช้กรดซัลฟิวริกทำงานที่อุณหภูมิ 10-40C เท่านั้น หากอุณหภูมิต่ำกว่าช่วงนี้ ไอออนของกรดซัลฟิวริกจะตกผลึก ประสิทธิภาพในการเคลื่อนที่แบบลูกสูบสำหรับใช้ในชีวิตประจำวันยังคงอยู่ที่ระดับ 65-75%
คุณสมบัติของการชาร์จและการคายประจุ
อัลกอริธึมการชาร์จขึ้นอยู่กับวิธีการจัดเรียงแบตเตอรี่และประเภทของแบตเตอรี่โดยตรง ตัวอย่างเช่น แบตเตอรี่บางชนิดสามารถเติมความจุได้อย่างปลอดภัยจากแหล่งจ่ายแรงดันไฟคงที่ ส่วนอื่น ๆ ใช้งานได้เฉพาะกับแหล่งจ่ายกระแสไฟที่มีการควบคุมซึ่งสามารถเปลี่ยนพารามิเตอร์ได้ขึ้นอยู่กับระดับของประจุ
กระบวนการชาร์จที่จัดไม่ถูกต้องอาจทำให้แบตเตอรี่เสียหายได้ ในกรณีร้ายแรง แบตเตอรี่อาจลุกไหม้หรือระเบิดได้ มีแบตเตอรี่อัจฉริยะที่ติดตั้งอุปกรณ์ตรวจสอบแรงดันไฟฟ้า พารามิเตอร์หลักที่ควรนำมาพิจารณาเมื่อใช้งานแบตเตอรี่กัลวานิกแบบย้อนกลับได้คือ:
- อายุขัย. แม้จะมีการจัดการที่เหมาะสม จำนวนรอบการชาร์จสำหรับแบตเตอรี่ก็มีจำกัด ระบบแบตเตอรี่แบบต่างๆ ไม่ได้เสื่อมสภาพด้วยเหตุผลเดียวกันเสมอไป แต่โดยทั่วไป อายุการใช้งานแบตเตอรี่จะถูกจำกัดโดยจำนวนรอบการชาร์จ-คายประจุจนเต็มเป็นหลัก และประการที่สองคืออายุการใช้งานของการออกแบบโดยไม่อ้างอิงถึงความเข้มข้นของการใช้งาน
- เวลาในการชาร์จ การออกแบบพื้นฐานของแบตเตอรี่ไม่ได้หมายความถึงการชาร์จด้วยความเร็วสูงตามอำเภอใจ: ความต้านทานภายในของเซลล์กัลวานิกจะนำไปสู่การแปลงกระแสไฟชาร์จส่วนเกินเป็นความร้อน ซึ่งอาจทำให้อุปกรณ์เสียหายอย่างไม่สามารถย้อนกลับได้ จากมุมมองทางกายภาพ เวลาในการชาร์จจะถูกจำกัดด้วยอัตราการแพร่สูงสุดของวัสดุออกฤทธิ์ผ่านอิเล็กโทรไลต์อย่างง่าย เราสามารถสรุปได้ว่าการฟื้นฟูสมรรถภาพเต็มที่ในหนึ่งชั่วโมงเป็นตัวบ่งชี้ที่ดี
- ความลึกของการคายประจุ ระบุเป็นเปอร์เซ็นต์ของกำลังไฟฟ้าที่กำหนด อธิบายความจุที่ใช้งานได้ สำหรับแบตเตอรี่ประเภทต่างๆ ระดับการคายประจุในการใช้งานที่แนะนำอาจแตกต่างกันไป เนื่องจากมีการเปลี่ยนแปลงการทำงานหรืออายุ ตัวบ่งชี้ความลึกสูงสุดจะสูญเสียค่าเดิมไป
กระบวนการแพร่
เนื่องจากกระบวนการของการแพร่กระจาย การจัดตำแหน่งของความหนาแน่นของอิเล็กโทรไลต์ในช่องของกล่องแบตเตอรี่และในรูขุมขนของมวลที่ใช้งานของเพลต ทำให้สามารถคงโพลาไรซ์ของอิเล็กโทรดไว้ในแบตเตอรี่เมื่อปิดวงจรภายนอก
อัตราการแพร่โดยตรงขึ้นอยู่กับอุณหภูมิของอิเล็กโทรไลต์ ยิ่งอุณหภูมิสูงเท่าใด กระบวนการก็จะยิ่งเร็วขึ้นเท่านั้น และสามารถเปลี่ยนแปลงได้อย่างมากในเวลาตั้งแต่สองชั่วโมงถึงหนึ่งวัน การมีอยู่ของส่วนประกอบสองส่วนของศักย์ไฟฟ้าของอิเล็กโทรดในสภาวะชั่วครู่นำไปสู่การแบ่งออกเป็น EMF สมดุลและ EMF ที่ไม่สมดุลของแบตเตอรี่ สมดุล EMF ของแบตเตอรี่ได้รับผลกระทบจากเนื้อหาและความเข้มข้นของไอออนของสารออกฤทธิ์ในอิเล็กโทรไลต์ ตลอดจนคุณสมบัติทางเคมีและทางกายภาพของสารออกฤทธิ์ บทบาทหลักในขนาดของ EMF เล่นโดยความหนาแน่นของอิเล็กโทรไลต์และอุณหภูมิแทบไม่มีผลกับมัน การพึ่งพา EMF ต่อความหนาแน่นสามารถแสดงได้โดยสูตร:
แรงเคลื่อนไฟฟ้าของแบตเตอรี่ไม่เท่ากับแรงดันไฟของแบตเตอรี่ ซึ่งขึ้นอยู่กับการมีหรือไม่มีโหลดบนขั้วของมัน
admin25/07/2011
ความคิดเห็น
ชื่อ *
งาน
ไซต์นี้ใช้ Akismet เพื่อต่อสู้กับสแปม ค้นหาว่าข้อมูลความคิดเห็นของคุณได้รับการประมวลผลอย่างไร
« เครื่องวัดความเร็วรอบเครื่องกล
แรงดันแบตเตอรี่ »
แท็ก
VAZ, VAZ ทำงานผิดปกติ เซ็นเซอร์ อุปกรณ์จุดระเบิด หัวฉีด แผนผังเริ่มต้น รถยนต์ไฟฟ้า แหล่งจ่ายไฟ vaz 2110 ละมั่งละมั่ง บริษัทจดทะเบียนธุรกิจ ซ่อมรถยนต์
รายการล่าสุด
- เซ็นเซอร์ในรถ: ประเภทและวัตถุประสงค์
- EDumper รถยนต์ไฟฟ้าที่ใหญ่ที่สุดในโลก
- ไฟเลเซอร์.
- ข้อดีและข้อเสียของหลอดฮาโลเจน
- อุปกรณ์และหลักการทำงานของเซ็นเซอร์จอดรถ
หอจดหมายเหตุ
จดหมายเหตุ Select SEPTEMBER 2019 สิงหาคม 2017 กรกฎาคม 2017 มิถุนายน 2017 พฤษภาคม 2017 เมษายน 2017 มีนาคม 2017 ธันวาคม 2016 พฤศจิกายน 2016 ตุลาคม 2016 กันยายน 2016 สิงหาคม 2016 กรกฎาคม 2016 มิถุนายน 2016 พฤษภาคม 2016 เมษายน 2016 มีนาคม 2016 กุมภาพันธ์ 2016 พฤศจิกายน 2015 ตุลาคม 2015 สิงหาคม 2015 กรกฎาคม 2015 มิถุนายน 2015 พฤษภาคม 2015 มกราคม 2558 ธันวาคม 2557 พฤศจิกายน 2557 ตุลาคม 2557 กันยายน 2557 สิงหาคม 2557 กรกฎาคม 2557 มิถุนายน 2557 พฤษภาคม 2557 เมษายน 2557 กุมภาพันธ์ 2557 มกราคม 2557 ธันวาคม 2556 พฤศจิกายน 2556 ตุลาคม 2556 สิงหาคม 2556 มิถุนายน 2556 พฤษภาคม 2556 มีนาคม 2555, 2556, 2555, 2555, 2555, 2555 2555, 2555, 2554, 2555, 2554, 2555, 2554, 2554, 2554, 2554, 2554, 2554, 2554, 2554, 2554, 2554, 2554, 2554, 2554, 2554, 2554, 2554, 2554, 2554, 2554, กันยายน 2555 2554 2554 2554 2554 2554 2554 2554
หมวดหมู่
- แบตเตอรี่สะสม
- วีดีโอ
- เครื่องกำเนิดไฟฟ้า
- เซนเซอร์
- การวินิจฉัย
- จุดระเบิด
- ข่าว
- อุปกรณ์
- อุปกรณ์
- ซ่อมแซม
- หัวเทียน
- สตาร์ทเตอร์
- โครงการ
- อุปกรณ์
- รถยนต์ไฟฟ้า
- แหล่งจ่ายไฟ
เราอยู่ในโซเชียลเน็ตเวิร์ก
ช่างไฟฟ้าอัตโนมัติ@ สงวนลิขสิทธิ์. เมื่อคัดลอกเอกสารของไซต์ คุณต้องระบุลิงก์ไปยังไซต์
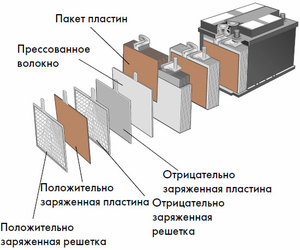
อุปกรณ์และหลักการทำงาน
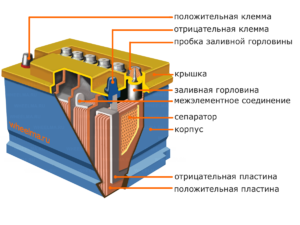
แต่ละเซลล์ดังกล่าวมีแคโทด (ขั้วบวก) และขั้วบวก (ขั้วลบ) อิเล็กโทรดเหล่านี้แยกจากกันโดยอิเล็กโทรไลต์ที่ช่วยให้เกิดการแลกเปลี่ยนไอออนระหว่างกัน วัสดุอิเล็กโทรดและองค์ประกอบอิเล็กโทรไลต์ได้รับการคัดเลือกเพื่อให้มีแรงเคลื่อนไฟฟ้าเพียงพอระหว่างขั้วแบตเตอรี่
เนื่องจากอิเล็กโทรดมีศักยภาพของพลังงานเคมีจำกัด แบตเตอรี่จะหมดในระหว่างการใช้งาน ชนิดของเซลล์กัลวานิกซึ่งถูกดัดแปลงสำหรับการเติมเต็มหลังจากการคายประจุบางส่วนหรือทั้งหมดเรียกว่าแบตเตอรี่ การประกอบเซลล์ที่เชื่อมต่อกันดังกล่าวเป็นแบตเตอรี่การทำงานของแบตเตอรี่เกี่ยวข้องกับการเปลี่ยนแปลงวัฏจักรของสองสถานะ:
- การชาร์จ - แบตเตอรี่ทำงานเป็นตัวรับกระแสไฟฟ้า ภายในเซลล์ พลังงานไฟฟ้าจะถูกรับรู้ในการเปลี่ยนแปลงทางเคมี
- การคายประจุ - อุปกรณ์ทำหน้าที่เป็นแหล่งกระแสไฟฟ้าโดยการแปลงพลังงานของปฏิกิริยาเคมีเป็นพลังงานไฟฟ้า
พื้นที่ใช้งาน
คุณลักษณะความจุสูงพิเศษของแบตเตอรี่วานาเดียมรีดอกซ์ทำให้เหมาะสำหรับใช้ในอุตสาหกรรมที่ต้องการการจัดเก็บพลังงานสูง ตัวอย่างเช่น ช่วยปรับสมดุลปริมาณการผลิตของแหล่งพลังงานดังกล่าว เช่น ลมหรือพลังงานแสงอาทิตย์ หรือช่วยให้เครื่องกำเนิดไฟฟ้าดูดซับกระแสไฟขนาดใหญ่เมื่อจำเป็น หรือการปรับสมดุลของอุปทานและความต้องการพลังงานในพื้นที่ห่างไกล
ลักษณะการปลดปล่อยตัวเองที่จำกัดของแบตเตอรี่วานาเดียมรีดอกซ์ทำให้มีประโยชน์ในอุตสาหกรรมที่ต้องเก็บแบตเตอรี่ไว้เป็นเวลานานโดยมีการบำรุงรักษาและความพร้อมเพียงเล็กน้อย สิ่งนี้นำไปสู่การใช้ในอุปกรณ์อิเล็กทรอนิกส์ทางทหารบางประเภทเช่นในเซ็นเซอร์ของระบบการขุด GATOR ความสามารถในการหมุนเวียนและอยู่ที่ศูนย์ทำให้เหมาะสำหรับการใช้งานพลังงานแสงอาทิตย์และอุตสาหกรรมที่แบตเตอรี่ต้องเริ่มต้นวันใหม่ให้ว่างเปล่าและชาร์จใหม่ตามภาระและสภาพอากาศ ตัวอย่างเช่น แบตเตอรี่ลิเธียมไอออนมักจะได้รับความเสียหายเมื่อปล่อยให้ปล่อยประจุได้ต่ำกว่า 20% ของปริมาตร ดังนั้นส่วนใหญ่มักจะทำงานในช่วง 20 ถึง 100% ซึ่งหมายความว่าจะใช้ได้เพียง 20% ของความจุที่กำหนดเท่านั้น
เวลาตอบสนองที่รวดเร็วมากของพวกมันยังทำให้แทบขาดไม่ได้สำหรับเครื่องสำรองไฟฟ้า ซึ่งสามารถใช้แทนแบตเตอรี่ตะกั่วกรดและแม้แต่เครื่องกำเนิดไฟฟ้าดีเซล เวลาตอบสนองที่รวดเร็วทำให้เหมาะสำหรับการควบคุมความถี่ ในขณะนี้ ทั้ง UPS และมาตรการจัดการความถี่ไม่ได้ผลด้วยตัวมันเอง แต่มีแนวโน้มว่าแบตเตอรี่จะสามารถค้นหาการใช้งานในอุตสาหกรรมเหล่านี้ได้เมื่อใช้ประโยชน์จากแหล่งเงินทุนที่หลากหลาย นอกจากนี้ ความสามารถเหล่านี้ทำให้แบตเตอรี่วานาเดียมรีดอกซ์เป็นโซลูชัน "ชิ้นเดียว" ที่มีประสิทธิภาพสำหรับโครงข่ายไฟฟ้าขนาดเล็กที่ขึ้นอยู่กับการทำงานที่เชื่อถือได้ การควบคุมความถี่ และความต้องการในการเปลี่ยนโหลด (เช่น การรุกของพลังงานหมุนเวียนสูง โหลดที่ผันผวนสูง หรือความต้องการ เพิ่มประสิทธิภาพเครื่องกำเนิดไฟฟ้าด้วยการเปลี่ยนเวลาตอบสนอง)
แบตเตอรี่วานาเดียมรีดอกซ์ที่ใช้งานได้ที่ใหญ่ที่สุด
สถานีย่อย "มินามิ ฮายากิตะ":
- วันที่เปิดตัว: ธันวาคม 2015
- พลังงาน: 60 MWh
- กำลังไฟ: 15 MW
- เวลาทำงาน: 4 ชั่วโมง
- ประเทศ: ญี่ปุ่น
เหม็น, มณฑลเหลียวหนิง
- วันที่เปิดตัว: N/A
- พลังงาน: 10 MWh
- กำลังไฟ: 5 MW
- เวลาทำงาน: 2 ชั่วโมง
- ประเทศ: ประเทศจีน
ฟาร์มกังหันลมโทมาเมะ
- วันที่เปิดตัว: 2005
- พลังงาน: 6 MWh
- กำลังไฟ: 4 MW
- เวลาทำงาน: 1 ชั่วโมง 30 นาที
- ประเทศ: ญี่ปุ่น
โครงการจางเป่ย
- วันที่เปิดตัว 2016
- พลังงาน: 8 MWh
- กำลังไฟ: 2 MW
- เวลาทำงาน: 4 ชั่วโมง
- ประเทศ: ประเทศจีน
โครงการ SnoPUD MESA 2
- วันที่เปิดตัว: มีนาคม 2017
- พลังงาน: 8 MWh
- กำลังไฟ: 2 MW
- เวลาทำงาน: 4 ชั่วโมง
- ประเทศ: USA
สถานีย่อยในเอสคอนดิโด
- วันที่เปิดตัว: 2017
- พลังงาน: 8 MWh
- กำลังไฟ: 2 MW
- เวลาทำงาน: 4 ชั่วโมง
- ประเทศ: USA
สถานีย่อย ใน Pullman, Washington
- วันที่เปิดตัว: เมษายน 2015
- พลังงาน: 4 MWh
- กำลังไฟ: 1 MW
- เวลาทำงาน: 4 ชั่วโมง
- ประเทศ: USA
ภายในปี 2018 การพัฒนาแบตเตอรี่วานาเดียมรีดอกซ์ในประเทศจีนคาดว่าจะแล้วเสร็จ พลังงานของมันคือ 800 MWh กำลัง - 200 MW และเวลาทำงาน - 4 ชั่วโมง
เงื่อนไข
- Sequential - อิลิเมนต์จะตามมาทีหลัง
- แรงเคลื่อนไฟฟ้า (EMF) คือแรงดันไฟฟ้าที่เกิดจากแบตเตอรี่หรือแรงแม่เหล็กตามกฎหมายของฟาราเดย์
- ขนาน - ส่วนประกอบทางไฟฟ้าถูกจัดเรียงเพื่อให้กระแสไหลไปตามเส้นทางตั้งแต่สองทางขึ้นไป
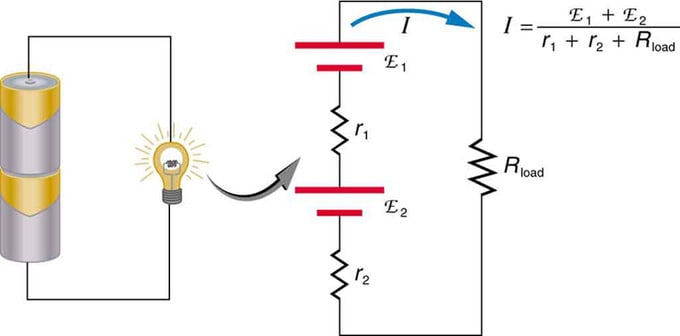
หากคุณใช้แหล่งจ่ายแรงดันไฟฟ้าหลายแหล่ง สามารถเชื่อมต่อแบบอนุกรมหรือแบบขนานได้ ในเวอร์ชันซีรีส์ พวกมันจะถูกปรับไปในทิศทางเดียวกัน ความต้านทานภายในเพิ่มขึ้น และเพิ่มแรงเคลื่อนไฟฟ้าตามพีชคณิต ประเภทที่คล้ายกันนี้มักพบในไฟฉาย ของเล่น และเครื่องใช้อื่นๆ ที่หลากหลาย เซลล์ถูกวางเป็นอนุกรมเพื่อเพิ่มแรงเคลื่อนไฟฟ้าทั้งหมด
การเชื่อมต่อแบบอนุกรมของแหล่งจ่ายแรงดันสองแหล่งในทิศทางเดียวกัน แผนภาพแสดงตะเกียงที่มีสองเซลล์และหนึ่งหลอด
แบตเตอรี่ - การเชื่อมต่อหลายองค์ประกอบโวลต์ แต่มีข้อเสียอย่างหนึ่งในการเชื่อมต่อแบบอนุกรมเนื่องจากมีการเพิ่มความต้านทานภายใน บางครั้งสิ่งนี้สร้างปัญหา สมมติว่าคุณมีแบตเตอรี่ 6V สองก้อนที่คุณใส่แทนแบตเตอรี่ 12V ปกติ ด้วยเหตุนี้ คุณจึงไม่เพียงเพิ่ม EMF เท่านั้น แต่ยังรวมถึงความต้านทานภายในจากแบตเตอรี่แต่ละก้อนด้วย
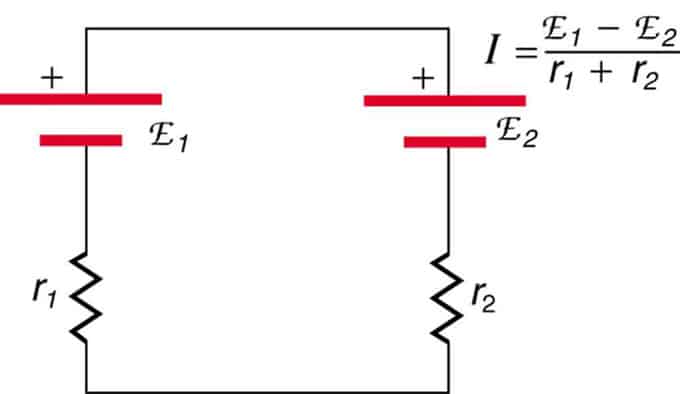
หากเซลล์อยู่ตรงข้าม (เซลล์หนึ่งอยู่ด้านหลังอีกเซลล์) แรงเคลื่อนไฟฟ้าทั้งหมดจะลดลง
นี่คือแหล่งจ่ายแรงดันไฟสองแหล่งที่เชื่อมต่อแบบอนุกรมกับการปล่อยมลพิษที่ไม่เห็นด้วย กระแสไหลไปในทิศทางของ EMF ที่มากขึ้นและถูกจำกัดโดยผลรวมของความต้านทานภายใน ตัวอย่างคือที่ชาร์จ จะต้องมีแรงเคลื่อนไฟฟ้ามากกว่าแบตเตอรี่
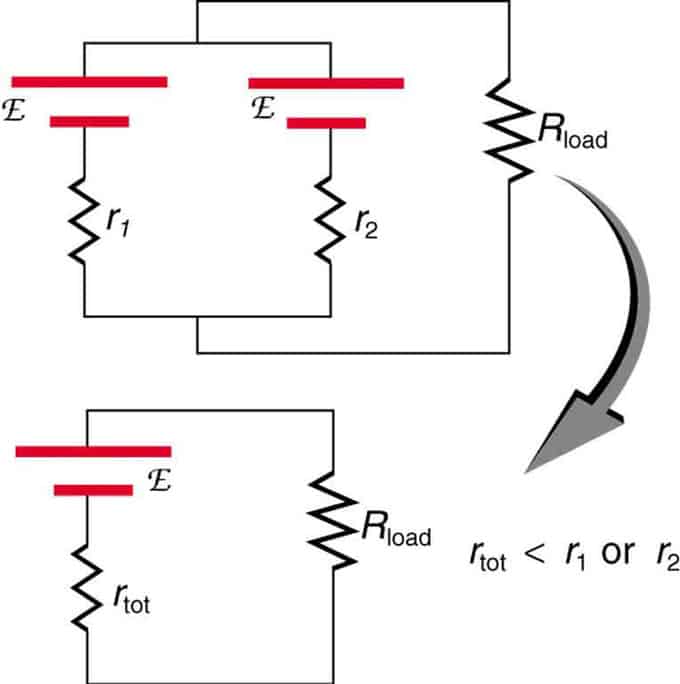
หากแหล่งกำเนิดสองแหล่งที่มีแรงเคลื่อนไฟฟ้าเท่ากันนั้นขนานกันและเชื่อมต่อกับความต้านทานโหลด ดังนั้น EMF ทั้งหมดจะยังคงเหมือนเดิมกับแหล่งแต่ละแหล่ง อย่างไรก็ตาม ความต้านทานภายในทั้งหมดจะลดลง ปรากฎว่ารุ่นขนานสามารถสร้างกระแสได้มากขึ้น
แหล่งจ่ายแรงดันไฟสองแหล่งที่มี EMF เดียวถูกรวมเข้าด้วยกันในการเชื่อมต่อแบบขนาน พวกมันสร้าง EMF หนึ่งตัว แต่มีความต้านทานรวมน้อยกว่าแบบเดี่ยว ใช้ชุดค่าผสมที่คล้ายกันหากคุณต้องการเพื่อให้ได้กระแสที่มากขึ้น
| ภาพรวม |
|
| การเชื่อมต่อแบบขนานและแบบอนุกรมของตัวต้านทาน |
|
| กฎของเคอร์ชอฟฟ์ |
|
| โวลต์มิเตอร์และแอมมิเตอร์ |
|
| วงจร RC |
|
ภาพรวมทางประวัติศาสตร์
การพัฒนาเซลล์กัลวานิกแรกให้เครดิตกับนักฟิสิกส์ชาวอิตาลี Alessandro Volta เขาทำการทดลองหลายครั้งเกี่ยวกับปรากฏการณ์ไฟฟ้าเคมีในช่วงทศวรรษที่ 1790 และราวปี 1800 เขาได้สร้างแบตเตอรี่ก้อนแรกขึ้น ซึ่งรุ่นเดียวกันของเขาเรียกว่า "คอลัมน์โวลตาอิก" อุปกรณ์ประกอบด้วยแผ่นสังกะสีและเงินสลับกัน โดยคั่นด้วยชั้นกระดาษหรือผ้าที่แช่ในสารละลายโซเดียมไฮดรอกไซด์
การทดลองเหล่านี้ได้กลายเป็นพื้นฐานสำหรับงานของ Michael Faraday เกี่ยวกับกฎเชิงปริมาณของไฟฟ้าเคมี เขาอธิบายหลักการทำงานของแบตเตอรี่และจากผลงานของนักวิทยาศาสตร์ เซลล์ไฟฟ้าเชิงพาณิชย์ตัวแรกได้ถูกสร้างขึ้น วิวัฒนาการเพิ่มเติมมีลักษณะดังนี้:
- ในปี ค.ศ. 1836 นักเคมีชาวอังกฤษ จอห์น แดเนียล นำเสนอแบบจำลองที่ปรับปรุงแล้วของเซลล์ ซึ่งประกอบด้วยอิเล็กโทรดทองแดงและสังกะสีที่แช่ในกรดไฮโดรคลอริก องค์ประกอบของแดเนียลสามารถให้แรงดันไฟฟ้าคงที่ได้อย่างมีประสิทธิภาพมากกว่าอุปกรณ์ของโวลต์
- 1839 นักฟิสิกส์โกรฟทำความคืบหน้าต่อไปด้วยเซลล์ของเหลวสองเซลล์ ซึ่งประกอบด้วยสังกะสีที่แช่ในกรดซัลฟิวริกเจือจางในภาชนะที่มีรูพรุน หลังแยกกรดซัลฟิวริกออกจากภาชนะที่มีกรดไนตริกโดยมีแคโทดแพลตตินัมวางไว้ กรดไนตริกทำหน้าที่เป็นตัวออกซิไดซ์เพื่อป้องกันการสูญเสียแรงดันไฟฟ้าเนื่องจากการสะสมของไฮโดรเจนที่แคโทดนักเคมีชาวเยอรมัน Robert Bunsen แทนที่แพลตตินัมด้วยคาร์บอนราคาถูกในเซลล์ Grove และด้วยเหตุนี้จึงส่งเสริมการยอมรับอย่างกว้างขวางของแบตเตอรี่ประเภทนี้
- ในปี 1859 Gaston Plante ได้คิดค้นเซลล์ตะกั่ว-กรด ซึ่งเป็นบรรพบุรุษของแบตเตอรี่รถยนต์สมัยใหม่ อุปกรณ์ของ Plante สามารถผลิตกระแสไฟฟ้าขนาดใหญ่ผิดปกติได้ แต่ใช้สำหรับการทดลองในห้องปฏิบัติการเท่านั้นเป็นเวลาเกือบสองทศวรรษ
- พ.ศ. 2438-2448 การประดิษฐ์องค์ประกอบอัลคาไลน์นิกเกิลแคดเมียมและนิกเกิลเหล็ก ทำให้สามารถสร้างระบบที่มีรอบการชาร์จ-คายประจุจำนวนมากได้
- นับตั้งแต่ช่วงทศวรรษที่ 1930 เป็นต้นมา การพัฒนาแบตเตอรี่อัลคาไลน์ซิลเวอร์-สังกะสีและปรอท-สังกะสีได้เริ่มต้นขึ้น ซึ่งให้ความหนาแน่นของพลังงานสูงต่อหน่วยน้ำหนักและปริมาตร
- ตั้งแต่กลางศตวรรษที่ 20 ความก้าวหน้าทางเทคโนโลยีการผลิตและการถือกำเนิดของวัสดุใหม่ได้นำไปสู่แบตเตอรี่ที่ทรงพลังและกะทัดรัดยิ่งขึ้น ที่โดดเด่นที่สุดคือการเปิดตัวแบตเตอรี่นิกเกิลเมทัลไฮไดรด์และลิเธียมออกสู่ตลาด
ชาร์จแบตเตอรี่
บทความหลัก: ที่ชาร์จ
เมื่อพลังงานเคมีหมดลง แรงดันไฟและกระแสไฟตก และแบตเตอรี่จะหยุดทำงาน คุณสามารถชาร์จแบตเตอรี่ (แบตเตอรี่ของแบตเตอรี่) จากแหล่งไฟฟ้ากระแสตรงใดๆ ที่มีแรงดันไฟฟ้าสูงกว่าในขณะที่จำกัดกระแสไฟ กระแสไฟชาร์จที่พบบ่อยที่สุดคือ (เป็นแอมแปร์) ซึ่งคิดเป็นสัดส่วนกับ 1/10 ของความจุตามเงื่อนไขของแบตเตอรี่ (ในหน่วยแอมแปร์ชั่วโมง)
อย่างไรก็ตาม ตามคำอธิบายทางเทคนิคที่เผยแพร่โดยผู้ผลิตแบตเตอรี่ไฟฟ้าที่ใช้กันอย่างแพร่หลาย (NiMH, NiCd) ก็สามารถสันนิษฐานได้ว่าโหมดการชาร์จนี้ โดยทั่วไปจะเรียกว่า มาตรฐานคำนวณตามระยะเวลาของวันทำการแปดชั่วโมง เมื่อแบตเตอรี่หมดเมื่อสิ้นสุดวันทำงาน เชื่อมต่อกับเครื่องชาร์จหลักก่อนเริ่มวันทำการใหม่ การใช้โหมดการชาร์จดังกล่าวสำหรับแบตเตอรี่ประเภทนี้ที่มีการใช้งานอย่างเป็นระบบทำให้คุณสามารถรักษาสมดุลต้นทุนด้านคุณภาพในการใช้งานผลิตภัณฑ์ได้ ดังนั้น ตามคำแนะนำของผู้ผลิต โหมดนี้สามารถใช้ได้กับแบตเตอรี่นิกเกิลแคดเมียมและนิกเกิลเมทัลไฮไดรด์เท่านั้น
แบตเตอรี่หลายประเภทมีข้อจำกัดที่แตกต่างกันซึ่งต้องนำมาพิจารณาในระหว่างการชาร์จและการใช้งานในภายหลัง เช่น แบตเตอรี่ NiMH มีความไวต่อการชาร์จมากเกินไป แบตเตอรี่ลิเธียมมีความไวต่อการคายประจุเกิน แรงดันไฟ และอุณหภูมิ แบตเตอรี่ NiCd และ NiMH มีผลหน่วยความจำที่เรียกว่า ซึ่งประกอบด้วยความจุที่ลดลงเมื่อทำการชาร์จเมื่อแบตเตอรี่ไม่ได้คายประจุจนหมด นอกจากนี้ แบตเตอรี่ประเภทนี้ยังมีการคายประจุในตัวเองอย่างเห็นได้ชัด กล่าวคือ จะค่อยๆ สูญเสียประจุโดยไม่ต้องเชื่อมต่อกับโหลด เพื่อต่อสู้กับเอฟเฟกต์นี้ สามารถใช้การรีชาร์จแบบหยดได้
วิธีการชาร์จแบตเตอรี่
มีการใช้หลายวิธีในการชาร์จแบตเตอรี่ โดยทั่วไป วิธีการชาร์จจะขึ้นอยู่กับประเภทของแบตเตอรี่
- การชาร์จ DC ช้า
ชาร์จด้วยกระแสตรงตามสัดส่วน 0.1-0.2 ของความจุ Q ตามเงื่อนไข ประมาณ 15-7 ชั่วโมงตามลำดับ
วิธีการชาร์จที่ยาวที่สุดและปลอดภัยที่สุด เหมาะสำหรับแบตเตอรี่ส่วนใหญ่
- ชาร์จเร็ว
ชาร์จด้วยกระแสตรงตามสัดส่วน 1/3 Q ประมาณ 3-5 ชั่วโมง
- การชาร์จแบบเร่งหรือ "delta-V"
ประจุที่มีประจุกระแสไฟเริ่มต้นเป็นสัดส่วนกับความจุปกติของแบตเตอรี่ ซึ่งวัดแรงดันแบตเตอรี่อย่างต่อเนื่องและประจุจะสิ้นสุดลงหลังจากที่ชาร์จแบตเตอรี่จนเต็มแล้ว เวลาในการชาร์จประมาณหนึ่งชั่วโมงครึ่ง แบตเตอรี่อาจร้อนจัดและทำลายได้
- ชาร์จย้อนกลับ
ทำได้โดยการสลับพัลส์ประจุยาวกับพัลส์คายประจุสั้น วิธีย้อนกลับมีประโยชน์มากที่สุดสำหรับการชาร์จแบตเตอรี่ NiCd และ NiMH ซึ่งมีลักษณะเฉพาะที่เรียกว่าน. "ผลหน่วยความจำ".