استخدام حمض الهيدروكلوريك
يستخدم حمض الهيدروكلوريك على نطاق واسع في الصناعة لاستخراج المعادن من الخامات ، ومعادن التخليل ، إلخ. كما أنه يستخدم في تصنيع سائل اللحام ، وفي ترسيب الفضة ، وكجزء لا يتجزأ من الماء الريجي.
حجم استخدام حمض الهيدروكلوريك في الصناعة أقل من نطاق حمض النيتريك. هذا يرجع إلى حقيقة أن حمض الهيدروكلوريك يسبب تآكل معدات الفولاذ. بالإضافة إلى ذلك ، فإن أبخرتها المتطايرة ضارة جدًا وتتسبب أيضًا في تآكل المنتجات المعدنية. يجب أن يؤخذ ذلك في الاعتبار عند تخزين حمض الهيدروكلوريك. يتم تخزين حمض الهيدروكلوريك ونقله في خزانات وبراميل مبطنة بالمطاط ، أي في الأوعية ، سطحها الداخلي مغطى بمطاط مقاوم للأحماض ، وكذلك في قوارير زجاجية وأواني من البولي إيثيلين.
يستخدم حمض الهيدروكلوريك لإنتاج كلوريدات الزنك والمنغنيز والحديد والمعادن الأخرى ، وكذلك كلوريد الأمونيوم. يستخدم حمض الهيدروكلوريك لتنظيف أسطح المعادن والأوعية والآبار من الكربونات والأكاسيد والرواسب والملوثات الأخرى. في هذه الحالة ، يتم استخدام إضافات خاصة - مثبطات تحمي المعدن من الذوبان والتآكل ، ولكنها لا تؤخر انحلال الأكاسيد والكربونات والمركبات الأخرى المماثلة.
يستخدم حمض الهيدروكلوريك في الإنتاج الصناعي للراتنجات الاصطناعية والمطاط. يتم استخدامه كمادة خام في إنتاج كلوريد الميثيل من كحول الميثيل ، وكلوريد الإيثيل من الإيثيلين ، وكلوريد الفينيل من الأسيتيلين.
طرق الإسعافات الأولية والعلاج
إذا تم العثور على علامات التسمم ، يجب استدعاء سيارة إسعاف. في المنزل ، يُسمح بالقيام بأنشطة تهدف إلى تحسين حالة الضحية. يجب إجراء الإسعافات الأولية للتسمم بحمض الهيدروكلوريك بسرعة لتقليل مخاطر النتائج السلبية.
الأحداث:
- إذا لامس مركب الملح الجلد ، يتم غسل المناطق المتضررة بكمية كبيرة من الماء البارد. وقت المعالجة نصف ساعة على الأقل.
- في حالة التسمم بالأبخرة ، يتم تزويد الضحية بالهواء النقي ، ويتم فتح النوافذ ، ويتم فك أزرار الملابس الضيقة.
- يوصى بمراقبة حالة المريض ، في حالة عدم وجود علامات على الحياة ، يتم إجراء الإنعاش.
- يُسمح للضحية من الأبخرة بشرب الشاي الدافئ والماء. يوصى بشطف الأنف والفم بالماء البارد.
- في حالة الجرعة الزائدة الناتجة عن تناول الحمض ، يتم وضع كيس ثلج على البطن لمنع أو تقليل النزيف المحتمل.
- لا يسمح بالمنتجات الطبية. يُسمح بإعطاء المريض كوبًا من الماء (يمكنك معدن قلوي). سائل الشرب مطلوب في رشفات صغيرة.
- لا يجوز غسل المعدة ، حاول التسبب في التقيؤ في المنزل. يمكن أن تؤدي هذه الإسعافات الأولية إلى تطوير حروق في الحلق ونزيف.
يتم العلاج في مؤسسة طبية تحت إشراف متخصصين.
معالجة:
- تطهير المعدة بالمسبار ،
- استخدام القطارات مع المحاليل الطبية ،
- وصف الأدوية لتسكين الآلام
- استخدام الأدوية التي تهدف إلى استعادة عمل الأجهزة والأنظمة ،
- إذا لزم الأمر ، استنشاق الأكسجين والتهوية الاصطناعية للرئتين ،
- إجراء علاج إنعاش في حالة عدم وجود علامات تدل على الحياة ،
- اختيار الفيتامينات والتغذية الخاصة.
يتم العلاج في العناية المركزة ، ثم في المستشفى. المدة تعتمد على حالة المريض ودرجة التسمم.
الحروق والتسمم
بقدر فعالية هذا العلاج ، فهو خطير. يمكن لحمض الهيدروكلوريك ، اعتمادًا على التركيز ، أن يتسبب في حروق كيميائية بأربع درجات:
- لا يوجد سوى احمرار وألم.
- هناك فقاعات مع سائل واضح وتورم.
- النخر المتشكل للطبقات العليا من الجلد.تمتلئ البثور بالدم أو محتويات عكرة.
- تصل الآفة إلى الأوتار والعضلات.
إذا دخلت المادة في العين بطريقة ما ، فمن الضروري شطفها بالماء ثم بمحلول الصودا. لكن على أي حال ، فإن أول شيء يجب فعله هو استدعاء سيارة إسعاف.
إن تناول الحمض بالداخل محفوف بآلام حادة في الصدر والبطن ، وتورم في الحنجرة ، وتقيؤ الكتل الدموية. نتيجة لذلك ، أمراض الكبد والكلى الشديدة.
وأول علامات التسمم في أزواج تشمل السعال الجاف المتكرر والاختناق وتلف الأسنان وحرقان في الأغشية المخاطية وآلام في البطن. تتمثل الإسعافات الأولية في حالات الطوارئ في غسل الفم وشطفه بالماء ، وكذلك الوصول إلى الهواء النقي. فقط عالم السموم يمكن أن يقدم مساعدة حقيقية.
خصائص الطيف الكيميائي
يتفاعل الحمض مع العديد من المعادن والأملاح. يعتبر قويًا جدًا ويتساوى مع الشامواه. يظهر التفاعل الرئيسي في جميع مجموعات المعادن الموجودة على يسار الهيدروجين (المغنيسيوم والحديد والزنك - الجهد الكهربائي).
يتفاعل محلول كلوريد الهيدروجين بشكل مخفف مع الأملاح ، ولكن فقط مع تلك التي تتكون من أحماض أقل قوة. معروفة بكل كربونات الصوديوم والكالسيوم ، بعد التفاعل معها تتحلل إلى ماء وأول أكسيد الكربون.
حمض النيتريك
- رد فعل نوعي لمحلول ملحي. للحصول عليه ، من الضروري إضافة نترات الفضة إلى هذا الكاشف ، ونتيجة لذلك ، سيتشكل راسب أبيض ، يتم الحصول على مادة النيتروجين منه.
بمساعدة هذا المزيج من الماء والهيدروجين ، يتم إجراء العديد من التجارب المثيرة للاهتمام. على سبيل المثال ، قم بتخفيفه بالأمونيا. نتيجة لذلك ، سوف تحصل على دخان أبيض ، كثيف ، له قوام بلورات صغيرة. الميثيلامين ، الأنيلين ، ثاني أكسيد المنغنيز ، كربونات البوتاسيوم هي كواشف تتأثر أيضًا بالحمض.
كيف ولماذا يتم استخدامه
ربما يكون هذا بحق أحد المواد المهمة الموجودة والضرورية في جميع فروع الحياة البشرية تقريبًا.
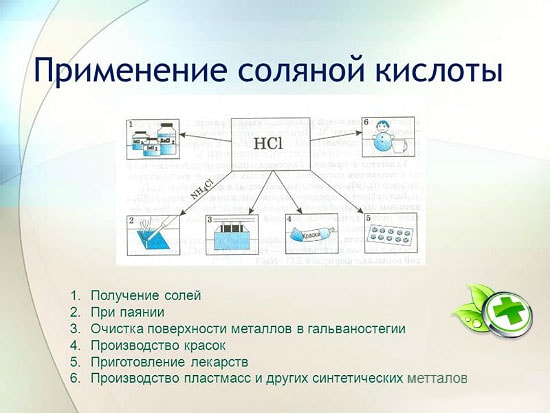
توطين منطقة التطبيق:
- علم المعادن. تنظيف الأسطح من المناطق المؤكسدة ، إذابة الصدأ ، معالجة ما قبل اللحام ، التعليب. يساعد حمض الهيدروكلوريك على استخراج شوائب صغيرة من المعادن من الخامات. يتم الحصول على الزركونيوم والتيتانيوم بطريقة تحويل الأكاسيد إلى كلوريدات.
- صناعة تكنولوجيا الغذاء. يستخدم محلول التركيز المنخفض كمضافات غذائية. يحتوي الجيلاتين والفركتوز لمرضى السكر على مستحلب نقي. تحتوي الصودا العادية أيضًا على نسبة عالية من هذه المادة. على عبوات البضائع سترى تحت الاسم E507.
- مجال الطب. مع وجود مؤشر غير كافي للبيئة الحمضية في المعدة ومشاكل في الامعاء. انخفاض درجة الحموضة يؤدي إلى الإصابة بالسرطان. حتى مع التغذية السليمة والفيتامينات بكثرة ، لا يختفي الخطر ، فمن الضروري إجراء اختبارات للحصول على عصير من الجهاز الهضمي ، لأنه في بيئة حمضية غير كافية ، لا يتم امتصاص المواد المفيدة عمليًا ، ويضطرب الهضم.
- يستخدم محلول الملح كمثبط - حماية ضد الأوساخ والالتهابات ، عمل مطهر. لتصنيع الخلائط اللاصقة ومنتجات السيراميك. يقوم بغسل المبادلات الحرارية.
- كما أن إجراء تنقية مياه الشرب لا يكتمل بدون مشاركة الكلور.
- انتاج المطاط وتبييض قواعد النسيج.
- يمكنك العناية بعدساتك بهذا المحلول.
- غسول الفم في المنزل
- المادة موصل ممتاز للكهرباء.
كيف يحدث التسمم
حمض الهيدروكلوريك سائل عديم اللون ذو رائحة نفاذة مميزة. من أقوى الأحماض القادرة على إذابة بعض المعادن. يتحول بسهولة إلى غاز.
يستخدم كلوريد الهيدروجين في صناعة النسيج ، وتجارة الجلود ، وتعدين المعادن الثمينة ، وإنتاج الغراء والأحماض.
المادة موجودة في المعدة بأقل تركيز. يساهم الحمض في تطبيع العملية الهضمية ، ويحمي الجسم من البكتيريا والكائنات الحية الدقيقة الضارة.
بتركيز يزيد عن 24٪ ، يمكن أن يسبب حمض الهيدروكلوريك ضررًا لا رجعة فيه لجسم الإنسان. تتسبب الأبخرة عند ملامستها للهواء في تهيج أعضاء الجهازين البصري والجهاز التنفسي.
هناك العديد من العوامل التي يمكن أن تثير تطور التسمم.
عوامل:
التسمم بالبخار ممكن عند العمل في غرف ذات تهوية سيئة ،
البلع عن طريق الإهمال ، أكثر شيوعًا عند الأطفال ،
دخول حمض الهيدروكلوريك على البشرة والأغشية المخاطية في حالة عدم الامتثال لقواعد استخدام الكاشف.
يحدث التسمم بمادة في المنزل عند البالغين نتيجة الاستخدام بدون معدات واقية للجلد والعينين وأعضاء الجهاز التنفسي. يمكن أن يحدث التسمم عندما ينتقل الحمض بشكل غير دقيق من حاوية إلى أخرى.
الديناميكا الدوائية والحركية الدوائية
ما هي حموضة المعدة؟ هذه سمة من سمات تركيز حمض الهيدروكلوريك في المعدة. يتم التعبير عن الحموضة في الرقم الهيدروجيني
. عادة ، يجب أن ينتج الحمض في تكوين عصير المعدة وأن يلعب دورًا نشطًا في عمليات الهضم. صيغة حمض الهيدروكلوريك: حمض الهيدروكلوريك
. يتم إنتاجه من قبل الخلايا الجدارية الموجودة في الغدد القاعدية ، بمشاركة H + / K + -ATPase
. تبطن هذه الخلايا قاع وجسم المعدة. حموضة عصير المعدة نفسها متغيرة وتعتمد على عدد الخلايا الجدارية وشدة عمليات تحييد المادة بواسطة المكونات القلوية لعصير المعدة. ينتج التركيز إلى - أنت مستقر وتساوي 160 مليمول / لتر. يجب أن لا ينتج الشخص السليم عادة أكثر من 7 و 5 مليمول على الأقل من مادة ما في الساعة.
مع الإنتاج غير الكافي أو المفرط لحمض الهيدروكلوريك ، تحدث أمراض الجهاز الهضمي ، وتتدهور القدرة على امتصاص بعض العناصر الدقيقة ، مثل الحديد. الدواء يحفز إفراز العصارة المعدية ويقلل الرقم الهيدروجيني
. ينشط الببسينوجين
، يحوله إلى إنزيم نشط بيبسين
. المادة لها تأثير مفيد على الانعكاس الحمضي للمعدة ، وتبطئ انتقال الطعام غير المهضوم بشكل كامل إلى الأمعاء. تتباطأ عمليات تخمر محتويات الجهاز الهضمي ، ويختفي الألم والتجشؤ ، ويتم امتصاص الحديد بشكل أفضل.
بعد تناوله عن طريق الفم ، يتم استقلاب الدواء جزئيًا عن طريق اللعاب ومخاط المعدة ، محتويات الاثني عشر. المادة غير المقيدة تخترق الاثني عشر ، حيث يتم تحييدها تمامًا بمحتوياتها القلوية.
استخدام آخر للحمض في الحياة اليومية
مع التركيبة الحمضية ، يمكنك بسهولة تنظيف الترسبات الكلسية والصدأ من أنابيب السباكة القيشاني ، وإزالة حصوات المسالك البولية وغيرها من الملوثات. للحصول على تأثير أكبر ، يضاف مثبط (على سبيل المثال ، يوروتروبين) إلى العامل ، مما يؤدي إلى إبطاء التفاعل الكيميائي.
يتم تنفيذ الإجراء على النحو التالي: يخفف الحمض بالماء حتى يتم الوصول إلى تركيز 5٪ ويضاف مثبط بمعدل 0.5 جم لكل 1 لتر من السائل. يتم معالجة السطح بالتركيب الناتج ويترك لمدة 30-40 دقيقة (حسب درجة التلوث) ، وبعد ذلك يتم غسله بالماء.
يستخدم محلول حمضي معتدل أيضًا لإزالة بقع التوت أو الحبر أو الصدأ من الأقمشة. للقيام بذلك ، تنقع المادة في التركيبة لفترة من الوقت ، وبعد ذلك يتم شطفها جيدًا وغسلها بالطريقة المعتادة.
التخلص من الكلس في الغلاية
لهذا الغرض ، يتم استخدام محلول حمض الهيدروكلوريك بنسبة 3-5 ٪ ، والذي يُسكب في غلاية ويتم تسخينه إلى 60-80°
C لمدة 1-2 ساعة أو حتى تتفكك رواسب الحجم. بعد ذلك ، يصبح المقياس فضفاضًا ويمكن إزالته بسهولة باستخدام ملعقة خشبية.
تعود فعالية الطريقة إلى حقيقة أن الكاشف يتفاعل مع كربونات المغنيسيوم والكالسيوم ويحولها إلى أملاح قابلة للذوبان. إن إطلاق ثاني أكسيد الكربون في نفس الوقت يدمر طبقة القشور ويجعلها مفكوكة. بعد إزالة رواسب الملح ، يتم غسل الأطباق جيدًا بالماء النظيف.
نقطة مهمة!
هذه الطريقة غير مناسبة لإزالة الترسبات الكلسية المينا المتشققة أو غلايات الألمنيوم: سيؤدي ذلك إلى تآكل المعدن وإتلافه بشدة.
الحصول على مادة
الآن يمكننا التحدث عما يفعلونه لتكوين حمض الهيدروكلوريك.
أولاً ، عن طريق حرق الهيدروجين في الكلور ، يتم الحصول على المكون الرئيسي ، كلوريد الهيدروجين الغازي. ثم يذوب في الماء. نتيجة هذا التفاعل البسيط هي تكوين حمض اصطناعي.
يمكن أيضًا الحصول على هذه المادة من الغازات المنبعثة. هذه عبارة عن غازات نفايات كيميائية (جانبية). يتم تشكيلها من خلال مجموعة متنوعة من العمليات. على سبيل المثال ، عند معالجة الهيدروكربونات بالكلور. يسمى كلوريد الهيدروجين في تركيبها الغاز المنبعث. وهكذا يتم الحصول على الحمض على التوالي.
وتجدر الإشارة إلى أن حصة مادة الغازات المنبعثة في الحجم الإجمالي لإنتاجها آخذة في الازدياد في السنوات الأخيرة. والحمض المتكون نتيجة احتراق الهيدروجين في الكلور ينزاح. ومع ذلك ، في الإنصاف ، تجدر الإشارة إلى أنه يحتوي على شوائب أقل.
استخدام الإنتاج
لها تطبيقات واسعة في الصناعات المعدنية والغذائية والطبية.
- علم المعادن. تستخدم في لحام المعادن وقصديرها وتنظيفها.
- الصناعات الغذائية. التطبيق في إنتاج منظمات الحموضة الغذائية ، على سبيل المثال ، E507.
- النوع الكهربائي. تستخدم للتخليل.
- الدواء. يجد تطبيقه في إنتاج عصير المعدة الاصطناعي.
المدرجة في الأصباغ الاصطناعية. يتم استخدامه في إنتاج منتجات التنظيف والمنظفات. لكن في السوائل المعدة للاستخدام المنزلي ، يكون تركيز حامض الكبريتيك ضئيلًا.
كيف يتم إنتاج حمض الهيدروكلوريك في المختبر
إنتاج المادة واسع النطاق والبيع مجاني. في ظروف التجارب المعملية ، يتم إنتاج محلول بتأثير حمض الكبريتيك عالي التركيز على ملح المطبخ العادي (كلوريد الصوديوم).
هناك طريقتان لإذابة كلوريد الهيدروجين في الماء:
- يحرق الهيدروجين في الكلور (اصطناعي).
- المصاحب (خارج الغاز). جوهرها في إجراء الكلورة العضوية ، نزع الكلور.
المادة مناسبة بشكل جيد للتوليف أثناء الانحلال الحراري للنفايات من الكلور العضوي. يحدث هذا نتيجة انهيار الهيدروكربونات مع نقص كامل في الأكسجين. يمكنك أيضًا استخدام الكلوريدات المعدنية ، وهي المواد الخام للمواد غير العضوية. إذا لم يكن هناك حمض الكبريتيك المركز (المنحل بالكهرباء) ، خذه مخففًا.
بالنسبة لاستخراج الكاشف في الظروف الطبيعية ، غالبًا ما يمكن العثور على هذا المزيج الكيميائي في مياه النفايات البركانية. كلوريد الهيدروجين هو أحد مكونات معادن سيلفين (كلوريد البوتاسيوم ، يشبه عظام الألعاب) ، بيسكوفيت. كل هذه طرق لاستخراج المادة في الصناعة.
يوجد هذا الإنزيم في المعدة عند البشر. يمكن أن يكون الحل إما حمض أو قاعدة. واحدة من أكثر طرق الاستخراج شيوعًا تسمى الكبريتات.
الخواص الكيميائية
حمض الهيدروكلوريك ، كلوريد الهيدروجين أو حمض الهيدروكلوريك - محلول هكل
في الماء. وفقًا لـ Wikipedia ، تنتمي المادة إلى مجموعة غير عضوية قوية أحادية القاعدة لـ t. الاسم الكامل للمجمع باللاتينية: حامض الهيدروكلوريك.
صيغة حمض الهيدروكلوريك في الكيمياء: حمض الهيدروكلوريك
. في الجزيء ، تتحد ذرات الهيدروجين مع ذرات الهالوجين - Cl
. إذا أخذنا في الاعتبار التكوين الإلكتروني لهذه الجزيئات ، فيمكن ملاحظة أن المركبات تشارك في تكوين المدارات الجزيئية 1 ثانية
- مدارات الهيدروجين وكلاهما 3 ثانية
و 3 ص
مداري ذرة Cl
. في الصيغة الكيميائية لحمض الهيدروكلوريك 1 ثانية-
, 3 ثانية
و 3 ص
- المدارات الذرية تتداخل وتشكل 1 ، 2 ، 3 مدارات. حيث 3 ثانية
-وربيتال غير ملزم. هناك تحول في كثافة الإلكترون إلى الذرة Cl
وتنخفض قطبية الجزيء ، لكن الطاقة الرابطة للمدارات الجزيئية تزداد (إذا اعتبرناها جنبًا إلى جنب مع غيرها هاليدات الهيدروجين
).
الخصائص الفيزيائية لكلوريد الهيدروجين. إنه سائل صافٍ عديم اللون يدخن عند تعرضه للهواء. الكتلة المولية لمركب كيميائي = 36.6 جرام لكل مول. في ظل الظروف القياسية ، عند درجة حرارة هواء تبلغ 20 درجة مئوية ، يكون الحد الأقصى لتركيز مادة ما هو 38٪ من الوزن. كثافة حمض الهيدروكلوريك المركز في هذا النوع من المحلول 1.19 جم / سم مكعب. بشكل عام ، الخصائص والخصائص الفيزيائية مثل الكثافة ، المولارية ، اللزوجة ، السعة الحرارية ، نقطة الغليان و الرقم الهيدروجيني
، تعتمد بشدة على تركيز المحلول. تمت مناقشة هذه القيم بمزيد من التفصيل في جدول الكثافات. على سبيل المثال ، كثافة حمض الهيدروكلوريك 10٪ = 1.048 كجم لكل لتر. عندما تصلب ، تتشكل المادة هيدرات بلورية
تراكيب مختلفة.
الخواص الكيميائية لحمض الهيدروكلوريك. مع ماذا يتفاعل حمض الهيدروكلوريك؟ تتفاعل المادة مع المعادن التي تقف أمام الهيدروجين في سلسلة من الجهود الكهروكيميائية (الحديد والمغنيسيوم والزنك وغيرها). في هذه الحالة ، تتشكل الأملاح وغازية ح
. الرصاص والنحاس والذهب والفضة والمعادن الأخرى الموجودة على يمين الهيدروجين لا تتفاعل مع حمض الهيدروكلوريك. تتفاعل المادة مع أكاسيد المعادن مما ينتج الماء والملح القابل للذوبان. هيدروكسيد الصوديوم تحت تأثير الماء والأشكال. رد فعل التحييد هو سمة من سمات هذا المركب.
يتفاعل حمض الهيدروكلوريك المخفف مع الأملاح المعدنية التي تتكون من أحماض أضعف. على سبيل المثال، حمض البروبيونيك
أضعف من الملح. لا تتفاعل المادة مع أحماض أقوى. و كربونات الصوديوم
سوف تتشكل بعد التفاعل مع حمض الهيدروكلوريك
كلوريد وأول أكسيد الكربون والماء.
بالنسبة للمركب الكيميائي ، تكون التفاعلات مع عوامل مؤكسدة قوية مميزة ، مع ثاني أكسيد المنغنيز
, برمنجنات البوتاسيوم
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. المادة تتفاعل مع الأمونيا
الذي ينتج دخانًا أبيض كثيفًا يتكون من بلورات صغيرة جدًا من كلوريد الأمونيوم. يتفاعل البيرولوزيت المعدني أيضًا مع حمض الهيدروكلوريك لاحتوائه ثاني أكسيد المنغنيز
: MnO2 + 4HCl = Cl2 + MnO2 + 2H2O
(تفاعل أكسدة).
يوجد تفاعل نوعي مع حمض الهيدروكلوريك وأملاحه. عندما تتفاعل مادة مع نترات الفضة
راسب أبيض كلوريد الفضة
وشكلت حمض النيتريك
. معادلة تفاعل التفاعل ميثيلامين
مع كلوريد الهيدروجين يبدو كالتالي: HCl + CH3NH2 = (CH3NH3) كلوريد
.
مادة تتفاعل مع قاعدة ضعيفة الأنيلين
. بعد إذابة الأنيلين في الماء ، يضاف حمض الهيدروكلوريك إلى الخليط. نتيجة لذلك ، تذوب القاعدة وتتشكل هيدروكلوريد الأنيلين
(كلوريد فينيلامونيوم
): (С6Н5NH3) Cl
. تفاعل تفاعل كربيد الألومنيوم مع حمض الهيدروكلوريك: Al4C3 + 12HCL = 3CH4 + 4AlCl3
. معادلة التفاعل كربونات البوتاسيوم
التي يبدو بها مثل هذا: K2CO3 + 2HCl = 2KCl + H2O + CO2.
طلب
في علم المعادن لاستخراج الخامات ، وإزالة الصدأ ، والقشور ، والأوساخ والأكاسيد ، واللحام والصفيح ؛
في صناعة المطاط والراتنجات الاصطناعية ؛
في الطلاء الكهربائي
كمنظم الحموضة في صناعة المواد الغذائية ؛
للحصول على كلوريدات المعادن ؛
للحصول على الكلور
في الطب لعلاج حموضة المعدة غير كافية.
كمنظف ومطهر.
- (حمض الهيدروكلوريك) ، محلول مائي من كلوريد الهيدروجين ، وهو غاز عديم اللون ذو رائحة نفاذة. يتم الحصول عليها عن طريق عمل حمض الكبريتيك على الملح الشائع ، كمنتج ثانوي لكلورة الهيدروكربونات ، أو عن طريق تفاعل الهيدروجين والكلور. يستخدم حمض الهيدروكلوريك في ... ... القاموس الموسوعي العلمي والتقني
حامض الهيدروكلوريك
- - HCl (SC) (حمض الهيدروكلوريك ، حمض الهيدروكلوريك ، كلوريد الهيدروجين) هو محلول كلوريد الهيدروجين (HCl) في الماء ، مادة مضافة مضادة للتجمد. وهو سائل عديم اللون ذو رائحة نفاذة وبدون جزيئات معلقة ..... موسوعة مصطلحات وتعريفات وشروحات مواد البناء
حامض الهيدروكلوريك
- (حمض الهيدروكلوريك) محلول كلوريد الهيدروجين في الماء ؛ حامض قوي. دخان سائل عديم اللون في الهواء (حمض الهيدروكلوريك التقني يكون مصفرًا بسبب شوائب Fe ، Cl2 ، إلخ). التركيز الأقصى (عند 20 درجة مئوية) هو 38٪ بالكتلة ... ... قاموس موسوعي كبير
حامض الهيدروكلوريك
- (Acidum muriaticum ، Acid ، hydrochloricum) ، محلول كلوريد الهيدروجين (HC1) في الماء. في الطبيعة ، يحدث في مياه بعض المصادر البركانية ، ويوجد أيضًا في عصير المعدة (تصل إلى 0.5٪). يمكن الحصول على كلوريد الهيدروجين ... موسوعة طبية كبيرة
حامض الهيدروكلوريك
- (حمض الهيدروكلوريك ، حمض الهيدروكلوريك) حمض متطاير أحادي القاعدة قوي ذو رائحة نفاذة ، محلول مائي من كلوريد الهيدروجين ؛ التركيز الأقصى 38٪ بالكتلة ، كثافة هذا المحلول 1.19 جم / سم 3. تستخدم في ... ... الموسوعة الروسية لحماية العمال
حامض الهيدروكلوريك
- (حمض الهيدروكلوريك) محلول HCl مائي من كلوريد الهيدروجين ، حمض أحادي القاعدة قوي ، متطاير ، ذو رائحة نفاذة ؛ شوائب الحديد والكلور يصبغها مصفر. تحتوي S. المركزة للبيع على 37٪ ... ... موسوعة البوليتكنيك الكبيرة
حامض الهيدروكلوريك
- الاسم ، عدد المرادفات: 1 حمض (171) قاموس مرادف أيسيس. في. تريشين. 2013 ... قاموس مرادف
حامض الهيدروكلوريك
الموسوعة الحديثة
حامض الهيدروكلوريك
- حمض الهيدروجين ، محلول مائي من كلوريد الهيدروجين حمض الهيدروكلوريك ؛ سائل دخان برائحة نفاذة. يستخدم حمض الهيدروكلوريك للحصول على العديد من الكلوريدات ومعادن التخليل ومعالجة الخامات وإنتاج الكلور والصودا والمطاط وما إلى ذلك ... ... قاموس موسوعي مصور
حامض الهيدروكلوريك
- (حمض الهيدروكلوريك) ، محلول كلوريد الهيدروجين في الماء ؛ حامض قوي. سائل عديم اللون "دخن" في الهواء (حمض الهيدروكلوريك التقني يكون مصفرًا بسبب شوائب من Fe ، Cl2 ، إلخ). أقصى تركيز (عند 20 درجة مئوية) 38٪ بالكتلة ، ...... القاموس الموسوعي
ما هو خطر التسمم
حمض الهيدروكلوريك خطر خاص على جسم الإنسان. في حالة التسمم بمثل هذه المادة ، قد تتطور مضاعفات وانتهاكات خطيرة لوظائف الجسم.
المضاعفات:
- - اعتلال الكبد نتيجة التهاب الكبد السام.
- نزيف في المعدة نتيجة تدمير جدران العضو.
- حالة صدمة من الألم عند دخول الحمض إلى مساحة كبيرة ،
- في حالة ملامسة العين ، ضعف البصر ،
- - خلل وظيفي خطير في الكلى.
- فشل تنفسي ، اختناق ، ضيق تنفس ،
- تطور الغيبوبة.
تتطور عواقب مماثلة تدريجيًا اعتمادًا على درجة التسمم.
استنتاج
إذا اتبعت الاحتياطات وقواعد السلامة ، فسيصبح حمض الهيدروكلوريك مساعدًا لا غنى عنه في الحياة اليومية. ويمكنك شرائه بأفضل الأسعار المعقولة في شركتنا.
مثل الأحماض. يوفر البرنامج التعليمي لتحفيظ الطلاب أسماء وصيغ ستة ممثلين لهذه المجموعة. وبالنظر إلى الجدول الذي يوفره الكتاب المدرسي ، تلاحظ في قائمة الأحماض الذي يأتي أولاً ويهتم بك في المقام الأول - حمض الهيدروكلوريك. للأسف ، في الفصل الدراسي في المدرسة ، لا تتم دراسة الممتلكات أو أي معلومات أخرى عنها. لذلك ، فإن أولئك الذين يتوقون إلى اكتساب المعرفة خارج المناهج الدراسية يبحثون عن معلومات إضافية في جميع أنواع المصادر. لكن في كثير من الأحيان ، لا يجد الكثير المعلومات التي يحتاجونها. وهكذا فإن موضوع مقال اليوم مخصص لهذا الحمض المعين.
تعريف
حمض الهيدروكلوريك هو حمض أحادي القاعدة قوي. في بعض المصادر ، قد يطلق عليه الهيدروكلوريك والهيدروكلوريك ، وكذلك كلوريد الهيدروجين.
الخصائص الفيزيائية
إنه سائل كاوي عديم اللون ودخان في الهواء (الصورة على اليمين). ومع ذلك ، فإن الحمض التقني له لون مصفر بسبب وجود الحديد والكلور والمواد المضافة الأخرى فيه. أكبر تركيز له عند درجة حرارة 20 درجة مئوية هو 38٪. كثافة حمض الهيدروكلوريك بهذه المعلمات هي 1.19 جم / سم 3. لكن هذا المركب بدرجات متفاوتة من التشبع له بيانات مختلفة تمامًا.مع انخفاض التركيز ، تنخفض القيمة العددية للمولارية واللزوجة ونقطة الانصهار ، لكن السعة الحرارية المحددة ونقطة الغليان تزداد. إن تجمد حمض الهيدروكلوريك بأي تركيز يعطي هيدرات بلورية مختلفة.
الخواص الكيميائية
يمكن لجميع المعادن التي تأتي قبل الهيدروجين في السلسلة الكهروكيميائية لجهدها أن تتفاعل مع هذا المركب ، وتشكل الأملاح وتطلق غاز الهيدروجين. إذا تم استبدالها بأكاسيد معدنية ، فإن منتجات التفاعل ستكون ملحًا وماءًا قابلين للذوبان. سيكون نفس التأثير في تفاعل حمض الهيدروكلوريك مع الهيدروكسيدات. ومع ذلك ، إذا تمت إضافة أي ملح من المعادن (على سبيل المثال ، كربونات الصوديوم) إليها ، يتم أخذ بقاياها من حمض أضعف (كربوني) ، ثم كلوريد هذا المعدن (الصوديوم) والماء والغاز المقابل للحمض بقايا (في هذه الحالة ، ثاني أكسيد الكربون).
إيصال
يتكون المركب الذي تمت مناقشته الآن عندما يتم إذابة غاز كلوريد الهيدروجين ، والذي يمكن الحصول عليه عن طريق حرق الهيدروجين في الكلور ، في الماء. يسمى حمض الهيدروكلوريك ، الذي تم الحصول عليه باستخدام هذه الطريقة ، الاصطناعية. يمكن أن تعمل الغازات المنبعثة أيضًا كمصدر للحصول على هذه المادة. وسيطلق على حمض الهيدروكلوريك هذا اسم الغازات المنبعثة. في الآونة الأخيرة ، يكون مستوى إنتاج حمض الهيدروكلوريك باستخدام هذه الطريقة أعلى بكثير من إنتاجه بطريقة تركيبية ، على الرغم من أن الأخيرة تعطي المركب في شكل أنقى. هذه كلها طرق للحصول عليها في الصناعة. ومع ذلك ، في المختبرات ، يتم إنتاج حمض الهيدروكلوريك بثلاث طرق (يختلف الأولان فقط في درجة الحرارة ونواتج التفاعل) باستخدام أنواع مختلفة من التفاعلات الكيميائية ، مثل:
- تأثير حامض الكبريتيك المشبع على كلوريد الصوديوم عند 150 درجة مئوية.
- تفاعل المواد المذكورة أعلاه في ظل ظروف بدرجة حرارة 550 درجة مئوية وما فوق.
- التحلل المائي للألمنيوم أو كلوريد المغنيسيوم.
طلب
لا يمكن للمعادن المائية والتشكيل الكهربائي الاستغناء عن استخدام حمض الهيدروكلوريك ، عند الحاجة ، لتنظيف سطح المعادن أثناء القصدير واللحام والحصول على كلوريدات المنغنيز والحديد والزنك والمعادن الأخرى. في صناعة المواد الغذائية ، يُعرف هذا المركب باسم المضافات الغذائية E507 - هناك منظم حموضة ضروري لصنع ماء صودا. كما يوجد حمض الهيدروكلوريك المركز في العصارة المعدية لأي شخص ويساعد على هضم الطعام. خلال هذه العملية ، تنخفض درجة التشبع بسبب. هذه التركيبة مخففة بالطعام. ومع ذلك ، مع الصيام لفترات طويلة ، يزداد تركيز حمض الهيدروكلوريك في المعدة تدريجياً. وبما أن هذا المركب مادة كاوية للغاية ، فإنه يمكن أن يؤدي إلى قرحة في المعدة.
استنتاج
يمكن أن يكون حمض الهيدروكلوريك مفيدًا وضارًا للإنسان. يؤدي ملامسته للجلد إلى حروق كيميائية شديدة ، وتؤدي أبخرة هذا المركب إلى تهيج الجهاز التنفسي والعينين.
ولكن إذا تعاملت مع هذه المادة بعناية ، فقد تكون مفيدة أكثر من مرة