استغلال

في بطاريات تدفق الفاناديوم ، يتم توصيل كلا القطبين المرجعيين أيضًا بخزانات ومضخات التخزين بحيث يمكن تدوير كميات كبيرة جدًا من الإلكتروليت عبر الخلية. يعد تداول الإلكتروليت السائل أمرًا صعبًا إلى حد ما ويحد من استخدام بطاريات تدفق الفاناديوم في الصناعات التي تتطلب التنقل ، مما يجعلها فعالة في المباني الثابتة الكبيرة.
عندما يتم شحن بطارية الفاناديوم ، تتحول أيونات VO2 + الموجودة في القطب المرجعي الموجب الشحنة إلى أيونات VO2 + عندما يتم فصل الإلكترونات عن الطرف الموجب للبطارية. وبالمثل ، في القطب المرجعي السالب ، تقوم الإلكترونات بتحويل أيونات V3 + إلى V2 +. أثناء التفريغ ، تنعكس هذه العملية ، مما يعطي جهد دائرة مفتوحة يبلغ 1.41 فولت عند 25 درجة مئوية.
تشتمل الخصائص المفيدة الأخرى لبطاريات تدفق الفاناديوم على استجابة سريعة جدًا لتغييرات الحمل وقدرة تحميل زائدة عالية للغاية. أظهرت الأبحاث التي أجريت في جامعة نيو ساوث ويلز أنها تستطيع تحقيق أوقات استجابة أقل من نصف ميلي ثانية عند تغيرات الحمل بنسبة 100٪ وتحمل 400٪ من الحمل الزائد لأكثر من 10 ثوانٍ. وقت الاستجابة محدود في معظم الحالات بواسطة المعدات الكهربائية. تعمل بطاريات الفاناديوم القائمة على حمض الكبريتيك فقط في درجات حرارة تتراوح بين 10 و 40 درجة مئوية. إذا كانت درجة الحرارة أقل من هذا النطاق ، تتبلور أيونات حامض الكبريتيك. تظل الكفاءة في الحركة الترددية في الاستخدام اليومي عند مستوى 65-75٪.
ميزات الشحن والتفريغ
تعتمد خوارزميات الشحن بشكل مباشر على كيفية ترتيب البطارية ونوعها. على سبيل المثال ، يمكن لبعض البطاريات تجديد طاقتها بأمان من مصادر الجهد المستمر. يعمل الآخرون فقط مع مصدر حالي منظم يمكنه تغيير المعلمات اعتمادًا على مستوى الشحن.
قد تؤدي عملية الشحن المنظمة بشكل غير صحيح إلى إتلاف البطارية. في الحالات القصوى ، قد تشتعل البطارية أو تنفجر. يوجد بطاريات ذكية مزودة بأجهزة مراقبة الجهد. المعلمات الرئيسية التي يجب مراعاتها عند تشغيل البطاريات الجلفانية القابلة للعكس هي:
- فترة الحياة. حتى مع المناولة المناسبة ، فإن عدد دورات الشحن للبطارية محدود. لا تتلف أنظمة البطاريات المختلفة دائمًا للأسباب نفسها. ولكن بشكل عام ، فإن عمر البطارية مقيد بشكل أساسي بعدد دورات الشحن والتفريغ الكاملة ، وثانيًا بعمر خدمة التصميم دون الرجوع إلى كثافة الاستخدام.
- وقت الشحن. لا يعني التصميم الأساسي للبطارية الشحن بسرعة عالية بشكل عشوائي: ستؤدي المقاومة الداخلية للخلية الجلفانية إلى تحويل تيار الشحن الزائد إلى حرارة ، مما قد يؤدي إلى إتلاف الجهاز بشكل لا رجعة فيه. من وجهة نظر مادية ، فإن وقت الشحن مقيد بأقصى معدل انتشار للمادة الفعالة من خلال الإلكتروليت.بشكل مبسط ، يمكننا أن نفترض أن استعادة السعة الكاملة في ساعة واحدة هي مؤشر جيد.
- عمق التفريغ. محدد كنسبة مئوية من الطاقة المقدرة. يصف القدرة الصالحة للاستخدام. بالنسبة للأنواع المختلفة من البطاريات ، قد يختلف مستوى تفريغ التشغيل الموصى به. نظرًا للتغيرات في التشغيل أو التقادم ، يفقد مؤشر الحد الأقصى للعمق قيمته الأصلية.
عملية الانتشار.
نظرًا لعملية الانتشار ومحاذاة كثافة الإلكتروليت في تجويف علبة البطارية وفي مسام الكتلة النشطة للوحات ، يمكن الحفاظ على استقطاب القطب في البطارية عند إيقاف تشغيل الدائرة الخارجية.
يعتمد معدل الانتشار بشكل مباشر على درجة حرارة المنحل بالكهرباء ، فكلما ارتفعت درجة الحرارة ، زادت سرعة العملية ويمكن أن تختلف اختلافًا كبيرًا بمرور الوقت ، من ساعتين إلى يوم. أدى وجود مكونين من جهد القطب في ظروف عابرة إلى الانقسام إلى توازن وعدم توازن EMF للبطارية. يتأثر توازن EMF للبطارية بمحتوى وتركيز أيونات المواد الفعالة في الإلكتروليت ، فضلاً عن الخصائص الكيميائية والفيزيائية للمواد الفعالة. يتم لعب الدور الرئيسي في حجم المجال الكهرومغناطيسي من خلال كثافة المنحل بالكهرباء ولا تؤثر درجة الحرارة عليه عمليًا. يمكن التعبير عن اعتماد EMF على الكثافة بالصيغة:
بطارية emf لا تساوي جهد البطارية ، والذي يعتمد على وجود أو عدم وجود حمل على أطرافها.
admin25 / 07/2011
تعليق
اسم *
موقع
يستخدم هذا الموقع Akismet لمحاربة البريد العشوائي. اكتشف كيف تتم معالجة بيانات تعليقك.
«مقياس سرعة الدوران الميكانيكي
قوة البطارية "
العلامات
أعطال VAZ ، VAZ أجهزة الاستشعار حاقن الإشعال ، مخططات المبتدئين ، السيارات الكهربائية ، مزود الطاقة vaz 2110 gazelle gazelle business registrates car repair
مدخلات حديثة
- الحساسات في السيارة: الأنواع والغرض
- أكبر EDumper السيارة الكهربائية في العالم ،
- أضواء الليزر.
- مزايا وعيوب مصابيح الهالوجين
- الجهاز ومبدأ تشغيل مجسات وقوف السيارات
أرشيف
أرشيفات اختيار سبتمبر 2019 أغسطس 2017 يوليو 2017 يونيو 2017 مايو 2017 أبريل 2017 مارس 2017 ديسمبر 2016 نوفمبر 2016 أكتوبر 2016 سبتمبر 2016 سبتمبر 2016 أغسطس 2016 يوليو 2016 يونيو 2016 مايو 2016 أبريل 2016 مارس 2016 فبراير 2016 نوفمبر 2015 أكتوبر 2015 أغسطس 2015 يوليو 2015 يونيو 2015 مايو 2015 يناير 2015 ديسمبر 2014 نوفمبر 2014 أكتوبر 2014 سبتمبر 2014 أغسطس 2014 يوليو 2014 يونيو 2014 مايو 2014 أبريل 2014 فبراير 2014 يناير 2014 ديسمبر 2013 نوفمبر 2013 أكتوبر 2013 أغسطس 2013 يونيو 2013 مايو 2013 مارت سبتمبر 2012 ، 2013 ، 2012 ، 2012 ، 2012 ، 2012 ، 2012 ، 2012 ، 2011 ، 2012 ، 2011 ، 2012 ، 2011 ، 2011 ، 2011 ، 2011 ، 2011 ، 2011 ، 2011 ، 2011 ، 2011 ، 2011 ، 2011 ، 2011 ، 2011 ، 2011 ، 2011 ، 2011 ، 2011 ، 2011 ، سبتمبر 2012 ، 2011 ، 2011 ، 2011 ، 2011 ، 2011 ، 2011
التصنيفات
- بطارية المجمع
- فيديو
- مولد كهرباء
- مجسات
- التشخيص
- اشتعال
- الإخبارية
- ادوات
- الأجهزة
- بصلح
- ولاعة
- بداية
- مخطط
- الأجهزة
- سيارات كهربائية
- مزود الطاقة
نحن في الشبكات الاجتماعية
Auto Electrician @ جميع الحقوق محفوظة. عند نسخ مواد الموقع ، يجب عليك توفير رابط للموقع.
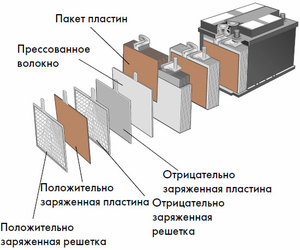
الجهاز ومبدأ العملية
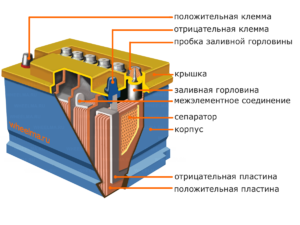
تحتوي كل خلية من هذه الخلايا على كاثود (قطب موجب) وأنود (سلبي). يتم فصل هذه الأقطاب بواسطة إلكتروليت يضمن تبادل الأيونات بينها. يتم اختيار مواد الإلكترود وتركيب الإلكتروليت لتوفير قوة دافعة كهربائية كافية بين أطراف البطارية.
نظرًا لأن الأقطاب الكهربائية تحتوي على إمكانات محدودة للطاقة الكيميائية ، فسيتم نفاد طاقة البطارية أثناء التشغيل. يسمى نوع الخلايا الجلفانية ، التي يتم تكييفها للتجديد بعد التفريغ الجزئي أو الكامل ، بالبطارية. مجموعة من هذه الخلايا المترابطة هي بطارية.تتضمن عملية البطارية تغييرًا دوريًا في حالتين:
- الشحن - تعمل البطارية كمستقبل للكهرباء ، داخل الخلايا تتحقق الطاقة الكهربائية في التغيرات الكيميائية.
- التفريغ - يعمل الجهاز كمصدر للتيار الكهربائي عن طريق تحويل طاقة التفاعلات الكيميائية إلى طاقة كهربائية.
مجالات الاستخدام
إن السعة الفائقة لبطاريات الأكسدة والاختزال من الفاناديوم تجعلها مناسبة تمامًا للاستخدام في الصناعات التي تتطلب تخزين طاقة عالية. على سبيل المثال ، المساعدة في تحقيق التوازن بين حجم إنتاج مصادر الطاقة مثل الرياح أو الطاقة الشمسية ، أو مساعدة المولدات على امتصاص الزيادات الكبيرة في الطاقة عند الحاجة ، أو موازنة العرض والطلب على الطاقة في المناطق النائية.
إن خصائص التفريغ الذاتي المحدودة لبطاريات الأكسدة والاختزال من الفاناديوم تجعلها مفيدة في الصناعات حيث يجب تخزين البطاريات لفترات طويلة مع الحد الأدنى من الصيانة والاستعداد. أدى ذلك إلى استخدامها في بعض أنواع الإلكترونيات العسكرية ، على سبيل المثال ، في مستشعرات نظام التعدين GATOR. إن قدرتها على الدوران والبقاء عند الصفر تجعلها مناسبة للتطبيقات والصناعات الشمسية حيث يجب أن تبدأ البطاريات يومها فارغًا وإعادة شحنها بناءً على الحمل والطقس. على سبيل المثال ، غالبًا ما تتعرض بطاريات أيونات الليثيوم للتلف عندما يُسمح لها بتفريغ أقل من 20٪ من حجمها ، لذا فهي تعمل غالبًا في نطاق 20 إلى 100٪ ، مما يعني أنه لا يمكنها استخدام سوى 20٪ من سعتها المقدرة.
كما أن وقت استجابتها السريع للغاية يجعلها لا غنى عنها عمليًا لإمدادات الطاقة غير المنقطعة ، حيث يمكن استخدامها بدلاً من بطاريات الرصاص الحمضية وحتى مولدات الديزل. كما أن وقت الاستجابة السريع يجعلها مناسبة للتحكم في التردد. في الوقت الحالي ، لا تعد UPS ولا إجراءات إدارة التردد فعالة من تلقاء نفسها ، ولكن من المحتمل أن تكون البطارية قادرة على العثور على تطبيقات في هذه الصناعات عند الاستفادة منها من مصادر مختلفة للتمويل. بالإضافة إلى ذلك ، تجعل هذه القدرات بطاريات الأكسدة والاختزال من الفاناديوم حلاً فعالاً "من قطعة واحدة" لشبكات الطاقة الصغيرة التي تعتمد على التشغيل الموثوق به ، والتحكم في التردد ، واحتياجات تبديل الأحمال (مثل الاختراق العالي لمصادر الطاقة المتجددة ، والأحمال شديدة التقلب ، أو الرغبة في تحسين كفاءة المولد عن طريق تغيير وقت الاستجابة).
أكبر بطاريات الأكسدة والاختزال من الفاناديوم العاملة
المحطة الفرعية "مينامي هياكيتا":
- تاريخ الإطلاق: ديسمبر 2015
- الطاقة: 60 ميغاواط ساعة
- الطاقة: 15 ميغاواط
- وقت العمل: 4 ساعات
- دولة: اليابان
نتن ، مقاطعة لياونينغ
- تاريخ الإطلاق: N / A
- الطاقة: 10 ميغاواط ساعة
- الطاقة: 5 ميغاواط
- وقت العمل: 2 ساعة
- دولة: الصين
مزرعة الرياح Tomamae
- تاريخ الإطلاق: 2005
- الطاقة: 6 ميغاواط ساعة
- القدرة: 4 ميغاواط
- وقت العمل: 1 ساعة و 30 دقيقة
- دولة: اليابان
مشروع Zhangbei
- تاريخ الإطلاق 2016
- الطاقة: 8 ميغاواط ساعة
- الطاقة: 2 ميغاواط
- وقت العمل: 4 ساعات.
- دولة: الصين
مشروع SnoPUD MESA 2
- تاريخ الإطلاق: مارس 2017
- الطاقة: 8 ميغاواط ساعة
- الطاقة: 2 ميغاواط
- وقت العمل: 4 ساعات.
- الدولة: الولايات المتحدة الأمريكية
محطة فرعية في إسكونديدو
- تاريخ الإطلاق: 2017
- الطاقة: 8 ميغاواط ساعة
- الطاقة: 2 ميغاواط
- وقت العمل: 4 ساعات.
- الدولة: الولايات المتحدة الأمريكية
محطة فرعية في بولمان ، واشنطن
- تاريخ الإطلاق: أبريل 2015
- الطاقة: 4 ميغاواط ساعة
- الطاقة: 1 ميغاواط
- وقت العمل: 4 ساعات
- الدولة: الولايات المتحدة الأمريكية
بحلول عام 2018 ، من المتوقع أن يتم الانتهاء من تطوير بطارية الأكسدة والفاناديوم في الصين. ستكون طاقتها 800 ميغاواط ، الطاقة - 200 ميغاواط ، ووقت التشغيل - 4 ساعات.
شروط
- متسلسلة - تتبع العناصر الواحدة تلو الأخرى.
- القوة الدافعة الكهربائية (EMF) هي الجهد المتولد عن بطارية أو قوة مغناطيسية وفقًا لقانون فاراداي.
- متوازي - يتم ترتيب المكونات الكهربائية بحيث يتدفق التيار على طول مسارين أو أكثر.
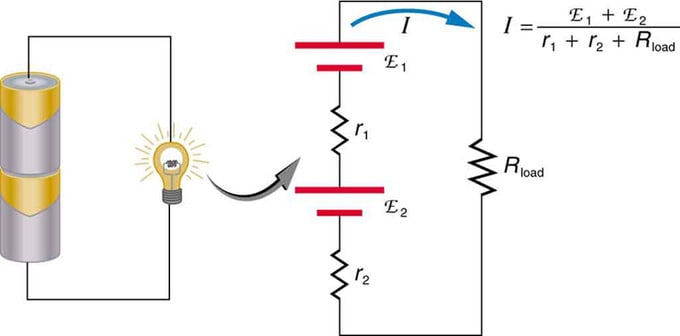
إذا كنت تستخدم مصادر جهد متعددة ، فيمكن توصيلها بالتسلسل أو بالتوازي. مع إصدار السلسلة ، يتم ضبطها في نفس الاتجاه ، ويتم دمج المقاومة الداخلية ، وتضاف القوة الدافعة الكهربائية جبريًا. الأنواع المماثلة شائعة في المصابيح اليدوية والألعاب ومجموعة متنوعة من الأجهزة الأخرى. يتم وضع الخلايا في سلسلة لزيادة إجمالي emf.
توصيل تسلسلي لمصدري جهد في نفس الاتجاه. يُظهر الرسم فانوسًا به خليتان ومصباح واحد
البطارية - توصيلات متعددة لعناصر الفولت. ولكن هناك عيبًا واحدًا في الاتصال المتسلسل ، حيث يتم إضافة المقاومة الداخلية. في بعض الأحيان هذا يخلق مشاكل. لنفترض أن لديك بطاريتين بقوة 6 فولت وضعتهما بدلاً من البطاريات المعتادة بجهد 12 فولت. نتيجة لذلك ، أضفت ليس فقط EMF ، ولكن أيضًا المقاومة الداخلية لكل بطارية.
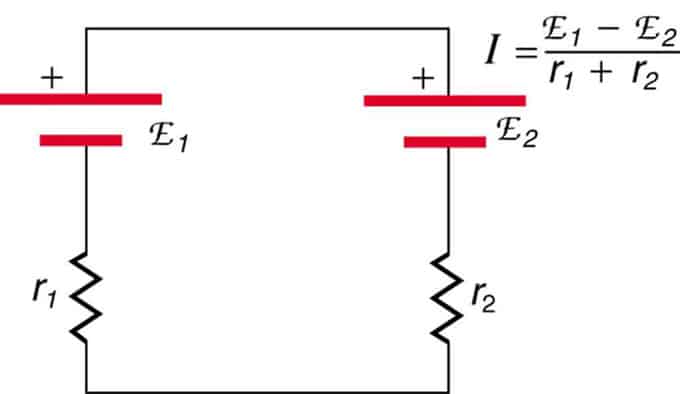
إذا كانت الخلايا موجودة في معارضة (واحدة تقع خلف الأخرى) ، فإن إجمالي emf سينخفض.
هذان مصدران للجهد متصلان في سلسلة بانبعاثات متعارضة. يتدفق التيار في اتجاه EMF الأكبر ويقتصر على مجموع المقاومة الداخلية. مثال على ذلك هو الشاحن. يجب أن يكون لديها emf أكثر من البطارية
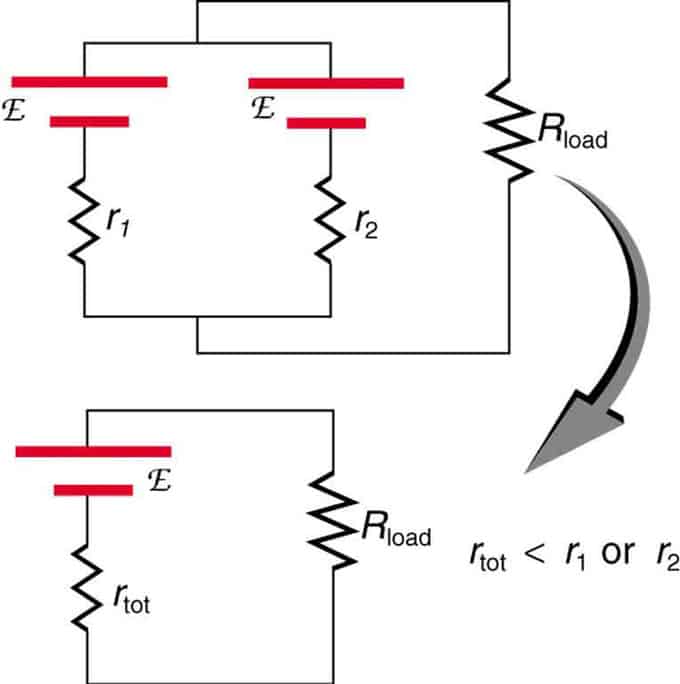
إذا كان هناك مصدران لهما نفس القوة الدافعة الكهربائية على التوازي ومتصلين بمقاومة الحمل ، فإن إجمالي EMF يظل هو نفسه مثل المصادر الفردية. ومع ذلك ، سيتم تقليل المقاومة الداخلية الإجمالية. اتضح أن النسخة المتوازية يمكن أن تولد المزيد من التيار.
يتم الجمع بين مصدرين للجهد مع EMF واحد في اتصال متوازي. إنهم يشكلون EMF واحدًا ، لكن لديهم مقاومة كلية أقل من الفردية. يتم استخدام مجموعات مماثلة إذا كنت بحاجة إلى تحقيق المزيد من الوقت الحالي.
| ملخص |
|
| اتصال متوازي ومتسلسل للمقاومات |
|
| قواعد كيرشوف |
|
| الفولتميتر والمقاييس |
|
| دوائر RC |
|
لمحة تاريخية
يرجع الفضل في تطوير أول خلية كلفانية إلى الفيزيائي الإيطالي أليساندرو فولتا. أجرى سلسلة من التجارب على الظواهر الكهروكيميائية خلال سبعينيات القرن الثامن عشر وحوالي عام 1800 ابتكر أول بطارية أطلق عليها معاصروه اسم "العمود الفولتية". يتكون الجهاز من أقراص متناوبة من الزنك والفضة مفصولة بطبقات من الورق أو القماش مبللة بمحلول هيدروكسيد الصوديوم.
أصبحت هذه التجارب أساس عمل مايكل فاراداي على القوانين الكمية للكيمياء الكهربية. وصف مبدأ تشغيل البطارية وبناءً على عمل العالم ، تم إنشاء أول خلايا كهربائية تجارية. بدا مزيد من التطور مثل هذا:
- في عام 1836 ، قدم الكيميائي البريطاني جون دانيال نموذجًا محسنًا للخلية ، يتكون من أقطاب من النحاس والزنك مغمورة في حمض الهيدروكلوريك. كان عنصر دانيال قادرًا على توفير جهد ثابت بكفاءة لا تضاهى أكثر من أجهزة فولت.
- 1839 أحرز الفيزيائي غروف مزيدًا من التقدم مع خليته المكونة من سائلين ، والتي تتكون من الزنك المغمور في حمض الكبريتيك المخفف في وعاء مسامي. يفصل الأخير حامض الكبريتيك من وعاء يحتوي على حامض النيتريك مع كاثود بلاتيني يوضع فيه. يعمل حمض النيتريك كعامل مؤكسد لمنع فقدان الجهد بسبب تراكم الهيدروجين عند الكاثود.استبدل الكيميائي الألماني روبرت بنسن البلاتين بكربون رخيص الثمن في خلية غروف وبالتالي شجع القبول الواسع لهذا النوع من البطاريات.
- في عام 1859 ، اخترع جاستون بلانت خلية حمض الرصاص ، ورائد بطارية السيارة الحديثة. كان جهاز بلانت قادرًا على إنتاج تيار كبير بشكل غير عادي ، ولكنه استخدم فقط للتجارب في المختبرات لما يقرب من عقدين من الزمن.
- 1895-1905 سنة. اختراع عناصر قلوية من النيكل والكادميوم والنيكل والحديد. هذا جعل من الممكن إنشاء أنظمة مع عدد كبير من دورات الشحن والتفريغ.
- منذ الثلاثينيات من القرن الماضي ، بدأ تطوير بطاريات الفضة والزنك والزئبق والزنك القلوية ، والتي وفرت كثافة طاقة عالية لكل وحدة وزن وحجم.
- منذ منتصف القرن العشرين ، أدى التقدم في تكنولوجيا التصنيع وظهور مواد جديدة إلى بطاريات أكثر قوة ومضغوطة. كان أبرزها إدخال بطاريات هيدريد الليثيوم والنيكل في السوق.
شحن البطاريات
مقالة مفصلة: شاحن
مع استنفاد الطاقة الكيميائية ، ينخفض الجهد والتيار وتتوقف البطارية عن العمل. يمكنك شحن البطارية (بطارية البطاريات) من أي مصدر تيار مستمر بجهد أعلى مع الحد من التيار. الأكثر شيوعًا هو تيار الشحن (بالأمبير) ، المتناسب مع 1/10 من السعة الاسمية المشروطة للبطارية (بساعات الأمبير).
ومع ذلك ، بناءً على الوصف الفني الموزع من قبل الشركات المصنعة للبطاريات الكهربائية المستخدمة على نطاق واسع (NiMH ، NiCd) ، يمكن افتراض أن وضع الشحن هذا ، يشار إليه عادةً باسم اساسي، يتم حسابها على أساس مدة يوم عمل من ثماني ساعات ، عندما تكون البطارية ، التي تم تفريغها في نهاية يوم العمل ، متصلة بشاحن التيار الكهربائي قبل بدء يوم عمل جديد. يتيح لك استخدام وضع الشحن هذا لهذه الأنواع من البطاريات ذات الاستخدام المنتظم الحفاظ على توازن الجودة والتكلفة في تشغيل المنتج. وبالتالي ، بناءً على اقتراح الشركة المصنعة ، لا يمكن استخدام هذا الوضع إلا لبطاريات النيكل والكادميوم وهيدريد معدن النيكل.
العديد من أنواع البطاريات لها قيود مختلفة يجب أخذها في الاعتبار أثناء الشحن والاستخدام اللاحق ، على سبيل المثال ، بطاريات NiMH حساسة للشحن الزائد ، وبطاريات الليثيوم حساسة للإفراط في الشحن والجهد ودرجة الحرارة. بطاريات NiCd و NiMH لها ما يسمى بتأثير الذاكرة ، والذي يتكون من انخفاض في السعة عند الشحن عندما لا يتم تفريغ البطارية تمامًا. أيضًا ، تتمتع هذه الأنواع من البطاريات بتفريغ ذاتي ملحوظ ، أي أنها تفقد الشحن تدريجيًا دون الاتصال بالحمل. لمكافحة هذا التأثير ، يمكن استخدام إعادة الشحن بالتنقيط.
طرق شحن البطارية
تستخدم عدة طرق لشحن البطاريات ؛ بشكل عام ، تعتمد طريقة الشحن على نوع البطارية.
- شحن بطيء للتيار المستمر
اشحن بتيار مباشر يتناسب مع 0.1-0.2 من السعة الاسمية المشروطة Q لحوالي 15-7 ساعات ، على التوالي.
طريقة الشحن الأطول والأكثر أمانًا. مناسب لمعظم أنواع البطاريات.
- شحن سريع
اشحن بتيار مباشر متناسب مع 1/3 Q لمدة 3-5 ساعات.
- الشحن المعجل أو "دلتا- V"
شحنة بتيار شحن أولي يتناسب مع السعة الاسمية الاسمية للبطارية ، حيث يتم قياس جهد البطارية باستمرار وينتهي الشحن بعد شحن البطارية بالكامل. مدة الشحن حوالي ساعة ونصف. يمكن أن ترتفع درجة حرارة البطارية بشكل مفرط بل ويمكن أن تدمرها.
- تهمة العكسي
يتم إجراؤه عن طريق تناوب نبضات الشحن الطويلة مع نبضات التفريغ القصيرة. الطريقة العكسية هي الأكثر فائدة لشحن بطاريات NiCd و NiMH ، والتي تتميز بما يسمى.ن. "تأثير الذاكرة".