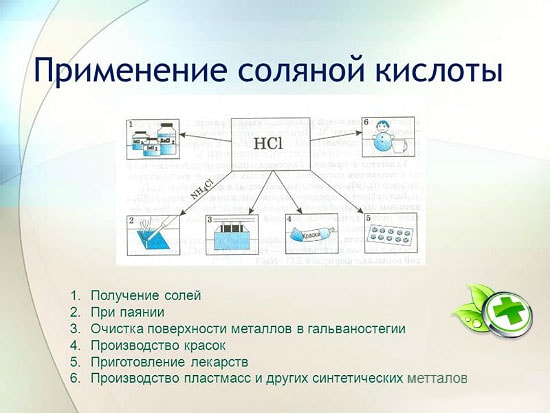
L'ús de l'àcid clorhídric
L'àcid clorhídric s'utilitza àmpliament a la indústria per extreure metalls de minerals, decapat de metalls, etc. També s'utilitza en la fabricació de líquids de soldadura, en la deposició de plata i com a part integral de l'aigua regia.
L'escala de l'ús de l'àcid clorhídric a la indústria és menor que la de l'àcid nítric. Això es deu al fet que l'àcid clorhídric provoca la corrosió dels equips d'acer. A més, els seus vapors volàtils són força nocius i també provoquen corrosió dels productes metàl·lics. Això s'ha de tenir en compte a l'hora d'emmagatzemar l'àcid clorhídric. L'àcid clorhídric s'emmagatzema i transporta en dipòsits i barrils revestits de cautxú, és a dir. en recipients, la superfície interior dels quals està coberta amb cautxú resistent als àcids, així com en ampolles de vidre i estris de polietilè.
L'àcid clorhídric s'utilitza per produir clorurs de zinc, manganès, ferro i altres metalls, així com clorur d'amoni. L'àcid clorhídric s'utilitza per netejar les superfícies de metalls, recipients, pous de carbonats, òxids i altres sediments i contaminants. En aquest cas, s'utilitzen additius especials: inhibidors que protegeixen el metall de la dissolució i la corrosió, però no retarden la dissolució d'òxids, carbonats i altres compostos similars.
L'HCl s'utilitza en la producció industrial de resines sintètiques, cautxús. S'utilitza com a matèria primera en la producció de clorur de metil a partir d'alcohol metílic, clorur d'etil d'etilè i clorur de vinil a partir d'acetilè.
Primers auxilis i mètodes de tractament
Si es troben signes d'intoxicació, cal trucar a una ambulància. A casa es permet realitzar activitats destinades a millorar l'estat de la víctima. Els primers auxilis per a la intoxicació per àcid clorhídric s'han de dur a terme ràpidament per reduir el risc de conseqüències negatives.
Esdeveniments:
- Si el compost de sal entra a la pell, les zones danyades es renten amb molta aigua freda. El temps de processament és d'almenys mitja hora.
- En cas d'intoxicació amb vapors, la víctima té accés a aire fresc, s'obren les finestres i es desbotona la roba ajustada.
- Es recomana controlar l'estat del pacient, en absència de signes de vida, es realitza la reanimació.
- La víctima dels vapors pot beure te calent, aigua. Es recomana esbandir el nas i la boca amb aigua freda.
- En cas d'una sobredosi derivada de la ingestió d'àcid, es col·loca una compresa de gel a l'abdomen per prevenir o reduir el possible sagnat.
- No s'admeten medicaments. Es permet donar al pacient un got d'aigua (pot mineral alcalina). Cal beure líquid a petits glops.
- No està permès rentar l'estómac, intentar provocar el vòmit a casa. Aquests primers auxilis poden provocar el desenvolupament de cremades a la gola, sagnat.
El tractament es porta a terme en una institució mèdica sota la supervisió d'especialistes.
Teràpia:
- Netejar l'estómac amb una sonda,
- Ús de comptagotes amb solucions medicinals,
- Prescripció de medicaments per alleujar el dolor
- L'ús de medicaments destinats a restaurar el funcionament d'òrgans i sistemes,
- Si cal, inhalació d'oxigen i ventilació artificial dels pulmons,
- Realització de teràpia de reanimació en absència de signes de vida,
- Selecció de vitamines i nutrició especial.
El tractament es porta a terme en cures intensives i després a l'hospital. La durada depèn de l'estat del pacient i del grau d'intoxicació.
Cremades i intoxicacions
Per eficaç que sigui aquest remei, és perillós. L'àcid clorhídric, depenent de la concentració, pot provocar cremades químiques de quatre graus:
- Només hi ha enrogiment i dolor.
- Hi ha butllofes amb un líquid clar i inflor.
- Necrosi formada de les capes superiors de la pell.Les butllofes s'omplen de sang o contingut ennuvolat.
- La lesió arriba als tendons i músculs.
Si la substància va entrar d'alguna manera als ulls, cal esbandir-los amb aigua i després amb una solució de refresc. Però en qualsevol cas, el primer que cal fer és trucar a una ambulància.
La ingestió d'àcid a l'interior està plena de dolors aguts al pit i l'abdomen, inflor de la laringe, vòmits de masses sagnants. Com a resultat, patologies greus del fetge i els ronyons.
I els primers signes d'enverinament en parelles inclouen una tos seca freqüent, sufocació, danys a les dents, ardor a les mucoses i dolor abdominal. El primer auxili d'emergència és el rentat i esbandit de la boca amb aigua, així com l'accés a l'aire fresc. Només un toxicòleg pot oferir una ajuda real.
Propietats de l'espectre químic
L'àcid interacciona amb molts metalls, sals. Es considera força fort i està a l'alçada de l'isard. La reacció principal es manifesta en tots els grups de metalls situats a l'esquerra de l'hidrogen (magnesi, ferro, zinc - potencials elèctrics).
La solució de clorur d'hidrogen en forma diluïda reacciona amb les sals, però només amb les formades per àcids menys forts. Coneguts per tots els carbonats de sodi i calci, després de la interacció amb ell, es descomponen en aigua i monòxid de carboni.
Àcid nítric
- una reacció qualitativa a la solució salina. Per obtenir-lo cal afegir nitrat de plata a aquest reactiu, com a resultat, es formarà un precipitat blanc, del qual s'obté una substància nitrogenada.
Amb l'ajuda d'aquesta barreja d'aigua i hidrogen es duen a terme molts experiments interessants. Per exemple, diluïu-lo amb amoníac. Com a resultat, obtindreu un fum blanc, gruixut, amb la consistència de petits cristalls. La metilamina, l'anilina, el diòxid de manganès, el carbonat de potassi són reactius que també es veuen afectats per l'àcid.
Com i per què s'utilitza
Potser, aquesta és amb raó una de les substàncies importants que es troben i són necessàries en gairebé totes les branques de la vida humana.
Localització de l'àrea d'aplicació:
- Metal·lúrgia. Neteja de superfícies de zones oxidades, dissolució d'òxid, tractament de presoldadura, estanyat. L'àcid clorhídric ajuda a extreure petites inclusions de metalls dels minerals. El zirconi i el titani s'obtenen mitjançant el mètode de conversió d'òxids en clorurs.
- Indústria de tecnologia alimentària. S'utilitza una solució de baixa concentració com a additiu alimentari. La gelatina, la fructosa per a diabètics contenen un emulsionant pur. La sosa normal també té un alt contingut d'aquesta substància. A l'embalatge de la mercaderia el veureu amb el nom E507.
- El camp de la medicina. Amb un indicador insuficient de l'ambient àcid a l'estómac i problemes amb els intestins. Ph baix condueix al càncer. Fins i tot amb una alimentació adequada, vitamines en abundància, el perill no desapareix, cal fer proves per obtenir suc del tracte gàstric, perquè en un ambient poc àcid, pràcticament no s'absorbeixen les substàncies útils, la digestió s'altera.
- La solució de sal s'utilitza com a inhibidor: protecció contra la brutícia i les infeccions, acció antisèptica. Per a la fabricació de mescles adhesives, productes ceràmics. Neteja els intercanviadors de calor.
- El procediment per purificar l'aigua potable tampoc no està complet sense la participació del clor.
- Producció de cautxú, blanqueig de bases de teixits.
- Pots cuidar les teves lents amb aquesta solució.
- Esbandida bucal a casa
- La substància és un excel·lent conductor de l'electricitat.
Com es produeix la intoxicació
L'àcid clorhídric és un líquid incolor amb una olor acre característica. Un dels àcids més forts, capaç de dissoldre alguns metalls. Es converteix fàcilment en un gas.
El clorur d'hidrogen s'utilitza en la indústria tèxtil, negocis de cuir, metal·lúrgia de metalls preciosos, en la producció de cola, àcids.
La substància està present a l'estómac en concentració mínima. L'àcid contribueix a la normalització del procés digestiu, protegeix el cos de bacteris i microorganismes nocius.
A una concentració superior al 24%, l'àcid clorhídric pot causar danys irreversibles al cos humà. Els vapors que es formen en contacte amb l'aire causen irritació als òrgans dels aparells visual i respiratori.
Hi ha diversos factors que poden provocar el desenvolupament d'intoxicació.
Factors:
La intoxicació per vapor és possible quan es treballa en habitacions amb poca ventilació,
Ingestió per negligència, més freqüent en nens,
L'entrada d'àcid clorhídric a l'epidermis, mucoses en cas d'incompliment de les normes d'ús del reactiu.
La intoxicació per una substància a la llar en adults es produeix com a conseqüència de l'ús sense equip de protecció de la pell, els ulls i els òrgans del sistema respiratori. La intoxicació pot ocórrer quan l'àcid es transfereix de manera imprecisa d'un recipient a un altre.
Farmacodinàmica i farmacocinètica
Què és l'acidesa gàstrica? Aquesta és una característica de la concentració d'àcid clorhídric a l'estómac. L'acidesa s'expressa en pH
. Normalment, l'àcid s'ha de produir en la composició del suc gàstric i participar activament en els processos de digestió. Fórmula de l'àcid clorhídric: HCl
. És produït per cèl·lules parietals situades a les glàndules fonòdiques, amb la participació de H+/K+-ATPasa
. Aquestes cèl·lules recobreixen el fons i el cos de l'estómac. L'acidesa del suc gàstric en si és variable i depèn del nombre de cèl·lules parietals i de la intensitat dels processos de neutralització de la substància pels components alcalins del suc gàstric. Concentració produïda a - vostè és estable i igual a 160 mmol/l. Una persona sana normalment no hauria de produir més de 7 i almenys 5 mmol d'una substància per hora.
Amb una producció insuficient o excessiva d'àcid clorhídric, es produeixen malalties del tracte digestiu, la capacitat d'absorbir certs microelements, com el ferro, es deteriora. El fàrmac estimula la secreció de suc gàstric, redueix pH
. S'activa pepsinogen
, el converteix en un enzim actiu pepsina
. La substància té un efecte beneficiós sobre el reflex àcid de l'estómac, retarda la transició dels aliments incompletament digerits als intestins. Els processos de fermentació del contingut de l'aparell digestiu s'alenteixen, el dolor i els erucs desapareixen, el ferro s'absorbeix millor.
Després de l'administració oral, el fàrmac es metabolitza parcialment per la saliva i el moc gàstric, el contingut del duodè 12. La substància no lligada penetra al duodè, on es neutralitza completament pel seu contingut alcalí.
Un altre ús de l'àcid a la vida quotidiana
Amb una composició àcida, podeu netejar fàcilment la calç i l'òxid de la fontaneria de façana, eliminar els pedres urinàries i altres contaminants. Per a un major efecte, s'afegeix un inhibidor (per exemple, urotropina) a l'agent, que alenteix la reacció química.
El procediment es realitza de la següent manera: l'àcid es dilueix amb aigua fins que s'aconsegueix una concentració del 5% i s'afegeix un inhibidor a raó de 0,5 g per 1 litre de líquid. La superfície es tracta amb la composició resultant i es deixa durant 30-40 minuts (segons el grau de contaminació), després dels quals es renta amb aigua.
També s'utilitza una solució àcida suau per eliminar les taques de baies, de tinta o d'òxid dels teixits. Per fer-ho, el material es remulla a la composició durant un temps, després s'esbandeix i es renta a fons de la manera habitual.
Desfer-se de l'escala a la tetera
Per a aquest propòsit, s'utilitza una solució d'àcid clorhídric al 3-5%, que s'aboca en una tetera i s'escalfa a 60-80°
C durant 1-2 hores o fins que els dipòsits de cal es desintegrin. Després d'això, l'escala es deixa anar i s'elimina fàcilment amb una espàtula de fusta.
L'eficàcia del mètode es deu al fet que el reactiu reacciona amb carbonats de magnesi i calci i els converteix en sals solubles. El diòxid de carboni alliberat al mateix temps destrueix la capa d'escala i la deixa anar. Després d'eliminar els dipòsits de sal, els plats es renten a fons amb aigua neta.
Punt important!
Aquest mètode no és adequat per a la descalcificació de bullidors d'alumini o d'esmalt trencat i esquerdat: això corroirà el metall i el danyarà greument.
Obtenció d'una substància
Ara podem parlar de què fan per formar àcid clorhídric.
En primer lloc, cremant hidrogen en clor, s'obté el component principal, el clorur d'hidrogen gasós. que després es dissol en aigua. El resultat d'aquesta reacció senzilla és la formació d'un àcid sintètic.
Aquesta substància també es pot obtenir a partir de gasos residuals. Aquests són gasos de residus químics (laterals). Estan formats per diferents processos. Per exemple, quan es cloren hidrocarburs. El clorur d'hidrogen en la seva composició s'anomena gas de sortida. I l'àcid així obtingut, respectivament.
Cal destacar que en els darrers anys la proporció de la substància emissió de gasos en el volum total de la seva producció ha anat augmentant. I l'àcid format com a conseqüència de la crema d'hidrogen en el clor es desplaça. Tanmateix, per ser justos, cal tenir en compte que conté menys impureses.
Ús de producció
Té una àmplia aplicació en la indústria metal·lúrgica, alimentària i mèdica.
- Metal·lúrgia. Ús en soldadura, estanyat i neteja de metalls.
- Industria alimentària. Aplicació en la producció de reguladors d'acidesa alimentària, per exemple, E507.
- Electrotipus. S'utilitza per decapat.
- Medicament. Troba la seva aplicació en la producció de suc gàstric artificial.
Inclòs en colorants sintètics. S'utilitza en la producció de productes de neteja i detergents. Però en líquids destinats a ús domèstic, la concentració d'àcid sulfúric és insignificant.
Com es produeix l'àcid clorhídric al laboratori
La producció de la substància és a gran escala, la venda és gratuïta. En les condicions dels experiments de laboratori, s'obté una solució per l'acció d'àcid sulfúric d'alta concentració sobre la sal de cuina normal (clorur de sodi).
Hi ha 2 mètodes per dissoldre el clorur d'hidrogen a l'aigua:
- L'hidrogen es crema en clor (sintètic).
- Associat (gass de sortida). La seva essència està en la realització de la cloració orgànica, la deshidrocloració.
La substància es presta bé a la síntesi durant la piròlisi dels residus d'organoclorats. Això passa com a conseqüència de la descomposició dels hidrocarburs amb una manca total d'oxigen. També podeu utilitzar clorurs metàl·lics, que són les matèries primeres de les substàncies inorgàniques. Si no hi ha àcid sulfúric concentrat (electròlit), prendre diluït.
Pel que fa a l'extracció del reactiu en condicions naturals, la majoria de les vegades aquesta mescla química es pot trobar a les aigües dels residus volcànics. El clorur d'hidrogen és un component dels minerals silvina (clorur de potassi, sembla ossos per als jocs), biscòfita. Tots aquests són mètodes per extreure la substància a la indústria.
En humans, aquest enzim es troba a l'estómac. Una solució pot ser un àcid o una base. Un dels mètodes d'extracció més comuns s'anomena sulfat.
Propietats químiques
Àcid clorhídric, clorur d'hidrogen o àcid clorhídric - solució HCl
a l'aigua. Segons la Viquipèdia, la substància pertany al grup dels inorgànics forts monobàsics to-t. El nom complet del compost en llatí: àcid clorhídric.
Fórmula de l'àcid clorhídric en química: HCl
. En una molècula, els àtoms d'hidrogen es combinen amb àtoms d'halogen - Cl
. Si tenim en compte la configuració electrònica d'aquestes molècules, es pot observar que els compostos participen en la formació d'orbitals moleculars. 1s
-orbitals d'hidrogen i tots dos 3s
i 3p
- orbitals d'un àtom Cl
. En la fórmula química de l'àcid clorhídric 1s-
, 3s-
i 3p
-els orbitals atòmics se superposen i formen 1, 2, 3 orbitals. On 3s
-orbital no és vinculant. Hi ha un desplaçament de la densitat electrònica cap a l'àtom Cl
i la polaritat de la molècula disminueix, però augmenta l'energia d'unió dels orbitals moleculars (si ho considerem juntament amb altres halurs d'hidrogen
).
Propietats físiques del clorur d'hidrogen. És un líquid clar i incolor que fuma quan s'exposa a l'aire. Massa molar d'un compost químic = 36,6 grams per mol. En condicions estàndard, a una temperatura de l'aire de 20 graus centígrads, la concentració màxima d'una substància és del 38% en pes. La densitat de l'àcid clorhídric concentrat en aquest tipus de solució és d'1,19 g/cm³. En general, propietats físiques i característiques com ara densitat, molaritat, viscositat, capacitat calorífica, punt d'ebullició i pH
, depenen molt de la concentració de la solució. Aquests valors es discuteixen amb més detall a la taula de densitats. Per exemple, la densitat de l'àcid clorhídric 10% = 1,048 kg per litre. Quan es solidifica, es forma la substància hidrats cristal·lins
diferents composicions.
Propietats químiques de l'àcid clorhídric. Amb què reacciona l'àcid clorhídric? La substància interacciona amb metalls que es troben davant de l'hidrogen en una sèrie de potencials electroquímics (ferro, magnesi, zinc i altres). En aquest cas, es formen sals i gasoses H
. El plom, el coure, l'or, la plata i altres metalls a la dreta de l'hidrogen no reaccionen amb l'àcid clorhídric. La substància reacciona amb òxids metàl·lics produint aigua i una sal soluble. Hidròxid de sodi sota l'acció de les formes i l'aigua. La reacció de neutralització és característica d'aquest compost.
L'àcid clorhídric diluït reacciona amb les sals metàl·liques, que estan formades per àcids més febles. Per exemple, àcid propiònic
més feble que la sal. La substància no reacciona amb àcids més forts. i carbonat de sodi
es formarà després de la reacció amb HCl
clorur, monòxid de carboni i aigua.
Per a un compost químic, les reaccions amb agents oxidants forts són característiques, amb diòxid de manganès
, permanganat de potassi
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. La substància reacciona amb amoníac
, que produeix un fum blanc espès, que consta de cristalls molt fins de clorur d'amoni. El mineral pirolusita també reacciona amb l'àcid clorhídric, ja que conté diòxid de manganès
: MnO2+4HCl=Cl2+MnO2+2H2O
(reacció d'oxidació).
Hi ha una reacció qualitativa a l'àcid clorhídric i les seves sals. Quan una substància interacciona amb nitrat de plata
un precipitat blanc clorur de plata
i format àcid nítric
. Equació de reacció d'interacció metilamina
amb clorur d'hidrogen té aquest aspecte: HCl + CH3NH2 = (CH3NH3)Cl
.
Una substància reacciona amb una base feble anilina
. Després de dissoldre l'anilina en aigua, s'afegeix àcid clorhídric a la mescla. Com a resultat, la base es dissol i es forma clorhidrat d'anilina
(clorur de fenilamoni
): (С6Н5NH3)Cl
. La reacció d'interacció del carbur d'alumini amb l'àcid clorhídric: Al4C3+12HCL=3CH4+4AlCl3
. Equació de reacció carbonat de potassi
amb el qual es veu així: K2CO3 + 2HCl = 2KCl + H2O + CO2.
Aplicació
en metal·lúrgia per a l'extracció de minerals, eliminació d'òxid, incrustacions, brutícia i òxids, soldadura i estanyat;
en la fabricació de cautxús i resines sintètiques;
en galvanoplastia;
com a regulador de l'acidesa en la indústria alimentària;
per obtenir clorurs metàl·lics;
per obtenir clor;
en medicina per al tractament de l'acidesa insuficient del suc gàstric;
com a netejador i desinfectant.
- (HCl), una solució aquosa de clorur d'hidrogen, un gas incolor d'olor picant. S'obté per l'acció de l'àcid sulfúric sobre la sal comuna, com a subproducte de la cloració d'hidrocarburs, o per la reacció de l'hidrogen i el clor. L'àcid clorhídric s'utilitza per a ... ... Diccionari enciclopèdic científic i tècnic
Àcid clorhídric
- - HCl (SC) (àcid clorhídric, àcid clorhídric, clorur d'hidrogen) és una solució de clorur d'hidrogen (HCl) en aigua, un additiu anticongelant. És un líquid incolor d'olor picant, sense partícules en suspensió. ... ... Enciclopèdia de termes, definicions i explicacions dels materials de construcció
ÀCID CLORHÍDRIC
- (àcid clorhídric) solució de clorur d'hidrogen en aigua; àcid fort. Un líquid incolor fumant a l'aire (l'àcid clorhídric tècnic és groguenc a causa de les impureses de Fe, Cl2, etc.). La concentració màxima (a 20 °C) és del 38% en massa, ... ... Gran Diccionari Enciclopèdic
ÀCID CLORHÍDRIC
- (Acidum muriaticum, Acid, hydrochloricum), una solució de clorur d'hidrogen (HC1) en aigua. A la natura, es troba a l'aigua de determinades fonts d'origen volcànic, i també es troba en el suc gàstric (fins a un 0,5%). El clorur d'hidrogen es pot obtenir... Big Medical Encyclopedia
ÀCID CLORHÍDRIC
- (àcid clorhídric, àcid clorhídric) un àcid volàtil monobàsic fort amb una olor picant, una solució aquosa de clorur d'hidrogen; la concentració màxima és del 38% en massa, la densitat d'aquesta solució és d'1,19 g/cm3. S'utilitza a ... ... Enciclopèdia russa de protecció laboral
ÀCID CLORHÍDRIC
- (àcid clorhídric) HCl solució aquosa de clorur d'hidrogen, àcid monobàsic fort, volàtil, amb una olor picant; impureses del ferro, el clor el taquen groguenc. El S. concentrat per vendre conté un 37% ... ... Gran Enciclopèdia Politècnica
àcid clorhídric
— substantiu, nombre de sinònims: 1 àcid (171) Diccionari de sinònims ASIS. V.N. Trishin. 2013 ... Diccionari de sinònims
ÀCID CLORHÍDRIC
Enciclopèdia Moderna
Àcid clorhídric
- ÀCID HIDROGÈNIC, solució aquosa de clorur d'hidrogen HCl; un líquid fumant amb una olor picant. L'àcid clorhídric s'utilitza per a l'obtenció de diversos clorurs, decapat de metalls, processament de minerals, en la producció de clor, sosa, cautxú, etc. ... ... Diccionari Enciclopèdic Il·lustrat
àcid clorhídric
- (àcid clorhídric), una solució de clorur d'hidrogen en aigua; àcid fort. Un líquid incolor "fumant" a l'aire (l'àcid clorhídric tècnic és groguenc a causa de les impureses de Fe, Cl2, etc.). Concentració màxima (a 20 °C) 38% en massa, ... ... Diccionari Enciclopèdic
Quin és el perill d'intoxicació
L'àcid clorhídric és un perill particular per al cos humà. En cas d'intoxicació amb aquesta substància, es poden produir complicacions greus i violacions de la funcionalitat del cos.
Complicacions:
- Violació del fetge, com a resultat de l'hepatitis tòxica,
- Sagnat a l'estómac a causa de les parets destruïdes de l'òrgan,
- Xoc del dolor quan l'àcid entra en una àrea gran,
- En cas de contacte amb els ulls, discapacitat visual,
- Mal funcionament greu dels ronyons,
- Insuficiència respiratòria, asfixia, dificultat per respirar,
- El desenvolupament d'un coma.
Conseqüències similars es desenvolupen gradualment segons el grau d'intoxicació.
Conclusió
Si seguiu les precaucions i normes de seguretat, l'àcid clorhídric es convertirà en un ajudant indispensable en la vida quotidiana. I pots comprar-lo als preus més assequibles de la nostra empresa.
Com els àcids. El programa educatiu preveu la memorització per part dels alumnes dels noms i fórmules de sis representants d'aquest col·lectiu. I, mirant la taula que ofereix el llibre de text, observeu a la llista d'àcids el que arriba primer i us interessa en primer lloc: l'àcid clorhídric. Per desgràcia, a l'aula de l'escola no s'estudia ni la propietat ni cap altra informació sobre aquesta. Per tant, els qui volen adquirir coneixements fora del currículum escolar busquen informació addicional en tota mena de fonts. Però sovint, molts no troben la informació que necessiten. I així el tema de l'article d'avui està dedicat a aquest àcid en particular.
Definició
L'àcid clorhídric és un àcid monobàsic fort. En algunes fonts, es pot anomenar clorhídric i clorhídric, així com clorur d'hidrogen.
Propietats físiques
És un líquid càustic incolor i fumant a l'aire (foto de la dreta). Tanmateix, l'àcid tècnic té un color groguenc a causa de la presència de ferro, clor i altres additius. La seva major concentració a una temperatura de 20 ° C és del 38%. La densitat de l'àcid clorhídric amb aquests paràmetres és d'1,19 g/cm 3 . Però aquest compost en diferents graus de saturació té dades completament diferents.Amb una disminució de la concentració, el valor numèric de la molaritat, la viscositat i el punt de fusió disminueixen, però augmenten la capacitat calorífica específica i el punt d'ebullició. La solidificació de l'àcid clorhídric de qualsevol concentració dóna diversos hidrats cristal·lins.
Propietats químiques
Tots els metalls que precedeixen l'hidrogen en la sèrie electroquímica del seu voltatge poden interactuar amb aquest compost, formant sals i alliberant gas hidrogen. Si se substitueixen per òxids metàl·lics, els productes de reacció seran sal soluble i aigua. El mateix efecte es produirà en la interacció de l'àcid clorhídric amb els hidròxids. Tanmateix, si s'hi afegeix alguna sal de metalls (per exemple, carbonat de sodi), el residu de la qual es va extreure d'un àcid més feble (carbònic), llavors el clorur d'aquest metall (sodi), l'aigua i el gas corresponent a l'àcid. es formen residus (en aquest cas, diòxid de carboni).
Rebut
El compost que ara es parla es forma quan el gas de clorur d'hidrogen, que es pot obtenir cremant hidrogen en clor, es dissol en aigua. L'àcid clorhídric, que es va obtenir mitjançant aquest mètode, s'anomena sintètic. Els gasos residuals també poden servir com a font per obtenir aquesta substància. I aquest àcid clorhídric s'anomenarà gas de sortida. Recentment, el nivell de producció d'àcid clorhídric mitjançant aquest mètode és molt superior al de la seva producció mitjançant un mètode sintètic, encara que aquest últim dóna el compost en una forma més pura. Totes aquestes són maneres d'aconseguir-ho a la indústria. Tanmateix, als laboratoris, l'àcid clorhídric es produeix de tres maneres (les dues primeres només difereixen en la temperatura i els productes de reacció) mitjançant diversos tipus d'interaccions químiques, com ara:
- Efecte de l'àcid sulfúric saturat sobre el clorur de sodi a una temperatura de 150 o C.
- La interacció de les substàncies anteriors en condicions amb una temperatura de 550 ° C i més.
- Hidròlisi de clorurs d'alumini o magnesi.
Aplicació
La hidrometal·lúrgia i l'electroconformació no poden prescindir de l'ús d'àcid clorhídric, on és necessari, per netejar la superfície dels metalls durant l'estanyat i la soldadura i per obtenir clorurs de manganès, ferro, zinc i altres metalls. A la indústria alimentària, aquest compost es coneix com a additiu alimentari E507: hi ha un regulador d'acidesa necessari per fer aigua de sosa. L'àcid clorhídric concentrat també es troba en el suc gàstric de qualsevol persona i ajuda a digerir els aliments. Durant aquest procés, el seu grau de saturació disminueix, perquè. aquesta composició es dilueix amb aliments. Tanmateix, amb el dejuni prolongat, la concentració d'àcid clorhídric a l'estómac augmenta gradualment. I com que aquest compost és molt càustic, pot provocar úlceres d'estómac.
Conclusió
L'àcid clorhídric pot ser beneficiós i perjudicial per als humans. El seu contacte amb la pell provoca l'aparició de cremades químiques greus, i els vapors d'aquest compost irriten les vies respiratòries i els ulls.
Però si maneges aquesta substància amb cura, pot ser útil més d'una vegada