Explotació

A les bateries de flux de vanadi, ambdós elèctrodes de referència es connecten addicionalment a tancs d'emmagatzematge i bombes de manera que es puguin circular volums molt grans d'electròlit per la cèl·lula. La circulació de l'electròlit líquid és una mica difícil i limita l'ús de bateries de flux de vanadi en indústries que requereixen mobilitat, fent-les efectives en grans edificis estacionaris.
Quan es carrega una bateria de vanadi, els ions VO2+ de l'elèctrode de referència carregat positivament es converteixen en ions VO2+ quan els electrons es desprenen del terminal positiu de la bateria. De la mateixa manera, a l'elèctrode de referència negatiu, els electrons converteixen els ions V3+ en V2+. Durant la descàrrega, aquest procés s'inverteix, donant una tensió de circuit obert d'1,41 V a 25 °C.
Altres propietats útils de les bateries de flux de vanadi inclouen una resposta molt ràpida als canvis de càrrega i una capacitat de sobrecàrrega extremadament alta. La investigació de la Universitat de Nova Gal·les del Sud ha demostrat que poden aconseguir temps de resposta de menys de mig mil·lisegon amb canvis de càrrega del 100% i suportar una sobrecàrrega del 400% durant més de 10 segons. El temps de resposta està en la majoria dels casos limitat per l'equip elèctric. Les bateries de vanadi a base d'àcid sulfúric només funcionen a temperatures de 10-40C. Si la temperatura és per sota d'aquest rang, els ions d'àcid sulfúric cristal·litzen. L'eficiència en el moviment alternatiu en l'ús quotidià es manté al nivell del 65-75%.
Característiques de càrrega i descàrrega
Els algorismes de càrrega depenen directament de com està disposada la bateria i de quin tipus pertany. Per exemple, algunes bateries poden omplir la seva capacitat de manera segura amb fonts de tensió constant. Altres només funcionen amb una font de corrent regulada que pot canviar els paràmetres en funció del nivell de càrrega.
Un procés de càrrega mal organitzat pot danyar la bateria. En casos extrems, la bateria pot encendre's o explotar. Hi ha bateries intel·ligents equipades amb dispositius de control de tensió. Els principals paràmetres que s'han de tenir en compte a l'hora de fer servir bateries galvàniques reversibles són:
- Esperança de vida. Fins i tot amb una manipulació adequada, el nombre de cicles de càrrega d'una bateria és limitat. Els diferents sistemes de bateries no sempre es desgasten pels mateixos motius. Però, en general, la durada de la bateria està limitada principalment pel nombre de cicles de càrrega-descàrrega complets i, en segon lloc, per la vida útil del disseny sense fer referència a la intensitat d'ús.
- Temps de càrrega. El disseny fonamental de la bateria no implica la càrrega a una velocitat arbitràriament alta: la resistència interna de la cèl·lula galvànica provocarà la conversió de l'excés de corrent de càrrega en calor, que pot danyar de manera irreversible el dispositiu. Des del punt de vista físic, el temps de càrrega està limitat per la velocitat màxima de difusió del material actiu a través de l'electròlit.De manera simplista, podem suposar que el restabliment de la capacitat total en una hora és un bon indicador.
- Profunditat de descàrrega. Especificat com a percentatge de la potència nominal. Descriu la capacitat útil. Per a diferents tipus de bateries, el nivell de descàrrega de funcionament recomanat pot variar. A causa de canvis en el funcionament o envelliment, l'indicador de profunditat màxima perd el seu valor original.
procés de difusió.
A causa del procés de difusió, l'alineació de la densitat d'electròlits a la cavitat de la caixa de la bateria i als porus de la massa activa de les plaques, la polarització de l'elèctrode es pot mantenir a la bateria quan el circuit extern està apagat.
La velocitat de difusió depèn directament de la temperatura de l'electròlit, com més alta és la temperatura, més ràpid té lloc el procés i pot variar molt en el temps, des de dues hores fins a un dia. La presència de dos components del potencial de l'elèctrode en condicions transitòries va provocar la divisió en EMF d'equilibri i no d'equilibri de la bateria. L'equilibri EMF de la bateria es veu afectat pel contingut i la concentració d'ions de substàncies actives a l'electròlit, així com per les propietats químiques i físiques de les substàncies actives. El paper principal en la magnitud de l'EMF el juga la densitat de l'electròlit i la temperatura pràcticament no l'afecta. La dependència de la CEM de la densitat es pot expressar amb la fórmula:
La fem de la bateria no és igual a la tensió de la bateria, que depèn de la presència o absència d'una càrrega als seus terminals.
admin25/07/2011
Un comentari
Nom *
Lloc
Aquest lloc utilitza Akismet per combatre el correu brossa. Descobriu com es processen les dades dels vostres comentaris.
« Tacòmetre mecànic
Tensió de la bateria »
Etiquetes
Avaries VAZ, VAZ Sensors Encesa Dispositius d'injecció Esquemes d'arrencada Cotxes elèctrics Font d'alimentació vaz 2110 gaselle gaselle registradors comercials reparació de cotxes
Entrades recents
- Sensors al cotxe: tipus i finalitat
- El cotxe elèctric més gran del món Edumper,
- Llums làser.
- Avantatges i desavantatges de les làmpades halògenes
- El dispositiu i el principi de funcionament dels sensors d'aparcament
Arxius
Arxius Selecció de setembre de 2019 agost 2017 JULIOL 2017 JUNY 2017 abril 2017 abril 2017 DESEMBRE 2016U 2016 OCTUBRE 2016 Setembre de 2016 agost 2016 JULIOL 2016 JUNY 2016 maig 2016 abril 2016 març 2016 febrer 2016 novembre de 2015 agost 2015 juliol de 2015 juny 2015 juny 2015 juny 2015 maig 2015 Gener 2015 Desembre 2014 Novembre 2014 Octubre 2014 Setembre 2014 Agost 2014 Juliol 2014 Juny 2014 Maig 2014 Abril 2014 Febrer 2014 Gener 2014 Desembre 2013 Novembre 2013 Octubre 2013 Agost 2013-03-2013 2012, 2012, 2011, 2012, 2011, 2012, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, Setembre de 2012, 2011, 2011, 2011, 2011, 2011, 2011
Categories
- Bateria acumuladora
- Vídeo
- Generador
- Sensors
- Diagnòstics
- Encesa
- Notícies
- Equipament
- Dispositius
- Reparació
- Bugia
- Arrancador
- Esquema
- Dispositius
- cotxes elèctrics
- Font d'alimentació
Estem a les xarxes socials
Electricista d'automòbils@ Tots els drets reservats. Quan copieu materials del lloc, heu de proporcionar un enllaç al lloc.
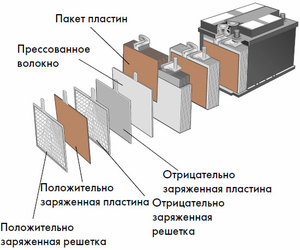
Dispositiu i principi de funcionament
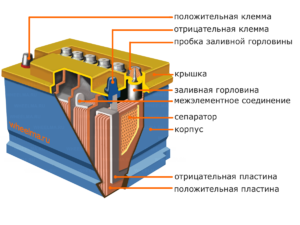
Cada cèl·lula té un càtode (elèctrode positiu) i un ànode (negatiu). Aquests elèctrodes estan separats per un electròlit que garanteix l'intercanvi d'ions entre ells. Els materials dels elèctrodes i la composició d'electròlits s'escullen per proporcionar força electromotriu suficient entre els terminals de la bateria.
Com que els elèctrodes contenen un potencial limitat d'energia química, la bateria s'esgotarà durant el funcionament. El tipus de cèl·lules galvàniques, que s'adapta a la reposició després d'una descàrrega parcial o completa, s'anomena bateria. Un conjunt d'aquestes cèl·lules interconnectades és una bateria.El funcionament de la bateria implica un canvi cíclic de dos estats:
- Càrrega: la bateria funciona com a receptor d'electricitat, dins de les cèl·lules l'energia elèctrica es realitza en canvis químics.
- Descàrrega: el dispositiu funciona com a font de corrent elèctric convertint l'energia de les reaccions químiques en energia elèctrica.
Àmbits d'ús
La característica d'alta capacitat de les bateries redox de vanadi les fa molt adequades per al seu ús en indústries que requereixen un alt emmagatzematge d'energia. Per exemple, ajudar a equilibrar el volum de producció d'aquestes fonts d'energia, com ara l'eòlica o solar, o ajudar els generadors a absorbir grans sobretensions quan sigui necessari, o equilibrar l'oferta i la demanda d'energia en zones remotes.
Les limitades característiques d'autodescàrrega de les bateries redox de vanadi les fan útils en indústries on les bateries s'han d'emmagatzemar durant llargs períodes de temps amb un manteniment i una preparació mínims. Això va provocar el seu ús en alguns tipus d'electrònica militar, per exemple, en els sensors del sistema miner GATOR. La seva capacitat de circular i mantenir-se a zero els fa aptes per a aplicacions solars i indústries on les bateries han de començar el dia buides i recarregar-se en funció de la càrrega i el clima. Per exemple, les bateries d'ions de liti sovint es fan malbé quan se'ls permet descarregar per sota del 20% del seu volum, de manera que sovint funcionen entre el 20 i el 100%, el que significa que només poden utilitzar el 20% de la seva capacitat nominal.
El seu temps de resposta extremadament ràpid també els fa pràcticament indispensables per a fonts d'alimentació ininterrompuda, on es poden utilitzar en lloc de bateries de plom-àcid i fins i tot generadors dièsel. També el temps de resposta ràpid els fa aptes per al control de freqüència. De moment, ni els SAI ni les mesures de gestió de freqüència són efectives per si soles, però és probable que la bateria pugui trobar aplicacions en aquestes indústries quan es capitalitzi de diverses fonts de finançament. A més, aquestes capacitats fan que les bateries redox de vanadi siguin una solució "d'una sola peça" eficaç per a xarxes elèctriques petites que depenen d'un funcionament fiable, control de freqüència i necessitats de canvi de càrrega (com ara una gran penetració de les energies renovables, càrregues molt fluctuants o el desig de optimitzar l'eficiència del generador amb canviant el temps de resposta).
Les bateries redox de vanadi més grans que funcionen
Subestació "Minami Hyakita":
- Data d'estrena: desembre de 2015
- Energia: 60 MWh
- Potència: 15 MW
- Temps de treball: 4 hores
- País: Japó
Stinky, província de Liaoning
- Data de llançament: N/A
- Energia: 10 MWh
- Potència: 5 MW
- Temps de treball: 2 hores
- País: Xina
Parc eòlic de Tomamae
- Data d'estrena: 2005
- Energia: 6 MWh
- Potència: 4 MW
- Temps de treball: 1 hora 30 minuts
- País: Japó
Projecte Zhangbei
- Data d'estrena 2016
- Energia: 8 MWh
- Potència: 2 MW
- Temps de treball: 4 hores.
- País: Xina
Projecte SnoPUD MESA 2
- Data d'estrena: març de 2017
- Energia: 8 MWh
- Potència: 2 MW
- Temps de treball: 4 hores.
- País: EUA
Subestació a Escondido
- Data d'estrena: 2017
- Energia: 8 MWh
- Potència: 2 MW
- Temps de treball: 4 hores.
- País: EUA
Subestació a Pullman, Washington
- Data d'estrena: abril de 2015
- Energia: 4 MWh
- Potència: 1 MW
- Temps de treball: 4 hores
- País: EUA
El 2018, s'espera que es completi el desenvolupament d'una bateria redox de vanadi a la Xina. La seva energia serà de 800 MWh, potència - 200 MW i temps de funcionament - 4 hores.
Termes
- Seqüencial: els elements se succeeixen un darrere l'altre.
- La força electromotriu (EMF) és la tensió generada per una bateria o força magnètica d'acord amb la llei de Faraday.
- Paral·lel: els components elèctrics estan disposats de manera que el corrent circula per dos o més camins.
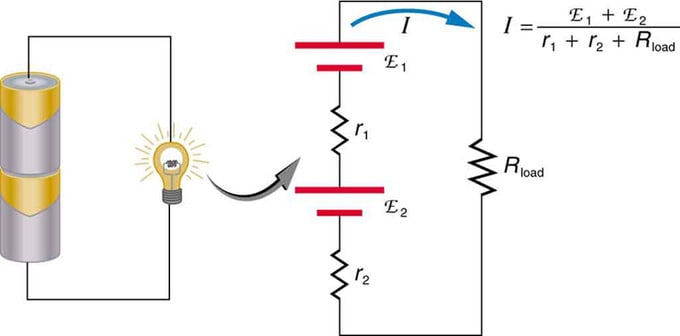
Si utilitzeu diverses fonts de tensió, es poden connectar en sèrie o en paral·lel. Amb la versió en sèrie, s'afinan en la mateixa direcció, la resistència interna s'incrementa i la força electromotriu s'afegeix algebraicament. Tipus similars són habituals en llanternes, joguines i una varietat d'altres aparells. Les cèl·lules es col·loquen en sèrie per augmentar la fem total.
Connexió en sèrie de dues fonts de tensió en la mateixa direcció. El diagrama mostra una llanterna amb dues cel·les i un llum
Bateria - connexió múltiple d'elements de volts. Però hi ha un inconvenient en la connexió en sèrie, ja que s'afegeixen resistències internes. De vegades això crea problemes. Suposem que teniu dues bateries de 6 V que poseu en comptes de les habituals de 12 V. Com a resultat, heu afegit no només l'EMF, sinó també la resistència interna de cada bateria.
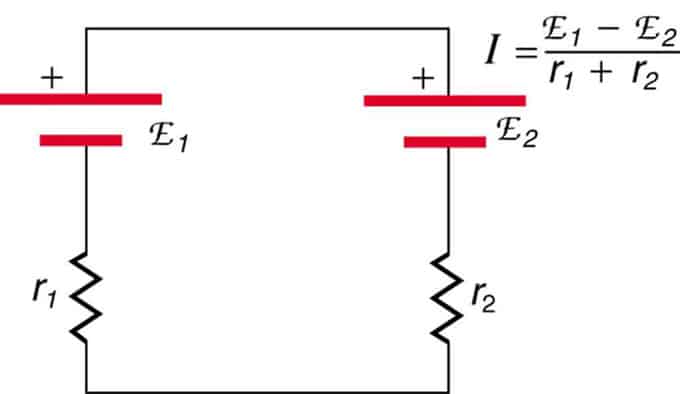
Si les cèl·lules es troben en oposició (una es troba darrere de l'altra), aleshores la fem total disminuirà.
Es tracta de dues fonts de tensió connectades en sèrie amb emissions oposades. El corrent flueix en la direcció de major EMF i està limitat per la suma de les resistències internes. Un exemple és un carregador. Ha de tenir més fem que la bateria
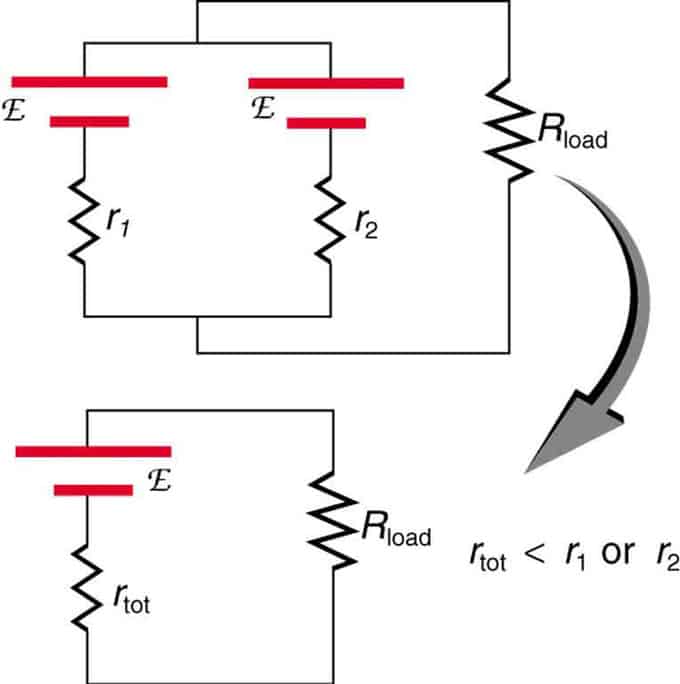
Si dues fonts amb la mateixa força electromotriu estan situades en paral·lel i connectades a la resistència de càrrega, aleshores la FEM total continua sent la mateixa que les individuals. Tanmateix, la resistència interna total es reduirà. Resulta que la versió paral·lela pot generar més corrent.
Dues fonts de tensió amb un sol EMF es combinen en paral·lel. Formen un EMF, però tenen menys resistència total que individualment. S'utilitzen combinacions similars si cal aconseguir més corrent.
| Visió general |
|
| Connexió en paral·lel i en sèrie de resistències |
|
| Kirchhoff governa |
|
| Voltímetres i amperímetres |
|
| Circuits RC |
|
Panoràmica històrica
El desenvolupament de la primera cèl·lula galvànica s'atribueix al físic italià Alessandro Volta. Va dur a terme una sèrie d'experiments amb fenòmens electroquímics durant la dècada de 1790 i cap al 1800 va crear la primera bateria, que els seus contemporanis van anomenar "columna voltaica". L'aparell consistia en discos alternats de zinc i plata separats per capes de paper o drap que s'han remullat en una solució d'hidròxid de sodi.
Aquests experiments es van convertir en la base del treball de Michael Faraday sobre les lleis quantitatives de l'electroquímica. Va descriure el principi de funcionament de la bateria i a partir del treball del científic es van crear les primeres cèl·lules elèctriques comercials. L'evolució posterior va ser així:
- El 1836, el químic britànic John Daniel va presentar un model millorat de la cèl·lula, format per elèctrodes de coure i zinc immersos en àcid clorhídric. L'element de Daniel era capaç de proporcionar una tensió constant d'una manera incomparablement més eficient que els dispositius de Volt.
- 1839 El físic Grove va fer més avenços amb la seva cèl·lula de dos fluids, formada per zinc submergit en àcid sulfúric diluït en un recipient porós. Aquest últim va separar l'àcid sulfúric d'un recipient que contenia àcid nítric amb un càtode de platí col·locat en ell. L'àcid nítric va servir com a agent oxidant per evitar la pèrdua de tensió a causa de l'acumulació d'hidrogen al càtode.El químic alemany Robert Bunsen va substituir el platí per carboni de baix cost a la cel·la Grove i així va promoure l'acceptació generalitzada d'aquest tipus de bateries.
- El 1859, Gaston Plante va inventar la cèl·lula de plom-àcid, la precursora de la bateria dels cotxes moderns. El dispositiu de Plante era capaç de produir un corrent inusualment gran, però només es va utilitzar per a experiments en laboratoris durant gairebé dues dècades.
- 1895-1905 anys. Invenció dels elements alcalins de níquel-cadmi i níquel-ferro. Això va permetre crear sistemes amb un nombre important de cicles de càrrega-descàrrega.
- Des de la dècada de 1930 es va iniciar el desenvolupament de piles alcalines de plata-zinc i mercuri-zinc, que proporcionaven una alta densitat d'energia per unitat de pes i volum.
- Des de mitjans del segle XX, els avenços en la tecnologia de fabricació i l'aparició de nous materials han donat lloc a bateries encara més potents i compactes. El més destacat va ser la introducció al mercat de bateries de níquel-hidrur metàl·lic i de liti.
Carregant bateries
Article principal: Carregador
A mesura que s'esgota l'energia química, la tensió i el corrent cauen i la bateria deixa de funcionar. Podeu carregar la bateria (bateria de les bateries) des de qualsevol font de corrent continu amb una tensió més alta limitant el corrent. El més habitual és el corrent de càrrega (en amperes), proporcional a 1/10 de la capacitat nominal condicional de la bateria (en amperes-hora).
No obstant això, a partir de la descripció tècnica distribuïda pels fabricants de bateries elèctriques àmpliament utilitzades (NiMH, NiCd), es pot suposar que aquest mode de càrrega, comunament conegut com a estàndard, es calcula a partir de la durada d'una jornada laboral de vuit hores, quan la bateria, descarregada al final de la jornada laboral, es connecta al carregador de xarxa abans de l'inici d'una nova jornada laboral. L'ús d'aquest mode de càrrega per a aquest tipus de bateries amb un ús sistemàtic permet mantenir un equilibri qualitat-cost en el funcionament del producte. Per tant, a proposta del fabricant, aquest mode només es pot utilitzar per a bateries de níquel-cadmi i níquel-hidrur metàl·lic.
Molts tipus de bateries tenen diferents limitacions que s'han de tenir en compte durant la càrrega i l'ús posterior, per exemple, les bateries de NiMH són sensibles a la sobrecàrrega, les bateries de liti són sensibles a la sobredescàrrega, el voltatge i la temperatura. Les bateries NiCd i NiMH tenen l'anomenat efecte memòria, que consisteix en una disminució de la capacitat quan es carrega quan la bateria no està completament descarregada. A més, aquest tipus de bateries tenen una notable autodescàrrega, és a dir, van perdent càrrega gradualment sense estar connectades a la càrrega. Per combatre aquest efecte, es pot utilitzar la recàrrega per degoteig.
Mètodes de càrrega de bateries
S'utilitzen diversos mètodes per carregar les bateries; En general, el mètode de càrrega depèn del tipus de bateria.
- Càrrega de CC lenta
Carregueu amb un corrent continu proporcional a 0,1-0,2 de la capacitat nominal condicional Q durant unes 15-7 hores, respectivament.
El mètode de càrrega més llarg i segur. Apte per a la majoria de tipus de bateries.
- càrrega ràpida
Carregueu amb corrent continu proporcional a 1/3 Q durant unes 3-5 hores.
- Càrrega accelerada o "delta-V".
Càrrega amb un corrent de càrrega inicial proporcional a la capacitat nominal nominal de la bateria, a la qual es mesura constantment la tensió de la bateria i la càrrega acaba després que la bateria estigui completament carregada. El temps de càrrega és d'aproximadament una hora i mitja. La bateria es pot sobreescalfar i fins i tot destruir-la.
- revertir la carga
Es realitza alternant polsos de càrrega llargs amb polsos de descàrrega curts. El mètode invers és més útil per carregar bateries NiCd i NiMH, que es caracteritzen per l'anomenada.n. "efecte memòria".