Brugen af saltsyre
Saltsyre bruges i vid udstrækning i industrien til at udvinde metaller fra malme, bejdsemetaller osv. Den bruges også til fremstilling af loddevæske, ved aflejring af sølv og som en integreret del af aqua regia.
Omfanget af brugen af saltsyre i industrien er mindre end salpetersyre. Dette skyldes, at saltsyre forårsager korrosion af ståludstyr. Derudover er dets flygtige dampe ret skadelige og forårsager også korrosion af metalprodukter. Dette skal tages i betragtning ved opbevaring af saltsyre. Saltsyre opbevares og transporteres i gummibeklædte tanke og tønder, dvs. i beholdere, hvis indre overflade er dækket med syrefast gummi, samt i glasflasker og polyethylenredskaber.
Saltsyre bruges til at fremstille chlorider af zink, mangan, jern og andre metaller samt ammoniumchlorid. Saltsyre bruges til at rense overfladerne på metaller, kar, brønde fra karbonater, oxider og andre sedimenter og forurenende stoffer. I dette tilfælde anvendes specielle tilsætningsstoffer - inhibitorer, der beskytter metallet mod opløsning og korrosion, men forsinker ikke opløsningen af oxider, carbonater og andre lignende forbindelser.
HCl bruges i industriel produktion af syntetiske harpikser, gummier. Det bruges som råmateriale til fremstilling af methylchlorid fra methylalkohol, ethylchlorid fra ethylen og vinylchlorid fra acetylen.
Førstehjælp og behandlingsmetoder
Hvis der konstateres tegn på forgiftning, skal en ambulance tilkaldes. Derhjemme er det tilladt at udføre aktiviteter, der har til formål at forbedre ofrets tilstand. Førstehjælp til saltsyreforgiftning bør udføres hurtigt for at mindske risikoen for negative konsekvenser.
Begivenheder:
- Hvis saltforbindelsen kommer på huden, vaskes de beskadigede områder med rigeligt køligt vand. Behandlingstiden er mindst en halv time.
- I tilfælde af forgiftning med dampe får offeret adgang til frisk luft, vinduer åbnes, stramt tøj knappes op.
- Det anbefales at overvåge patientens tilstand, i mangel af tegn på liv udføres genoplivning.
- Offeret fra dampene får lov til at drikke varm te, vand. Det anbefales at skylle næse og mund med koldt vand.
- I tilfælde af en overdosis som følge af indtagelse af syre, placeres en ispose på maven for at forhindre eller reducere mulig blødning.
- Ingen lægemidler er tilladt. Det er tilladt at give patienten et glas vand (du kan mineralsk alkalisk). Drikkevæske er påkrævet i små slurke.
- Det er ikke tilladt at vaske maven, prøv at fremkalde opkastning derhjemme. Sådan førstehjælp kan føre til udvikling af forbrændinger i halsen, blødning.
Behandling udføres i en medicinsk institution under tilsyn af specialister.
Terapi:
- Rens maven med en sonde,
- Brug af dråber med medicinske opløsninger,
- Udskrivning af medicin til at lindre smerter
- Brugen af medicin, der har til formål at genoprette funktionen af organer og systemer,
- Om nødvendigt iltindånding og kunstig ventilation af lungerne,
- Udførelse af genoplivningsterapi i fravær af tegn på liv,
- Udvalg af vitaminer og speciel ernæring.
Behandlingen udføres på intensiv og derefter på et hospital. Varigheden afhænger af patientens tilstand og graden af forgiftning.
Forbrændinger og forgiftning
Så effektivt som dette middel er, er det farligt. Saltsyre kan, afhængig af koncentrationen, forårsage kemiske forbrændinger på fire grader:
- Der er kun rødme og smerte.
- Der er blærer med en klar væske og hævelse.
- Dannet nekrose af de øverste lag af huden.Blærer fyldes med blod eller uklart indhold.
- Læsionen når sener og muskler.
Hvis stoffet på en eller anden måde kom ind i øjnene, er det nødvendigt at skylle dem med vand og derefter med en sodavandsopløsning. Men under alle omstændigheder er den første ting at gøre at ringe efter en ambulance.
Indtagelsen af syre indeni er fyldt med akutte smerter i brystet og maven, hævelse af strubehovedet, opkastning af blodige masser. Som et resultat, alvorlige patologier i leveren og nyrerne.
Og de første tegn på forgiftning i par omfatter en tør hyppig hoste, kvælning, beskadigelse af tænderne, svie i slimhinderne og mavesmerter. Den første nødhjælp er vask og mundskylning med vand, samt adgang til frisk luft. Kun en toksikolog kan give reel hjælp.
Egenskaber af det kemiske spektrum
Syre interagerer med mange metaller, salte. Den anses for ret stærk og er på niveau med gemser. Hovedreaktionen manifesterer sig i alle grupper af metaller placeret til venstre for brint (magnesium, jern, zink - elektriske potentialer).
Hydrogenchloridopløsning i fortyndet form reagerer med salte, men kun med dem, der dannes af mindre stærke syrer. Kendt af alle natrium- og calciumcarbonat, efter interaktion med det, nedbrydes de til vand og kulilte.
Salpetersyre
- en kvalitativ reaktion på saltvandsopløsning. For at opnå det er det nødvendigt at tilføje sølvnitrat til dette reagens, som et resultat vil der dannes et hvidt bundfald, hvorfra et nitrogenstof opnås.
Ved hjælp af denne blanding af vand og brint udføres mange interessante eksperimenter. Fortynd det for eksempel med ammoniak. Som et resultat vil du få hvid røg, tyk, med konsistensen af små krystaller. Methylamin, anilin, mangandioxid, kaliumcarbonat er reagenser, der også påvirkes af syre.
Hvordan og hvorfor bruges det
Måske er dette med rette et af de vigtige stoffer, der findes og er nødvendige i næsten alle grene af menneskelivet.
Anvendelsesområde lokalisering:
- Metallurgi. Overfladerensning fra oxiderede områder, rustopløsning, forloddebehandling, fortinning. Saltsyre hjælper med at udvinde små indeslutninger af metaller fra malme. Zirconium og titanium opnås ved hjælp af metoden til at omdanne oxider til chlorider.
- Fødevareteknologi industri. En lavkoncentrationsopløsning bruges som fødevaretilsætningsstof. Gelatine, fruktose til diabetikere indeholder en ren emulgator. Almindelig sodavand har også et højt indhold af dette stof. På emballagen af varer vil du se det under navnet E507.
- Medicinområdet. Med en utilstrækkelig indikator for det sure miljø i maven og problemer med tarmene. Lavt pH fører til kræft. Selv med korrekt ernæring, vitaminer i overflod, forsvinder faren ikke, det er nødvendigt at udføre tests for at få juice fra mavekanalen, for i et utilstrækkeligt surt miljø absorberes nyttige stoffer praktisk talt ikke, fordøjelsen er forstyrret.
- Saltopløsning bruges som en inhibitor - beskyttelse mod snavs og infektioner, antiseptisk virkning. Til fremstilling af klæbemiddelblandinger, keramiske produkter. Det skyller varmevekslere.
- Proceduren for rensning af drikkevand er heller ikke komplet uden deltagelse af klor.
- Produktion af gummi, blegning af stofunderlag.
- Du kan pleje dine linser med denne løsning.
- Mundskyl derhjemme
- Stoffet er en fremragende leder af elektricitet.
Hvordan forgiftning opstår
Saltsyre er en farveløs væske med en karakteristisk skarp lugt. En af de stærkeste syrer, der er i stand til at opløse nogle metaller. Bliver let til en gas.
Hydrogenchlorid bruges i tekstilindustrien, læderindustrien, metallurgi af ædle metaller, i produktionen af lim, syrer.
Stoffet er til stede i maven i minimal koncentration. Syre bidrager til normalisering af fordøjelsesprocessen, beskytter kroppen mod skadelige bakterier og mikroorganismer.
Ved en koncentration på over 24% kan saltsyre forårsage uoprettelig skade på menneskekroppen. Dampe dannet ved kontakt med luft forårsager irritation af organerne i syns- og åndedrætssystemerne.
Der er flere faktorer, der kan fremprovokere udviklingen af forgiftning.
Faktorer:
Dampforgiftning er mulig ved arbejde i rum med dårlig ventilation,
Indtagelse ved uagtsomhed, mere almindelig hos børn,
Indtrængen af saltsyre på epidermis, slimhinder i tilfælde af manglende overholdelse af reglerne for brug af reagenset.
Forgiftning af et stof i hjemmet hos voksne opstår som følge af brug uden beskyttelsesudstyr til hud, øjne og organer i åndedrætssystemet. Forgiftning kan opstå, når syre er unøjagtigt overført fra en beholder til en anden.
Farmakodynamik og farmakokinetik
Hvad er surhed i maven? Dette er karakteristisk for koncentrationen af saltsyre i maven. Surhed udtrykkes i pH
. Normalt skal syre produceres i sammensætningen af mavesaft og tage en aktiv del i fordøjelsesprocesserne. Formel for saltsyre: HCl
. Det er produceret af parietalceller placeret i fundic kirtlerne, med deltagelse af H+/K+-ATPase
. Disse celler beklæder fundus og krop i maven. Surheden af mavesaften i sig selv er variabel og afhænger af antallet af parietalceller og intensiteten af processerne til neutralisering af stoffet af de alkaliske komponenter i mavesaften. Koncentration produceret til - du er stabil og lig med 160 mmol/l. En rask person bør normalt ikke producere mere end 7 og mindst 5 mmol af et stof i timen.
Med utilstrækkelig eller overdreven produktion af saltsyre opstår sygdomme i fordøjelseskanalen, evnen til at absorbere visse mikroelementer, såsom jern, forringes. Lægemidlet stimulerer udskillelsen af mavesaft, reducerer pH
. Aktiverer pepsinogen
, omdanner det til et aktivt enzym pepsin
. Stoffet har en gavnlig effekt på syrerefleksen i maven, bremser overgangen af ufuldstændigt fordøjet mad ind i tarmene. Processerne med gæring af indholdet i fordøjelseskanalen bremses, smerte og bøvs forsvinder, jern absorberes bedre.
Efter oral administration metaboliseres lægemidlet delvist af spyt og maveslim, indholdet af duodenum 12. Det ubundne stof trænger ind i tolvfingertarmen, hvor det neutraliseres fuldstændigt af dets alkaliske indhold.
Endnu en brug af syre i hverdagen
Med en sur sammensætning kan du nemt rense kalk og rust fra fajance VVS, fjerne urinsten og andre forurenende stoffer. For en større effekt tilsættes en inhibitor (for eksempel urotropin) til midlet, som bremser den kemiske reaktion.
Fremgangsmåden udføres som følger: syren fortyndes med vand, indtil en koncentration på 5 % er nået, og en inhibitor tilsættes i en hastighed på 0,5 g pr. 1 liter væske. Overfladen behandles med den resulterende sammensætning og efterlades i 30-40 minutter (afhængig af graden af forurening), hvorefter den vaskes med vand.
En mild syreopløsning bruges også til at fjerne bærpletter, blæk eller rustpletter fra stoffer. For at gøre dette gennemblødes materialet i sammensætningen i et stykke tid, hvorefter det skylles grundigt og vaskes på den sædvanlige måde.
At komme af med kalk i elkedlen
Til dette formål anvendes en 3-5% saltsyreopløsning, som hældes i en kedel og opvarmes til 60-80°
C i 1-2 timer eller indtil kalkaflejringer går i opløsning. Herefter løsner skalaen sig og fjernes let med en træspatel.
Metodens effektivitet skyldes det faktum, at reagenset reagerer med magnesium- og calciumcarbonater og omdanner dem til opløselige salte. Den samtidig frigivne kuldioxid ødelægger skællaget og gør det løst. Efter fjernelse af saltaflejringer vaskes opvasken grundigt med rent vand.
Vigtigt punkt!
Denne metode er ikke egnet til afkalkning af skårede og revnede emalje- eller aluminiumkedler: dette vil korrodere metallet og forårsage alvorlig skade.
At få et stof
Nu kan vi tale om, hvad de gør for at danne saltsyre.
Først ved at brænde brint i klor opnås hovedkomponenten, gasformigt hydrogenchlorid. som derefter opløses i vand. Resultatet af denne simple reaktion er dannelsen af en syntetisk syre.
Dette stof kan også fås fra afgangsgasser. Disse er kemiske affaldsgasser (side)gasser. De er dannet af en række forskellige processer. For eksempel ved chlorering af kulbrinter. Hydrogenchloridet i deres sammensætning kaldes afgangsgas. Og den således opnåede syre hhv.
Det skal bemærkes, at i de senere år har afgangsgasstoffets andel af den samlede mængde af dets produktion været stigende. Og syren, der dannes som følge af afbrænding af brint i klor, fortrænges. Men retfærdigvis skal det bemærkes, at det indeholder færre urenheder.
Produktionsbrug
Det har en bred anvendelse i den metallurgiske, fødevare- og medicinske industri.
- Metallurgi. Anvendes til lodning, fortinning og rengøring af metaller.
- Fødevareindustri. Anvendelse i produktionen af surhedsregulerende midler til fødevarer, for eksempel E507.
- Elektrotype. Anvendes til syltning.
- Medicin. Det finder sin anvendelse i produktionen af kunstig mavesaft.
Inkluderet i syntetiske farvestoffer. Det bruges til fremstilling af rengørings- og rengøringsmidler. Men i væsker beregnet til husholdningsbrug er koncentrationen af svovlsyre ubetydelig.
Hvordan saltsyre fremstilles i laboratoriet
Produktionen af stoffet er storstilet, salget er gratis. Under laboratorieforsøg fremstilles en opløsning ved indvirkning af svovlsyre med høj koncentration på almindeligt køkkensalt (natriumchlorid).
Der er 2 metoder til at opløse hydrogenchlorid i vand:
- Brint forbrændes i klor (syntetisk).
- Tilknyttet (afgangsgas). Dens essens er at udføre organisk chlorering, dehydrochlorering.
Stoffet egner sig godt til syntese under pyrolysen af affald fra organochlor. Dette sker som følge af nedbrydning af kulbrinter med fuldstændig iltmangel. Du kan også bruge metalklorider, som er råvarerne til uorganiske stoffer. Hvis der ikke er koncentreret svovlsyre (elektrolyt), tages fortyndet.
Hvad angår udvindingen af reagenset under naturlige forhold, kan denne kemiske blanding oftest findes i vandet i vulkansk affald. Hydrogenchlorid er en bestanddel af mineralerne sylvin (kaliumchlorid, ligner knogler til spil), bischofit. Alle disse er metoder til at udvinde stoffet i industrien.
Hos mennesker findes dette enzym i maven. En opløsning kan enten være en syre eller en base. En af de mest almindelige metoder til udvinding kaldes sulfat.
Kemiske egenskaber
Saltsyre, hydrogenchlorid eller saltsyre - opløsning HCl
i vand. Ifølge Wikipedia tilhører stoffet gruppen af uorganiske stærke monobasiske to-t. Det fulde navn på forbindelsen på latin: saltsyre.
Formel for saltsyre i kemi: HCl
. I et molekyle kombinerer brintatomer med halogenatomer - Cl
. Hvis vi betragter den elektroniske konfiguration af disse molekyler, kan det bemærkes, at forbindelser deltager i dannelsen af molekylære orbitaler 1s
-brint orbitaler og begge dele 3s
og 3 s
- et atoms orbitaler Cl
. I den kemiske formel for saltsyre 1s-
, 3s-
og 3r
-atomare orbitaler overlapper hinanden og danner 1, 2, 3 orbitaler. Hvori 3s
-orbital er ikke bindende. Der sker en forskydning af elektrondensiteten til atomet Cl
og molekylets polaritet falder, men molekylære orbitalers bindingsenergi stiger (hvis vi betragter det sammen med andre hydrogenhalogenider
).
Fysiske egenskaber af hydrogenchlorid. Det er en klar, farveløs væske, der ryger, når den udsættes for luft. Molær masse af en kemisk forbindelse = 36,6 gram pr. mol. Under standardforhold, ved en lufttemperatur på 20 grader Celsius, er den maksimale koncentration af et stof 38 vægt%. Densiteten af koncentreret saltsyre i denne type opløsning er 1,19 g/cm³. Generelt fysiske egenskaber og karakteristika såsom massefylde, molaritet, viskositet, varmekapacitet, kogepunkt og pH
, stærkt afhængig af koncentrationen af opløsningen. Disse værdier er diskuteret mere detaljeret i tabellen over tætheder. For eksempel densiteten af saltsyre 10% = 1,048 kg pr. liter. Når stoffet er størknet, dannes det krystallinske hydrater
forskellige sammensætninger.
Kemiske egenskaber af saltsyre. Hvad reagerer saltsyre med? Stoffet interagerer med metaller, der står foran brint i en række elektrokemiske potentialer (jern, magnesium, zink og andre). I dette tilfælde dannes salte og gasformige H
. Bly, kobber, guld, sølv og andre metaller til højre for brint reagerer ikke med saltsyre. Stoffet reagerer med metaloxider og danner vand og et opløseligt salt. Natriumhydroxid under påvirkning af til-dig-former og vand. Neutraliseringsreaktionen er karakteristisk for denne forbindelse.
Fortyndet saltsyre reagerer med metalsalte, som dannes af svagere syrer. For eksempel, propionsyre
svagere end salt. Stoffet reagerer ikke med stærkere syrer. og natriumcarbonat
vil dannes efter reaktion med HCl
chlorid, kulilte og vand.
For en kemisk forbindelse er reaktioner med stærke oxidationsmidler karakteristiske, med mangandioxid
, kaliumpermanganat
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. Stoffet reagerer med ammoniak
, som producerer tyk hvid røg, som består af meget fine krystaller af ammoniumchlorid. Mineralet pyrolusit reagerer også med saltsyre, da det indeholder mangandioxid
: MnO2+4HCl=Cl2+MnO2+2H2O
(oxidationsreaktion).
Der er en kvalitativ reaktion på saltsyre og dens salte. Når et stof interagerer med sølvnitrat
et hvidt bundfald sølvklorid
og dannet salpetersyre
. Interaktionsreaktionsligning methylamin
med hydrogenchlorid ser sådan ud: HCl + CH3NH2 = (CH3NH3)Cl
.
Et stof reagerer med en svag base anilin
. Efter opløsning af anilin i vand tilsættes saltsyre til blandingen. Som et resultat opløses basen og dannes anilinhydrochlorid
(phenylammoniumchlorid
): (С6Н5NH3)Cl
. Reaktionen af interaktion af aluminiumcarbid med saltsyre: Al4C3+12HCL=3CH4+4AlCl3
. Reaktionsligning kaliumcarbonat
hvormed det ser sådan ud: K2CO3 + 2HCl = 2KCl + H2O + CO2.
Ansøgning
inden for metallurgi til udvinding af malme, fjernelse af rust, kedelsten, snavs og oxider, lodning og fortinning;
ved fremstilling af syntetisk gummi og harpiks;
i galvanisering;
som surhedsregulerende middel i fødevareindustrien;
for at opnå metalchlorider;
for at opnå klor;
i medicin til behandling af utilstrækkelig surhed af mavesaft;
som rengørings- og desinfektionsmiddel.
- (HCl), en vandig opløsning af hydrogenchlorid, en farveløs gas med en skarp lugt. Opnået ved virkningen af svovlsyre på almindeligt salt, som et biprodukt ved chlorering af kulbrinter eller ved reaktion af hydrogen og klor. Saltsyre bruges til ... ... Videnskabelig og teknisk encyklopædisk ordbog
Saltsyre
- - HCl (SC) (saltsyre, saltsyre, hydrogenchlorid) er en opløsning af hydrogenchlorid (HCl) i vand, et frostvæsketilsætningsstof. Det er en farveløs væske med en skarp lugt uden suspenderede partikler ... ... Encyklopædi med termer, definitioner og forklaringer af byggematerialer
SALTSYRE
- (saltsyre) opløsning af hydrogenchlorid i vand; stærk syre. En farveløs væske, der ryger i luften (teknisk saltsyre er gullig på grund af urenheder af Fe, Cl2 osv.). Den maksimale koncentration (ved 20 ° C) er 38 % efter masse, ... ... Big Encyclopedic Dictionary
SALTSYRE
- (Acidum muriaticum, Acid, hydrochloricum), en opløsning af hydrogenchlorid (HC1) i vand. I naturen forekommer det i vandet af visse kilder af vulkansk oprindelse og findes også i mavesaft (op til 0,5%). Hydrogenchlorid kan fås ... Big Medical Encyclopedia
SALTSYRE
- (saltsyre, saltsyre) en stærk monobasisk flygtig syre med en skarp lugt, en vandig opløsning af hydrogenchlorid; den maksimale koncentration er 38% efter masse, densiteten af en sådan opløsning er 1,19 g/cm3. Brugt i ... ... russisk encyklopædi om arbejdsbeskyttelse
SALTSYRE
- (saltsyre) HCl vandig opløsning af hydrogenchlorid, stærk monobasisk syre, flygtig, med en skarp lugt; urenheder af jern, klor pletter det gulligt. Den koncentrerede S. at sælge indeholder 37% ... ... Big Polytechnic Encyclopedia
saltsyre
— navneord, antal synonymer: 1 syre (171) ASIS Synonymordbog. V.N. Trishin. 2013 ... Synonymordbog
SALTSYRE
Moderne Encyklopædi
Saltsyre
- HYDROGENSYRE, vandig opløsning af hydrogenchlorid HCl; en rygende væske med en skarp lugt. Saltsyre bruges til at opnå forskellige chlorider, bejdsemetaller, forarbejdning af malme, til fremstilling af klor, sodavand, gummi osv. ... ... Illustrated Encyclopedic Dictionary
saltsyre
- (saltsyre), en opløsning af hydrogenchlorid i vand; stærk syre. En farveløs væske "røgende" i luften (teknisk saltsyre er gullig på grund af urenheder af Fe, Cl2 osv.). Maksimal koncentration (ved 20 ° C) 38 % efter masse, ... ... Encyclopedic Dictionary
Hvad er faren for beruselse
Saltsyre er en særlig fare for den menneskelige krop. I tilfælde af forgiftning med et sådant stof kan alvorlige komplikationer og krænkelser af kroppens funktionalitet udvikle sig.
Komplikationer:
- Krænkelse af leveren som følge af giftig hepatitis,
- Blødning i maven på grund af de ødelagte vægge i organet,
- Chok fra smerte, når syre trænger ind i et stort område,
- I tilfælde af kontakt med øjnene, synsnedsættelse,
- Alvorlig funktionsfejl i nyrerne,
- Åndedrætssvigt, kvælning, åndenød,
- Udviklingen af koma.
Lignende konsekvenser udvikler sig gradvist afhængigt af graden af forgiftning.
Konklusion
Hvis du følger forholdsreglerne og sikkerhedsreglerne, vil saltsyre blive en uundværlig assistent i hverdagen. Og du kan købe det til de mest overkommelige priser i vores virksomhed.
Ligesom syrer. Uddannelsesprogrammet sørger for, at eleverne husker navne og formler på seks repræsentanter for denne gruppe. Og ser du gennem tabellen i lærebogen, bemærker du i listen over syrer den, der kommer først og interesserede dig i første omgang - saltsyre. Ak, i klasseværelset på skolen studeres hverken ejendommen eller andre oplysninger om den. Derfor leder de, der er ivrige efter at få viden uden for skolens pensum, efter yderligere information i alle mulige kilder. Men ofte finder mange ikke den information, de har brug for. Og så emnet for dagens artikel er dedikeret til netop denne syre.
Definition
Saltsyre er en stærk monobasisk syre. I nogle kilder kan det kaldes saltsyre og saltsyre samt hydrogenchlorid.
Fysiske egenskaber
Det er en farveløs og rygende kaustisk væske i luften (foto til højre). Teknisk syre har dog en gullig farve på grund af tilstedeværelsen af jern, klor og andre tilsætningsstoffer i den. Dens største koncentration ved en temperatur på 20 ° C er 38%. Densiteten af saltsyre med sådanne parametre er 1,19 g/cm 3 . Men denne forbindelse i varierende grad af mætning har helt andre data.Med et fald i koncentrationen falder den numeriske værdi af molaritet, viskositet og smeltepunkt, men den specifikke varmekapacitet og kogepunkt stiger. Størkning af saltsyre af enhver koncentration giver forskellige krystallinske hydrater.
Kemiske egenskaber
Alle metaller, der kommer før brint i den elektrokemiske serie af deres spænding, kan interagere med denne forbindelse, danne salte og frigive brintgas. Hvis de erstattes af metaloxider, vil reaktionsprodukterne være opløseligt salt og vand. Den samme effekt vil være i samspillet mellem saltsyre og hydroxider. Hvis der imidlertid tilsættes et salt af metaller (f.eks. natriumcarbonat), hvis rest blev taget fra en svagere syre (kulsyre), så chlorid af dette metal (natrium), vand og gas svarende til syren der dannes rester (i dette tilfælde kuldioxid).
Kvittering
Den nu omtalte forbindelse dannes, når hydrogenchloridgas, som kan opnås ved at brænde brint i klor, opløses i vand. Saltsyre, som blev opnået ved hjælp af denne metode, kaldes syntetisk. Afgangsgasser kan også tjene som en kilde til at opnå dette stof. Og sådan saltsyre vil blive kaldt off-gas. For nylig er niveauet for produktion af saltsyre ved hjælp af denne metode meget højere end dets produktion ved en syntetisk metode, selvom sidstnævnte giver forbindelsen i en renere form. Disse er alle måder at få det i industrien. Men i laboratorier produceres saltsyre på tre måder (de to første adskiller sig kun i temperatur og reaktionsprodukter) ved hjælp af forskellige typer kemiske interaktioner, såsom:
- Virkning af mættet svovlsyre på natriumchlorid ved en temperatur på 150 o C.
- Interaktionen mellem ovennævnte stoffer under forhold med en temperatur på 550 ° C og derover.
- Hydrolyse af aluminium- eller magnesiumchlorider.
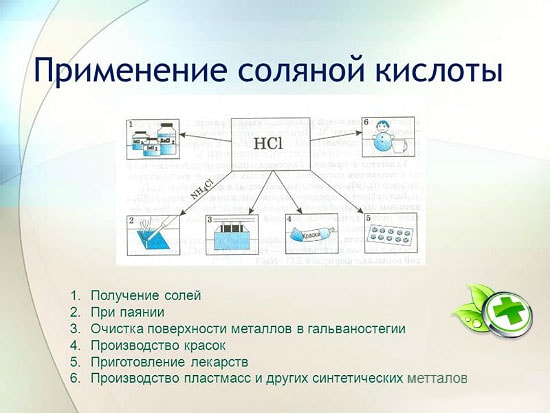
Ansøgning
Hydrometallurgi og elektroformning kan ikke undvære brugen af saltsyre, hvor det er nødvendigt, til at rense overfladen for metaller under fortinning og lodning og for at opnå chlorider af mangan, jern, zink og andre metaller. I fødevareindustrien er denne forbindelse kendt som fødevareadditiv E507 - der er det en surhedsregulator, der er nødvendig for at lave seltzer (sodavand). Koncentreret saltsyre findes også i mavesaften hos enhver person og hjælper med at fordøje maden. Under denne proces falder dens mætningsgrad, fordi. denne sammensætning fortyndes med mad. Men ved længerevarende faste stiger koncentrationen af saltsyre i maven gradvist. Og da denne forbindelse er meget ætsende, kan den føre til mavesår.
Konklusion
Saltsyre kan være både gavnligt og skadeligt for mennesker. Dens kontakt med huden fører til udseendet af alvorlige kemiske forbrændinger, og dampene af denne forbindelse irriterer luftvejene og øjnene.
Men hvis du håndterer dette stof forsigtigt, kan det være nyttigt mere end én gang i