Udnyttelse

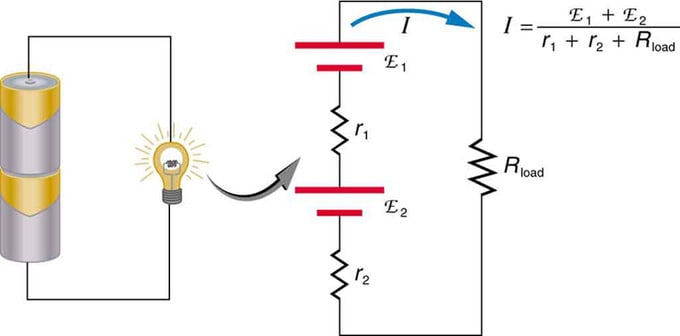
I vanadiumflow-batterier er begge referenceelektroder yderligere forbundet med lagertanke og pumper, så meget store mængder elektrolyt kan cirkuleres gennem cellen. Cirkulationen af flydende elektrolyt er noget vanskelig og begrænser brugen af vanadiumflow-batterier i industrier, der kræver mobilitet, hvilket gør dem effektive i store stationære bygninger.
Når et vanadiumbatteri oplades, bliver VO2+-ionerne i den positivt ladede referenceelektrode til VO2+-ioner, når elektronerne løsnes fra den positive batteripol. På samme måde konverterer elektroner i den negative referenceelektrode V3+ ioner til V2+. Under afladning vendes denne proces, hvilket giver en åben kredsløbsspænding på 1,41 V ved 25°C.
Andre nyttige egenskaber ved vanadiumflow-batterier inkluderer en meget hurtig reaktion på belastningsændringer og en ekstrem høj overbelastningskapacitet. Forskning ved University of New South Wales har vist, at de kan opnå responstider på mindre end et halvt millisekund ved 100 % belastningsændringer og modstå 400 % overbelastning i over 10 sekunder. Svartiden er i de fleste tilfælde begrænset af det elektriske udstyr. Vanadiumbatterier baseret på svovlsyre virker kun ved temperaturer på 10-40C. Hvis temperaturen er under dette område, krystalliserer svovlsyreioner. Effektiviteten i frem- og tilbagegående bevægelse i daglig brug forbliver på niveauet 65-75%.
Funktioner ved opladning og afladning
Opladningsalgoritmer afhænger direkte af, hvordan batteriet er indrettet, og hvilken type det tilhører. For eksempel kan nogle batterier sikkert genopbygge deres kapacitet fra konstant spændingskilder. Andre arbejder kun med en reguleret strømkilde, der kan ændre parametre afhængigt af ladeniveauet.
En forkert organiseret opladningsproces kan beskadige batteriet. I ekstreme tilfælde kan batteriet antændes eller eksplodere. Der er smarte batterier udstyret med spændingsovervågningsenheder. De vigtigste parametre, der skal tages i betragtning ved drift af reversible galvaniske batterier, er:
- Levetid. Selv med korrekt håndtering er antallet af opladningscyklusser for et batteri begrænset. Forskellige batterisystemer slides ikke altid af de samme årsager. Men generelt er batterilevetiden primært begrænset af antallet af fulde opladnings-afladningscyklusser og for det andet af designlevetiden uden reference til brugsintensiteten.
- Opladningstid. Batteriets grundlæggende design indebærer ikke opladning ved en vilkårlig høj hastighed: den indre modstand af den galvaniske celle vil føre til omdannelse af overskydende ladestrøm til varme, hvilket kan irreversibelt beskadige enheden. Fra et fysisk synspunkt er ladetiden begrænset af den maksimale diffusionshastighed af det aktive materiale gennem elektrolytten.Forenklet kan vi antage, at genoprettelse af fuld kapacitet på en time er en god indikator.
- Udledningsdybde. Angivet som en procentdel af den nominelle effekt. Beskriver den brugbare kapacitet. For forskellige typer batterier kan det anbefalede driftsafladningsniveau variere. På grund af ændringer i drift eller ældning mister indikatoren for maksimal dybde sin oprindelige værdi.
diffusionsproces.
På grund af diffusionsprocessen, justeringen af elektrolyttætheden i batterihusets hulrum og i porerne i den aktive masse af pladerne, kan elektrodepolariseringen opretholdes i batteriet, når det eksterne kredsløb er slukket.
Diffusionshastigheden afhænger direkte af elektrolyttens temperatur, jo højere temperatur, jo hurtigere foregår processen og kan variere meget i tid, fra to timer til et døgn. Tilstedeværelsen af to komponenter af elektrodepotentialet under forbigående forhold førte til opdelingen i ligevægt og ikke-ligevægt EMF af batteriet. Batteriets ligevægts-EMF påvirkes af indholdet og koncentrationen af ioner af aktive stoffer i elektrolytten, samt de kemiske og fysiske egenskaber af aktive stoffer. Hovedrollen i størrelsen af EMF spilles af elektrolyttens tæthed, og temperaturen påvirker den praktisk talt ikke. EMF's afhængighed af tæthed kan udtrykkes med formlen:
Batteriets emf er ikke lig med batterispændingen, som afhænger af tilstedeværelsen eller fraværet af en belastning på dets terminaler.
admin25/07/2011
En kommentar
Navn *
websted
Denne side bruger Akismet til at bekæmpe spam. Find ud af, hvordan dine kommentardata behandles.
«Mekanisk omdrejningstæller
Batterispænding »
Tags
VAZ, VAZ funktionsfejl Sensorer Tænding Injektor Enheder Starter Skema Elbiler Strømforsyning vaz 2110 gazelle gazelle virksomhedsregistratorer bilreparation
Seneste indlæg
- Sensorer i bilen: typer og formål
- Verdens største elbil EDumper,
- Laser lys.
- Fordele og ulemper ved halogenlamper
- Enheden og princippet om drift af parkeringssensorer
Arkiv
Archives Select September 2019 August 2017 April 2017 Marts 2017 Maj 2017 April 2016 Oktober 2016 September 2016 August 2016 juli 2016 juni 2016 Maj 2016 April 2016 marts 2016 Februar 2016 november 2015 oktober 2015 August 2015 juli 2015 juni 2015 maj 2015 januar 2015 december 2014 november 2014 oktober 2014 september 2014 august 2014 juli 2014 juni 2014 maj 2014 april 2014 februar 2014 januar 2014 december 2013 november 2013 oktober 2013 august 2013 august 2013 1220 maj 12012012012012012012 september 12012. 2012, 2012, 2011, 2012, 2011, 2012, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, september 2012, 2011, 2011, 2011, 2011, 2011, 2011
Kategorier
- Akkumulator batteri
- Video
- Generator
- Sensorer
- Diagnostik
- Tænding
- nyheder
- Udstyr
- Enheder
- Reparation
- Tændrør
- Forret
- Ordning
- Enheder
- elbiler
- Strømforsyning
Vi er i sociale netværk
Auto Electrician@ Alle rettigheder forbeholdes. Når du kopierer webstedsmateriale, skal du angive et link til webstedet.
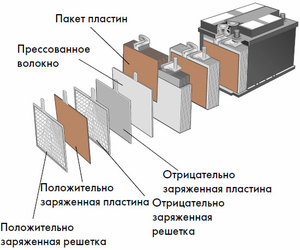
Enhed og funktionsprincip
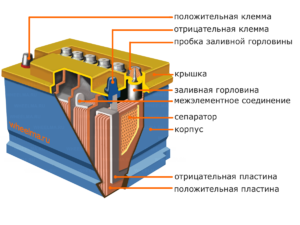
Hver sådan celle har en katode (positiv elektrode) og en anode (negativ). Disse elektroder er adskilt af en elektrolyt, der sikrer udvekslingen af ioner mellem dem. Elektrodematerialer og elektrolytsammensætning er valgt for at tilvejebringe tilstrækkelig elektromotorisk kraft mellem batteriterminalerne.
Da elektroderne indeholder et begrænset potentiale af kemisk energi, vil batteriet blive afladet under drift. Den type galvaniske celler, som er tilpasset til genopfyldning efter en delvis eller fuldstændig afladning, kaldes et batteri. En samling af sådanne indbyrdes forbundne celler er et batteri.Batteridrift involverer en cyklisk ændring af to tilstande:
- Opladning - batteriet fungerer som en modtager af elektricitet, inde i cellerne realiseres den elektriske energi i kemiske ændringer.
- Afladning - enheden fungerer som en kilde til elektrisk strøm ved at omdanne energien fra kemiske reaktioner til elektrisk energi.
Anvendelsesområder
Vanadium redox-batteriers ultrahøje kapacitetsegenskab gør dem velegnede til brug i industrier, der kræver høj energilagring. For eksempel at hjælpe med at balancere mængden af produktion af sådanne energikilder som vind eller sol, eller hjælpe generatorer med at absorbere store strømstød, når det er nødvendigt, eller at balancere udbud og efterspørgsel efter energi i fjerntliggende områder.
De begrænsede selvafladningsegenskaber ved vanadium redox-batterier gør dem nyttige i industrier, hvor batterier skal opbevares i lange perioder med minimal vedligeholdelse og beredskab. Dette førte til deres brug i nogle typer militærelektronik, for eksempel i sensorerne i GATOR-minesystemet. Deres evne til at cykle igennem og forblive på nul gør dem velegnede til solenergiapplikationer og industrier, hvor batterier skal starte dagen tomme og genoplades baseret på belastning og vejr. For eksempel bliver lithium-ion-batterier ofte beskadiget, når de får lov til at aflade under 20 % af deres volumen, så de fungerer oftest i intervallet 20 til 100 %, hvilket betyder, at de kun kan bruge 20 % af deres nominelle kapacitet.
Deres ekstremt hurtige responstid gør dem også praktisk talt uundværlige til uafbrydelige strømforsyninger, hvor de kan bruges i stedet for bly-syre-batterier og endda dieselgeneratorer. Også den hurtige responstid gør dem velegnede til frekvensstyring. I øjeblikket er hverken UPS eller frekvensstyringsforanstaltninger effektive i sig selv, men det er sandsynligt, at batteriet vil være i stand til at finde applikationer i disse industrier, når det aktiveres fra forskellige finansieringskilder. Derudover gør disse egenskaber vanadium redox-batterier til en effektiv "one-piece"-løsning til små elnet, der er afhængige af pålidelig drift, frekvensstyring og belastningsskiftebehov (såsom høj indtrængning af vedvarende energi, stærkt svingende belastninger eller ønsket om at optimere generatorens effektivitet ved at ændre responstiden).
De største fungerende vanadium redox-batterier
Understation "Minami Hyakita":
- Lanceringsdato: december 2015
- Energi: 60 MWh
- Effekt: 15 MW
- Arbejdstid: 4 timer
- Land: Japan
Stinky, Liaoning-provinsen
- Lanceringsdato: N/A
- Energi: 10 MWh
- Effekt: 5 MW
- Arbejdstid: 2 timer
- Land: Kina
Tomamae vindmøllepark
- Lanceringsdato: 2005
- Energi: 6 MWh
- Effekt: 4 MW
- Arbejdstid: 1 time og 30 minutter
- Land: Japan
Zhangbei projekt
- Lanceringsdato 2016
- Energi: 8 MWh
- Effekt: 2 MW
- Arbejdstid: 4 timer.
- Land: Kina
SnoPUD MESA 2 projekt
- Lanceringsdato: marts 2017
- Energi: 8 MWh
- Effekt: 2 MW
- Arbejdstid: 4 timer.
- Land: USA
Understation i Escondido
- Lanceringsdato: 2017
- Energi: 8 MWh
- Effekt: 2 MW
- Arbejdstid: 4 timer.
- Land: USA
Understation i Pullman, Washington
- Lanceringsdato: april 2015
- Energi: 4 MWh
- Effekt: 1 MW
- Arbejdstid: 4 timer
- Land: USA
I 2018 forventes udviklingen af et vanadium redox-batteri i Kina at være afsluttet. Dens energi vil være 800 MWh, effekt - 200 MW og driftstid - 4 timer.
Vilkår
- Sekventiel - elementer følger efter hinanden.
- Elektromotorisk kraft (EMF) er den spænding, der genereres af et batteri eller magnetisk kraft i overensstemmelse med Faradays lov.
- Parallel - Elektriske komponenter er arrangeret, så strømmen løber langs to eller flere veje.
Hvis du bruger flere spændingskilder, kan de forbindes i serie eller parallelt. Med serieversionen er de tunet i samme retning, den indre modstand plusses, og den elektromotoriske kraft tilføjes algebraisk. Lignende typer er almindelige i lommelygter, legetøj og en række andre apparater. Celler placeres i serier for at øge den totale emf.
Seriel forbindelse af to spændingskilder i samme retning. Diagrammet viser en lanterne med to celler og en lampe
Batteri - multipel tilslutning af volt-elementer. Men der er en ulempe ved serieforbindelse, da der tilføjes interne modstande. Nogle gange skaber dette problemer. Lad os sige, at du har to 6V batterier, som du sætter i i stedet for de sædvanlige 12V. Som et resultat har du tilføjet ikke kun EMF, men også den interne modstand fra hvert batteri.
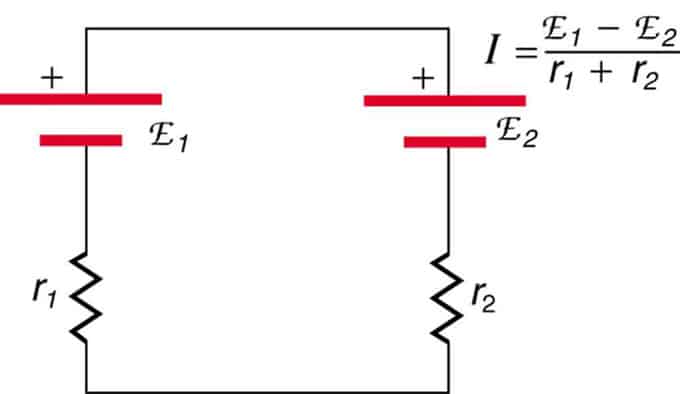
Hvis cellerne er placeret i opposition (den ene er placeret bag den anden), så vil den samlede emk falde.
Disse er to spændingskilder forbundet i serie med modsatrettede emissioner. Strømmen løber i retning af større EMF og er begrænset af summeringen af interne modstande. Et eksempel er en oplader. Den skal have mere emf end batteriet
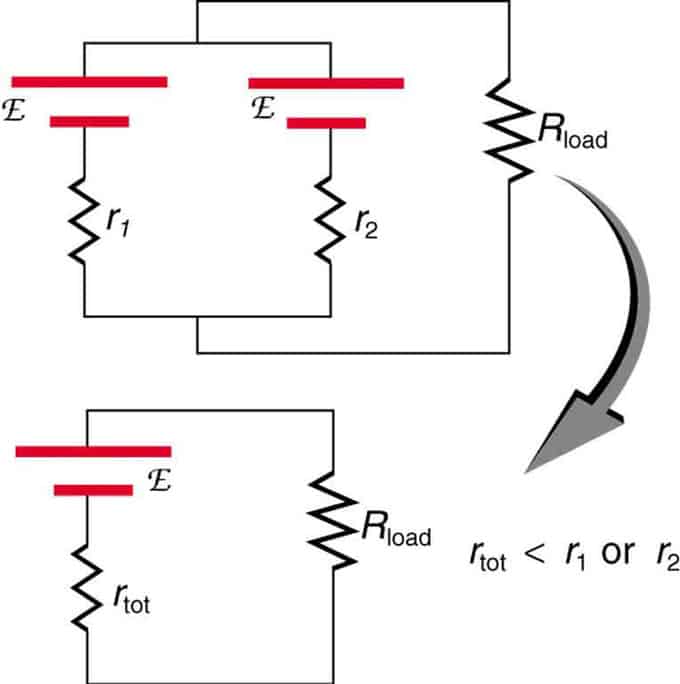
Hvis to kilder med samme elektromotoriske kraft er placeret parallelt og forbundet med belastningsmodstanden, så forbliver den samlede EMF den samme som de enkelte. Den totale indre modstand vil dog blive reduceret. Det viser sig, at den parallelle version kan generere mere strøm.
To spændingskilder med en enkelt EMF kombineres i parallelforbindelse. De danner én EMF, men har mindre total modstand end hver for sig. Lignende kombinationer bruges, hvis du skal opnå mere strøm.
| Oversigt |
|
| Parallel- og serieforbindelse af modstande |
|
| Kirchhoff regerer |
|
| Voltmetre og amperemeter |
|
| RC kredsløb |
|
Historisk oversigt
Udviklingen af den første galvaniske celle er krediteret til den italienske fysiker Alessandro Volta. Han udførte en række eksperimenter med elektrokemiske fænomener i løbet af 1790'erne og omkring 1800 skabte han det første batteri, som hans samtidige kaldte "voltaisk søjle". Enheden bestod af skiftevis zink- og sølvskiver adskilt af lag papir eller klud, der blev gennemblødt i en natriumhydroxidopløsning.
Disse eksperimenter blev grundlaget for Michael Faradays arbejde med elektrokemiens kvantitative love. Han beskrev princippet om batteriets drift og baseret på videnskabsmandens arbejde blev de første kommercielle elektriske celler skabt. Den videre udvikling så således ud:
- I 1836 præsenterede den britiske kemiker John Daniel en forbedret model af cellen, bestående af kobber- og zinkelektroder nedsænket i saltsyre. Daniels element var i stand til at levere konstant spænding usammenlignelig mere effektivt end Volts enheder.
- 1839 Yderligere fremskridt blev gjort af fysikeren Grove med sin to-væske celle, bestående af zink nedsænket i fortyndet svovlsyre i en porøs beholder. Sidstnævnte separerede svovlsyre fra en beholder indeholdende salpetersyre med en platinkatode placeret deri. Salpetersyren tjente som et oxidationsmiddel for at forhindre spændingstab på grund af brintakkumulering ved katoden.Den tyske kemiker Robert Bunsen erstattede platinet med billigt kulstof i Grove-cellen og fremmede derved den udbredte accept af denne type batterier.
- I 1859 opfandt Gaston Plante blysyrecellen, forløberen for det moderne bilbatteri. Plantes apparat var i stand til at producere en usædvanlig stor strøm, men blev kun brugt til eksperimenter i laboratorier i næsten to årtier.
- 1895-1905 år. Opfindelse af nikkel-cadmium og nikkel-jern alkaliske grundstoffer. Dette gjorde det muligt at skabe systemer med et betydeligt antal opladnings-afladningscyklusser.
- Siden 1930'erne begyndte udviklingen af sølv-zink og kviksølv-zink alkaliske batterier, som gav høj energitæthed pr. vægtenhed og volumen.
- Siden midten af det 20. århundrede har fremskridt inden for fremstillingsteknologi og fremkomsten af nye materialer ført til endnu mere kraftfulde og kompakte batterier. Mest bemærkelsesværdig var introduktionen af nikkel-metalhydrid og lithium-batterier på markedet.
Opladning af batterier
Hovedartikel: Oplader
Efterhånden som den kemiske energi er opbrugt, falder spændingen og strømmen, og batteriet holder op med at fungere. Du kan oplade batteriet (batterier af batterier) fra enhver DC-kilde med en højere spænding, mens du begrænser strømmen. Den mest almindelige er ladestrømmen (i ampere), proportional med 1/10 af batteriets betingede nominelle kapacitet (i amperetimer).
Men baseret på den tekniske beskrivelse distribueret af producenter af udbredte elektriske batterier (NiMH, NiCd), kan det antages, at denne ladetilstand, almindeligvis omtalt som standard, beregnes ud fra varigheden af en otte timers arbejdsdag, når batteriet, afladet ved arbejdsdagens afslutning, tilsluttes netopladeren inden start af en ny arbejdsdag. Brugen af en sådan ladetilstand til disse typer batterier med systematisk brug giver dig mulighed for at opretholde en kvalitets-omkostningsbalance i driften af produktet. Således kan denne tilstand efter producentens forslag kun bruges til nikkel-cadmium- og nikkel-metalhydrid-batterier.
Mange typer batterier har forskellige begrænsninger, som skal tages i betragtning ved opladning og efterfølgende brug, fx er NiMH-batterier følsomme over for overopladning, lithium-batterier er følsomme over for overafladning, spænding og temperatur. NiCd- og NiMH-batterier har en såkaldt memory-effekt, som består i et fald i kapaciteten, når opladningen udføres, når batteriet ikke er helt afladet. Også disse typer batterier har en mærkbar selvafladning, det vil sige, at de gradvist mister ladningen uden at være forbundet til belastningen. For at bekæmpe denne effekt kan drypopladning bruges.
Metoder til opladning af batteri
Der bruges flere metoder til at oplade batterier; Generelt afhænger opladningsmetoden af batteritypen.
- Langsom DC-opladning
Oplad med en jævnstrøm proportional med 0,1-0,2 af den betingede nominelle kapacitet Q i henholdsvis ca. 15-7 timer.
Den længste og sikreste opladningsmetode. Velegnet til de fleste typer batterier.
- hurtig opladning
Oplad med jævnstrøm proportionalt med 1/3 Q i ca. 3-5 timer.
- Accelereret eller "delta-V" opladning
En opladning med en initial ladestrøm proportional med batteriets nominelle nominelle kapacitet, hvor batterispændingen konstant måles og opladningen slutter, efter at batteriet er fuldt opladet. Opladningstiden er cirka halvanden time. Batteriet kan overophedes og endda ødelægge det.
- omvendt opladning
Det udføres ved at veksle lange ladningsimpulser med korte udladningsimpulser. Den omvendte metode er mest anvendelig til opladning af NiCd- og NiMH-batterier, som er karakteriseret ved de såkaldte.n. "hukommelseseffekt".