Die Verwendung von Salzsäure
Salzsäure wird in der Industrie häufig zum Extrahieren von Metallen aus Erzen, zum Beizen von Metallen usw. verwendet. Sie wird auch bei der Herstellung von Lötflüssigkeit, bei der Abscheidung von Silber und als integraler Bestandteil von Königswasser verwendet.
Der Umfang der Verwendung von Salzsäure in der Industrie ist geringer als der von Salpetersäure. Dies liegt daran, dass Salzsäure Korrosion von Stahlgeräten verursacht. Darüber hinaus sind seine flüchtigen Dämpfe ziemlich schädlich und verursachen auch Korrosion von Metallprodukten. Dies muss bei der Lagerung von Salzsäure berücksichtigt werden. Salzsäure wird in gummierten Tanks und Fässern gelagert und transportiert, d.h. in Gefäßen, deren Innenfläche mit säurebeständigem Gummi überzogen ist, sowie in Glasflaschen und Polyethylen-Utensilien.
Aus Salzsäure werden Chloride von Zink, Mangan, Eisen und anderen Metallen sowie Ammoniumchlorid hergestellt. Salzsäure wird verwendet, um die Oberflächen von Metallen, Gefäßen und Brunnen von Karbonaten, Oxiden und anderen Sedimenten und Verunreinigungen zu reinigen. In diesem Fall werden spezielle Additive verwendet - Inhibitoren, die das Metall vor Auflösung und Korrosion schützen, aber die Auflösung von Oxiden, Carbonaten und anderen ähnlichen Verbindungen nicht verzögern.
HCl wird in der industriellen Produktion von Kunstharzen, Kautschuken verwendet. Es wird als Rohstoff bei der Herstellung von Methylchlorid aus Methylalkohol, Ethylchlorid aus Ethylen und Vinylchlorid aus Acetylen verwendet.
Erste Hilfe und Behandlungsmethoden
Bei Anzeichen einer Vergiftung muss ein Krankenwagen gerufen werden. Zu Hause dürfen Aktivitäten durchgeführt werden, die darauf abzielen, den Zustand des Opfers zu verbessern. Erste Hilfe bei einer Salzsäurevergiftung sollte schnell durchgeführt werden, um das Risiko negativer Folgen zu verringern.
Veranstaltungen:
- Wenn die Salzverbindung auf die Haut gelangt, werden die beschädigten Stellen mit viel kaltem Wasser gewaschen. Die Bearbeitungszeit beträgt mindestens eine halbe Stunde.
- Bei einer Vergiftung mit Dämpfen erhält das Opfer Zugang zu frischer Luft, Fenster werden geöffnet, enge Kleidung wird aufgeknöpft.
- Es wird empfohlen, den Zustand des Patienten zu überwachen, wenn keine Lebenszeichen vorhanden sind, wird eine Wiederbelebung durchgeführt.
- Das Opfer der Dämpfe darf warmen Tee und Wasser trinken. Es wird empfohlen, Nase und Mund mit kaltem Wasser zu spülen.
- Im Falle einer Überdosierung infolge Einnahme von Säure wird ein Eisbeutel auf den Bauch gelegt, um mögliche Blutungen zu verhindern oder zu reduzieren.
- Es sind keine Arzneimittel erlaubt. Es ist erlaubt, dem Patienten ein Glas Wasser zu geben (Sie können mineralalkalisch sein). Trinkflüssigkeit wird in kleinen Schlucken benötigt.
- Es ist nicht erlaubt, den Magen zu waschen, versuchen Sie, zu Hause Erbrechen herbeizuführen. Eine solche Erste Hilfe kann zur Entwicklung von Halsverbrennungen und Blutungen führen.
Die Behandlung wird in einer medizinischen Einrichtung unter Aufsicht von Spezialisten durchgeführt.
Therapie:
- Reinigung des Magens mit einer Sonde,
- Verwendung von Tropfern mit medizinischen Lösungen,
- Verschreibung von Medikamenten zur Schmerzlinderung
- Die Verwendung von Arzneimitteln zur Wiederherstellung der Funktion von Organen und Systemen,
- ggf. Sauerstoffinhalation und künstliche Beatmung der Lunge,
- Durchführung einer Reanimationstherapie bei fehlenden Lebenszeichen,
- Auswahl an Vitaminen und Spezialnahrung.
Die Behandlung erfolgt auf der Intensivstation und dann in einem Krankenhaus. Die Dauer hängt vom Zustand des Patienten und dem Grad der Vergiftung ab.
Verbrennungen und Vergiftungen
So wirksam dieses Mittel auch ist, es ist gefährlich. Salzsäure kann je nach Konzentration Verätzungen von vier Grad hervorrufen:
- Es gibt nur Rötungen und Schmerzen.
- Es gibt Blasen mit einer klaren Flüssigkeit und Schwellungen.
- Gebildete Nekrose der oberen Hautschichten.Blasen füllen sich mit Blut oder trübem Inhalt.
- Die Läsion erreicht die Sehnen und Muskeln.
Wenn die Substanz irgendwie in die Augen gelangt ist, müssen sie mit Wasser und dann mit einer Sodalösung gespült werden. Aber in jedem Fall ist das erste, was zu tun ist, einen Krankenwagen zu rufen.
Die Einnahme von Säure im Inneren ist mit akuten Schmerzen in Brust und Bauch, Schwellung des Kehlkopfes und Erbrechen blutiger Massen behaftet. Infolgedessen schwere Pathologien der Leber und der Nieren.
Und die ersten Anzeichen einer Paarvergiftung sind trockener häufiger Husten, Würgen, Schäden an den Zähnen, Brennen in den Schleimhäuten und Bauchschmerzen. Die erste Soforthilfe ist das Waschen und Spülen des Mundes mit Wasser sowie der Zugang zu frischer Luft. Wirkliche Hilfe kann nur ein Toxikologe leisten.
Eigenschaften des chemischen Spektrums
Säure interagiert mit vielen Metallen, Salzen. Sie gilt als ziemlich kräftig und ist der Gämse ebenbürtig. Die Hauptreaktion manifestiert sich in allen Metallgruppen links von Wasserstoff (Magnesium, Eisen, Zink - elektrische Potentiale).
Chlorwasserstofflösung in verdünnter Form reagiert mit Salzen, aber nur mit solchen, die von weniger starken Säuren gebildet werden. Bekanntlich zerfallen alle Natrium- und Calciumcarbonate nach Wechselwirkung damit zu Wasser und Kohlenmonoxid.
Salpetersäure
- eine qualitative Reaktion auf Kochsalzlösung. Um es zu erhalten, muss diesem Reagenz Silbernitrat zugesetzt werden, wodurch sich ein weißer Niederschlag bildet, aus dem eine Stickstoffsubstanz gewonnen wird.
Mit Hilfe dieser Mischung aus Wasser und Wasserstoff werden viele interessante Experimente durchgeführt. Verdünnen Sie es beispielsweise mit Ammoniak. Als Ergebnis erhalten Sie weißen, dicken Rauch mit der Konsistenz kleiner Kristalle. Methylamin, Anilin, Mangandioxid, Kaliumcarbonat sind Reagenzien, die auch von Säure angegriffen werden.
Wie und warum wird es verwendet
Vielleicht ist dies zu Recht eine der wichtigen Substanzen, die in fast allen Bereichen des menschlichen Lebens vorkommt und notwendig ist.
Anwendungsbereich Lokalisierung:
- Metallurgie. Oberflächenreinigung von oxidierten Stellen, Rostlösung, Vorlötbehandlung, Verzinnung. Salzsäure hilft, kleine Metalleinschlüsse aus Erzen zu extrahieren. Zirkonium und Titan werden nach dem Verfahren der Umwandlung von Oxiden in Chloride gewonnen.
- Lebensmitteltechnologische Industrie. Als Lebensmittelzusatzstoff wird eine niedrig konzentrierte Lösung verwendet. Gelatine, Fruchtzucker für Diabetiker enthalten einen reinen Emulgator. Gewöhnliches Soda hat auch einen hohen Gehalt an dieser Substanz. Auf der Warenverpackung finden Sie es unter der Bezeichnung E507.
- Das Fachgebiet Medizin. Bei unzureichendem Indikator für das saure Milieu im Magen und Darmproblemen. Niedriger pH-Wert führt zu Krebs. Auch bei richtiger Ernährung, Vitaminen im Überfluss, verschwindet die Gefahr nicht, es ist notwendig, Tests durchzuführen, um Saft aus dem Magentrakt zu gewinnen, denn in einer unzureichend sauren Umgebung werden nützliche Substanzen praktisch nicht aufgenommen, die Verdauung wird gestört.
- Salzlösung wird als Inhibitor verwendet - Schutz vor Schmutz und Infektionen, antiseptische Wirkung. Zur Herstellung von Klebstoffmischungen, keramischen Produkten. Es spült Wärmetauscher.
- Auch die Aufbereitung von Trinkwasser ist ohne die Beteiligung von Chlor nicht vollständig.
- Herstellung von Gummi, Bleichen von Grundstoffen.
- Mit dieser Lösung können Sie Ihre Linsen pflegen.
- Mundwasser zu hause
- Die Substanz ist ein ausgezeichneter elektrischer Leiter.
Wie es zu einer Vergiftung kommt
Salzsäure ist eine farblose Flüssigkeit mit einem charakteristischen stechenden Geruch. Eine der stärksten Säuren, die einige Metalle lösen kann. Verwandelt sich leicht in ein Gas.
Chlorwasserstoff wird in der Textilindustrie, Lederindustrie, Metallurgie von Edelmetallen, bei der Herstellung von Leim, Säuren verwendet.
Die Substanz ist im Magen in minimaler Konzentration vorhanden. Säure trägt zur Normalisierung des Verdauungsprozesses bei, schützt den Körper vor schädlichen Bakterien und Mikroorganismen.
Ab einer Konzentration von mehr als 24 % kann Salzsäure den menschlichen Körper irreversibel schädigen. Dämpfe, die bei Kontakt mit Luft entstehen, reizen die Organe des Seh- und Atmungssystems.
Es gibt mehrere Faktoren, die die Entwicklung einer Vergiftung hervorrufen können.
Faktoren:
Beim Arbeiten in schlecht belüfteten Räumen ist eine Dampfvergiftung möglich,
Verschlucken durch Fahrlässigkeit, häufiger bei Kindern,
Das Eindringen von Salzsäure auf die Epidermis, Schleimhäute bei Nichteinhaltung der Regeln für die Verwendung des Reagenzes.
Eine Vergiftung durch eine Substanz zu Hause bei Erwachsenen tritt als Folge der Verwendung ohne Schutzausrüstung der Haut, der Augen und der Organe des Atmungssystems auf. Eine Vergiftung kann auftreten, wenn Säure ungenau von einem Behälter in einen anderen umgefüllt wird.
Pharmakodynamik und Pharmakokinetik
Was ist Magensäure? Dies ist ein Merkmal der Salzsäurekonzentration im Magen. Die Säure wird ausgedrückt in pH-Wert
. Normalerweise sollte Säure in der Zusammensetzung von Magensaft produziert werden und aktiv an den Verdauungsprozessen teilnehmen. Formel der Salzsäure: HCl
. Es wird von Belegzellen in den Fundusdrüsen unter Beteiligung von produziert H+/K+-ATPase
. Diese Zellen kleiden den Fundus und den Körper des Magens aus. Der Säuregehalt des Magensaftes selbst ist variabel und hängt von der Anzahl der Belegzellen und der Intensität der Neutralisationsprozesse der Substanz durch die alkalischen Bestandteile des Magensaftes ab. Konzentration hergestellt bis - Sie sind stabil und gleich 160 mmol/l. Ein gesunder Mensch sollte normalerweise nicht mehr als 7 und mindestens 5 mmol einer Substanz pro Stunde produzieren.
Bei unzureichender oder übermäßiger Produktion von Salzsäure treten Erkrankungen des Verdauungstrakts auf, die Fähigkeit, bestimmte Mikroelemente wie Eisen aufzunehmen, verschlechtert sich. Das Medikament stimuliert die Sekretion von Magensaft, reduziert pH-Wert
. Aktiviert Pepsinogen
, wandelt es in ein aktives Enzym um Pepsin
. Die Substanz wirkt sich positiv auf den Säurereflex des Magens aus, verlangsamt den Übergang unvollständig verdauter Nahrung in den Darm. Die Fermentationsprozesse des Inhalts des Verdauungstrakts verlangsamen sich, Schmerzen und Aufstoßen verschwinden, Eisen wird besser aufgenommen.
Nach oraler Verabreichung wird das Medikament teilweise durch Speichel und Magenschleim, den Inhalt des Zwölffingerdarms 12, metabolisiert. Die ungebundene Substanz dringt in den Zwölffingerdarm ein, wo sie durch ihren alkalischen Inhalt vollständig neutralisiert wird.
Eine weitere Verwendung von Säure im Alltag
Mit einer sauren Zusammensetzung können Sie Kalk und Rost leicht von Fayence-Rohrleitungen reinigen, Harnsteine und andere Verunreinigungen entfernen. Für eine größere Wirkung wird dem Mittel ein Hemmstoff (z. B. Urotropin) zugesetzt, der die chemische Reaktion verlangsamt.
Das Verfahren wird wie folgt durchgeführt: Die Säure wird mit Wasser verdünnt, bis eine Konzentration von 5 % erreicht ist, und ein Inhibitor wird in einer Menge von 0,5 g pro 1 Liter Flüssigkeit zugegeben. Die Oberfläche wird mit der resultierenden Zusammensetzung behandelt und 30-40 Minuten (je nach Verschmutzungsgrad) belassen, wonach sie mit Wasser gewaschen wird.
Eine milde Säurelösung wird auch verwendet, um Beerenflecken, Tinte oder Rostflecken aus Stoffen zu entfernen. Dazu wird das Material eine Weile in der Zusammensetzung eingeweicht, danach gründlich gespült und wie üblich gewaschen.
Kalk im Wasserkocher loswerden
Zu diesem Zweck wird eine 3-5% ige Salzsäurelösung verwendet, die in einen Kessel gegossen und auf 60-80 erhitzt wird°
C für 1-2 Stunden oder bis sich Kalkablagerungen auflösen. Danach löst sich der Kalk und lässt sich leicht mit einem Holzspatel entfernen.
Die Wirksamkeit des Verfahrens beruht auf der Tatsache, dass das Reagenz mit Magnesium- und Calciumcarbonaten reagiert und sie in lösliche Salze umwandelt. Das dabei freigesetzte Kohlendioxid zerstört die Kalkschicht und löst sie auf. Nach dem Entfernen von Salzablagerungen wird das Geschirr gründlich mit sauberem Wasser gespült.
Wichtiger Punkt!
Diese Methode eignet sich nicht zum Entkalken von abgesplitterten und rissigen Emaille- oder Aluminiumkesseln: Dadurch wird das Metall korrodiert und schwer beschädigt.
Eine Substanz bekommen
Jetzt können wir darüber sprechen, was sie tun, um Salzsäure zu bilden.
Zunächst wird durch Verbrennen von Wasserstoff in Chlor der Hauptbestandteil, gasförmiger Chlorwasserstoff, gewonnen. die dann in Wasser aufgelöst wird. Das Ergebnis dieser einfachen Reaktion ist die Bildung einer synthetischen Säure.
Dieser Stoff kann auch aus Abgasen gewonnen werden. Dies sind chemische Abfall-(Neben-)Gase. Sie werden durch eine Vielzahl von Prozessen gebildet. Zum Beispiel beim Chlorieren von Kohlenwasserstoffen. Der Chlorwasserstoff in ihrer Zusammensetzung wird als Abgas bezeichnet. bzw. die so erhaltene Säure.
Es ist zu beachten, dass in den letzten Jahren der Anteil des Abgases am Gesamtvolumen seiner Produktion zugenommen hat. Und die durch das Verbrennen von Wasserstoff in Chlor gebildete Säure wird verdrängt. Fairerweise sollte jedoch angemerkt werden, dass es weniger Verunreinigungen enthält.
Produktionseinsatz
Es hat eine breite Anwendung in der metallurgischen, Lebensmittel- und medizinischen Industrie.
- Metallurgie. Verwendung beim Löten, Verzinnen und Reinigen von Metallen.
- Lebensmittelindustrie. Anwendung bei der Herstellung von Säureregulatoren für Lebensmittel, z. B. E507.
- Elektrotyp. Wird zum Beizen verwendet.
- Medizin. Es findet seine Anwendung bei der Herstellung von künstlichem Magensaft.
In synthetischen Farbstoffen enthalten. Es wird zur Herstellung von Reinigungs- und Waschmitteln verwendet. Aber in Flüssigkeiten, die für den Hausgebrauch bestimmt sind, ist die Konzentration von Schwefelsäure vernachlässigbar.
Wie Salzsäure im Labor hergestellt wird
Die Produktion des Stoffes erfolgt im großen Stil, der Verkauf ist kostenlos. Unter den Bedingungen von Laborexperimenten wird eine Lösung durch Einwirkung von hochkonzentrierter Schwefelsäure auf gewöhnliches Kochsalz (Natriumchlorid) hergestellt.
Es gibt 2 Methoden zum Auflösen von Chlorwasserstoff in Wasser:
- Wasserstoff wird in Chlor (synthetisch) verbrannt.
- Assoziiert (Abgas). Seine Essenz liegt in der Durchführung von organischer Chlorierung, Dehydrochlorierung.
Die Substanz eignet sich gut zur Synthese während der Pyrolyse von Abfällen aus Organochlor. Dies geschieht durch den Abbau von Kohlenwasserstoffen bei völligem Sauerstoffmangel. Sie können auch Metallchloride verwenden, die die Rohstoffe anorganischer Substanzen sind. Wenn keine konzentrierte Schwefelsäure (Elektrolyt) vorhanden ist, verdünnt einnehmen.
Was die Extraktion des Reagens unter natürlichen Bedingungen betrifft, so findet sich diese chemische Mischung meistens in den Gewässern vulkanischer Abfälle. Chlorwasserstoff ist ein Bestandteil der Mineralien Sylvin (Kaliumchlorid, sieht aus wie Knochen für Wild), Bischofit. All dies sind Methoden, um die Substanz in der Industrie zu extrahieren.
Beim Menschen kommt dieses Enzym im Magen vor. Eine Lösung kann entweder eine Säure oder eine Base sein. Eine der gebräuchlichsten Extraktionsmethoden heißt Sulfat.
Chemische Eigenschaften
Salzsäure, Chlorwasserstoff oder Salzsäure - Lösung Hcl
im Wasser. Laut Wikipedia gehört die Substanz zur Gruppe der anorganischen starken monobasischen to-t. Der vollständige Name der Verbindung in lateinischer Sprache: Salzsäure.
Formel der Salzsäure in der Chemie: HCl
. In einem Molekül verbinden sich Wasserstoffatome mit Halogenatomen - Kl
. Wenn wir die elektronische Konfiguration dieser Moleküle betrachten, kann festgestellt werden, dass Verbindungen an der Bildung von Molekülorbitalen beteiligt sind 1s
-Wasserstofforbitale und beides 3 Sek
und 3p
-Orbitale eines Atoms Kl
. In der chemischen Formel von Salzsäure 1s-
, 3s-
und 3p
-Atomorbitale überlappen und bilden 1, 2, 3 Orbitale. Dabei 3 Sek
-orbital ist unverbindlich. Es findet eine Verschiebung der Elektronendichte zum Atom statt Kl
und die Polarität des Moleküls nimmt ab, aber die Bindungsenergie der Molekülorbitale nimmt zu (wenn wir es zusammen mit anderen betrachten Halogenwasserstoffe
).
Physikalische Eigenschaften von Chlorwasserstoff. Es ist eine klare, farblose Flüssigkeit, die an der Luft raucht. Molmasse einer chemischen Verbindung = 36,6 Gramm pro Mol. Unter Normbedingungen, bei einer Lufttemperatur von 20 Grad Celsius, beträgt die maximale Konzentration eines Stoffes 38 Gew.-%. Die Dichte konzentrierter Salzsäure in einer solchen Lösung beträgt 1,19 g/cm³. Im Allgemeinen werden physikalische Eigenschaften und Eigenschaften wie Dichte, Molarität, Viskosität, Wärmekapazität, Siedepunkt u pH-Wert
, hängen stark von der Konzentration der Lösung ab. Diese Werte werden in der Dichtetabelle näher erläutert. Beispielsweise ist die Dichte von Salzsäure 10 % = 1,048 kg pro Liter. Beim Erstarren bildet sich die Substanz kristalline Hydrate
verschiedene Kompositionen.
Chemische Eigenschaften von Salzsäure. Womit reagiert Salzsäure? Die Substanz interagiert mit Metallen, die in einer Reihe von elektrochemischen Potentialen vor Wasserstoff stehen (Eisen, Magnesium, Zink und andere). Dabei werden Salze gebildet und gasförmig h
. Blei, Kupfer, Gold, Silber und andere Metalle rechts von Wasserstoff reagieren nicht mit Salzsäure. Die Substanz reagiert mit Metalloxiden unter Bildung von Wasser und einem löslichen Salz. Natriumhydroxid unter Einwirkung von zu Ihnen Formen und Wasser. Charakteristisch für diese Verbindung ist die Neutralisationsreaktion.
Verdünnte Salzsäure reagiert mit Metallsalzen, die von schwächeren Säuren gebildet werden. Zum Beispiel, Propionsäure
schwächer als Salz. Der Stoff reagiert nicht mit stärkeren Säuren. und Natriumcarbonat
bildet sich nach Reaktion mit HCl
Chlorid, Kohlenmonoxid und Wasser.
Charakteristisch für eine chemische Verbindung sind Reaktionen mit starken Oxidationsmitteln, mit Mangandioxid
, Kaliumpermanganat
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. Der Stoff reagiert mit Ammoniak
, das dicken weißen Rauch erzeugt, der aus sehr kleinen Kristallen von Ammoniumchlorid besteht. Das Mineral Pyrolusit reagiert auch mit der darin enthaltenen Salzsäure Mangandioxid
: MnO2+4HCl=Cl2+MnO2+2H2O
(Oxidationsreaktion).
Es gibt eine qualitative Reaktion auf Salzsäure und ihre Salze. Wenn eine Substanz mit interagiert Silbernitrat
ein weißer Niederschlag Silberchlorid
und gebildet Salpetersäure
. Wechselwirkungsreaktionsgleichung Methylamin
mit Chlorwasserstoff sieht so aus: HCl + CH3NH2 = (CH3NH3)Cl
.
Ein Stoff reagiert mit einer schwachen Base Anilin
. Nach dem Auflösen von Anilin in Wasser wird der Mischung Salzsäure zugesetzt. Dadurch löst sich die Base auf und bildet sich Anilinhydrochlorid
(Phenylammoniumchlorid
): (С6Н5NH3)Cl
. Die Reaktion der Wechselwirkung von Aluminiumcarbid mit Salzsäure: Al4C3+12HCl=3CH4+4AlCl3
. Reaktionsgleichung Kaliumcarbonat
damit sieht es so aus: K2CO3 + 2HCl = 2KCl + H2O + CO2.
Anwendung
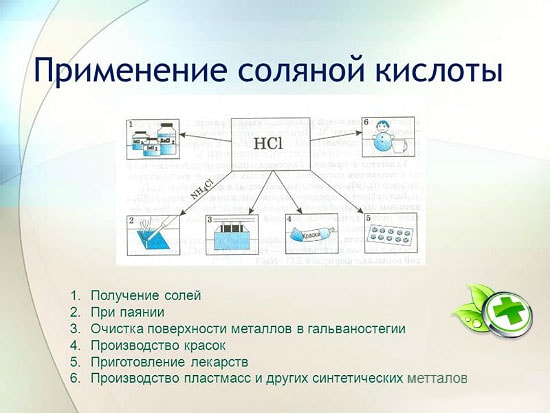
in der Metallurgie zur Gewinnung von Erzen, Entfernung von Rost, Zunder, Schmutz und Oxiden, Löten und Verzinnen;
bei der Herstellung von synthetischen Kautschuken und Harzen;
in der Galvanik;
als Säureregulator in der Lebensmittelindustrie;
um Metallchloride zu erhalten;
um Chlor zu erhalten;
in der Medizin zur Behandlung von Magensaftmangel;
als Reinigungs- und Desinfektionsmittel.
- (HCl), eine wässrige Lösung von Chlorwasserstoff, ein farbloses Gas mit stechendem Geruch. Wird durch die Einwirkung von Schwefelsäure auf Kochsalz, als Nebenprodukt der Chlorierung von Kohlenwasserstoffen oder durch die Reaktion von Wasserstoff und Chlor erhalten. Salzsäure wird verwendet für ... ... Wissenschaftliches und technisches Lexikon
Salzsäure
- - HCl (SC) (Salzsäure, Salzsäure, Chlorwasserstoff) ist eine Lösung von Chlorwasserstoff (HCl) in Wasser, ein Frostschutzzusatz. Es ist eine farblose Flüssigkeit mit stechendem Geruch, ohne Schwebeteilchen ... ... Enzyklopädie der Begriffe, Definitionen und Erklärungen von Baustoffen
SALZSÄURE
- (Salzsäure) Lösung von Chlorwasserstoff in Wasser; starke Säure. An der Luft rauchende farblose Flüssigkeit (technische Salzsäure ist gelblich durch Verunreinigungen von Fe, Cl2 etc.). Die maximale Konzentration (bei 20 °C) beträgt 38 Masse-%, ... ... Big Encyclopedic Dictionary
SALZSÄURE
- (Acidum muriaticum, Acid, hydrochloricum), eine Lösung von Chlorwasserstoff (HC1) in Wasser. In der Natur kommt es im Wasser bestimmter Quellen vulkanischen Ursprungs und auch im Magensaft vor (bis zu 0,5 %). Chlorwasserstoff kann erhalten werden ... Große medizinische Enzyklopädie
SALZSÄURE
- (Salzsäure, Salzsäure) starke monobasische flüchtige Säure mit stechendem Geruch, eine wässrige Lösung von Chlorwasserstoff; die maximale Konzentration beträgt 38 Masse-%, die Dichte einer solchen Lösung beträgt 1,19 g/cm3. Verwendet in ... ... der russischen Enzyklopädie des Arbeitsschutzes
SALZSÄURE
- (Salzsäure) HCl wässrige Lösung von Chlorwasserstoff, starke einbasige Säure, flüchtig, mit stechendem Geruch; Verunreinigungen von Eisen, Chlor färben es gelblich. Das konzentrierte S. zu verkaufen enthält 37% ... ... Große Polytechnische Enzyklopädie
Salzsäure
— Substantiv, Anzahl Synonyme: 1 acid (171) ASIS Synonymwörterbuch. VN Trishin. 2013 ... Synonymwörterbuch
SALZSÄURE
Moderne Enzyklopädie
Salzsäure
- WASSERSTOFFSÄURE, wässrige Lösung von Chlorwasserstoff HCl; eine rauchende Flüssigkeit mit stechendem Geruch. Salzsäure wird zur Gewinnung verschiedener Chloride, zum Beizen von Metallen, zur Verarbeitung von Erzen, zur Herstellung von Chlor, Soda, Gummi usw. verwendet. ... ... Illustriertes Lexikon
Salzsäure
- (Salzsäure), eine Lösung von Chlorwasserstoff in Wasser; starke Säure. An Luft „rauchende“ farblose Flüssigkeit (technische Salzsäure ist gelblich durch Verunreinigungen von Fe, Cl2 etc.). Maximale Konzentration (bei 20 ° C) 38 Massen-%, ... ... Enzyklopädisches Wörterbuch
Welche Vergiftungsgefahr besteht
Salzsäure ist eine besondere Gefahr für den menschlichen Körper. Im Falle einer Vergiftung mit einer solchen Substanz können schwerwiegende Komplikationen und Funktionsstörungen des Körpers auftreten.
Komplikationen:
- Verletzung der Leber als Folge einer toxischen Hepatitis,
- Blutungen im Magen aufgrund der zerstörten Organwände,
- Ein Schockzustand vor Schmerz, wenn Säure in einen großen Bereich eindringt,
- Bei Augenkontakt, Sehbehinderung,
- Schwerwiegende Funktionsstörung der Nieren,
- Atemstillstand, Erstickung, Kurzatmigkeit,
- Die Entwicklung eines Komas.
Ähnliche Folgen entwickeln sich allmählich je nach Vergiftungsgrad.
Fazit
Wenn Sie die Vorsichtsmaßnahmen und Sicherheitsregeln beachten, wird Salzsäure zu einem unverzichtbaren Helfer im Alltag. Und Sie können es zu den günstigsten Preisen in unserem Unternehmen kaufen.
Wie Säuren. Das Bildungsprogramm sieht vor, dass die Schüler die Namen und Formeln von sechs Vertretern dieser Gruppe auswendig lernen. Und wenn Sie die Tabelle des Lehrbuchs durchsehen, bemerken Sie in der Liste der Säuren diejenige, die zuerst kommt und Sie an erster Stelle interessiert - Salzsäure. Leider werden im Klassenzimmer in der Schule weder das Eigentum noch andere Informationen darüber studiert. Daher suchen diejenigen, die sich außerhalb des Schullehrplans Wissen aneignen möchten, in allen möglichen Quellen nach zusätzlichen Informationen. Aber oft finden viele nicht die Informationen, die sie brauchen. Und so widmet sich das Thema des heutigen Artikels dieser speziellen Säure.
Definition
Salzsäure ist eine starke einbasige Säure. In einigen Quellen kann es als Salzsäure und Salzsäure sowie als Chlorwasserstoff bezeichnet werden.
Physikalische Eigenschaften
Es ist eine farblose und rauchende ätzende Flüssigkeit in der Luft (Foto rechts). Technische Säure hat jedoch aufgrund des Vorhandenseins von Eisen, Chlor und anderen Zusätzen eine gelbliche Farbe. Seine größte Konzentration bei einer Temperatur von 20 ° C beträgt 38%. Die Dichte von Salzsäure mit solchen Parametern beträgt 1,19 g/cm 3 . Aber diese Verbindung in unterschiedlichen Sättigungsgraden hat völlig andere Daten.Mit abnehmender Konzentration nehmen die Zahlenwerte von Molarität, Viskosität und Schmelzpunkt ab, jedoch steigen die spezifische Wärmekapazität und der Siedepunkt. Die Verfestigung von Salzsäure beliebiger Konzentration ergibt verschiedene kristalline Hydrate.
Chemische Eigenschaften
Alle Metalle, die in der elektrochemischen Spannungsreihe vor Wasserstoff stehen, können mit dieser Verbindung interagieren, Salze bilden und Wasserstoffgas freisetzen. Wenn sie durch Metalloxide ersetzt werden, sind die Reaktionsprodukte lösliches Salz und Wasser. Der gleiche Effekt tritt bei der Wechselwirkung von Salzsäure mit Hydroxiden auf. Setzt man ihm aber irgendein Salz von Metallen (z. B. Natriumkarbonat) zu, dessen Rückstand einer schwächeren Säure (Kohlensäure) entzogen wurde, so Chlorid dieses Metalls (Natrium), Wasser und der Säure entsprechendes Gas Rückstände (in diesem Fall Kohlendioxid) entstehen.
Kassenbon
Die nun besprochene Verbindung entsteht, wenn Chlorwasserstoffgas, das durch Verbrennen von Wasserstoff in Chlor gewonnen werden kann, in Wasser gelöst wird. Salzsäure, die nach diesem Verfahren gewonnen wurde, wird als synthetisch bezeichnet. Auch Abgase können als Quelle zur Gewinnung dieses Stoffes dienen. Und solche Salzsäure wird als Abgas bezeichnet. In letzter Zeit ist das Produktionsniveau von Salzsäure unter Verwendung dieses Verfahrens viel höher als die Herstellung durch ein synthetisches Verfahren, obwohl das letztere die Verbindung in einer reineren Form ergibt. Dies sind alles Möglichkeiten, es in der Industrie zu bekommen. In Laboratorien wird Salzsäure jedoch auf drei Arten hergestellt (die ersten beiden unterscheiden sich nur in Temperatur und Reaktionsprodukten), wobei verschiedene Arten chemischer Wechselwirkungen verwendet werden, wie zum Beispiel:
- Wirkung von gesättigter Schwefelsäure auf Natriumchlorid bei 150°C.
- Die Wechselwirkung der oben genannten Substanzen unter Bedingungen mit einer Temperatur von 550 ° C und darüber.
- Hydrolyse von Aluminium- oder Magnesiumchloriden.
Anwendung
Die Hydrometallurgie und die Galvanoformung können nicht auf die Verwendung von Salzsäure verzichten, wo sie benötigt wird, um die Oberfläche von Metallen beim Verzinnen und Löten zu reinigen und Chloride von Mangan, Eisen, Zink und anderen Metallen zu erhalten. In der Lebensmittelindustrie ist diese Verbindung als Lebensmittelzusatzstoff E507 bekannt – dort ist sie als Säureregulator notwendig, um Selterswasser herzustellen. Konzentrierte Salzsäure kommt auch im Magensaft eines jeden Menschen vor und hilft, Nahrung zu verdauen. Während dieses Vorgangs nimmt sein Sättigungsgrad ab, weil. diese Zusammensetzung wird mit Nahrung verdünnt. Bei längerem Fasten steigt die Salzsäurekonzentration im Magen jedoch allmählich an. Und da diese Verbindung sehr ätzend ist, kann sie zu Magengeschwüren führen.
Fazit
Salzsäure kann für den Menschen sowohl nützlich als auch schädlich sein. Sein Kontakt mit der Haut führt zu schweren Verätzungen, und die Dämpfe dieser Verbindung reizen die Atemwege und Augen.
Aber wenn Sie sorgfältig mit dieser Substanz umgehen, kann sie sich mehr als einmal als nützlich erweisen