Ausbeutung

Bei Vanadium-Flow-Batterien sind beide Referenzelektroden zusätzlich mit Speichertanks und Pumpen verbunden, sodass sehr große Elektrolytmengen durch die Zelle zirkuliert werden können. Die Zirkulation von flüssigem Elektrolyt ist etwas schwierig und schränkt die Verwendung von Vanadium-Flow-Batterien in Industrien ein, die Mobilität erfordern, wodurch sie in großen stationären Gebäuden effektiv sind.
Beim Laden einer Vanadium-Batterie verwandeln sich die VO2+-Ionen in der positiv geladenen Referenzelektrode in VO2+-Ionen, wenn die Elektronen vom positiven Batteriepol abgelöst werden. In ähnlicher Weise wandeln Elektronen in der negativen Referenzelektrode V3+-Ionen in V2+ um. Beim Entladen kehrt sich dieser Vorgang um, was zu einer Leerlaufspannung von 1,41 V bei 25 °C führt.
Weitere nützliche Eigenschaften von Vanadium-Flow-Batterien sind eine sehr schnelle Reaktion auf Lastwechsel und eine extrem hohe Überlastfähigkeit. Untersuchungen an der University of New South Wales haben gezeigt, dass sie Reaktionszeiten von weniger als einer halben Millisekunde bei 100 % Lastwechsel erreichen und 400 % Überlast für über 10 Sekunden standhalten können. Die Reaktionszeit wird in den meisten Fällen durch die elektrische Ausrüstung begrenzt. Vanadium-Batterien auf Basis von Schwefelsäure funktionieren nur bei Temperaturen von 10-40 °C. Unterschreitet die Temperatur diesen Bereich, kristallisieren Schwefelsäureionen aus. Der Wirkungsgrad bei der Hin- und Herbewegung im täglichen Gebrauch bleibt auf dem Niveau von 65-75%.
Funktionen zum Laden und Entladen
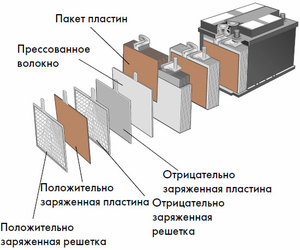
Ladealgorithmen hängen direkt davon ab, wie die Batterie angeordnet ist und zu welchem Typ sie gehört. Beispielsweise können einige Batterien ihre Kapazität sicher aus Konstantspannungsquellen auffüllen. Andere arbeiten nur mit einer einstellbaren Stromquelle, die Parameter je nach Ladezustand ändern kann.
Ein falsch organisierter Ladevorgang kann den Akku beschädigen. Im Extremfall kann sich der Akku entzünden oder explodieren. Es gibt intelligente Batterien, die mit Spannungsüberwachungsgeräten ausgestattet sind. Die wichtigsten Parameter, die beim Betrieb reversibler galvanischer Batterien berücksichtigt werden sollten, sind:
- Lebensdauer. Auch bei sachgemäßer Handhabung ist die Anzahl der Ladezyklen eines Akkus begrenzt. Unterschiedliche Batteriesysteme verschleißen nicht immer aus den gleichen Gründen. Aber generell wird die Batterielebensdauer in erster Linie durch die Anzahl der vollen Lade-Entlade-Zyklen und zweitens durch die Auslegungslebensdauer ohne Bezug zur Nutzungsintensität begrenzt.
- Aufladezeit. Der grundsätzliche Aufbau der Batterie impliziert kein Laden mit beliebig hoher Geschwindigkeit: Der Innenwiderstand der galvanischen Zelle führt dazu, dass überschüssiger Ladestrom in Wärme umgewandelt wird, was das Gerät irreversibel schädigen kann. Aus physikalischer Sicht ist die Ladezeit durch die maximale Diffusionsgeschwindigkeit des Aktivmaterials durch den Elektrolyten begrenzt.Vereinfacht können wir davon ausgehen, dass die Wiederherstellung der vollen Kapazität in einer Stunde ein guter Indikator ist.
- Entladungstiefe. Angabe in Prozent der Nennleistung. Beschreibt die nutzbare Kapazität. Für verschiedene Batterietypen kann der empfohlene Betriebsentladungspegel variieren. Durch Betriebsveränderungen oder Alterung verliert die Maximaltiefenanzeige ihren ursprünglichen Wert.
Diffusionsprozess.
Durch den Diffusionsprozess, die Ausrichtung der Elektrolytdichte im Hohlraum des Batteriegehäuses und in den Poren der aktiven Masse der Platten, kann die Elektrodenpolarisation in der Batterie aufrechterhalten werden, wenn der äußere Stromkreis abgeschaltet wird.
Die Diffusionsgeschwindigkeit hängt direkt von der Temperatur des Elektrolyten ab, je höher die Temperatur, desto schneller läuft der Prozess ab und kann zeitlich stark variieren, von zwei Stunden bis zu einem Tag. Das Vorhandensein von zwei Komponenten des Elektrodenpotentials unter transienten Bedingungen führte zur Unterteilung in Gleichgewichts- und Nichtgleichgewichts-EMK der Batterie. Die Gleichgewichts-EMK der Batterie wird durch den Gehalt und die Konzentration von Ionen von Wirkstoffen im Elektrolyten sowie von den chemischen und physikalischen Eigenschaften von Wirkstoffen beeinflusst. Die Hauptrolle bei der Größe der EMF spielt die Dichte des Elektrolyten und die Temperatur hat praktisch keinen Einfluss darauf. Die Abhängigkeit der EMF von der Dichte kann durch die Formel ausgedrückt werden:
Die EMK der Batterie ist nicht gleich der Batteriespannung, die vom Vorhandensein oder Fehlen einer Last an ihren Anschlüssen abhängt.
Administrator25.07.2011
Ein Kommentar
Name *
Seite? ˅
Diese Seite verwendet Akismet, um Spam zu bekämpfen. Erfahren Sie, wie Ihre Kommentardaten verarbeitet werden.
« Mechanischer Drehzahlmesser
Batteriespannung "
Stichworte
VAZ, VAZ Fehlfunktionen Sensoren Zündung Einspritzdüsen Starter Schaltpläne Elektroautos Stromversorgung vaz 2110 Gazelle Gazelle Geschäftsregister Autoreparatur
neueste Einträge
- Sensoren im Auto: Arten und Zweck
- Das größte Elektroauto der Welt EDumper,
- Laserlichter.
- Vor- und Nachteile von Halogenlampen
- Das Gerät und Funktionsprinzip von Parksensoren
Archiv
Archiv Select September 2019 August 2017 Juli 2017 Juni 2017 Mai 2017 April 2017 März 2017 Dezember 2016 November 2016 Oktober 2016 September 2016 August 2016 Juli 2016 Juni 2016 Mai 2016 April 2016 März 2016 Februar 2016 November 2015 Oktober 2015 August 2015 Juli 2015 Juni 2015 Mai 2015 Januar 2015 Dezember 2014 November 2014 Oktober 2014 September 2014 August 2014 Juli 2014 Juni 2014 Mai 2014 April 2014 Februar 2014 Januar 2014 Dezember 2013 November 2013 Oktober 2013 August 2013 Juni 2013 Mai 2013 Mart September 2012, 2012, 2012, 2012, 2012, 2012, 2013 2012, 2011, 2011, 2012, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, September 2012, 2011, 2011, 2011, 2011, 2011, 2011
Kategorien
- Akkumulator
- Video
- Generator
- Sensoren
- Diagnose
- Zündung
- Nachrichten
- Ausrüstung
- Geräte
- Reparatur
- Zündkerze
- Anlasser
- Planen
- Geräte
- elektrische Autos
- Stromversorgung
Wir sind in sozialen Netzwerken
Autoelektriker@ Alle Rechte vorbehalten. Beim Kopieren von Site-Material müssen Sie einen Link zur Site bereitstellen.
Gerät und Funktionsprinzip
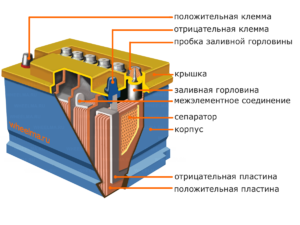
Jede solche Zelle hat eine Kathode (positive Elektrode) und eine Anode (negativ). Diese Elektroden sind durch einen Elektrolyten getrennt, der den Austausch von Ionen zwischen ihnen gewährleistet. Elektrodenmaterialien und Elektrolytzusammensetzung werden ausgewählt, um eine ausreichende elektromotorische Kraft zwischen den Batterieanschlüssen bereitzustellen.
Da die Elektroden ein begrenztes Potenzial an chemischer Energie enthalten, wird die Batterie während des Betriebs erschöpft. Als Batterie bezeichnet man den Typ galvanischer Zellen, der nach teilweiser oder vollständiger Entladung wieder aufgeladen werden kann. Eine Anordnung solcher miteinander verbundener Zellen ist eine Batterie.Der Batteriebetrieb beinhaltet einen zyklischen Wechsel zweier Zustände:
- Laden - die Batterie fungiert als Stromempfänger, in den Zellen wird die elektrische Energie in chemischen Veränderungen umgesetzt.
- Entladen - Das Gerät fungiert als elektrische Stromquelle, indem es die Energie chemischer Reaktionen in elektrische Energie umwandelt.
Einsatzbereiche
Die ultrahohe Kapazitätseigenschaft von Vanadium-Redox-Batterien macht sie gut geeignet für den Einsatz in Industrien, die eine hohe Energiespeicherung erfordern. Zum Beispiel helfen, das Produktionsvolumen solcher Energiequellen wie Wind oder Sonne auszugleichen, oder Generatoren zu helfen, bei Bedarf große Energiespitzen zu absorbieren, oder Angebot und Nachfrage nach Energie für abgelegene Gebiete auszugleichen.
Die begrenzten Selbstentladungseigenschaften von Vanadium-Redox-Batterien machen sie in Branchen nützlich, in denen Batterien für lange Zeiträume mit minimaler Wartung und Einsatzbereitschaft gelagert werden müssen. Dies führte zu ihrer Verwendung in einigen Arten von Militärelektronik, beispielsweise in den Sensoren des GATOR-Bergbausystems. Ihre Fähigkeit, durchzulaufen und bei Null zu bleiben, macht sie für Solaranwendungen und Industrien geeignet, in denen Batterien den Tag leer beginnen und je nach Last und Wetter wieder aufladen müssen. Beispielsweise werden Lithium-Ionen-Batterien oft beschädigt, wenn sie auf weniger als 20 % ihres Volumens entladen werden, sodass sie meistens im Bereich von 20 bis 100 % arbeiten, was bedeutet, dass sie nur 20 % ihrer Nennkapazität nutzen können.
Ihre extrem schnelle Reaktionszeit macht sie auch für unterbrechungsfreie Stromversorgungen praktisch unverzichtbar, wo sie anstelle von Blei-Säure-Batterien und sogar Dieselgeneratoren eingesetzt werden können. Auch die schnelle Reaktionszeit macht sie für die Frequenzsteuerung geeignet. Derzeit sind weder USV- noch Frequenzmanagementmaßnahmen allein wirksam, aber es ist wahrscheinlich, dass die Batterie in diesen Branchen Anwendung finden kann, wenn sie aus verschiedenen Finanzierungsquellen kapitalisiert wird. Darüber hinaus machen diese Fähigkeiten Vanadium-Redox-Batterien zu einer effektiven „einteiligen“ Lösung für kleine Stromnetze, die auf zuverlässigen Betrieb, Frequenzsteuerung und Lastumschaltanforderungen angewiesen sind (z Optimierung des Generatorwirkungsgrades durch Verschiebung der Ansprechzeit).
Die größten funktionierenden Vanadium-Redox-Batterien
Umspannwerk "Minami Hyakita":
- Erscheinungsdatum: Dezember 2015
- Energie: 60 MWh
- Leistung: 15 MW
- Arbeitszeit: 4 Stunden
- Land: Japan
Stinke, Provinz Liaoning
- Startdatum: N/A
- Energie: 10 MWh
- Leistung: 5 MW
- Arbeitszeit: 2 Stunden
- Land: China
Windpark Tomamae
- Erscheinungsdatum: 2005
- Energie: 6 MWh
- Leistung: 4 MW
- Arbeitszeit: 1 Stunde 30 Minuten
- Land: Japan
Zhangbei-Projekt
- Startdatum 2016
- Energie: 8 MWh
- Leistung: 2 MW
- Arbeitszeit: 4 Stunden.
- Land: China
SnoPUD MESA 2-Projekt
- Startdatum: März 2017
- Energie: 8 MWh
- Leistung: 2 MW
- Arbeitszeit: 4 Stunden.
- Land: USA
Umspannwerk in Escondido
- Erscheinungsdatum: 2017
- Energie: 8 MWh
- Leistung: 2 MW
- Arbeitszeit: 4 Stunden.
- Land: USA
Umspannwerk in Pullman, Washington
- Startdatum: April 2015
- Energie: 4 MWh
- Leistung: 1 MW
- Arbeitszeit: 4 Stunden
- Land: USA
Bis 2018 soll die Entwicklung einer Vanadium-Redox-Batterie in China abgeschlossen sein. Seine Energie beträgt 800 MWh, seine Leistung 200 MW und seine Betriebszeit 4 Stunden.
Bedingungen
- Sequential - Elemente folgen nacheinander.
- Die elektromotorische Kraft (EMF) ist die von einer Batterie erzeugte Spannung oder magnetische Kraft gemäß dem Faradayschen Gesetz.
- Parallel - Elektrische Komponenten sind so angeordnet, dass Strom entlang zweier oder mehrerer Pfade fließt.
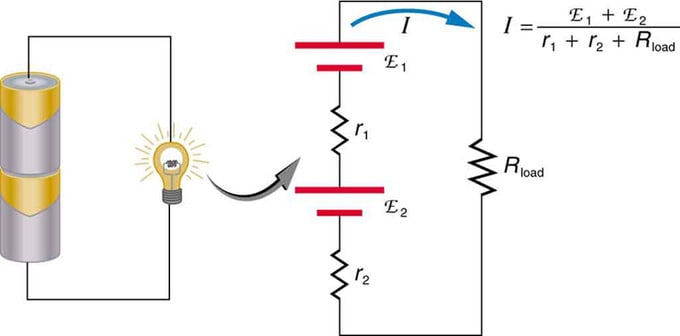
Wenn Sie mehrere Spannungsquellen verwenden, können diese in Reihe oder parallel geschaltet werden. Bei der Serienversion werden sie gleichsinnig gestimmt, der Innenwiderstand addiert und die elektromotorische Kraft algebraisch addiert. Ähnliche Typen sind in Taschenlampen, Spielzeug und einer Vielzahl anderer Geräte üblich. Zellen werden in Reihe geschaltet, um die Gesamt-EMK zu erhöhen.
Reihenschaltung zweier Spannungsquellen in gleicher Richtung. Das Diagramm zeigt eine Laterne mit zwei Zellen und einer Lampe
Batterie - Mehrfachverbindung von Voltelementen. Aber es gibt einen Nachteil bei der seriellen Verbindung, da Innenwiderstände hinzugefügt werden. Manchmal führt dies zu Problemen. Angenommen, Sie haben zwei 6-V-Batterien, die Sie anstelle der üblichen 12-V-Batterien einsetzen. Als Ergebnis haben Sie nicht nur die EMF, sondern auch den Innenwiderstand jeder Batterie hinzugefügt.
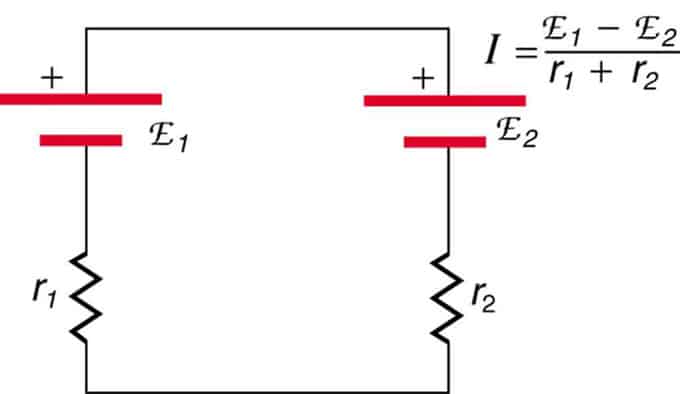
Wenn sich die Zellen gegenüberliegen (eine befindet sich hinter der anderen), nimmt die Gesamt-EMK ab.
Dies sind zwei in Reihe geschaltete Spannungsquellen mit entgegengesetzten Emissionen. Der Strom fließt in Richtung größerer EMK und wird durch die Summe der Innenwiderstände begrenzt. Ein Beispiel ist ein Ladegerät. Es muss mehr EMK haben als die Batterie
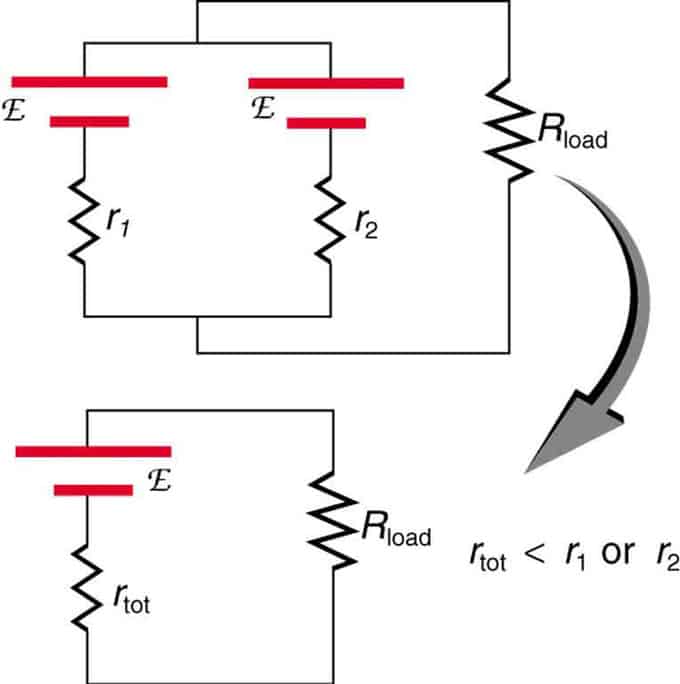
Wenn zwei Quellen mit gleicher elektromotorischer Kraft parallel angeordnet und mit dem Lastwiderstand verbunden sind, bleibt die Gesamt-EMK gleich wie die einzelnen. Der Gesamtinnenwiderstand wird jedoch reduziert. Es stellt sich heraus, dass die parallele Version mehr Strom erzeugen kann.
Zwei Spannungsquellen mit einer einzigen EMK werden in Parallelschaltung kombiniert. Sie bilden eine EMF, haben aber einen geringeren Gesamtwiderstand als einzeln. Ähnliche Kombinationen werden verwendet, wenn Sie mehr Strom erreichen müssen.
| Überblick |
|
| Parallel- und Reihenschaltung von Widerständen |
|
| Kirchhoff-Regeln |
|
| Voltmeter und Amperemeter |
|
| RC-Schaltungen |
|
Historischer Überblick
Die Entwicklung der ersten galvanischen Zelle wird dem italienischen Physiker Alessandro Volta zugeschrieben. Er führte in den 1790er Jahren eine Reihe von Experimenten mit elektrochemischen Phänomenen durch und schuf um 1800 die erste Batterie, die seine Zeitgenossen "voltaische Säule" nannten. Das Gerät bestand aus abwechselnden Zink- und Silberscheiben, die durch Papier- oder Stoffschichten getrennt waren, die in einer Natriumhydroxidlösung getränkt waren.
Diese Experimente bildeten die Grundlage für Michael Faradays Arbeit über die quantitativen Gesetze der Elektrochemie. Er beschrieb das Funktionsprinzip der Batterie und basierend auf der Arbeit des Wissenschaftlers wurden die ersten kommerziellen elektrischen Zellen hergestellt. Die weitere Entwicklung sah so aus:
- 1836 präsentierte der britische Chemiker John Daniel ein verbessertes Modell der Zelle, bestehend aus in Salzsäure getauchten Kupfer- und Zinkelektroden. Daniels Element war in der Lage, konstante Spannung unvergleichlich effizienter bereitzustellen als die Geräte von Volt.
- 1839 Weitere Fortschritte erzielte der Physiker Grove mit seiner Zweiflüssigkeitszelle, bestehend aus in verdünnter Schwefelsäure getauchtem Zink in einem porösen Behälter. Letzterer trennte Schwefelsäure aus einem Gefäß mit Salpetersäure, in dem sich eine Platinkathode befand. Die Salpetersäure diente als Oxidationsmittel, um einen Spannungsverlust durch Wasserstoffansammlung an der Kathode zu verhindern.Der deutsche Chemiker Robert Bunsen ersetzte in der Grove-Zelle das Platin durch preiswerten Kohlenstoff und förderte damit die breite Akzeptanz dieses Batterietyps.
- 1859 erfand Gaston Plante die Blei-Säure-Zelle, den Vorläufer der modernen Autobatterie. Plantes Gerät konnte einen ungewöhnlich großen Strom erzeugen, wurde aber fast zwei Jahrzehnte lang nur für Experimente in Labors verwendet.
- 1895-1905 Jahre. Erfindung der alkalischen Elemente Nickel-Cadmium und Nickel-Eisen. Dadurch war es möglich, Systeme mit einer beträchtlichen Anzahl von Lade-Entlade-Zyklen zu erstellen.
- Seit den 1930er Jahren begann die Entwicklung von Silber-Zink- und Quecksilber-Zink-Alkalibatterien, die eine hohe Energiedichte pro Gewichts- und Volumeneinheit lieferten.
- Seit Mitte des 20. Jahrhunderts haben Fortschritte in der Fertigungstechnologie und das Aufkommen neuer Materialien zu noch leistungsfähigeren und kompakteren Batterien geführt. Am bemerkenswertesten war die Markteinführung von Nickel-Metallhydrid- und Lithiumbatterien.
Batterien aufladen
Hauptartikel: Ladegerät
Wenn die chemische Energie erschöpft ist, fallen Spannung und Strom ab und die Batterie funktioniert nicht mehr. Sie können die Batterie (Batterie der Batterien) von jeder Gleichstromquelle mit einer höheren Spannung laden, während Sie den Strom begrenzen. Am gebräuchlichsten ist der Ladestrom (in Ampere), proportional zu 1/10 der bedingten Nennkapazität der Batterie (in Amperestunden).
Aufgrund der technischen Beschreibung, die von Herstellern weit verbreiteter Elektrobatterien (NiMH, NiCd) verbreitet wird, kann jedoch davon ausgegangen werden, dass dieser allgemein als Standard, errechnet sich aus der Dauer eines achtstündigen Arbeitstages, wenn die am Ende des Arbeitstages entladene Batterie vor Beginn eines neuen Arbeitstages an das Netzladegerät angeschlossen wird. Die Verwendung eines solchen Lademodus für diese Batterietypen bei systematischer Verwendung ermöglicht es Ihnen, ein Qualitäts-Kosten-Verhältnis beim Betrieb des Produkts aufrechtzuerhalten. Daher kann dieser Modus auf Empfehlung des Herstellers nur für Nickel-Cadmium- und Nickel-Metallhydrid-Akkus verwendet werden.
Viele Batterietypen haben unterschiedliche Einschränkungen, die beim Laden und anschließenden Gebrauch berücksichtigt werden müssen, z. B. sind NiMH-Batterien empfindlich gegen Überladung, Lithium-Batterien sind empfindlich gegen Tiefentladung, Spannung und Temperatur. NiCd- und NiMH-Akkus haben einen sogenannten Memory-Effekt, der in einer Kapazitätsabnahme beim Laden besteht, wenn der Akku nicht vollständig entladen ist. Außerdem haben diese Batterietypen eine merkliche Selbstentladung, dh sie verlieren allmählich an Ladung, ohne an die Last angeschlossen zu werden. Um diesem Effekt entgegenzuwirken, kann eine Tropfaufladung verwendet werden.
Batterielademethoden
Zum Laden von Batterien werden mehrere Methoden verwendet; Generell hängt die Lademethode vom Batterietyp ab.
- Langsame DC-Ladung
Laden Sie mit einem Gleichstrom, der proportional zu 0,1-0,2 der bedingten Nennkapazität Q ist, für jeweils etwa 15-7 Stunden.
Die längste und sicherste Lademethode. Für die meisten Batterietypen geeignet.
- schnelles Laden
Mit Gleichstrom proportional zu 1/3 Q ca. 3-5 Stunden laden.
- Beschleunigte oder "Delta-V"-Ladung
Eine Ladung mit einem zur Nennkapazität der Batterie proportionalen Anfangsladestrom, bei der die Batteriespannung ständig gemessen wird und die Ladung endet, nachdem die Batterie vollständig geladen ist. Die Ladezeit beträgt etwa anderthalb Stunden. Der Akku kann überhitzen und sogar zerstört werden.
- umgekehrte Ladung
Es erfolgt durch abwechselnde lange Ladeimpulse mit kurzen Entladeimpulsen. Die umgekehrte Methode ist am nützlichsten zum Laden von NiCd- und NiMH-Akkus, die durch die sogenannten gekennzeichnet sind.n. "Erinnerungseffekt".