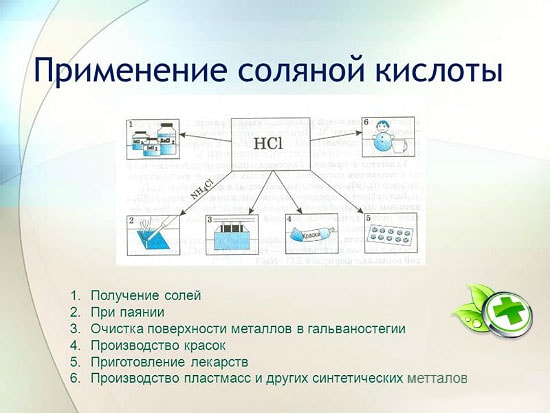
El uso de ácido clorhídrico
El ácido clorhídrico se usa ampliamente en la industria para extraer metales de minerales, decapar metales, etc. También se usa en la fabricación de líquidos de soldadura, en la deposición de plata y como parte integral del agua regia.
La escala del uso del ácido clorhídrico en la industria es menor que la del ácido nítrico. Esto se debe al hecho de que el ácido clorhídrico provoca la corrosión de los equipos de acero. Además, sus vapores volátiles son bastante dañinos y también provocan la corrosión de los productos metálicos. Esto debe tenerse en cuenta al almacenar ácido clorhídrico. El ácido clorhídrico se almacena y transporta en tanques y barriles revestidos de goma, es decir, en recipientes cuya superficie interior está cubierta con caucho resistente a los ácidos, así como en botellas de vidrio y utensilios de polietileno.
El ácido clorhídrico se utiliza para producir cloruros de zinc, manganeso, hierro y otros metales, así como cloruro de amonio. El ácido clorhídrico se utiliza para limpiar las superficies de metales, recipientes, pozos de carbonatos, óxidos y otros sedimentos y contaminantes. En este caso, se utilizan aditivos especiales: inhibidores que protegen el metal de la disolución y la corrosión, pero no retrasan la disolución de óxidos, carbonatos y otros compuestos similares.
El HCl se utiliza en la producción industrial de resinas sintéticas, cauchos. Se utiliza como materia prima en la producción de cloruro de metilo a partir de alcohol metílico, cloruro de etilo a partir de etileno y cloruro de vinilo a partir de acetileno.
Primeros auxilios y métodos de tratamiento.
Si se encuentran signos de envenenamiento, se debe llamar a una ambulancia. En el hogar, está permitido realizar actividades destinadas a mejorar la condición de la víctima. Los primeros auxilios para el envenenamiento por ácido clorhídrico deben llevarse a cabo rápidamente para reducir el riesgo de consecuencias negativas.
Eventos:
- Si el compuesto de sal entra en contacto con la piel, las áreas dañadas se lavan con abundante agua fría. El tiempo de procesamiento es de al menos media hora.
- En caso de intoxicación con vapores, a la víctima se le proporciona acceso al aire fresco, se abren las ventanas y se desabrocha la ropa ajustada.
- Se recomienda monitorear el estado del paciente, en ausencia de signos de vida, se realiza la reanimación.
- A la víctima de los vapores se le permite beber té caliente, agua. Se recomienda enjuagar la nariz y la boca con agua fría.
- En caso de sobredosis por ingestión de ácido, se coloca una bolsa de hielo en el abdomen para prevenir o reducir el posible sangrado.
- No se permiten medicamentos. Se permite dar al paciente un vaso de agua (puede mineral alcalino). Se requiere beber líquido en pequeños sorbos.
- No está permitido lavar el estómago, intente inducir el vómito en casa. Dichos primeros auxilios pueden conducir al desarrollo de quemaduras en la garganta, sangrado.
El tratamiento se lleva a cabo en una institución médica bajo la supervisión de especialistas.
Terapia:
- Limpiar el estómago con una sonda,
- Uso de goteros con soluciones medicinales,
- Prescripción de medicamentos para aliviar el dolor.
- El uso de medicamentos destinados a restaurar el funcionamiento de órganos y sistemas,
- Si es necesario, inhalación de oxígeno y ventilación artificial de los pulmones,
- Llevar a cabo la terapia de reanimación en ausencia de signos de vida,
- Selección de vitaminas y nutrición especial.
El tratamiento se lleva a cabo en cuidados intensivos y luego en un hospital. La duración depende del estado del paciente y del grado de intoxicación.
Quemaduras y envenenamiento
Tan efectivo como es este remedio, es peligroso. El ácido clorhídrico, dependiendo de la concentración, puede provocar quemaduras químicas de cuatro grados:
- Solo hay enrojecimiento y dolor.
- Hay burbujas con un líquido claro e hinchazón.
- Necrosis formada de las capas superiores de la piel.Las ampollas se llenan de sangre o contenido turbio.
- La lesión alcanza los tendones y los músculos.
Si la sustancia de alguna manera entró en los ojos, es necesario enjuagarlos con agua y luego con una solución de soda. Pero en cualquier caso, lo primero que hay que hacer es llamar a una ambulancia.
La ingestión de ácido en el interior está cargada de dolores agudos en el pecho y el abdomen, hinchazón de la laringe, vómitos con masas sanguinolentas. Como resultado, patologías graves del hígado y los riñones.
Y los primeros signos de intoxicación en parejas incluyen tos seca y frecuente, asfixia, daño en los dientes, ardor en las mucosas y dolor abdominal. Los primeros auxilios de emergencia son el lavado y enjuague de la boca con agua, así como el acceso al aire fresco. Solo un toxicólogo puede brindar una ayuda real.
Propiedades del espectro químico
El ácido interactúa con muchos metales, sales. Se considera bastante fuerte y está a la par con la gamuza. La reacción principal se manifiesta en todos los grupos de metales ubicados a la izquierda del hidrógeno (magnesio, hierro, zinc - potenciales eléctricos).
La solución de cloruro de hidrógeno en forma diluida reacciona con las sales, pero solo con las formadas por ácidos menos fuertes. Conocidos por todos los carbonatos de sodio y calcio, después de la interacción con él, se descomponen en agua y monóxido de carbono.
Ácido nítrico
- una reacción cualitativa a la solución salina. Para obtenerlo, es necesario agregar nitrato de plata a este reactivo, como resultado, se formará un precipitado blanco, del cual se obtiene una sustancia nitrogenada.
Con la ayuda de esta mezcla de agua e hidrógeno, se llevan a cabo muchos experimentos interesantes. Por ejemplo, diluirlo con amoníaco. Como resultado, obtendrás un humo blanco, espeso, con la consistencia de pequeños cristales. La metilamina, la anilina, el dióxido de manganeso, el carbonato de potasio son reactivos que también se ven afectados por el ácido.
¿Cómo y por qué se usa?
Quizás, esta es legítimamente una de las sustancias importantes que se encuentran y son necesarias en casi todas las ramas de la vida humana.
Localización del área de aplicación:
- Metalurgia. Limpieza superficial de zonas oxidadas, disolución de óxido, tratamiento previo a la soldadura, estañado. El ácido clorhídrico ayuda a extraer pequeñas inclusiones de metales de los minerales. El circonio y el titanio se obtienen mediante el método de conversión de óxidos en cloruros.
- Industria de la tecnología alimentaria. Una solución de baja concentración se utiliza como aditivo alimentario. La gelatina, la fructosa para diabéticos contienen un emulsionante puro. La soda ordinaria también tiene un alto contenido de esta sustancia. En el embalaje de los productos, lo verá con el nombre E507.
- El campo de la medicina. Con un indicador insuficiente del ambiente ácido en el estómago y problemas con los intestinos. Ph bajo conduce al cáncer. Incluso con una nutrición adecuada, vitaminas en abundancia, el peligro no desaparece, es necesario realizar pruebas para obtener jugo del tracto gástrico, porque en un ambiente insuficientemente ácido, las sustancias útiles prácticamente no se absorben, se altera la digestión.
- La solución de sal se usa como inhibidor: protección contra la suciedad y las infecciones, acción antiséptica. Para la fabricación de mezclas adhesivas, productos cerámicos. Enjuaga los intercambiadores de calor.
- El procedimiento para purificar el agua potable tampoco está completo sin la participación del cloro.
- Producción de caucho, blanqueo de bases de tela.
- Puedes cuidar tus lentes con esta solución.
- Enjuague bucal en casa
- La sustancia es un excelente conductor de electricidad.
Cómo se produce el envenenamiento
El ácido clorhídrico es un líquido incoloro con un olor acre característico. Uno de los ácidos más fuertes, capaz de disolver algunos metales. Se convierte fácilmente en gas.
El cloruro de hidrógeno se utiliza en la industria textil, el negocio del cuero, la metalurgia de metales preciosos, en la producción de pegamento, ácidos.
La sustancia está presente en el estómago en una concentración mínima. El ácido contribuye a la normalización del proceso digestivo, protege al cuerpo de bacterias y microorganismos dañinos.
En una concentración superior al 24%, el ácido clorhídrico puede causar daños irreversibles al cuerpo humano. Los vapores que se forman al entrar en contacto con el aire provocan irritación en los órganos de los sistemas respiratorio y visual.
Hay varios factores que pueden provocar el desarrollo de intoxicaciones.
Factores:
La intoxicación por vapor es posible cuando se trabaja en habitaciones con poca ventilación,
Ingestión por negligencia, más frecuente en niños,
La entrada de ácido clorhídrico en la epidermis, membranas mucosas en caso de incumplimiento de las reglas para usar el reactivo.
El envenenamiento por una sustancia en el hogar en adultos ocurre como resultado del uso sin equipo de protección de la piel, los ojos y los órganos del sistema respiratorio. La intoxicación puede ocurrir cuando el ácido se transfiere incorrectamente de un recipiente a otro.
Farmacodinámica y farmacocinética
¿Qué es la acidez gástrica? Esta es una característica de la concentración de ácido clorhídrico en el estómago. La acidez se expresa en pH
. Normalmente, el ácido debe producirse en la composición del jugo gástrico y tomar parte activa en los procesos de digestión. Fórmula del ácido clorhídrico: HCl
. Es producido por células parietales ubicadas en las glándulas fúndicas, con la participación de H+/K+-ATPasa
. Estas células recubren el fondo y el cuerpo del estómago. La acidez del jugo gástrico en sí es variable y depende del número de células parietales y de la intensidad de los procesos de neutralización de la sustancia por los componentes alcalinos del jugo gástrico. Concentración producida a - eres estable e igual a 160 mmol/l. Una persona sana normalmente no debería producir más de 7 y al menos 5 mmol de una sustancia por hora.
Con una producción insuficiente o excesiva de ácido clorhídrico, se producen enfermedades del tracto digestivo, se deteriora la capacidad de absorber ciertos microelementos, como el hierro. El fármaco estimula la secreción de jugo gástrico, reduce pH
. Activa pepsinógeno
, lo convierte en una enzima activa pepsina
. La sustancia tiene un efecto beneficioso sobre el reflejo ácido del estómago, ralentiza la transición de los alimentos digeridos de forma incompleta a los intestinos. Los procesos de fermentación de los contenidos del tracto digestivo se ralentizan, desaparecen el dolor y los eructos, el hierro se absorbe mejor.
Después de la administración oral, el fármaco se metaboliza parcialmente por la saliva y el moco gástrico, el contenido del duodeno 12. La sustancia no unida penetra en el duodeno, donde es completamente neutralizada por su contenido alcalino.
Otro uso del ácido en la vida cotidiana.
Con una composición ácida, puede limpiar fácilmente la cal y el óxido de las tuberías de loza, eliminar cálculos urinarios y otros contaminantes. Para un mayor efecto, se agrega un inhibidor (por ejemplo, urotropina) al agente, lo que ralentiza la reacción química.
El procedimiento se lleva a cabo de la siguiente manera: se diluye el ácido con agua hasta alcanzar una concentración del 5% y se agrega un inhibidor a razón de 0,5 g por 1 litro de líquido. La superficie se trata con la composición resultante y se deja durante 30-40 minutos (dependiendo del grado de contaminación), luego de lo cual se lava con agua.
También se utiliza una solución ácida suave para eliminar manchas de bayas, tinta u óxido de las telas. Para hacer esto, el material se empapa en la composición por un tiempo, luego de lo cual se enjuaga a fondo y se lava de la manera habitual.
Deshacerse de la escala en el hervidor
Para este propósito, se usa una solución de ácido clorhídrico al 3-5%, que se vierte en un hervidor y se calienta a 60-80°
C durante 1-2 horas o hasta que los depósitos de sarro se desintegren. Después de eso, la escama se afloja y se quita fácilmente con una espátula de madera.
La eficacia del método se debe al hecho de que el reactivo reacciona con los carbonatos de magnesio y calcio y los convierte en sales solubles. El dióxido de carbono liberado al mismo tiempo destruye la capa de escamas y la suelta. Después de eliminar los depósitos de sal, los platos se lavan a fondo con agua limpia.
¡Punto importante!
Este método no es adecuado para descalcificar recipientes de esmalte o aluminio astillados y agrietados: esto corroerá el metal y lo dañará gravemente.
obtener una sustancia
Ahora podemos hablar sobre lo que hacen para formar ácido clorhídrico.
Primero, al quemar hidrógeno en cloro, se obtiene el componente principal, cloruro de hidrógeno gaseoso. que luego se disuelve en agua. El resultado de esta simple reacción es la formación de un ácido sintético.
Esta sustancia también se puede obtener de los gases de escape. Estos son gases residuales (secundarios) químicos. Se forman por una variedad de procesos. Por ejemplo, al clorar hidrocarburos. El cloruro de hidrógeno en su composición se denomina gas de escape. y el ácido así obtenido, respectivamente.
Cabe señalar que en los últimos años la proporción de la sustancia gaseosa en el volumen total de su producción ha ido en aumento. Y el ácido formado como resultado de la quema de hidrógeno en cloro se desplaza. Sin embargo, para ser justos, debe tenerse en cuenta que contiene menos impurezas.
Uso de producción
Tiene una amplia aplicación en las industrias metalúrgica, alimentaria y médica.
- Metalurgia. Úselo para soldar, estañar y limpiar metales.
- Industria de alimentos. Aplicación en la producción de reguladores de acidez de alimentos, por ejemplo, E507.
- Electrotipia. Se utiliza para decapado.
- Medicamento. Encuentra su aplicación en la producción de jugo gástrico artificial.
Incluido en tintes sintéticos. Se utiliza en la producción de productos de limpieza y detergentes. Pero en los líquidos destinados al uso doméstico, la concentración de ácido sulfúrico es despreciable.
Cómo se produce el ácido clorhídrico en el laboratorio
La producción de la sustancia es a gran escala, la venta es gratuita. En las condiciones de los experimentos de laboratorio, se produce una solución por la acción del ácido sulfúrico de alta concentración sobre la sal común de cocina (cloruro de sodio).
Hay 2 métodos para disolver cloruro de hidrógeno en agua:
- El hidrógeno se quema en cloro (sintético).
- Asociado (off-gas). Su esencia está en llevar a cabo la cloración orgánica, la deshidrocloración.
La sustancia se presta bien a la síntesis durante la pirólisis de residuos de organoclorados. Esto sucede como resultado de la descomposición de los hidrocarburos con una falta total de oxígeno. También puede utilizar cloruros metálicos, que son las materias primas de las sustancias inorgánicas. Si no hay ácido sulfúrico concentrado (electrolito), tomar diluido.
En cuanto a la extracción del reactivo en condiciones naturales, la mayoría de las veces esta mezcla química se puede encontrar en las aguas de los desechos volcánicos. El cloruro de hidrógeno es un componente de los minerales silvina (cloruro de potasio, parece huesos para juegos), bischofita. Todos estos son métodos para extraer la sustancia en la industria.
En los humanos, esta enzima se encuentra en el estómago. Una solución puede ser un ácido o una base. Uno de los métodos más comunes de extracción se llama sulfato.
Propiedades químicas
Ácido clorhídrico, cloruro de hidrógeno o ácido clorhídrico - solución ácido clorhídrico
en agua. Según Wikipedia, la sustancia pertenece al grupo de to-t monobásicos fuertes inorgánicos. El nombre completo del compuesto en latín: ácido clorhídrico.
Fórmula del ácido clorhídrico en química: HCl
. En una molécula, los átomos de hidrógeno se combinan con los átomos de halógeno: cl
. Si consideramos la configuración electrónica de estas moléculas, se puede notar que los compuestos participan en la formación de los orbitales moleculares. 1s
-orbitales de hidrógeno y ambos 3s
y 3p
-orbitales de un átomo cl
. En la fórmula química del ácido clorhídrico 1s-
, 3s-
y 3p
-Los orbitales atómicos se superponen y forman 1, 2, 3 orbitales. Donde 3s
-orbital no es vinculante. Hay un desplazamiento de la densidad electrónica hacia el átomo. cl
y la polaridad de la molécula disminuye, pero la energía de enlace de los orbitales moleculares aumenta (si lo consideramos junto con otros haluros de hidrogeno
).
Propiedades físicas del cloruro de hidrógeno. Es un líquido transparente e incoloro que echa humo cuando se expone al aire. Masa molar de un compuesto químico = 36,6 gramos por mol. En condiciones estándar, a una temperatura del aire de 20 grados centígrados, la concentración máxima de una sustancia es del 38 % en peso. La densidad del ácido clorhídrico concentrado en este tipo de solución es de 1,19 g/cm³. En general, las propiedades físicas y características tales como densidad, molaridad, viscosidad, capacidad calorífica, punto de ebullición y pH
, dependen fuertemente de la concentración de la solución. Estos valores se comentan con más detalle en la tabla de densidades. Por ejemplo, la densidad del Ácido Clorhídrico al 10% = 1,048 kg por litro. Cuando solidifica, la sustancia forma hidratos cristalinos
diferentes composiciones.
Propiedades químicas del ácido clorhídrico. ¿Con qué reacciona el ácido clorhídrico? La sustancia interactúa con los metales que se encuentran frente al hidrógeno en una serie de potenciales electroquímicos (hierro, magnesio, zinc y otros). En este caso, las sales se forman y gaseosas. H
. El plomo, el cobre, el oro, la plata y otros metales a la derecha del hidrógeno no reaccionan con el ácido clorhídrico. La sustancia reacciona con óxidos metálicos produciendo agua y una sal soluble. Hidróxido de sodio bajo la acción de to-you formas y agua. La reacción de neutralización es característica de este compuesto.
El ácido clorhídrico diluido reacciona con las sales metálicas, que están formadas por ácidos más débiles. Por ejemplo, ácido propiónico
más débil que la sal. La sustancia no reacciona con ácidos más fuertes. y carbonato de sodio
se formará después de la reacción con HCl
cloruro, monóxido de carbono y agua.
Para un compuesto químico son características las reacciones con agentes oxidantes fuertes, con dióxido de manganeso
, permanganato de potasio
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. La sustancia reacciona con amoníaco
, que produce un humo blanco espeso, que consiste en cristales muy pequeños de cloruro de amonio. El mineral pirolusita también reacciona con el ácido clorhídrico, ya que contiene dióxido de manganeso
: MnO2+4HCl=Cl2+MnO2+2H2O
(reacción de oxidación).
Hay una reacción cualitativa al ácido clorhídrico y sus sales. Cuando una sustancia interactúa con nitrato de plata
un precipitado blanco cloruro de plata
y formado Ácido nítrico
. Ecuación de reacción de interacción metilamina
con cloruro de hidrógeno se ve así: HCl + CH3NH2 = (CH3NH3)Cl
.
Una sustancia reacciona con una base débil. anilina
. Después de disolver la anilina en agua, se agrega ácido clorhídrico a la mezcla. Como resultado, la base se disuelve y forma clorhidrato de anilina
(cloruro de fenilamonio
): (С6Н5NH3)Cl
. La reacción de interacción del carburo de aluminio con ácido clorhídrico: Al4C3+12HCL=3CH4+4AlCl3
. Ecuación de reacción Carbonato de potasio
con lo que queda asi: K2CO3 + 2HCl = 2KCl + H2O + CO2.
Solicitud
en metalurgia para la extracción de minerales, eliminación de herrumbre, incrustaciones, suciedad y óxidos, soldadura y estañado;
en la fabricación de cauchos y resinas sintéticas;
en galvanoplastia;
como regulador de la acidez en la industria alimentaria;
para obtener cloruros metálicos;
para obtener cloro;
en medicina para el tratamiento de la acidez insuficiente del jugo gástrico;
como limpiador y desinfectante.
- (HCl), una solución acuosa de cloruro de hidrógeno, un gas incoloro con un olor acre. Obtenido por la acción del ácido sulfúrico sobre la sal común, como subproducto de la cloración de hidrocarburos, o por reacción de hidrógeno y cloro. El ácido clorhídrico se utiliza para ... ... Diccionario enciclopédico científico y técnico
Ácido clorhídrico
- - HCl (SC) (ácido clorhídrico, ácido clorhídrico, cloruro de hidrógeno) es una solución de cloruro de hidrógeno (HCl) en agua, un aditivo anticongelante. Es un líquido incoloro de olor acre, sin partículas en suspensión. ... ... Enciclopedia de términos, definiciones y explicaciones de materiales de construcción
ÁCIDO CLORHÍDRICO
- (ácido clorhídrico) solución de cloruro de hidrógeno en agua; ácido fuerte Líquido incoloro que echa humo en el aire (el ácido clorhídrico técnico es amarillento debido a las impurezas de Fe, Cl2, etc.). La concentración máxima (a 20 ° C) es del 38% en masa, ... ... Gran Diccionario Enciclopédico
ÁCIDO CLORHÍDRICO
- (Acidum muriaticum, Acid, hydrochloricum), una solución de cloruro de hidrógeno (HC1) en agua. En la naturaleza se encuentra en el agua de determinadas fuentes de origen volcánico, y también se encuentra en los jugos gástricos (hasta un 0,5%). Se puede obtener cloruro de hidrógeno ... Gran Enciclopedia Médica
ÁCIDO CLORHÍDRICO
- (ácido clorhídrico, ácido clorhídrico) ácido volátil monobásico fuerte con olor acre, una solución acuosa de cloruro de hidrógeno; la concentración máxima es del 38% en masa, la densidad de dicha solución es de 1,19 g/cm3. Utilizado en ... ... Enciclopedia rusa de protección laboral.
ÁCIDO CLORHÍDRICO
- (ácido clorhídrico) HCl solución acuosa de cloruro de hidrógeno, ácido monobásico fuerte, volátil, con olor acre; las impurezas del hierro, el cloro lo tiñen de color amarillento. El S. concentrado para vender contiene 37% ... ... Gran Enciclopedia Politécnica
ácido clorhídrico
— sustantivo, número de sinónimos: 1 acid (171) Diccionario de sinónimos ASIS. VN Trishin. 2013... Diccionario de sinónimos
ÁCIDO CLORHÍDRICO
Enciclopedia moderna
Ácido clorhídrico
- ÁCIDO HIDRÓGENO, solución acuosa de cloruro de hidrógeno HCl; un líquido humeante con un olor acre. El ácido clorhídrico se utiliza para obtener diversos cloruros, decapar metales, procesar minerales, en la producción de cloro, sosa, cauchos, etc. ... ... Diccionario Enciclopédico Ilustrado
ácido clorhídrico
- (ácido clorhídrico), una solución de cloruro de hidrógeno en agua; ácido fuerte Líquido incoloro que "echa humo" en el aire (el ácido clorhídrico técnico es amarillento debido a las impurezas de Fe, Cl2, etc.). Concentración máxima (a 20 ° C) 38% en masa, ... ... Diccionario Enciclopédico
¿Cuál es el peligro de intoxicación?
El ácido clorhídrico es un peligro particular para el cuerpo humano. En caso de envenenamiento con dicha sustancia, pueden desarrollarse complicaciones graves y violaciones de la funcionalidad del cuerpo.
Complicaciones:
- Violación del hígado, como resultado de hepatitis tóxica,
- Sangrado en el estómago debido a la destrucción de las paredes del órgano.
- Un estado de shock por dolor cuando el ácido entra en un área grande,
- En caso de contacto con los ojos, discapacidad visual,
- Mal funcionamiento grave de los riñones,
- Insuficiencia respiratoria, asfixia, dificultad para respirar,
- El desarrollo de un coma.
Consecuencias similares se desarrollan gradualmente según el grado de envenenamiento.
Conclusión
Si sigue las precauciones y las reglas de seguridad, el ácido clorhídrico se convertirá en un asistente indispensable en la vida cotidiana. Y puede comprarlo a los precios más asequibles en nuestra empresa.
Como ácidos. El programa educativo prevé la memorización por parte de los estudiantes de los nombres y fórmulas de seis representantes de este grupo. Y, al mirar a través de la tabla provista por el libro de texto, nota en la lista de ácidos el que viene primero y le interesó en primer lugar: el ácido clorhídrico. Por desgracia, en el aula de la escuela, no se estudia la propiedad ni ninguna otra información al respecto. Por lo tanto, aquellos que están ansiosos por adquirir conocimientos fuera del currículo escolar buscan información adicional en todo tipo de fuentes. Pero a menudo, muchos no encuentran la información que necesitan. Y así, el tema del artículo de hoy está dedicado a este ácido en particular.
Definición
El ácido clorhídrico es un ácido monobásico fuerte. En algunas fuentes, puede llamarse clorhídrico y clorhídrico, así como cloruro de hidrógeno.
Propiedades físicas
Es un líquido cáustico incoloro y humeante en el aire (foto de la derecha). Sin embargo, el ácido técnico tiene un color amarillento debido a la presencia de hierro, cloro y otros aditivos en él. Su mayor concentración a una temperatura de 20 ° C es del 38%. La densidad del ácido clorhídrico con tales parámetros es de 1,19 g/cm 3 . Pero este compuesto en diversos grados de saturación tiene datos completamente diferentes.Con una disminución en la concentración, el valor numérico de la molaridad, la viscosidad y el punto de fusión disminuyen, pero aumentan la capacidad calorífica específica y el punto de ebullición. La solidificación del ácido clorhídrico de cualquier concentración da varios hidratos cristalinos.
Propiedades químicas
Todos los metales que preceden al hidrógeno en la serie electroquímica de su voltaje pueden interactuar con este compuesto, formando sales y liberando hidrógeno gaseoso. Si se reemplazan por óxidos metálicos, los productos de reacción serán sal soluble y agua. El mismo efecto se producirá en la interacción del ácido clorhídrico con los hidróxidos. Sin embargo, si se le agrega cualquier sal de metales (por ejemplo, carbonato de sodio), cuyo residuo se tomó de un ácido más débil (carbónico), entonces el cloruro de este metal (sodio), el agua y el gas correspondiente al ácido se forman residuos (en este caso, dióxido de carbono).
Recibo
El compuesto que ahora se analiza se forma cuando se disuelve en agua gas cloruro de hidrógeno, que puede obtenerse quemando hidrógeno en cloro. El ácido clorhídrico, que se obtuvo mediante este método, se llama sintético. Los gases de escape también pueden servir como fuente para obtener esta sustancia. Y tal ácido clorhídrico se llamará gas de escape. Recientemente, el nivel de producción de ácido clorhídrico por este método es mucho más alto que su producción por un método sintético, aunque este último da el compuesto en una forma más pura. Todas estas son formas de conseguirlo en la industria. Sin embargo, en los laboratorios, el ácido clorhídrico se produce de tres formas (las dos primeras difieren solo en la temperatura y los productos de reacción) utilizando varios tipos de interacciones químicas, tales como:
- Efecto del ácido sulfúrico saturado sobre el cloruro de sodio a 150°C.
- La interacción de las sustancias anteriores en condiciones con una temperatura de 550 ° C y superior.
- Hidrólisis de cloruros de aluminio o magnesio.
Solicitud
La hidrometalurgia y el electroformado no pueden prescindir del uso de ácido clorhídrico, donde sea necesario, para limpiar la superficie de los metales durante el estañado y la soldadura y para obtener cloruros de manganeso, hierro, zinc y otros metales. En la industria alimentaria, este compuesto se conoce como aditivo alimentario E507; allí es un regulador de acidez necesario para hacer agua mineral (soda). El ácido clorhídrico concentrado también se encuentra en el jugo gástrico de cualquier persona y ayuda a digerir los alimentos. Durante este proceso, su grado de saturación disminuye, porque. esta composición se diluye con alimentos. Sin embargo, con un ayuno prolongado, la concentración de ácido clorhídrico en el estómago aumenta gradualmente. Y dado que este compuesto es muy cáustico, puede provocar úlceras estomacales.
Conclusión
El ácido clorhídrico puede ser tanto beneficioso como perjudicial para los seres humanos. Su contacto con la piel provoca quemaduras químicas graves, y los vapores de este compuesto irritan las vías respiratorias y los ojos.
Pero si maneja esta sustancia con cuidado, puede ser útil más de una vez en