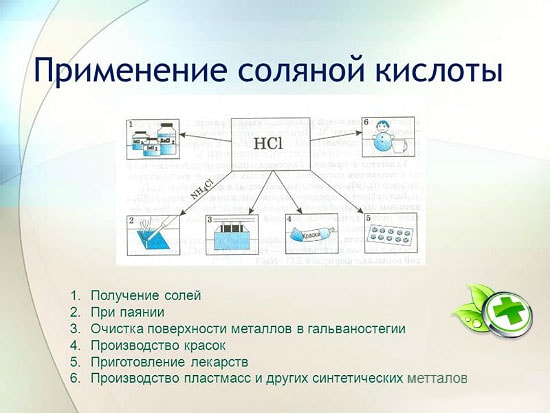
Kloorivetyhapon käyttö
Kloorivetyhappoa käytetään laajalti teollisuudessa metallien uuttamiseen malmeista, metallien peittaukseen jne. Sitä käytetään myös juotosnesteen valmistuksessa, hopean kerrostuksessa ja kiinteänä osana aqua regiaa.
Kloorivetyhapon käyttö teollisuudessa on pienempi kuin typpihapon. Tämä johtuu siitä, että suolahappo aiheuttaa teräslaitteiden korroosiota. Lisäksi sen haihtuvat höyryt ovat varsin haitallisia ja aiheuttavat myös metallituotteiden korroosiota. Tämä on otettava huomioon suolahappoa varastoitaessa. Kloorivetyhappoa varastoidaan ja kuljetetaan kumipäällysteisissä säiliöissä ja tynnyreissä, ts. astioissa, joiden sisäpinta on päällystetty haponkestävällä kumilla, sekä lasipulloissa ja polyeteeniastioissa.
Kloorivetyhappoa käytetään sinkin, mangaanin, raudan ja muiden metallien kloridien sekä ammoniumkloridin valmistukseen. Kloorivetyhappoa käytetään metallien, astioiden, kaivojen pintojen puhdistamiseen karbonaateista, oksideista ja muista sedimenteistä ja epäpuhtauksista. Tässä tapauksessa käytetään erityisiä lisäaineita - inhibiittoreita, jotka suojaavat metallia liukenemiselta ja korroosiolta, mutta eivät hidasta oksidien, karbonaattien ja muiden vastaavien yhdisteiden liukenemista.
HCl:a käytetään synteettisten hartsien, kumien teollisessa tuotannossa. Sitä käytetään raaka-aineena valmistettaessa metyylikloridia metyylialkoholista, etyylikloridia eteenistä ja vinyylikloridia asetyleenistä.
Ensiapu ja hoitomenetelmät
Jos myrkytyksen merkkejä havaitaan, on kutsuttava ambulanssi. Kotona on sallittua suorittaa toimintoja, joiden tarkoituksena on parantaa uhrin tilaa. Ensiapu suolahappomyrkytyksen yhteydessä on suoritettava nopeasti negatiivisten seurausten riskin vähentämiseksi.
Tapahtumat:
- Jos suolayhdistettä joutuu iholle, vaurioituneet alueet pestään runsaalla viileällä vedellä. Käsittelyaika on vähintään puoli tuntia.
- Höyrymyrkytystapauksessa uhrille tarjotaan pääsy raittiiseen ilmaan, ikkunat avataan, tiukat vaatteet avataan.
- On suositeltavaa seurata potilaan tilaa, jos elämän merkkejä ei ole, elvytys suoritetaan.
- Höyryistä uhri saa juoda lämmintä teetä, vettä. On suositeltavaa huuhdella nenä ja suu viileällä vedellä.
- Jos yliannostus johtuu hapon nauttimisesta, vatsan alueelle asetetaan jääpakkaus estämään tai vähentämään mahdollista verenvuotoa.
- Lääkkeitä ei sallita. Potilaalle saa antaa lasillinen vettä (voit mineraali-emäksistä). Nestettä tarvitaan pienissä kulauksissa.
- Vatsaa ei saa pestä, yritä oksentaa kotona. Tällainen ensiapu voi johtaa kurkun palovammojen kehittymiseen, verenvuotoon.
Hoito suoritetaan lääketieteellisessä laitoksessa asiantuntijoiden valvonnassa.
Terapia:
- Vatsan puhdistaminen anturin avulla,
- Tippaleiden käyttö lääkeliuosten kanssa,
- Lääkkeiden määrääminen kivun lievittämiseksi
- Elinten ja järjestelmien toiminnan palauttamiseen tarkoitettujen lääkkeiden käyttö,
- Tarvittaessa happihengitys ja keuhkojen tekohengitys,
- Elvytyshoidon suorittaminen ilman elonmerkkejä,
- Vitamiinien valikoima ja erikoisravinto.
Hoito suoritetaan tehohoidossa ja sen jälkeen sairaalassa. Kesto riippuu potilaan tilasta ja myrkytysasteesta.
Palovammat ja myrkytykset
Niin tehokas kuin tämä lääke on, se on vaarallinen. Kloorivetyhappo voi pitoisuudesta riippuen aiheuttaa neljän asteen kemiallisia palovammoja:
- On vain punoitusta ja kipua.
- On rakkuloita, joissa on kirkasta nestettä ja turvotusta.
- Muodostunut ihon ylempien kerrosten nekroosi.Rakkulat täyttyvät verellä tai samealla sisällöllä.
- Vaurio ulottuu jänteisiin ja lihaksiin.
Jos ainetta joutui jotenkin silmiin, ne on huuhdeltava vedellä ja sitten soodaliuoksella. Mutta joka tapauksessa ensimmäinen asia, joka on tehtävä, on kutsua ambulanssi.
Hapon nieleminen sisällä on täynnä akuutteja rinta- ja vatsakipuja, kurkunpään turvotusta, veristen massojen oksentelua. Seurauksena on vakavia maksan ja munuaisten patologioita.
Ja ensimmäisiä myrkytyksen merkkejä pareittain ovat kuiva toistuva yskä, tukehtuminen, hampaiden vaurioituminen, limakalvojen polttaminen ja vatsakipu. Ensimmäinen hätäapu on suun pesu ja huuhtelu vedellä sekä pääsy raittiiseen ilmaan. Vain toksikologi voi tarjota todellista apua.
Kemiallisen spektrin ominaisuudet
Happo on vuorovaikutuksessa monien metallien, suolojen kanssa. Sitä pidetään melko vahvana ja se on tasavertainen säämiskän kanssa. Pääreaktio ilmenee kaikissa metalliryhmissä, jotka sijaitsevat vedyn vasemmalla puolella (magnesium, rauta, sinkki - sähköpotentiaalit).
Laimeassa muodossa oleva kloorivetyliuos reagoi suolojen kanssa, mutta vain vähemmän vahvojen happojen muodostamien suolojen kanssa. Kaikille natrium- ja kalsiumkarbonaateille tuttuja, vuorovaikutuksessa sen kanssa ne hajoavat vedeksi ja hiilimonoksidiksi.
Typpihappo
- laadullinen reaktio suolaliuokseen. Sen saamiseksi on tarpeen lisätä hopeanitraattia tähän reagenssiin, minkä seurauksena muodostuu valkoinen sakka, josta saadaan typpiaine.
Tämän veden ja vedyn seoksen avulla suoritetaan monia mielenkiintoisia kokeita. Laimenna se esimerkiksi ammoniakilla. Tämän seurauksena saat valkoista savua, paksua, jonka konsistenssi on pieniä kiteitä. Metyyliamiini, aniliini, mangaanidioksidi ja kaliumkarbonaatti ovat reagensseja, joihin myös happo vaikuttaa.
Miten ja miksi sitä käytetään
Ehkä tämä on oikeutetusti yksi tärkeimmistä aineista, joita löytyy ja tarvitaan melkein kaikilla ihmiselämän aloilla.
Sovellusalueen lokalisointi:
- Metallurgia. Pintojen puhdistus hapettuneilta alueilta, ruosteenpoisto, esijuotoskäsittely, tinaus. Kloorivetyhappo auttaa uuttamaan pieniä metallisulkeumia malmeista. Zirkoniumia ja titaania saadaan käyttämällä menetelmää, jolla oksidit muunnetaan klorideiksi.
- Elintarviketeknologiateollisuus. Elintarvikkeiden lisäaineena käytetään matalapitoisuutta liuosta. Gelatiini, fruktoosi diabeetikoille sisältävät puhdasta emulgointiainetta. Tavallisessa soodassa on myös korkea pitoisuus tätä ainetta. Tavaroiden pakkauksessa näet sen nimellä E507.
- Lääketieteen ala. Riittämätön indikaattori mahalaukun happamasta ympäristöstä ja suolisto-ongelmista. Matala Ph johtaa syöpään. Jopa oikealla ravitsemuksella, runsaasti vitamiineja, vaara ei katoa, on tarpeen suorittaa testejä mehun saamiseksi mahalaukusta, koska riittämättömän happamassa ympäristössä hyödylliset aineet eivät käytännössä imeydy, ruoansulatus häiriintyy.
- Suolaliuosta käytetään estäjänä - suojaa lialta ja infektioilta, antiseptinen vaikutus. Liimaseosten, keraamisten tuotteiden valmistukseen. Se huuhtelee lämmönvaihtimia.
- Juomaveden puhdistusmenettely ei myöskään ole täydellinen ilman kloorin osallistumista.
- Kumin valmistus, kangaspohjien valkaisu.
- Tällä ratkaisulla voit hoitaa linssejäsi.
- Suuvesi kotona
- Aine on erinomainen sähkönjohdin.
Kuinka myrkytys tapahtuu
Kloorivetyhappo on väritöntä nestettä, jolla on tyypillinen pistävä haju. Yksi vahvimmista hapoista, joka pystyy liuottamaan joitain metalleja. Muuttuu helposti kaasuksi.
Kloorivetyä käytetään tekstiiliteollisuudessa, nahkateollisuudessa, jalometallien metallurgiassa, liiman ja happojen valmistuksessa.
Ainetta on mahalaukussa pieninä pitoisuuksina. Happo edistää ruoansulatusprosessin normalisoitumista, suojaa kehoa haitallisilta bakteereilta ja mikro-organismeilta.
Yli 24 %:n pitoisuudella suolahappo voi aiheuttaa peruuttamatonta haittaa ihmiskeholle. Kosketuksessa ilman kanssa muodostuneet höyryt ärsyttävät näkö- ja hengityselimiä.
On useita tekijöitä, jotka voivat aiheuttaa myrkytyksen kehittymisen.
Tekijät:
Höyrymyrkytys on mahdollista, kun työskentelet tiloissa, joissa on huono ilmanvaihto,
Nieleminen huolimattomuudesta, yleisempi lapsilla,
Kloorivetyhapon pääsy orvaskelle, limakalvoille, jos reagenssin käyttöä koskevia sääntöjä ei noudateta.
Aikuisten kotona tapahtuva ainemyrkytys johtuu ihon, silmien ja hengityselinten suojavarusteiden käytöstä ilman. Myrkytys voi tapahtua, kun happoa siirretään epätarkasti säiliöstä toiseen.
Farmakodynamiikka ja farmakokinetiikka
Mikä on mahalaukun happamuus? Tämä on ominaisuus suolahapon pitoisuudelle mahassa. Happamuus ilmaistaan pH
. Normaalisti happoa tulee tuottaa mahanesteen koostumuksessa ja osallistua aktiivisesti ruoansulatusprosesseihin. Kloorivetyhapon kaava: HCl
. Sitä tuottavat pohjarauhasissa sijaitsevat parietaalisolut, joihin osallistuvat H+/K+-ATPaasi
. Nämä solut reunustavat mahan pohjaa ja runkoa. Itse mahanesteen happamuus vaihtelee ja riippuu parietaalisolujen lukumäärästä ja aineen neutralointiprosessien voimakkuudesta mahanesteen emäksisten komponenttien avulla. Pitoisuus tuotetaan - olet vakaa ja vastaa 160 mmol/l. Terveen ihmisen ei pitäisi normaalisti tuottaa enempää kuin 7 ja vähintään 5 mmol ainetta tunnissa.
Riittämättömällä tai liiallisella suolahapon tuotannolla esiintyy ruoansulatuskanavan sairauksia, kyky imeä tiettyjä mikroelementtejä, kuten rautaa, heikkenee. Lääke stimuloi mahanesteen eritystä, vähentää pH
. Aktivoi pepsinogeeni
, muuttaa sen aktiiviseksi entsyymiksi pepsiini
. Aine vaikuttaa suotuisasti mahalaukun happorefleksiin, hidastaa epätäydellisesti sulatetun ruoan siirtymistä suolistoon. Ruoansulatuskanavan sisällön käymisprosessit hidastuvat, kipu ja röyhtäily häviävät, rauta imeytyy paremmin.
Oraalisen annon jälkeen lääke metaboloituu osittain syljen ja mahalaukun liman vaikutuksesta, pohjukaissuolen sisältö 12. Sitoutumaton aine tunkeutuu pohjukaissuoleen, jossa sen alkalinen sisältö neutraloi sen täysin.
Toinen hapon käyttö jokapäiväisessä elämässä
Happamalla koostumuksella voit helposti puhdistaa kalkki- ja ruosteen fajanssiputkistosta, poistaa virtsakiven ja muut epäpuhtaudet. Suuremman vaikutuksen saavuttamiseksi aineeseen lisätään inhibiittoria (esimerkiksi urotropiinia), joka hidastaa kemiallista reaktiota.
Menettely suoritetaan seuraavasti: happoa laimennetaan vedellä, kunnes saavutetaan 5 %:n pitoisuus, ja lisätään inhibiittoria nopeudella 0,5 g per 1 litra nestettä. Pinta käsitellään saadulla koostumuksella ja jätetään 30-40 minuutiksi (saastumisasteesta riippuen), minkä jälkeen se pestään vedellä.
Mietoa happoliuosta käytetään myös marja-, muste- tai ruostetahrojen poistamiseen kankaista. Tätä varten materiaalia liotetaan koostumuksessa jonkin aikaa, minkä jälkeen se huuhdellaan perusteellisesti ja pestään tavalliseen tapaan.
Kattilakiven poistaminen kattilassa
Tätä tarkoitusta varten käytetään 3-5-prosenttista suolahappoliuosta, joka kaadetaan kattilaan ja kuumennetaan 60-80 asteeseen.°
C 1-2 tuntia tai kunnes kalkkijäämät hajoavat. Sen jälkeen asteikko löystyy ja on helppo poistaa puisella lastalla.
Menetelmän tehokkuus johtuu siitä, että reagenssi reagoi magnesium- ja kalsiumkarbonaattien kanssa ja muuttaa ne liukoisiksi suoloiksi. Samalla vapautuva hiilidioksidi tuhoaa hilsekerroksen ja irrottaa sen. Suolakertymien poistamisen jälkeen astiat pestään perusteellisesti puhtaalla vedellä.
Tärkeä pointti!
Tämä menetelmä ei sovellu kalkinpoistoon halkeilevista ja halkeilevista emali- tai alumiinikattiloista: tämä syövyttää metallia ja aiheuttaa vakavia vaurioita.
Aineen saaminen
Nyt voimme puhua siitä, mitä he tekevät muodostaakseen suolahappoa.
Ensinnäkin polttamalla vetyä kloorissa saadaan pääkomponentti, kaasumainen kloorivety. joka sitten liuotetaan veteen. Tämän yksinkertaisen reaktion tulos on synteettisen hapon muodostuminen.
Tätä ainetta voidaan saada myös poistokaasuista. Nämä ovat kemiallisia jätekaasuja (sivukaasuja). Ne muodostuvat erilaisilla prosesseilla. Esimerkiksi kloorattaessa hiilivetyjä. Niiden koostumuksessa olevaa kloorivetyä kutsutaan poistokaasuksi. Ja näin saatu happo, vastaavasti.
On huomattava, että viime vuosina poistokaasuaineen osuus sen tuotannon kokonaismäärästä on kasvanut. Ja vedyn palamisen seurauksena kloorissa muodostunut happo syrjäytetään. Rehellisyyden nimissä on kuitenkin huomattava, että se sisältää vähemmän epäpuhtauksia.
Tuotantokäyttö
Sillä on laaja sovellus metallurgisessa, elintarvike- ja lääketeollisuudessa.
- Metallurgia. Käytetään metallien juottamiseen, tinaukseen ja puhdistukseen.
- Ruokateollisuus. Käyttö elintarvikkeiden happamuudensäätöaineiden valmistuksessa, esimerkiksi E507.
- Elektrotyyppi. Käytetään peittaukseen.
- Lääke. Se löytää sovelluksensa keinotekoisen mahanesteen valmistuksessa.
Sisältyy synteettisiin väriaineisiin. Sitä käytetään puhdistus- ja pesuaineiden valmistuksessa. Mutta kotikäyttöön tarkoitetuissa nesteissä rikkihapon pitoisuus on mitätön.
Kuinka suolahappoa tuotetaan laboratoriossa
Aineen tuotanto on laajamittaista, myynti on ilmaista. Laboratoriokokeiden olosuhteissa liuos tuotetaan vaikuttamalla korkean pitoisuuden rikkihappoa tavalliseen keittiösuolaan (natriumkloridi).
Kloorivedyn liuottamiseksi veteen on kaksi tapaa:
- Vetyä poltetaan kloorissa (synteettinen).
- Liittynyt (poistokaasu). Sen ydin on orgaanisen kloorauksen, dehydrokloorauksen suorittaminen.
Aine soveltuu hyvin synteesiin organokloorista peräisin olevan jätteen pyrolyysin aikana. Tämä tapahtuu hiilivetyjen hajoamisen seurauksena täydellisen hapen puutteen seurauksena. Voit käyttää myös metalliklorideja, jotka ovat epäorgaanisten aineiden raaka-aineita. Jos väkevää rikkihappoa (elektrolyyttiä) ei ole, ota laimennettuna.
Mitä tulee reagenssin uuttamiseen luonnollisissa olosuhteissa, tämä kemiallinen seos löytyy useimmiten vulkaanisen jätteen vesistä. Kloorivety on sylviinin (kaliumkloridi, näyttää luilta pelien) kivennäisaineissa, biskofiitissa. Kaikki nämä ovat menetelmiä aineen uuttamiseksi teollisuudessa.
Ihmisillä tämä entsyymi löytyy mahalaukusta. Liuos voi olla joko happoa tai emästä. Yksi yleisimmistä uuttomenetelmistä on nimeltään sulfaatti.
Kemiallisia ominaisuuksia
Kloorivetyhappo, kloorivety tai suolahappo - liuos HCl
vedessä. Wikipedian mukaan aine kuuluu ryhmään epäorgaaniset vahvat yksiemäksiset to-t. Yhdisteen koko nimi latinaksi: suolahappo.
Kloorivetyhapon kaava kemiassa: HCl
. Molekyylissä vetyatomit yhdistyvät halogeeniatomien kanssa - Cl
. Jos tarkastellaan näiden molekyylien elektronista konfiguraatiota, voidaan havaita, että yhdisteet osallistuvat molekyylien kiertoradan muodostumiseen 1s
-vetykiertoradat ja molemmat 3s
ja 3p
-atomin kiertoradat Cl
. Kloorivetyhapon kemiallisessa kaavassa 1s-
, 3s-
ja 3r
-atomiorbitaalit menevät päällekkäin ja muodostavat 1, 2, 3 orbitaalia. Jossa 3s
-orbital ei ole sitova. Elektronitiheys siirtyy atomiin Cl
ja molekyylin polariteetti pienenee, mutta molekyyliratojen sitoutumisenergia kasvaa (jos ajatellaan sitä yhdessä muiden kanssa vetyhalogenidit
).
Kloorivedyn fysikaaliset ominaisuudet. Se on kirkas, väritön neste, joka savuaa joutuessaan alttiiksi ilmalle. Kemiallisen yhdisteen moolimassa = 36,6 grammaa moolia kohden. Normaaliolosuhteissa, 20 celsiusasteen ilman lämpötilassa, aineen enimmäispitoisuus on 38 painoprosenttia. Väkevän suolahapon tiheys tällaisessa liuoksessa on 1,19 g/cm³. Yleisesti ottaen fysikaaliset ominaisuudet ja ominaisuudet, kuten tiheys, molaarisuus, viskositeetti, lämpökapasiteetti, kiehumispiste ja pH
, riippuvat voimakkaasti liuoksen pitoisuudesta. Näitä arvoja käsitellään tarkemmin tiheystaulukossa. Esimerkiksi kloorivetyhapon 10 % tiheys = 1,048 kg litrassa. Kiinteytettynä aine muodostuu kiteisiä hydraatteja
erilaisia koostumuksia.
Kloorivetyhapon kemialliset ominaisuudet. Minkä kanssa suolahappo reagoi? Aine on vuorovaikutuksessa metallien kanssa, jotka seisovat vedyn edessä sähkökemiallisten potentiaalien sarjassa (rauta, magnesium, sinkki ja muut). Tässä tapauksessa muodostuu suoloja ja kaasumaisia H
. Lyijy, kupari, kulta, hopea ja muut vedyn oikealla puolella olevat metallit eivät reagoi kloorivetyhapon kanssa. Aine reagoi metallioksidien kanssa muodostaen vettä ja liukoista suolaa. Natriumhydroksidi to-you-muotojen ja veden vaikutuksesta. Neutralointireaktio on ominaista tälle yhdisteelle.
Laimennettu kloorivetyhappo reagoi metallisuolojen kanssa, joita muodostavat heikommat hapot. Esimerkiksi, propionihappo
heikompi kuin suola. Aine ei reagoi vahvempien happojen kanssa. ja Sooda
muodostuu reaktion jälkeen HCl
kloridi, hiilimonoksidi ja vesi.
Kemialliselle yhdisteelle reaktiot voimakkaiden hapettimien kanssa ovat ominaisia mangaanidioksidi
, kaliumpermanganaattia
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. Aine reagoi ammoniakkia
, joka tuottaa paksua valkoista savua, joka koostuu erittäin hienoista ammoniumkloridikiteistä. Mineraalipyrolusiitti reagoi myös suolahapon kanssa sellaisenaan mangaanidioksidi
: Mn02+4HCl=Cl2+Mn02+2H20
(hapetusreaktio).
Suolahappoon ja sen suoloihin tapahtuu kvalitatiivinen reaktio. Kun aine on vuorovaikutuksessa hopeanitraatti
valkoinen sakka hopeakloridi
ja muodostettu typpihappo
. Vuorovaikutusreaktioyhtälö metyyliamiini
kloorivedyn kanssa näyttää tältä: HCl + CH3NH2 = (CH3NH3)Cl
.
Aine reagoi heikon emäksen kanssa aniliini
. Kun aniliini on liuotettu veteen, seokseen lisätään suolahappoa. Tämän seurauksena emäs liukenee ja muodostuu aniliinihydrokloridi
(fenyyliammoniumkloridi
): (С6Н5NH3)Cl
. Alumiinikarbidin vuorovaikutuksen reaktio suolahapon kanssa: Al4C3+12HCL=3CH4+4AICl3
. Reaktioyhtälö kaliumkarbonaatti
jonka kanssa se näyttää tältä: K2CO3 + 2HCl = 2KCl + H2O + CO2.
Sovellus
metallurgiassa malmien louhintaan, ruosteen, hilseen, lian ja oksidien poistoon, juottamiseen ja tinaukseen;
synteettisten kumien ja hartsien valmistuksessa;
galvanoinnissa;
happamuudensäätöaineena elintarviketeollisuudessa;
metallikloridien saamiseksi;
kloorin saamiseksi;
lääketieteessä mahanesteen riittämättömän happamuuden hoitoon;
puhdistus- ja desinfiointiaineena.
- (HCl), vetykloridin vesiliuos, väritön kaasu, jolla on pistävä haju. Saatu rikkihapon vaikutuksesta tavalliseen suolaan, hiilivetyjen kloorauksen sivutuotteena tai vedyn ja kloorin reaktiolla. Kloorivetyhappoa käytetään ... ... Tieteellinen ja tekninen tietosanakirja
Suolahappo
- - HCl (SC) (kloorivetyhappo, suolahappo, kloorivety) on kloorivedyn (HCl) liuos vedessä, jäätymisenestoaine. Se on väritön neste, jolla on pistävä haju, ilman suspendoituneita hiukkasia... ... Rakennusmateriaalien termien, määritelmien ja selitysten tietosanakirja
SUOLAHAPPO
- (kloorivetyhappo) kloorivedyn liuos vedessä; vahvaa happoa. Väritön neste, joka savuaa ilmassa (tekninen suolahappo on kellertävää Fe:n, Cl2:n jne. epäpuhtauksien takia). Maksimipitoisuus (20 °C:ssa) on 38 massaprosenttia, ... ... Big Encyclopedic Dictionary
SUOLAHAPPO
- (Acidum muriaticum, Acid, hydrochloricum), kloorivedyn (HC1) liuos vedessä. Luonnossa sitä esiintyy tiettyjen vulkaanista alkuperää olevien lähteiden vedessä, ja sitä löytyy myös mahanesteestä (jopa 0,5%). Kloorivetyä voi saada ... Big Medical Encyclopedia
SUOLAHAPPO
- (kloorivetyhappo, kloorivetyhappo) vahva yksiemäksinen haihtuva happo, jolla on pistävä haju, kloorivedyn vesiliuos; maksimipitoisuus on 38 massaprosenttia, tällaisen liuoksen tiheys on 1,19 g/cm3. Käytetään ... ... venäläisessä työsuojelun tietosanakirjassa
SUOLAHAPPO
- (kloorivetyhappo) HCl:n vesiliuos vetykloridia, vahva yksiemäksinen happo, haihtuva, pistävä haju; raudan epäpuhtaudet, kloori tahraa sen kellertäväksi. Keskitetty S. myydään sisältää 37% ... ... Big Polytechnic Encyclopedia
suolahappo
— substantiivi, synonyymien lukumäärä: 1 happo (171) ASIS Synonyymisanakirja. V.N. Trishin. 2013 ... Synonyymisanakirja
SUOLAHAPPO
Nykyaikainen tietosanakirja
Suolahappo
- VETYHAPPO, kloorivedyn HCl:n vesiliuos; savuava neste, jolla on pistävä haju. Kloorivetyhappoa käytetään erilaisten kloridien, metallien peittaukseen, malmien prosessointiin, kloorin, soodan, kumien jne. valmistukseen. ... ... Kuvitettu Ensyklopedinen sanakirja
suolahappo
- (kloorivetyhappo), kloorivedyn liuos vedessä; vahvaa happoa. Väritön neste, "savuva" ilmassa (tekninen suolahappo on kellertävää Fe:n, Cl2:n jne. epäpuhtauksien takia). Maksimipitoisuus (20 °C:ssa) 38 massaprosenttia, ... ... Encyclopedic Dictionary
Mikä on myrkytyksen vaara
Kloorivetyhappo on erityinen vaara ihmiskeholle. Jos myrkytys sellaisella aineella, voi kehittyä vakavia komplikaatioita ja kehon toimintahäiriöitä.
Komplikaatiot:
- Maksan toimintahäiriö myrkyllisen hepatiitin seurauksena,
- Verenvuoto mahassa elimen tuhoutuneiden seinien vuoksi,
- Shokki kivusta, kun happoa pääsee suurelle alueelle,
- Jos ainetta joutuu silmiin, näön heikkeneminen,
- Vakava munuaisten toimintahäiriö,
- Hengitysvajaus, tukehtuminen, hengenahdistus,
- Kooman kehittyminen.
Samanlaiset seuraukset kehittyvät vähitellen myrkytyksen asteesta riippuen.
Johtopäätös
Jos noudatat varotoimia ja turvallisuussääntöjä, suolahaposta tulee välttämätön apulainen jokapäiväisessä elämässä. Ja voit ostaa sen edullisimmalla hinnalla yrityksessämme.
Kuten hapot. Koulutusohjelmassa opiskelijoiden on opittava ulkoa tämän ryhmän kuuden edustajan nimet ja kaavat. Ja kun katsot oppikirjan tarjoamaa taulukkoa, huomaat happoluettelossa sen, joka on ensin ja joka kiinnosti sinua ensisijaisesti - kloorivetyhappo. Valitettavasti koulun luokkahuoneessa ei tutkita omaisuutta eikä muitakaan tietoja siitä. Siksi ne, jotka haluavat saada tietoa koulun opetussuunnitelman ulkopuolelta, etsivät lisätietoa kaikenlaisista lähteistä. Mutta usein monet eivät löydä tarvitsemaansa tietoa. Ja niinpä tämän päivän artikkelin aihe on omistettu tälle hapolle.
Määritelmä
Kloorivetyhappo on vahva yksiemäksinen happo. Joissakin lähteissä sitä voidaan kutsua kloorivety- ja kloorivetyhapoksi sekä vetykloridiksi.
Fyysiset ominaisuudet
Se on väritöntä ja savuavaa emäksistä nestettä ilmassa (kuva oikealla). Teknisellä hapolla on kuitenkin kellertävä väri, koska siinä on rautaa, klooria ja muita lisäaineita. Sen suurin pitoisuus 20 °C:n lämpötilassa on 38%. Kloorivetyhapon tiheys tällaisilla parametreilla on 1,19 g/cm3. Mutta tällä yhdisteellä eri kylläisyysasteilla on täysin erilaiset tiedot.Pitoisuuden pienentyessä molaarisuuden, viskositeetin ja sulamispisteen numeerinen arvo laskee, mutta ominaislämpökapasiteetti ja kiehumispiste kasvavat. Minkä tahansa pitoisuuden suolahapon kiinteyttäminen tuottaa erilaisia kiteisiä hydraatteja.
Kemiallisia ominaisuuksia
Kaikki metallit, jotka tulevat ennen vetyä niiden jännitteen sähkökemiallisessa sarjassa, voivat olla vuorovaikutuksessa tämän yhdisteen kanssa, muodostaen suoloja ja vapauttaen vetykaasua. Jos ne korvataan metallioksideilla, reaktiotuotteet ovat liukoista suolaa ja vettä. Sama vaikutus on kloorivetyhapon vuorovaikutuksessa hydroksidien kanssa. Jos siihen kuitenkin lisätään metallien suolaa (esim. natriumkarbonaattia), jonka jäännös on otettu heikommalta haposta (hiili), niin tämän metallin kloridia (natrium), vettä ja happoa vastaavaa kaasua jäännös (tässä tapauksessa hiilidioksidi) muodostuu.
Kuitti
Nyt käsitelty yhdiste muodostuu, kun vetykloridikaasua, joka voidaan saada polttamalla vetyä kloorissa, liuotetaan veteen. Tällä menetelmällä saatua suolahappoa kutsutaan synteettiseksi. Poistokaasut voivat myös toimia lähteenä tämän aineen saamiseksi. Ja tällaista suolahappoa kutsutaan pakohapoksi. Viime aikoina suolahapon tuotantotaso tällä menetelmällä on paljon korkeampi kuin sen synteettisellä menetelmällä, vaikka jälkimmäinen antaa yhdisteen puhtaammassa muodossa. Nämä ovat kaikki tapoja saada se teollisuudessa. Kuitenkin laboratorioissa suolahappoa tuotetaan kolmella tavalla (kaksi ensimmäistä eroavat vain lämpötilan ja reaktiotuotteiden osalta) käyttämällä erilaisia kemiallisia vuorovaikutuksia, kuten:
- Kyllästetyn rikkihapon vaikutus natriumkloridiin 150 o C:n lämpötilassa.
- Yllä olevien aineiden vuorovaikutus olosuhteissa, joiden lämpötila on 550 ° C tai korkeampi.
- Alumiini- tai magnesiumkloridien hydrolyysi.
Sovellus
Hydrometallurgia ja sähkömuovaus eivät tule toimeen ilman suolahapon käyttöä siellä, missä sitä tarvitaan metallien pinnan puhdistamiseen tinauksen ja juottamisen aikana sekä mangaanin, raudan, sinkin ja muiden metallien kloridien saamiseksi. Elintarviketeollisuudessa tämä yhdiste tunnetaan elintarvikelisäaineena E507 - siellä se on happamuudensäätöaine, jota tarvitaan seltzer- (sooda)veden valmistamiseen. Konsentroitua suolahappoa löytyy myös jokaisen ihmisen mahanesteestä ja se auttaa sulattamaan ruokaa. Tämän prosessin aikana sen kyllästysaste laskee, koska. tämä koostumus laimennetaan ruoalla. Pitkäaikaisessa paastossa suolahapon pitoisuus mahassa kuitenkin kasvaa vähitellen. Ja koska tämä yhdiste on erittäin syövyttävää, se voi johtaa mahahaavoihin.
Johtopäätös
Kloorivetyhappo voi olla sekä hyödyllistä että haitallista ihmisille. Sen ihokosketus johtaa vakaviin kemiallisiin palovammoihin, ja tämän yhdisteen höyryt ärsyttävät hengitysteitä ja silmiä.
Mutta jos käsittelet tätä ainetta huolellisesti, siitä voi olla hyötyä useammin kuin kerran