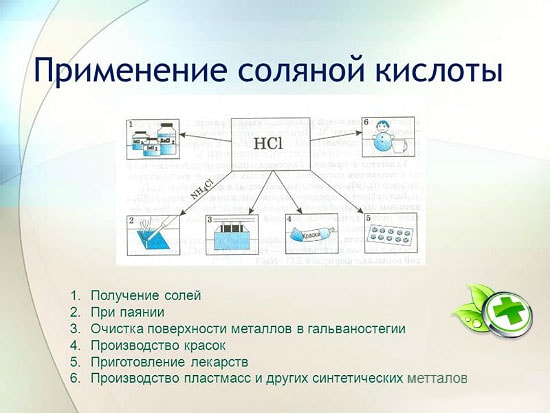
L'uso di acido cloridrico
L'acido cloridrico è ampiamente utilizzato nell'industria per l'estrazione di metalli dai minerali, il decapaggio dei metalli, ecc. Viene anche utilizzato nella produzione di liquido di saldatura, nella deposizione di argento e come parte integrante dell'acqua regia.
La scala dell'uso dell'acido cloridrico nell'industria è inferiore a quella dell'acido nitrico. Ciò è dovuto al fatto che l'acido cloridrico provoca la corrosione delle apparecchiature in acciaio. Inoltre, i suoi vapori volatili sono piuttosto dannosi e causano anche la corrosione dei prodotti in metallo. Questo deve essere preso in considerazione quando si conserva l'acido cloridrico. L'acido cloridrico viene immagazzinato e trasportato in serbatoi e botti rivestiti di gomma, ad es. in vasi, la cui superficie interna è ricoperta di gomma resistente agli acidi, nonché in bottiglie di vetro e utensili in polietilene.
L'acido cloridrico viene utilizzato per produrre cloruri di zinco, manganese, ferro e altri metalli, nonché cloruro di ammonio. L'acido cloridrico viene utilizzato per pulire le superfici di metalli, vasi, pozzi da carbonati, ossidi e altri sedimenti e contaminanti. In questo caso vengono utilizzati additivi speciali: inibitori che proteggono il metallo dalla dissoluzione e dalla corrosione, ma non ritardano la dissoluzione di ossidi, carbonati e altri composti simili.
L'HCl è utilizzato nella produzione industriale di resine sintetiche, gomme. Viene utilizzato come materia prima nella produzione di cloruro di metile dall'alcol metilico, cloruro di etile dall'etilene e cloruro di vinile dall'acetilene.
Primo soccorso e metodi di trattamento
Se vengono rilevati segni di avvelenamento, è necessario chiamare un'ambulanza. A casa è consentito svolgere attività volte a migliorare le condizioni della vittima. Il primo soccorso per l'avvelenamento da acido cloridrico dovrebbe essere effettuato rapidamente per ridurre il rischio di conseguenze negative.
Eventi:
- Se il composto salino viene a contatto con la pelle, le aree danneggiate vengono lavate con abbondante acqua fredda. Il tempo di elaborazione è di almeno mezz'ora.
- In caso di intossicazione da vapori, alla vittima viene fornito l'accesso all'aria aperta, le finestre vengono aperte, i vestiti attillati vengono sbottonati.
- Si raccomanda di monitorare le condizioni del paziente, in assenza di segni di vita, viene eseguita la rianimazione.
- La vittima dei vapori può bere tè caldo, acqua. Si consiglia di sciacquare naso e bocca con acqua fredda.
- In caso di sovradosaggio dovuto all'ingestione di acido, viene applicato un impacco di ghiaccio sull'addome per prevenire o ridurre possibili emorragie.
- Non sono ammessi medicinali. È consentito dare al paziente un bicchiere d'acqua (puoi essere minerale alcalino). È necessario bere liquido a piccoli sorsi.
- Non è consentito lavare lo stomaco, provare a indurre il vomito a casa. Tale primo soccorso può portare allo sviluppo di ustioni alla gola, sanguinamento.
Il trattamento viene effettuato in un istituto medico sotto la supervisione di specialisti.
Terapia:
- Pulire lo stomaco con una sonda,
- Uso di contagocce con soluzioni medicinali,
- Prescrivere farmaci per alleviare il dolore
- L'uso di farmaci volti a ripristinare il funzionamento di organi e sistemi,
- Se necessario, inalazione di ossigeno e ventilazione artificiale dei polmoni,
- Effettuare una terapia di rianimazione in assenza di segni di vita,
- Selezione di vitamine e nutrizione speciale.
Il trattamento viene effettuato in terapia intensiva e poi in ospedale. La durata dipende dalle condizioni del paziente e dal grado di avvelenamento.
Ustioni e avvelenamento
Per quanto efficace sia questo rimedio, è pericoloso. L'acido cloridrico, a seconda della concentrazione, può causare ustioni chimiche di quattro gradi:
- C'è solo arrossamento e dolore.
- Ci sono vesciche con un liquido chiaro e gonfiore.
- Necrosi formata degli strati superiori della pelle.Le bolle si riempiono di sangue o contenuto torbido.
- La lesione raggiunge tendini e muscoli.
Se la sostanza in qualche modo è entrata negli occhi, è necessario risciacquarli con acqua e poi con una soluzione di soda. Ma in ogni caso, la prima cosa da fare è chiamare un'ambulanza.
L'ingestione di acido all'interno è irta di dolori acuti al petto e all'addome, gonfiore della laringe, vomito di masse sanguinolente. Di conseguenza, gravi patologie del fegato e dei reni.
E i primi segni di avvelenamento in coppia includono tosse secca frequente, soffocamento, danni ai denti, bruciore alle mucose e dolore addominale. Il primo soccorso è il lavaggio e il risciacquo della bocca con acqua, nonché l'accesso all'aria fresca. Solo un tossicologo può fornire un aiuto reale.
Proprietà dello spettro chimico
L'acido interagisce con molti metalli, sali. È considerato abbastanza forte ed è alla pari del camoscio. La reazione principale si manifesta in tutti i gruppi di metalli situati a sinistra dell'idrogeno (magnesio, ferro, zinco - potenziali elettrici).
La soluzione di acido cloridrico in forma diluita reagisce con i sali, ma solo con quelli formati da acidi meno forti. Conosciuti da tutto il carbonato di sodio e di calcio, dopo l'interazione con esso, si decompongono in acqua e monossido di carbonio.
L'acido nitrico
- una reazione qualitativa alla soluzione salina. Per ottenerlo, è necessario aggiungere nitrato d'argento a questo reagente, di conseguenza si formerà un precipitato bianco, da cui si ottiene una sostanza azotata.
Con l'aiuto di questa miscela di acqua e idrogeno, vengono condotti molti esperimenti interessanti. Ad esempio, diluiscilo con l'ammoniaca. Di conseguenza, otterrete un fumo bianco, denso, avente la consistenza di piccoli cristalli. Metilamina, anilina, biossido di manganese, carbonato di potassio sono reagenti che risentono anche dell'acido.
Come e perché si usa
Forse questa è giustamente una delle sostanze importanti che si trovano e sono necessarie in quasi tutti i rami della vita umana.
Localizzazione dell'area di applicazione:
- Metallurgia. Pulizia superficiale da zone ossidate, dissoluzione ruggine, trattamento di pre-saldatura, stagnatura. L'acido cloridrico aiuta ad estrarre piccole inclusioni di metalli dai minerali. Zirconio e titanio si ottengono utilizzando il metodo della conversione degli ossidi in cloruri.
- Industria delle tecnologie alimentari. Una soluzione a bassa concentrazione viene utilizzata come additivo alimentare. Gelatina, fruttosio per diabetici contengono un emulsionante puro. La soda ordinaria ha anche un alto contenuto di questa sostanza. Sulla confezione della merce lo vedrai sotto il nome E507.
- Il campo della medicina. Con un indicatore insufficiente dell'ambiente acido nello stomaco e problemi con l'intestino. Ph basso porta al cancro. Anche con una corretta alimentazione, vitamine in abbondanza, il pericolo non scompare, è necessario eseguire test per ottenere il succo dal tratto gastrico, perché in un ambiente non sufficientemente acido, le sostanze utili non vengono praticamente assorbite, la digestione è disturbata.
- La soluzione salina viene utilizzata come inibitore: protezione contro lo sporco e le infezioni, azione antisettica. Per la fabbricazione di miscele adesive, prodotti ceramici. Lava gli scambiatori di calore.
- Anche la procedura per purificare l'acqua potabile non è completa senza la partecipazione del cloro.
- Produzione di gomma, candeggio di basi in tessuto.
- Puoi prenderti cura delle tue lenti con questa soluzione.
- Collutorio a casa
- La sostanza è un ottimo conduttore di elettricità.
Come si verifica l'avvelenamento
L'acido cloridrico è un liquido incolore con un caratteristico odore pungente. Uno degli acidi più forti, in grado di sciogliere alcuni metalli. Si trasforma facilmente in gas.
Il cloruro di idrogeno è utilizzato nell'industria tessile, nella pelletteria, nella metallurgia dei metalli preziosi, nella produzione di colle, acidi.
La sostanza è presente nello stomaco in minima concentrazione. L'acido contribuisce alla normalizzazione del processo digestivo, protegge il corpo da batteri e microrganismi nocivi.
A una concentrazione superiore al 24%, l'acido cloridrico può causare danni irreversibili al corpo umano. I vapori formatisi al contatto con l'aria provocano irritazione agli organi dell'apparato visivo e respiratorio.
Ci sono diversi fattori che possono provocare lo sviluppo di avvelenamento.
Fattori:
L'intossicazione da vapore è possibile quando si lavora in ambienti con scarsa ventilazione,
Ingestione per negligenza, più comune nei bambini,
L'ingresso di acido cloridrico sull'epidermide, le mucose in caso di mancato rispetto delle regole per l'uso del reagente.
L'avvelenamento da una sostanza in casa negli adulti si verifica a seguito dell'uso senza dispositivi di protezione della pelle, degli occhi e degli organi dell'apparato respiratorio. L'intossicazione può verificarsi quando l'acido viene trasferito in modo impreciso da un contenitore all'altro.
Farmacodinamica e farmacocinetica
Cos'è l'acidità gastrica? Questa è una caratteristica della concentrazione di acido cloridrico nello stomaco. L'acidità è espressa in pH
. Normalmente, l'acido dovrebbe essere prodotto nella composizione del succo gastrico e prendere parte attiva ai processi di digestione. Formula di acido cloridrico: HCl
. È prodotto dalle cellule parietali situate nelle ghiandole del fondo, con la partecipazione di H+/K+-ATPasi
. Queste cellule rivestono il fondo e il corpo dello stomaco. L'acidità del succo gastrico stesso è variabile e dipende dal numero di cellule parietali e dall'intensità dei processi di neutralizzazione della sostanza da parte dei componenti alcalini del succo gastrico. Concentrazione prodotta a - sei stabile e pari a 160 mmol/l. Una persona sana dovrebbe normalmente produrre non più di 7 e almeno 5 mmol di una sostanza all'ora.
Con una produzione insufficiente o eccessiva di acido cloridrico, si verificano malattie dell'apparato digerente, la capacità di assorbire alcuni microelementi, come il ferro, si deteriora. Il farmaco stimola la secrezione di succo gastrico, riduce pH
. Si attiva pepsinogeno
, lo converte in un enzima attivo pepsina
. La sostanza ha un effetto benefico sul riflesso acido dello stomaco, rallenta il passaggio del cibo non completamente digerito nell'intestino. I processi di fermentazione del contenuto del tubo digerente rallentano, il dolore e l'eruttazione scompaiono, il ferro viene assorbito meglio.
Dopo somministrazione orale, il farmaco viene parzialmente metabolizzato dalla saliva e dal muco gastrico, il contenuto del duodeno 12. La sostanza non legata penetra nel duodeno, dove viene completamente neutralizzata dal suo contenuto alcalino.
Un altro uso dell'acido nella vita di tutti i giorni
Con una composizione acida, puoi pulire facilmente il calcare e la ruggine dalle tubature in maiolica, rimuovere la pietra urinaria e altri contaminanti. Per un effetto maggiore, all'agente viene aggiunto un inibitore (ad esempio urotropina), che rallenta la reazione chimica.
La procedura viene eseguita come segue: l'acido viene diluito con acqua fino a raggiungere una concentrazione del 5% e viene aggiunto un inibitore in ragione di 0,5 g per 1 litro di liquido. La superficie viene trattata con la composizione risultante e lasciata per 30-40 minuti (a seconda del grado di contaminazione), dopodiché viene lavata con acqua.
Una soluzione acida delicata viene utilizzata anche per rimuovere macchie di bacche, inchiostro o macchie di ruggine dai tessuti. Per fare questo, il materiale viene immerso nella composizione per un po ', dopodiché viene accuratamente risciacquato e lavato nel solito modo.
Sbarazzarsi di scala nel bollitore
A tale scopo viene utilizzata una soluzione di acido cloridrico al 3-5%, che viene versata in un bollitore e riscaldata a 60-80°
C per 1-2 ore o fino a quando i depositi di calcare non si disintegrano. Successivamente, la scala si allenta e si rimuove facilmente con una spatola di legno.
L'efficacia del metodo è dovuta al fatto che il reagente reagisce con i carbonati di magnesio e calcio e li converte in sali solubili. L'anidride carbonica rilasciata allo stesso tempo distrugge lo strato di scaglie e lo libera. Dopo aver rimosso i depositi di sale, le stoviglie vengono lavate accuratamente con acqua pulita.
Punto importante!
Questo metodo non è adatto per disincrostare lo smalto scheggiato e screpolato o i bollitori di alluminio: ciò corroderà il metallo e lo danneggerà gravemente.
Ottenere una sostanza
Ora possiamo parlare di cosa fanno per formare acido cloridrico.
In primo luogo, bruciando idrogeno nel cloro, si ottiene il componente principale, acido cloridrico gassoso. che viene poi sciolto in acqua. Il risultato di questa semplice reazione è la formazione di un acido sintetico.
Questa sostanza può essere ottenuta anche dai gas di scarico. Questi sono gas di scarico (laterali) chimici. Sono formati da una varietà di processi. Ad esempio, durante la clorazione di idrocarburi. L'acido cloridrico nella loro composizione è chiamato gas di scarico. E l'acido così ottenuto, rispettivamente.
Va notato che negli ultimi anni la quota della sostanza off-gas nel volume totale della sua produzione è in aumento. E l'acido formato dalla combustione dell'idrogeno nel cloro viene spostato. Tuttavia, in tutta onestà, va notato che contiene meno impurità.
Uso produttivo
Ha un'ampia applicazione nell'industria metallurgica, alimentare e medica.
- Metallurgia. Utilizzare nella saldatura, stagnatura e pulizia dei metalli.
- Industria alimentare. Applicazione nella produzione di regolatori di acidità alimentare, ad esempio E507.
- Elettrotipo. Usato per il decapaggio.
- Medicinale. Trova la sua applicazione nella produzione di succo gastrico artificiale.
Incluso in coloranti sintetici. Viene utilizzato nella produzione di prodotti per la pulizia e la detergenza. Ma nei liquidi destinati all'uso domestico, la concentrazione di acido solforico è trascurabile.
Come viene prodotto l'acido cloridrico in laboratorio
La produzione della sostanza è su larga scala, la vendita è gratuita. Nelle condizioni degli esperimenti di laboratorio, una soluzione viene prodotta dall'azione dell'acido solforico ad alta concentrazione sul normale sale da cucina (cloruro di sodio).
Esistono 2 metodi per sciogliere l'acido cloridrico in acqua:
- L'idrogeno viene bruciato nel cloro (sintetico).
- Associato (off-gas). La sua essenza sta nell'effettuare la clorazione organica, la deidroclorurazione.
La sostanza si presta bene alla sintesi durante la pirolisi dei rifiuti da organoclorurati. Ciò accade a causa della rottura degli idrocarburi con una completa mancanza di ossigeno. Puoi anche usare cloruri metallici, che sono le materie prime delle sostanze inorganiche. Se non c'è acido solforico concentrato (elettrolita), assumere diluito.
Per quanto riguarda l'estrazione del reagente in condizioni naturali, molto spesso questa miscela chimica si trova nelle acque dei rifiuti vulcanici. Il cloruro di idrogeno è un componente dei minerali sylvin (cloruro di potassio, sembra ossa per i giochi), bischofite. Tutti questi sono metodi per estrarre la sostanza nell'industria.
Negli esseri umani, questo enzima si trova nello stomaco. Una soluzione può essere sia un acido che una base. Uno dei metodi di estrazione più comuni è chiamato solfato.
Proprietà chimiche
Acido cloridrico, acido cloridrico o acido cloridrico - soluzione Hcl
in acqua. Secondo Wikipedia, la sostanza appartiene al gruppo degli inorganici monobasici forti to-t. Il nome completo del composto in latino: acido cloridrico.
Formula dell'acido cloridrico in chimica: HCl
. In una molecola, gli atomi di idrogeno si combinano con gli atomi di alogeno - cl
. Se consideriamo la configurazione elettronica di queste molecole, si può notare che i composti partecipano alla formazione degli orbitali molecolari 1s
-orbitali dell'idrogeno ed entrambi 3s
e 3p
-orbitali di un atomo cl
. Nella formula chimica dell'acido cloridrico 1s-
, 3s-
e 3p
-gli orbitali atomici si sovrappongono e formano 1, 2, 3 orbitali. in cui 3s
-orbitale non è vincolante. C'è uno spostamento della densità elettronica nell'atomo cl
e la polarità della molecola diminuisce, ma aumenta l'energia di legame degli orbitali molecolari (se la consideriamo insieme ad altre alogenuri di idrogeno
).
Proprietà fisiche dell'acido cloridrico. È un liquido limpido e incolore che fuma se esposto all'aria. Massa molare di un composto chimico = 36,6 grammi per mole. In condizioni standard, a una temperatura dell'aria di 20 gradi Celsius, la concentrazione massima di una sostanza è del 38% in peso. La densità dell'acido cloridrico concentrato in questo tipo di soluzione è 1,19 g/cm³. In generale, proprietà fisiche e caratteristiche come densità, molarità, viscosità, capacità termica, punto di ebollizione e pH
, dipendono fortemente dalla concentrazione della soluzione. Questi valori sono discussi in modo più dettagliato nella tabella delle densità. Ad esempio, la densità dell'acido cloridrico 10% = 1,048 kg per litro. Quando si solidifica, la sostanza si forma idrati cristallini
composizioni diverse.
Proprietà chimiche dell'acido cloridrico. Con cosa reagisce l'acido cloridrico? La sostanza interagisce con i metalli che stanno di fronte all'idrogeno in una serie di potenziali elettrochimici (ferro, magnesio, zinco e altri). In questo caso, si formano sali e gassosi h
. Piombo, rame, oro, argento e altri metalli a destra dell'idrogeno non reagiscono con l'acido cloridrico. La sostanza reagisce con ossidi metallici producendo acqua e un sale solubile. Sodio idrossido sotto l'azione di forme e acqua. La reazione di neutralizzazione è caratteristica di questo composto.
L'acido cloridrico diluito reagisce con i sali metallici, che sono formati da acidi più deboli. Ad esempio, acido propionico
più debole del sale. La sostanza non reagisce con acidi più forti. e carbonato di sodio
si formerà dopo la reazione con HCl
cloruro, monossido di carbonio e acqua.
Per un composto chimico, sono caratteristiche reazioni con forti agenti ossidanti, con biossido di manganese
, Permanganato di Potassio
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. La sostanza reagisce con ammoniaca
, che produce un denso fumo bianco, costituito da cristalli molto piccoli di cloruro di ammonio. Il minerale pirolusite reagisce anche con l'acido cloridrico, poiché contiene biossido di manganese
: MnO2+4HCl=Cl2+MnO2+2H2O
(reazione di ossidazione).
Esiste una reazione qualitativa all'acido cloridrico e ai suoi sali. Quando una sostanza interagisce con nitrato d'argento
un precipitato bianco cloruro d'argento
e formato l'acido nitrico
. Equazione di reazione di interazione metilammina
con acido cloridrico si presenta così: HCl + CH3NH2 = (CH3NH3)Cl
.
Una sostanza reagisce con una base debole anilina
. Dopo aver sciolto l'anilina in acqua, alla miscela viene aggiunto acido cloridrico. Di conseguenza, la base si dissolve e si forma cloridrato di anilina
(cloruro di fenilammonio
): (С6Н5NH3)Cl
. La reazione di interazione del carburo di alluminio con acido cloridrico: Al4C3+12HCL=3CH4+4AlCl3
. Equazione di reazione carbonato di potassio
con cui si presenta così: K2CO3 + 2HCl = 2KCl + H2O + CO2.
Applicazione
nella metallurgia per l'estrazione di minerali, rimozione di ruggine, incrostazioni, sporco e ossidi, saldatura e stagnatura;
nella fabbricazione di gomme e resine sintetiche;
in galvanica;
come regolatore di acidità nell'industria alimentare;
ottenere cloruri metallici;
ottenere il cloro;
in medicina per il trattamento dell'acidità insufficiente del succo gastrico;
come detergente e disinfettante.
- (HCl), una soluzione acquosa di acido cloridrico, un gas incolore dall'odore pungente. Ottenuto dall'azione dell'acido solforico sul sale comune, come sottoprodotto della clorazione degli idrocarburi, o dalla reazione di idrogeno e cloro. L'acido cloridrico è usato per ... ... Dizionario enciclopedico scientifico e tecnico
Acido cloridrico
- - HCl (SC) (acido cloridrico, acido cloridrico, acido cloridrico) è una soluzione di acido cloridrico (HCl) in acqua, un additivo antigelo. È un liquido incolore dall'odore pungente, senza particelle in sospensione. ... ... Enciclopedia di termini, definizioni e spiegazioni dei materiali da costruzione
ACIDO CLORIDRICO
- (acido cloridrico) soluzione di acido cloridrico in acqua; acido forte. Un liquido incolore fumante nell'aria (l'acido cloridrico tecnico è giallastro a causa delle impurità di Fe, Cl2, ecc.). La concentrazione massima (a 20°C) è del 38% in massa, ... ... Grande Dizionario Enciclopedico
ACIDO CLORIDRICO
- (Acidum muriaticum, Acid, hydrochloricum), una soluzione di acido cloridrico (HC1) in acqua. In natura si trova nell'acqua di alcune sorgenti di origine vulcanica e si trova anche nel succo gastrico (fino allo 0,5%). L'acido cloridrico può essere ottenuto ... Grande enciclopedia medica
ACIDO CLORIDRICO
- (acido cloridrico, acido cloridrico) acido volatile monobasico forte con un odore pungente, una soluzione acquosa di acido cloridrico; la concentrazione massima è del 38% in massa, la densità di tale soluzione è 1,19 g/cm3. Usato in ... ... Enciclopedia russa della protezione del lavoro
ACIDO CLORIDRICO
- (acido cloridrico) HCl soluzione acquosa di acido cloridrico, acido monobasico forte, volatile, di odore pungente; impurità di ferro, il cloro la macchia giallastra. Il concentrato S. da vendere contiene il 37%... ... Grande Enciclopedia Politecnica
acido cloridrico
— sostantivo, numero di sinonimi: 1 acid (171) Dizionario dei sinonimi ASIS. V.N. Trishin. 2013 ... Dizionario dei sinonimi
ACIDO CLORIDRICO
Enciclopedia moderna
Acido cloridrico
- ACIDO IDROGENO, soluzione acquosa di acido cloridrico HCl; un liquido fumante con un odore pungente. L'acido cloridrico viene utilizzato per ottenere vari cloruri, decapaggio dei metalli, lavorazione dei minerali, nella produzione di cloro, soda, gomme, ecc... ... Dizionario Enciclopedico Illustrato
acido cloridrico
- (acido cloridrico), una soluzione di acido cloridrico in acqua; acido forte. Un liquido incolore "fumante" nell'aria (l'acido cloridrico tecnico è giallastro a causa delle impurità di Fe, Cl2, ecc.). Concentrazione massima (a 20°C) 38% in massa, ... ... Dizionario Enciclopedico
Qual è il pericolo di intossicazione
L'acido cloridrico è un pericolo particolare per il corpo umano. In caso di avvelenamento con una tale sostanza, possono svilupparsi gravi complicazioni e violazioni della funzionalità del corpo.
Complicazioni:
- Violazione del fegato, a causa di epatite tossica,
- Sanguinamento nello stomaco a causa delle pareti distrutte dell'organo,
- Uno stato di shock dovuto al dolore quando l'acido entra in una vasta area,
- In caso di contatto con gli occhi, disabilità visiva,
- Grave malfunzionamento dei reni,
- Insufficienza respiratoria, soffocamento, mancanza di respiro,
- Lo sviluppo di un coma.
Conseguenze simili si sviluppano gradualmente a seconda del grado di avvelenamento.
Conclusione
Se segui le precauzioni e le regole di sicurezza, l'acido cloridrico diventerà un assistente indispensabile nella vita di tutti i giorni. E puoi acquistarlo ai prezzi più convenienti nella nostra azienda.
Come gli acidi. Il programma educativo prevede la memorizzazione da parte degli studenti dei nomi e delle formule di sei rappresentanti di questo gruppo. E, guardando la tabella fornita dal libro di testo, noti nell'elenco degli acidi quello che viene prima e ti interessa in primo luogo: l'acido cloridrico. Purtroppo, in classe a scuola, non viene studiata né la proprietà né altre informazioni a riguardo. Pertanto, coloro che sono desiderosi di acquisire conoscenze al di fuori del curriculum scolastico sono alla ricerca di informazioni aggiuntive in tutti i tipi di fonti. Ma spesso, molti non trovano le informazioni di cui hanno bisogno. E quindi il tema dell'articolo di oggi è dedicato a questo particolare acido.
Definizione
L'acido cloridrico è un forte acido monobasico. In alcune fonti, può essere chiamato cloridrico e cloridrico, nonché acido cloridrico.
Proprietà fisiche
È un liquido caustico incolore e fumante nell'aria (foto a destra). Tuttavia, l'acido tecnico ha un colore giallastro a causa della presenza di ferro, cloro e altri additivi. La sua massima concentrazione a una temperatura di 20 ° C è del 38%. La densità dell'acido cloridrico con tali parametri è 1,19 g/cm 3 . Ma questo composto in vari gradi di saturazione ha dati completamente diversi.Con una diminuzione della concentrazione, il valore numerico di molarità, viscosità e punto di fusione diminuisce, ma aumentano la capacità termica specifica e il punto di ebollizione. La solidificazione dell'acido cloridrico di qualsiasi concentrazione dà vari idrati cristallini.
Proprietà chimiche
Tutti i metalli che precedono l'idrogeno nella serie elettrochimica del loro voltaggio possono interagire con questo composto, formando sali e rilasciando idrogeno gassoso. Se vengono sostituiti da ossidi metallici, i prodotti di reazione saranno sale e acqua solubili. Lo stesso effetto sarà nell'interazione dell'acido cloridrico con gli idrossidi. Se, tuttavia, viene aggiunto ad esso qualsiasi sale di metalli (ad esempio carbonato di sodio), il cui residuo è stato prelevato da un acido più debole (carbonico), quindi cloruro di questo metallo (sodio), acqua e gas corrispondenti all'acido si formano residui (in questo caso anidride carbonica).
Ricevuta
Il composto ora discusso si forma quando il gas acido cloridrico, che può essere ottenuto bruciando idrogeno nel cloro, viene disciolto in acqua. L'acido cloridrico, che è stato ottenuto con questo metodo, è chiamato sintetico. I gas di scarico possono anche servire come fonte per ottenere questa sostanza. E tale acido cloridrico sarà chiamato gas di scarico. Recentemente, il livello di produzione di acido cloridrico utilizzando questo metodo è molto superiore alla sua produzione con un metodo sintetico, sebbene quest'ultimo dia il composto in una forma più pura. Questi sono tutti modi per ottenerlo nell'industria. Tuttavia, nei laboratori, l'acido cloridrico viene prodotto in tre modi (i primi due differiscono solo per la temperatura e i prodotti di reazione) utilizzando vari tipi di interazioni chimiche, come ad esempio:
- Effetto dell'acido solforico saturo sul cloruro di sodio a 150°C.
- L'interazione delle suddette sostanze in condizioni con una temperatura di 550 ° C e oltre.
- Idrolisi di cloruri di alluminio o magnesio.
Applicazione
L'idrometallurgia e l'elettroformatura non possono prescindere dall'utilizzo dell'acido cloridrico, ove necessario, per pulire la superficie dei metalli durante la stagnatura e la saldatura e per ottenere cloruri di manganese, ferro, zinco e altri metalli. Nell'industria alimentare, questo composto è noto come additivo alimentare E507 - lì è necessario un regolatore di acidità per produrre acqua seltz (soda). L'acido cloridrico concentrato si trova anche nel succo gastrico di qualsiasi persona e aiuta a digerire il cibo. Durante questo processo, il suo grado di saturazione diminuisce, perché. questa composizione è diluita con il cibo. Tuttavia, con il digiuno prolungato, la concentrazione di acido cloridrico nello stomaco aumenta gradualmente. E poiché questo composto è molto caustico, può causare ulcere allo stomaco.
Conclusione
L'acido cloridrico può essere sia benefico che dannoso per l'uomo. Il suo contatto con la pelle provoca gravi ustioni chimiche e i vapori di questo composto irritano le vie respiratorie e gli occhi.
Ma se gestisci con cura questa sostanza, può tornare utile più di una volta