Sfruttamento

Nelle batterie a flusso di vanadio, entrambi gli elettrodi di riferimento sono inoltre collegati a serbatoi di stoccaggio e pompe in modo che volumi molto grandi di elettrolita possano circolare attraverso la cella. La circolazione dell'elettrolita liquido è alquanto difficile e limita l'uso di batterie a flusso di vanadio nelle industrie che richiedono mobilità, rendendole efficaci nei grandi edifici fissi.
Quando una batteria al vanadio viene caricata, gli ioni VO2+ nell'elettrodo di riferimento caricato positivamente si trasformano in ioni VO2+ quando gli elettroni vengono staccati dal terminale positivo della batteria. Allo stesso modo, nell'elettrodo di riferimento negativo, gli elettroni convertono gli ioni V3+ in V2+. Durante la scarica, questo processo viene invertito, determinando una tensione a circuito aperto di 1,41 V a 25°C.
Altre proprietà utili delle batterie a flusso di vanadio includono una risposta molto rapida alle variazioni di carico e una capacità di sovraccarico estremamente elevata. La ricerca dell'Università del New South Wales ha dimostrato che possono raggiungere tempi di risposta inferiori a mezzo millisecondo con variazioni di carico del 100% e resistere a un sovraccarico del 400% per oltre 10 secondi. Il tempo di risposta è nella maggior parte dei casi limitato dalle apparecchiature elettriche. Le batterie al vanadio a base di acido solforico funzionano solo a temperature di 10-40°C. Se la temperatura è inferiore a questo intervallo, gli ioni di acido solforico cristallizzano. L'efficienza nel movimento alternativo nell'uso quotidiano rimane al livello del 65-75%.
Caratteristiche di carica e scarica
Gli algoritmi di ricarica dipendono direttamente da come è organizzata la batteria e dal tipo a cui appartiene. Ad esempio, alcune batterie possono ricaricare in sicurezza la loro capacità da fonti di tensione costante. Altri funzionano solo con una sorgente di corrente regolabile che può modificare i parametri a seconda del livello di carica.
Un processo di ricarica organizzato in modo errato può danneggiare la batteria. In casi estremi, la batteria potrebbe incendiarsi o esplodere. Esistono batterie intelligenti dotate di dispositivi di monitoraggio della tensione. I parametri principali che dovrebbero essere presi in considerazione quando si utilizzano batterie galvaniche reversibili sono:
- Durata. Anche con una corretta manipolazione, il numero di cicli di carica di una batteria è limitato. I diversi sistemi di batterie non sempre si consumano per gli stessi motivi. Ma in generale, la durata della batteria è limitata principalmente dal numero di cicli di carica-scarica completi e, in secondo luogo, dalla durata del progetto senza riferimento all'intensità di utilizzo.
- Tempo di ricarica. Il design fondamentale della batteria non implica la ricarica ad una velocità arbitrariamente elevata: la resistenza interna della cella galvanica porterà alla conversione della corrente di carica in eccesso in calore, che può danneggiare irreversibilmente il dispositivo. Da un punto di vista fisico, il tempo di carica è limitato dalla massima velocità di diffusione del materiale attivo attraverso l'elettrolita.Semplificando, possiamo presumere che il ripristino della piena capacità in un'ora sia un buon indicatore.
- Profondità di scarico. Specificato come percentuale della potenza nominale. Descrive la capacità utilizzabile. Per diversi tipi di batterie, il livello di scarica operativo consigliato può variare. A causa di cambiamenti di funzionamento o invecchiamento, l'indicatore di profondità massima perde il suo valore originale.
processo di diffusione.
A causa del processo di diffusione, dell'allineamento della densità dell'elettrolito nella cavità del vano batteria e nei pori della massa attiva delle piastre, la polarizzazione dell'elettrodo può essere mantenuta nella batteria quando il circuito esterno è spento.
La velocità di diffusione dipende direttamente dalla temperatura dell'elettrolita, maggiore è la temperatura, più veloce è il processo e può variare notevolmente nel tempo, da due ore a un giorno. La presenza di due componenti del potenziale dell'elettrodo in condizioni transitorie ha portato alla divisione in EMF di equilibrio e di non equilibrio della batteria. L'equilibrio elettromagnetico della batteria è influenzato dal contenuto e dalla concentrazione di ioni di sostanze attive nell'elettrolita, nonché dalle proprietà chimiche e fisiche delle sostanze attive. Il ruolo principale nell'entità dell'EMF è giocato dalla densità dell'elettrolita e la temperatura praticamente non lo influisce. La dipendenza dell'EMF dalla densità può essere espressa dalla formula:
La fem della batteria non è uguale alla tensione della batteria, che dipende dalla presenza o meno di un carico sui suoi terminali.
amministratore25/07/2011
Un commento
Nome *
Luogo
Questo sito utilizza Akismet per combattere lo spam. Scopri come vengono elaborati i dati dei tuoi commenti.
« Contagiri meccanico
Voltaggio batteria "
Tag
Malfunzionamenti VAZ, VAZ Sensori Accensione Iniettore Dispositivi Schema di avviamento Auto elettriche Alimentazione vaz 2110 gazzella gazzella registrar di imprese riparazione auto
Voci recenti
- Sensori in macchina: tipi e scopo
- L'auto elettrica più grande del mondo EDumper,
- Luci laser.
- Vantaggi e svantaggi delle lampade alogene
- Il dispositivo e il principio di funzionamento dei sensori di parcheggio
Archivi
Archivi Select Select Settembre 2017 Agosto 2017 luglio 2017 giugno 2017 maggio 2017 Aprile 2017 marzo 2017 dicembre 2016 novembre 2016 ottobre 2016 settembre 2016 agosto 2016 luglio 2016 giugno 2016 maggio 2016 aprile 2016 marzo 2016 febbraio 2016 novembre 2015 ottobre 2015 agosto 2015 luglio 2015 giugno 2015 maggio 2015 Gennaio 2015 Dicembre 2014 Novembre 2014 Ottobre 2014 Settembre 2014 Agosto 2014 Luglio 2014 Giugno 2014 Maggio 2014 Aprile 2014 Febbraio 2014 Gennaio 2014 Dicembre 2013 Novembre 2013 Ottobre 2013 Agosto 2013 Giugno 2013 Maggio 2013 Mart Settembre 2012, 2013, 2012, 2012, 2012, 2012, 2012, 2012, 2012, 2012 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, Settembre 2012, 2011, 2011, 2011, 2011, 2011, 2011
Categorie
- Batteria dell'accumulatore
- video
- Generatore
- Sensori
- Diagnostica
- Accensione
- notizia
- Attrezzatura
- Dispositivi
- Riparazione
- Candela
- Antipasto
- schema
- Dispositivi
- auto elettrica
- Alimentazione elettrica
Siamo nei social network
Elettricista automobilistico @ Tutti i diritti riservati. Quando si copiano i materiali del sito, è necessario fornire un collegamento al sito.
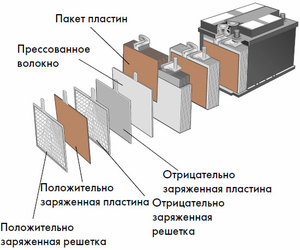
Dispositivo e principio di funzionamento
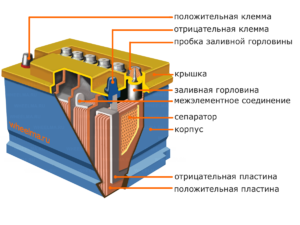
Ciascuna di queste celle ha un catodo (elettrodo positivo) e un anodo (negativo). Questi elettrodi sono separati da un elettrolita che assicura lo scambio di ioni tra di loro. I materiali degli elettrodi e la composizione dell'elettrolita vengono scelti per fornire una forza elettromotrice sufficiente tra i terminali della batteria.
Poiché gli elettrodi contengono un potenziale limitato di energia chimica, la batteria si esaurirà durante il funzionamento. Il tipo di celle galvaniche, che si adatta al rifornimento dopo una scarica parziale o completa, è chiamato batteria. Un insieme di tali celle interconnesse è una batteria.Il funzionamento a batteria comporta un cambio ciclico di due stati:
- Ricarica - la batteria funziona come un ricevitore di elettricità, all'interno delle celle l'energia elettrica si realizza in trasformazioni chimiche.
- Scarica: il dispositivo funziona come una fonte di corrente elettrica convertendo l'energia delle reazioni chimiche in energia elettrica.
Aree di utilizzo
La caratteristica di capacità ultra elevata delle batterie redox al vanadio le rende adatte per l'uso in settori che richiedono un elevato accumulo di energia. Ad esempio, aiutando a bilanciare il volume di produzione di tali fonti di energia come l'eolico o il solare, o aiutando i generatori ad assorbire grandi picchi di energia quando necessario, o bilanciando l'offerta e la domanda di energia per aree remote.
Le limitate caratteristiche di autoscarica delle batterie redox al vanadio le rendono utili nei settori in cui le batterie devono essere conservate per lunghi periodi di tempo con manutenzione e prontezza minime. Ciò ha portato al loro utilizzo in alcuni tipi di elettronica militare, ad esempio nei sensori del sistema minerario GATOR. La loro capacità di scorrere e rimanere a zero li rende adatti per applicazioni solari e industrie in cui le batterie devono iniziare la giornata vuote e ricaricarsi in base al carico e alle condizioni meteorologiche. Ad esempio, le batterie agli ioni di litio sono spesso danneggiate quando possono scaricarsi al di sotto del 20% del loro volume, quindi funzionano più spesso nell'intervallo dal 20 al 100%, il che significa che possono utilizzare solo il 20% della loro capacità nominale.
Il loro tempo di risposta estremamente rapido li rende inoltre praticamente indispensabili per i gruppi di continuità, dove possono essere utilizzati al posto delle batterie al piombo e persino dei generatori diesel. Anche il tempo di risposta veloce li rende adatti al controllo della frequenza. Al momento, né l'UPS né le misure di gestione della frequenza sono efficaci da sole, ma è probabile che la batteria sarà in grado di trovare applicazioni in questi settori se capitalizzata da varie fonti di finanziamento. Inoltre, queste capacità rendono le batterie redox al vanadio un'efficace soluzione "in un unico pezzo" per piccole reti elettriche che dipendono da operazioni affidabili, controllo della frequenza e esigenze di commutazione del carico (come un'elevata penetrazione di energie rinnovabili, carichi altamente fluttuanti o il desiderio di ottimizzare l'efficienza del generatore spostando il tempo di risposta).
Le più grandi batterie redox al vanadio funzionanti
Sottostazione "Minami Hyakita":
- Data di lancio: dicembre 2015
- Energia: 60 MWh
- Potenza: 15 MW
- Orario di lavoro: 4 ore
- Paese: Giappone
Puzzolente, provincia di Liaoning
- Data di lancio: N/A
- Energia: 10 MWh
- Potenza: 5 MW
- Orario di lavoro: 2 ore
- Paese: Cina
Parco eolico di Tomamae
- Data di lancio: 2005
- Energia: 6 MWh
- Potenza: 4 MW
- Orario di lavoro: 1 ora e 30 minuti
- Paese: Giappone
Progetto Zhangbei
- Data di lancio 2016
- Energia: 8 MWh
- Potenza: 2 MW
- Orario di lavoro: 4 ore.
- Paese: Cina
Progetto SnoPUD MESA 2
- Data di lancio: marzo 2017
- Energia: 8 MWh
- Potenza: 2 MW
- Orario di lavoro: 4 ore.
- Paese: Stati Uniti
Sottostazione a Escondido
- Data di lancio: 2017
- Energia: 8 MWh
- Potenza: 2 MW
- Orario di lavoro: 4 ore.
- Paese: Stati Uniti
Sottostazione a Pullman, Washington
- Data di lancio: aprile 2015
- Energia: 4 MWh
- Potenza: 1 MW
- Orario di lavoro: 4 ore
- Paese: Stati Uniti
Entro il 2018, lo sviluppo di una batteria redox al vanadio dovrebbe essere completato in Cina. La sua energia sarà di 800 MWh, potenza - 200 MW e tempo di funzionamento - 4 ore.
Termini
- Sequenziale - gli elementi si susseguono uno dopo l'altro.
- La forza elettromotrice (EMF) è la tensione generata da una batteria o forza magnetica secondo la legge di Faraday.
- Parallelo - I componenti elettrici sono disposti in modo che la corrente scorra lungo due o più percorsi.
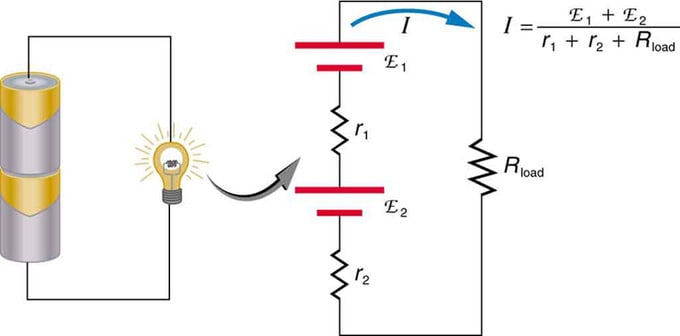
Se si utilizzano più sorgenti di tensione, possono essere collegate in serie o in parallelo. Con la versione di serie, sono sintonizzati nella stessa direzione, la resistenza interna viene aumentata e la forza elettromotrice viene aggiunta algebricamente. Tipi simili sono comuni nelle torce elettriche, nei giocattoli e in una varietà di altri apparecchi. Le celle sono poste in serie per aumentare la fem totale.
Collegamento seriale di due sorgenti di tensione nella stessa direzione. Il diagramma mostra una lanterna con due celle e una lampada
Batteria: connessione multipla di elementi volt. Ma c'è uno svantaggio nella connessione seriale, poiché vengono aggiunte resistenze interne. A volte questo crea problemi. Diciamo che hai due batterie da 6V che inserisci invece delle solite 12V. Di conseguenza, hai aggiunto non solo l'EMF, ma anche la resistenza interna di ciascuna batteria.
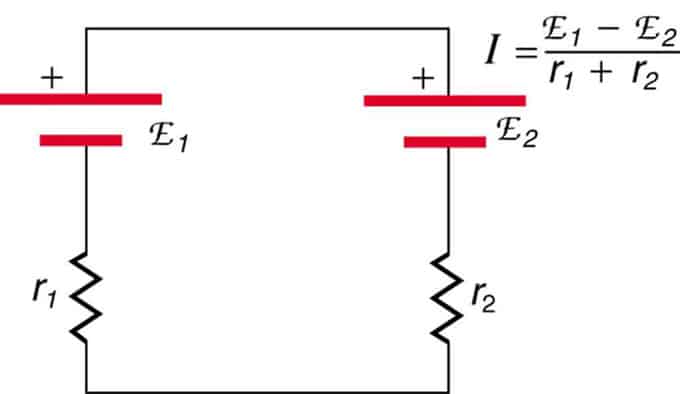
Se le celle si trovano in opposizione (una si trova dietro l'altra), l'EMF totale diminuirà.
Si tratta di due sorgenti di tensione collegate in serie con emissioni opposte. La corrente scorre nella direzione di una maggiore EMF ed è limitata dalla somma delle resistenze interne. Un esempio è un caricatore. Deve avere più emf della batteria
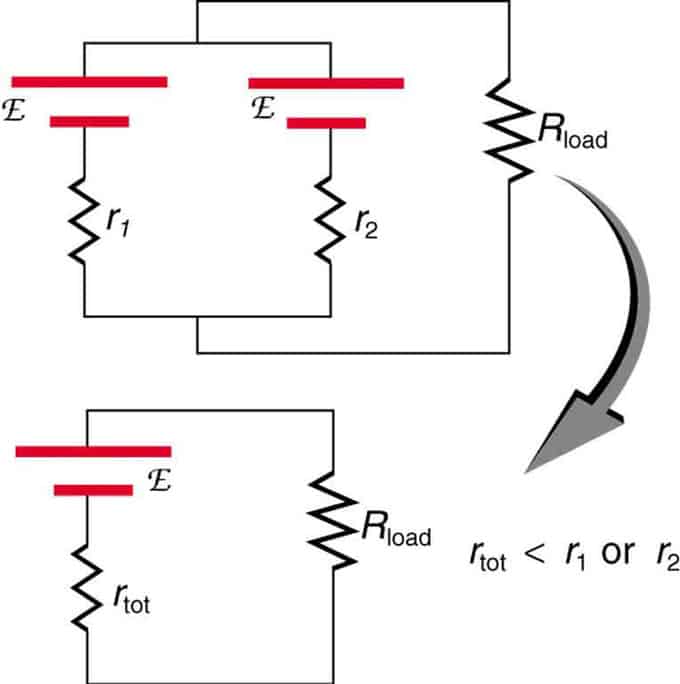
Se due sorgenti con la stessa forza elettromotrice sono poste in parallelo e collegate alla resistenza di carico, l'EMF totale rimane lo stesso di quelle individuali. Tuttavia, la resistenza interna totale sarà ridotta. Si scopre che la versione parallela può generare più corrente.
Due sorgenti di tensione con un singolo EMF sono combinate in collegamento in parallelo. Formano un CEM, ma hanno una resistenza totale inferiore rispetto a quella individuale. Combinazioni simili vengono utilizzate se è necessario ottenere più corrente.
| Panoramica |
|
| Collegamento in parallelo e in serie di resistori |
|
| Regole di Kirchhoff |
|
| Voltmetri e amperometri |
|
| Circuiti RC |
|
Panoramica storica
Lo sviluppo della prima cella galvanica è attribuito al fisico italiano Alessandro Volta. Condusse una serie di esperimenti con fenomeni elettrochimici durante gli anni '90 del Settecento e intorno al 1800 creò la prima batteria, che i suoi contemporanei chiamarono la "colonna voltaica". Il dispositivo consisteva in dischi alternati di zinco e argento separati da strati di carta o stoffa imbevuti di una soluzione di idrossido di sodio.
Questi esperimenti sono diventati la base per il lavoro di Michael Faraday sulle leggi quantitative dell'elettrochimica. Descrisse il principio di funzionamento della batteria e, sulla base del lavoro dello scienziato, furono create le prime celle elettriche commerciali. L'ulteriore evoluzione era simile a questa:
- Nel 1836, il chimico britannico John Daniel presentò un modello migliorato della cella, costituito da elettrodi di rame e zinco immersi in acido cloridrico. L'elemento di Daniel è stato in grado di fornire una tensione costante in modo incomparabilmente più efficiente rispetto ai dispositivi di Volt.
- 1839 Ulteriori progressi furono compiuti dal fisico Grove con la sua cella a due fluidi, costituita da zinco immerso in acido solforico diluito in un contenitore poroso. Quest'ultimo separava l'acido solforico da un recipiente contenente acido nitrico con un catodo di platino posto al suo interno. L'acido nitrico fungeva da agente ossidante per prevenire la perdita di tensione dovuta all'accumulo di idrogeno al catodo.Il chimico tedesco Robert Bunsen ha sostituito il platino con carbonio poco costoso nella cella Grove e quindi ha promosso l'accettazione diffusa di questo tipo di batteria.
- Nel 1859 Gaston Plante inventò la cella al piombo, precursore della moderna batteria per auto. Il dispositivo di Plante è stato in grado di produrre una corrente insolitamente grande, ma è stato utilizzato solo per esperimenti in laboratorio per quasi due decenni.
- 1895-1905 anni. Invenzione di elementi alcalini nichel-cadmio e nichel-ferro. Ciò ha permesso di realizzare impianti con un numero significativo di cicli di carica-scarica.
- Dagli anni '30 iniziò lo sviluppo delle batterie alcaline argento-zinco e mercurio-zinco, che fornivano un'elevata densità di energia per unità di peso e volume.
- Dalla metà del 20° secolo, i progressi nella tecnologia di produzione e l'avvento di nuovi materiali hanno portato a batterie ancora più potenti e compatte. Degna di nota è stata l'introduzione sul mercato delle batterie al nichel-metallo idruro e al litio.
Ricarica delle batterie
Articolo principale: Caricabatterie
Quando l'energia chimica si esaurisce, la tensione e la corrente diminuiscono e la batteria smette di funzionare. È possibile caricare la batteria (batteria delle batterie) da qualsiasi fonte CC con una tensione maggiore limitando la corrente. La più comune è la corrente di carica (in ampere), proporzionale a 1/10 della capacità nominale condizionale della batteria (in ampere ore).
Tuttavia, sulla base della descrizione tecnica distribuita dai produttori di batterie elettriche di uso comune (NiMH, NiCd), si può presumere che questa modalità di carica, comunemente indicata come standard, è calcolato in base alla durata di una giornata lavorativa di otto ore, quando la batteria, scarica al termine della giornata lavorativa, viene collegata al caricabatterie di rete prima dell'inizio di una nuova giornata lavorativa. L'uso di tale modalità di carica per questi tipi di batterie con un uso sistematico consente di mantenere un equilibrio qualità-costo nel funzionamento del prodotto. Pertanto, su suggerimento del produttore, questa modalità può essere utilizzata solo per batterie al nichel-cadmio e al nichel-metallo idruro.
Molti tipi di batterie hanno limitazioni diverse che devono essere prese in considerazione durante la carica e il successivo utilizzo, ad esempio le batterie NiMH sono sensibili al sovraccarico, le batterie al litio sono sensibili al sovraccarico, alla tensione e alla temperatura. Le batterie NiCd e NiMH hanno un cosiddetto effetto memoria, che consiste in una diminuzione della capacità quando la carica viene eseguita quando la batteria non è completamente scarica. Inoltre, questi tipi di batterie hanno una notevole autoscarica, cioè perdono gradualmente la carica senza essere collegate al carico. Per combattere questo effetto, è possibile utilizzare la ricarica a goccia.
Metodi di ricarica della batteria
Diversi metodi vengono utilizzati per caricare le batterie; In genere, il metodo di ricarica dipende dal tipo di batteria.
- Carica CC lenta
Caricare con una corrente continua proporzionale a 0,1-0,2 della capacità nominale condizionata Q per circa 15-7 ore, rispettivamente.
Il metodo di ricarica più lungo e sicuro. Adatto per la maggior parte dei tipi di batterie.
- ricarica rapida
Carica con corrente continua proporzionale a 1/3 Q per circa 3-5 ore.
- Carica accelerata o "delta-V".
Una carica con una corrente di carica iniziale proporzionale alla capacità nominale nominale della batteria, alla quale la tensione della batteria viene costantemente misurata e la carica termina dopo che la batteria è completamente carica. Il tempo di ricarica è di circa un'ora e mezza. La batteria può surriscaldarsi e persino distruggerla.
- carica inversa
Viene eseguito alternando lunghi impulsi di carica con brevi impulsi di scarica. Il metodo inverso è particolarmente utile per caricare le batterie NiCd e NiMH, che sono caratterizzate dal cosiddetto.n. "effetto memoria".