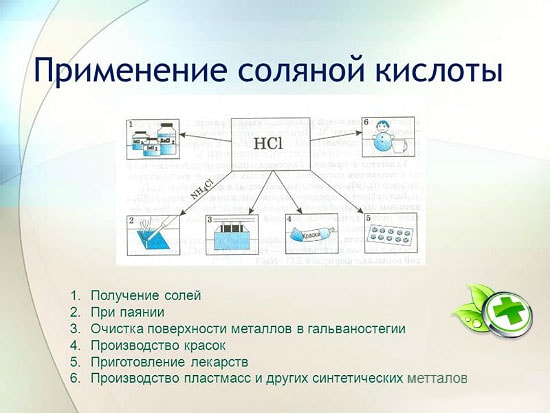
Sālsskābes lietošana
Sālsskābi plaši izmanto rūpniecībā metālu ieguvei no rūdām, metālu kodināšanai uc To izmanto arī lodēšanas šķidruma ražošanā, sudraba nogulsnēšanā un kā ūdens regijas neatņemamu sastāvdaļu.
Sālsskābes izmantošana rūpniecībā ir mazāka nekā slāpekļskābe. Tas ir saistīts ar faktu, ka sālsskābe izraisa tērauda iekārtu koroziju. Turklāt tā gaistošie tvaiki ir diezgan kaitīgi un arī izraisa metāla izstrādājumu koroziju. Tas jāņem vērā, uzglabājot sālsskābi. Sālsskābe tiek uzglabāta un transportēta ar gumijas pārklājumu cisternās un mucās, t.i. traukos, kuru iekšējā virsma ir pārklāta ar skābju noturīgu gumiju, kā arī stikla pudelēs un polietilēna traukos.
Sālsskābi izmanto cinka, mangāna, dzelzs un citu metālu hlorīdu, kā arī amonija hlorīda ražošanai. Sālsskābi izmanto metālu, trauku, aku virsmu tīrīšanai no karbonātiem, oksīdiem un citiem nosēdumiem un piesārņotājiem. Šajā gadījumā tiek izmantotas īpašas piedevas - inhibitori, kas aizsargā metālu no šķīšanas un korozijas, bet neaizkavē oksīdu, karbonātu un citu līdzīgu savienojumu šķīšanu.
HCl izmanto sintētisko sveķu, gumijas rūpnieciskajā ražošanā. To izmanto kā izejvielu metilhlorīda ražošanā no metilspirta, etilhlorīda ražošanā no etilēna un vinilhlorīda ražošanā no acetilēna.
Pirmā palīdzība un ārstēšanas metodes
Ja tiek konstatētas saindēšanās pazīmes, ir jāizsauc ātrā palīdzība. Mājās ir atļauts veikt darbības, kuru mērķis ir uzlabot cietušā stāvokli. Pirmā palīdzība saindēšanās ar sālsskābi gadījumā jāveic ātri, lai samazinātu negatīvo seku risku.
Pasākumi:
- Ja sāls savienojums nokļūst uz ādas, bojātās vietas nomazgā ar lielu daudzumu vēsa ūdens. Apstrādes laiks ir vismaz pusstunda.
- Tvaiku reibuma gadījumā cietušajam tiek nodrošināta piekļuve svaigam gaisam, tiek atvērti logi, atpogātas ciešas drēbes.
- Ieteicams uzraudzīt pacienta stāvokli, ja nav dzīvības pazīmju, tiek veikta reanimācija.
- Cietušajam no tvaikiem ir atļauts dzert siltu tēju, ūdeni. Degunu un muti ieteicams izskalot ar vēsu ūdeni.
- Pārdozēšanas gadījumā, ko izraisa skābes uzņemšana, uz vēdera tiek uzlikts ledus iepakojums, lai novērstu vai samazinātu iespējamo asiņošanu.
- Nekādas zāles nav atļautas. Ir atļauts dot pacientam glāzi ūdens (var minerālu sārmainu). Dzeramais šķidrums ir nepieciešams maziem malciņiem.
- Nav atļauts mazgāt kuņģi, mēģināt izraisīt vemšanu mājās. Šāda pirmā palīdzība var izraisīt rīkles apdegumus, asiņošanu.
Ārstēšana tiek veikta medicīnas iestādē speciālistu uzraudzībā.
Terapija:
- Kuņģa tīrīšana ar zondi,
- Pilinātāju lietošana ar medicīniskiem šķīdumiem,
- Zāļu izrakstīšana sāpju mazināšanai
- tādu zāļu lietošana, kuru mērķis ir atjaunot orgānu un sistēmu darbību,
- Ja nepieciešams, skābekļa inhalācija un plaušu mākslīgā ventilācija,
- Reanimācijas terapijas veikšana, ja nav dzīvības pazīmju,
- Vitamīnu izvēle un īpašs uzturs.
Ārstēšana tiek veikta intensīvajā terapijā un pēc tam slimnīcā. Ilgums ir atkarīgs no pacienta stāvokļa un saindēšanās pakāpes.
Apdegumi un saindēšanās
Lai cik efektīvs ir šis līdzeklis, tas ir bīstams. Sālsskābe atkarībā no koncentrācijas var izraisīt četru grādu ķīmiskus apdegumus:
- Ir tikai apsārtums un sāpes.
- Ir burbuļi ar dzidru šķidrumu un pietūkumu.
- Veidojas ādas augšējo slāņu nekroze.Blisteri piepildās ar asinīm vai duļķainu saturu.
- Bojājums sasniedz cīpslas un muskuļus.
Ja viela kaut kādā veidā nokļuvusi acīs, tās jāizskalo ar ūdeni un pēc tam ar sodas šķīdumu. Bet jebkurā gadījumā pirmais, kas jādara, ir izsaukt ātro palīdzību.
Skābes uzņemšana iekšpusē ir saistīta ar akūtām sāpēm krūtīs un vēderā, balsenes pietūkumu, asiņainu masu vemšanu. Tā rezultātā smagas aknu un nieru patoloģijas.
Un pirmās saindēšanās pazīmes pa pāriem ir sauss biežs klepus, aizrīšanās, zobu bojājumi, dedzināšana gļotādās un sāpes vēderā. Pirmā neatliekamā palīdzība ir mutes mazgāšana un skalošana ar ūdeni, kā arī piekļuve svaigam gaisam. Tikai toksikologs var sniegt reālu palīdzību.
Ķīmiskā spektra īpašības
Skābe mijiedarbojas ar daudziem metāliem, sāļiem. Tas tiek uzskatīts par diezgan spēcīgu un ir līdzvērtīgs zamšādai. Galvenā reakcija izpaužas visās metālu grupās, kas atrodas pa kreisi no ūdeņraža (magnijs, dzelzs, cinks - elektriskie potenciāli).
Ūdeņraža hlorīda šķīdums atšķaidītā veidā reaģē ar sāļiem, bet tikai ar tiem, ko veido mazāk spēcīgas skābes. Zināms visiem nātrija un kalcija karbonātiem, pēc mijiedarbības ar to tie sadalās ūdenī un oglekļa monoksīdā.
Slāpekļskābe
- kvalitatīva reakcija uz sāls šķīdumu. Lai to iegūtu, šim reaģentam jāpievieno sudraba nitrāts, kā rezultātā veidosies baltas nogulsnes, no kurām iegūst slāpekļa vielu.
Ar šī ūdens un ūdeņraža maisījuma palīdzību tiek veikti daudzi interesanti eksperimenti. Piemēram, atšķaidiet to ar amonjaku. Rezultātā jūs iegūsit baltus dūmus, biezus, ar mazu kristālu konsistenci. Metilamīns, anilīns, mangāna dioksīds, kālija karbonāts ir reaģenti, kurus ietekmē arī skābe.
Kā un kāpēc to lieto
Iespējams, šī ir pamatoti viena no svarīgākajām vielām, kas ir atrodama un nepieciešama gandrīz visās cilvēka dzīves jomās.
Pielietojuma zonas lokalizācija:
- Metalurģija. Virsmu tīrīšana no oksidētajām vietām, rūsas šķīdināšana, pirmslodēšana, alvošana. Sālsskābe palīdz no rūdām iegūt nelielus metālu ieslēgumus. Cirkoniju un titānu iegūst, izmantojot oksīdu pārvēršanas metodi hlorīdos.
- Pārtikas tehnoloģiju nozare. Zemas koncentrācijas šķīdumu izmanto kā pārtikas piedevu. Želatīns, fruktoze diabēta slimniekiem satur tīru emulgatoru. Arī parastajā soda ir augsts šīs vielas saturs. Uz preču iepakojuma jūs to redzēsiet ar nosaukumu E507.
- Medicīnas joma. Ar nepietiekamu skābās vides indikatoru kuņģī un problēmām ar zarnām. Zems Ph izraisa vēzi. Pat ar pareizu uzturu, vitamīnu pārpilnību, briesmas nepazūd, ir jāveic testi sulas iegūšanai no kuņģa trakta, jo nepietiekami skābā vidē derīgās vielas praktiski neuzsūcas, tiek traucēta gremošana.
- Sāls šķīdums tiek izmantots kā inhibitors - aizsardzība pret netīrumiem un infekcijām, antiseptiska iedarbība. Līmju maisījumu, keramikas izstrādājumu ražošanai. Tas izskalo siltummaiņus.
- Dzeramā ūdens attīrīšanas procedūra arī nav pilnīga bez hlora līdzdalības.
- Gumijas ražošana, audumu pamatņu balināšana.
- Izmantojot šo risinājumu, varat rūpēties par savām lēcām.
- Mutes skalojamais līdzeklis mājās
- Viela ir lielisks elektrības vadītājs.
Kā notiek saindēšanās
Sālsskābe ir bezkrāsains šķidrums ar raksturīgu asu smaku. Viena no spēcīgākajām skābēm, kas spēj izšķīdināt dažus metālus. Viegli pārvēršas gāzē.
Hlorūdeņradi izmanto tekstilrūpniecībā, ādas biznesā, dārgmetālu metalurģijā, līmes, skābju ražošanā.
Viela atrodas kuņģī minimālā koncentrācijā. Skābe veicina gremošanas procesa normalizēšanos, aizsargā organismu no kaitīgām baktērijām un mikroorganismiem.
Koncentrācijā, kas pārsniedz 24%, sālsskābe var radīt neatgriezenisku kaitējumu cilvēka ķermenim. Tvaiki, kas veidojas saskarē ar gaisu, izraisa redzes un elpošanas sistēmas orgānu kairinājumu.
Ir vairāki faktori, kas var izraisīt saindēšanās attīstību.
Faktori:
Tvaika intoksikācija iespējama, strādājot telpās ar sliktu ventilāciju,
Norīšana nolaidības dēļ, biežāk bērniem,
Sālsskābes iekļūšana epidermā, gļotādās, ja netiek ievēroti reaģenta lietošanas noteikumi.
Saindēšanās ar vielu mājās pieaugušajiem rodas, lietojot bez ādas, acu un elpošanas sistēmas orgānu aizsardzības līdzekļiem. Intoksikācija var rasties, ja skābe tiek neprecīzi pārnesta no viena konteinera uz otru.
Farmakodinamika un farmakokinētika
Kas ir kuņģa skābums? Tas ir raksturīgs sālsskābes koncentrācijai kuņģī. Skābums ir izteikts pH
. Parasti skābei vajadzētu ražot kuņģa sulas sastāvā un aktīvi piedalīties gremošanas procesos. Sālsskābes formula: HCl
. To ražo parietālās šūnas, kas atrodas fundūza dziedzeros, piedaloties H+/K+-ATPāze
. Šīs šūnas izklāj kuņģa dibenu un ķermeni. Pati kuņģa sulas skābums ir mainīgs un ir atkarīgs no parietālo šūnu skaita un vielas neitralizācijas procesu intensitātes ar kuņģa sulas sārmainām sastāvdaļām. Koncentrācija tiek ražota līdz - jūs esat stabils un vienāds ar 160 mmol/l. Veselam cilvēkam stundā vajadzētu ražot ne vairāk kā 7 un vismaz 5 mmol vielas.
Ar nepietiekamu vai pārmērīgu sālsskābes ražošanu, rodas gremošanas trakta slimības, pasliktinās spēja absorbēt noteiktus mikroelementus, piemēram, dzelzi. Zāles stimulē kuņģa sulas sekrēciju, samazina pH
. Aktivizējas pepsinogēns
, pārvērš to par aktīvu fermentu pepsīns
. Viela labvēlīgi ietekmē kuņģa skābes refleksu, palēnina nepilnīgi sagremotas pārtikas pāreju zarnās. Palēninās gremošanas trakta satura rūgšanas procesi, pazūd sāpes un atraugas, labāk uzsūcas dzelzs.
Pēc iekšķīgas lietošanas zāles daļēji metabolizējas ar siekalām un kuņģa gļotām, divpadsmitpirkstu zarnas saturs 12. Nesaistītā viela iekļūst divpadsmitpirkstu zarnā, kur to pilnībā neitralizē sārmains saturs.
Vēl viens skābes lietojums ikdienas dzīvē
Ar skābo sastāvu jūs varat viegli notīrīt kaļķakmeni un rūsu no fajansa santehnikas, noņemt urīnakmeņus un citus piesārņotājus. Lai panāktu lielāku efektu, līdzeklim pievieno inhibitoru (piemēram, urotropīnu), kas palēnina ķīmisko reakciju.
Procedūru veic šādi: skābi atšķaida ar ūdeni, līdz tiek sasniegta 5% koncentrācija, un pievieno inhibitoru ar ātrumu 0,5 g uz 1 litru šķidruma. Virsmu apstrādā ar iegūto sastāvu un atstāj uz 30-40 minūtēm (atkarībā no piesārņojuma pakāpes), pēc tam to mazgā ar ūdeni.
Vieglu skābes šķīdumu izmanto arī ogu traipu, tintes vai rūsas traipu noņemšanai no audumiem. Lai to izdarītu, materiālu kādu laiku iemērc kompozīcijā, pēc tam to rūpīgi izskalo un mazgā parastajā veidā.
Atbrīvošanās no katlakmens tējkannā
Šim nolūkam izmanto 3-5% sālsskābes šķīdumu, ko ielej tējkannā un uzkarsē līdz 60-80.°
C 1-2 stundas vai līdz katlakmens nogulsnes sadalās. Pēc tam zvīņa kļūst vaļīga un viegli noņemama ar koka lāpstiņu.
Metodes efektivitāte ir saistīta ar to, ka reaģents reaģē ar magnija un kalcija karbonātiem un pārvērš tos šķīstošos sāļos. Tajā pašā laikā izdalītais oglekļa dioksīds iznīcina katlakmens slāni un padara to vaļīgu. Pēc sāls nogulšņu noņemšanas traukus rūpīgi nomazgā ar tīru ūdeni.
Svarīgs punkts!
Šī metode nav piemērota atkaļķošanai no plīsušām un saplaisājušām emaljas vai alumīnija tējkannām: tas sarūsēs metālu un nopietni to sabojās.
Vielas iegūšana
Tagad mēs varam runāt par to, ko viņi dara, lai veidotu sālsskābi.
Pirmkārt, sadedzinot ūdeņradi hlorā, tiek iegūta galvenā sastāvdaļa - gāzveida hlorūdeņradis. ko pēc tam izšķīdina ūdenī. Šīs vienkāršās reakcijas rezultāts ir sintētiskās skābes veidošanās.
Šo vielu var iegūt arī no izplūdes gāzēm. Tās ir ķīmiskās atkritumu (blakus) gāzes. Tos veido dažādi procesi. Piemēram, hlorējot ogļūdeņražus. To sastāvā esošo ūdeņraža hlorīdu sauc par izplūdes gāzi. Un attiecīgi iegūtā skābe.
Jāpiebilst, ka pēdējos gados pieaug izplūdes gāzu vielas īpatsvars tās kopējā ražošanas apjomā. Un skābe, kas veidojas ūdeņraža sadedzināšanas rezultātā hlorā, tiek izspiesta. Tomēr, godīgi sakot, jāatzīmē, ka tajā ir mazāk piemaisījumu.
Ražošanas izmantošana
Tam ir plašs pielietojums metalurģijas, pārtikas un medicīnas nozarēs.
- Metalurģija. Izmanto metālu lodēšanai, alvošanai un tīrīšanai.
- Pārtikas rūpniecība. Pielietojums pārtikas skābuma regulētāju ražošanā, piemēram, E507.
- Elektrotips. Izmanto kodināšanai.
- Medicīna. Tas atrod savu pielietojumu mākslīgās kuņģa sulas ražošanā.
Iekļauts sintētisko krāsvielu sastāvā. To izmanto tīrīšanas un mazgāšanas līdzekļu ražošanā. Bet šķidrumos, kas paredzēti lietošanai mājās, sērskābes koncentrācija ir niecīga.
Kā laboratorijā tiek ražota sālsskābe
Vielas ražošana ir liela mēroga, pārdošana ir bezmaksas. Laboratorijas eksperimentu apstākļos šķīdums tiek iegūts, augstas koncentrācijas sērskābei iedarbojoties uz parasto virtuves sāli (nātrija hlorīdu).
Ir 2 metodes hlorūdeņraža šķīdināšanai ūdenī:
- Ūdeņradis tiek sadedzināts hlorā (sintētisks).
- Saistīts (izplūdes gāze). Tās būtība ir veikt organisko hlorēšanu, dehidrohlorēšanu.
Viela ir piemērota sintēzei atkritumu pirolīzes laikā no hlororganiskās vielas. Tas notiek ogļūdeņražu sadalīšanās rezultātā ar pilnīgu skābekļa trūkumu. Var izmantot arī metālu hlorīdus, kas ir neorganisko vielu izejvielas. Ja nav koncentrētas sērskābes (elektrolīta), ņemiet atšķaidītu.
Runājot par reaģenta ekstrakciju dabiskos apstākļos, visbiežāk šo ķīmisko maisījumu var atrast vulkānisko atkritumu ūdeņos. Ūdeņraža hlorīds ir minerālvielu silvīna (kālija hlorīds, izskatās kā kauli spēlēm), bišofīta sastāvdaļa. Visas šīs ir metodes, kā iegūt vielu rūpniecībā.
Cilvēkiem šis enzīms atrodas kuņģī. Šķīdums var būt gan skābe, gan bāze. Vienu no visizplatītākajām ekstrakcijas metodēm sauc par sulfātu.
Ķīmiskās īpašības
Sālsskābe, hlorūdeņradis vai sālsskābe - šķīdums Hcl
ūdenī. Saskaņā ar Wikipedia viela pieder neorganisko stipro monobāzisko to-t grupai. Savienojuma pilns nosaukums latīņu valodā: sālsskābe.
Sālsskābes formula ķīmijā: HCl
. Molekulā ūdeņraža atomi savienojas ar halogēna atomiem - Cl
. Ja ņem vērā šo molekulu elektronisko konfigurāciju, var atzīmēt, ka savienojumi piedalās molekulāro orbitāļu veidošanā. 1s
-ūdeņraža orbitāles un abi 3s
un 3p
- atoma orbitāles Cl
. Sālsskābes ķīmiskajā formulā 1s-
, 3s-
un 3p
-atomu orbitāles pārklājas un veido 1, 2, 3 orbitāles. Kurā 3s
-orbitāle nav saistoša. Notiek elektronu blīvuma nobīde uz atomu Cl
un samazinās molekulas polaritāte, bet palielinās molekulāro orbitāļu saistīšanās enerģija (ja to aplūkojam kopā ar citām ūdeņraža halogenīdi
).
Ūdeņraža hlorīda fizikālās īpašības. Tas ir dzidrs, bezkrāsains šķidrums, kas smēķē, saskaroties ar gaisu. Ķīmiskā savienojuma molārā masa = 36,6 grami uz molu. Standarta apstākļos, gaisa temperatūrā 20 grādi pēc Celsija, maksimālā vielas koncentrācija ir 38% no svara. Koncentrētas sālsskābes blīvums šāda veida šķīdumā ir 1,19 g/cm³. Kopumā fizikālās īpašības un raksturlielumi, piemēram, blīvums, molaritāte, viskozitāte, siltumietilpība, viršanas temperatūra un pH
, ir ļoti atkarīgas no šķīduma koncentrācijas. Šīs vērtības ir sīkāk aplūkotas blīvumu tabulā. Piemēram, 10% sālsskābes blīvums = 1,048 kg litrā. Sacietējot, viela veidojas kristāliskie hidrāti
dažādas kompozīcijas.
Sālsskābes ķīmiskās īpašības. Ar ko reaģē sālsskābe? Viela mijiedarbojas ar metāliem, kas atrodas ūdeņraža priekšā virknē elektroķīmisko potenciālu (dzelzs, magnijs, cinks un citi). Šajā gadījumā veidojas sāļi un gāzveida H
. Svins, varš, zelts, sudrabs un citi metāli pa labi no ūdeņraža nereaģē ar sālsskābi. Viela reaģē ar metālu oksīdiem, veidojot ūdeni un šķīstošu sāli. Nātrija hidroksīds to-you formu un ūdens iedarbībā. Šim savienojumam raksturīga neitralizācijas reakcija.
Atšķaidīta sālsskābe reaģē ar metālu sāļiem, kurus veido vājākas skābes. Piemēram, propionskābe
vājāka par sāli. Viela nereaģē ar stiprākām skābēm. un nātrija karbonāts
veidosies pēc reakcijas ar HCl
hlorīds, oglekļa monoksīds un ūdens.
Ķīmiskajam savienojumam raksturīgas reakcijas ar spēcīgiem oksidētājiem, ar mangāna dioksīds
, kālija permanganāts
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. Viela reaģē ar amonjaks
, kas rada biezus baltus dūmus, kas sastāv no ļoti maziem amonija hlorīda kristāliem. Minerāls piroluzīts reaģē arī ar sālsskābi, jo tas satur mangāna dioksīds
: MnO2+4HCl=Cl2+MnO2+2H2O
(oksidācijas reakcija).
Ir kvalitatīva reakcija uz sālsskābi un tās sāļiem. Kad viela mijiedarbojas ar sudraba nitrāts
baltas nogulsnes sudraba hlorīds
un veidojas slāpekļskābe
. Mijiedarbības reakcijas vienādojums metilamīns
ar ūdeņraža hlorīdu izskatās šādi: HCl + CH3NH2 = (CH3NH3)Cl
.
Viela reaģē ar vāju bāzi anilīns
. Pēc anilīna izšķīdināšanas ūdenī maisījumam pievieno sālsskābi. Tā rezultātā bāze izšķīst un veidojas anilīna hidrohlorīds
(fenilamonija hlorīds
): (С6Н5NH3)Cl
. Alumīnija karbīda mijiedarbības reakcija ar sālsskābi: Al4C3+12HCL=3CH4+4AlCl3
. Reakcijas vienādojums kālija karbonāts
ar ko tas izskatās šādi: K2CO3 + 2HCl = 2KCl + H2O + CO2.
Pieteikums
metalurģijā rūdu ieguvei, rūsas, katlakmens, netīrumu un oksīdu noņemšanai, lodēšanai un alvošanai;
sintētisko kaučuku un sveķu ražošanā;
galvanizēšanā;
kā skābuma regulētājs pārtikas rūpniecībā;
metālu hlorīdu iegūšanai;
lai iegūtu hloru;
medicīnā nepietiekama kuņģa sulas skābuma ārstēšanai;
kā tīrīšanas un dezinfekcijas līdzeklis.
- (HCl), ūdeņraža hlorīda ūdens šķīdums, bezkrāsaina gāze ar asu smaku. Iegūst, sērskābei iedarbojoties uz vārāmo sāli, kā ogļūdeņražu hlorēšanas blakusproduktu vai ūdeņraža un hlora reakciju. Sālsskābi izmanto ... ... Zinātniskā un tehniskā enciklopēdiskā vārdnīca
Sālsskābe
- - HCl (SC) (sālsskābe, sālsskābe, hlorūdeņradis) ir hlorūdeņraža (HCl) šķīdums ūdenī, antifrīza piedeva. Tas ir bezkrāsains šķidrums ar asu smaku, bez suspendētām daļiņām ... ... Būvmateriālu terminu, definīciju un skaidrojumu enciklopēdija
SĀLSSKĀBE
- (sālsskābe) hlorūdeņraža šķīdums ūdenī; stipra skābe. Bezkrāsains šķidrums, kas kūp gaisā (tehniskā sālsskābe ir dzeltenīga Fe, Cl2 uc piemaisījumu dēļ). Maksimālā koncentrācija (pie 20 ° C) ir 38 masas%, ... ... Lielā enciklopēdiskā vārdnīca
SĀLSSKĀBE
- (Acidum muriaticum, Acid, hydrochloricum), ūdeņraža hlorīda (HC1) šķīdums ūdenī. Dabā tas sastopams noteiktu vulkāniskas izcelsmes avotu ūdenī, kā arī atrodams kuņģa sulā (līdz 0,5%). Ūdeņraža hlorīdu var iegūt ... Lielā medicīnas enciklopēdija
SĀLSSKĀBE
- (sālsskābe, sālsskābe) spēcīga vienbāziska gaistoša skābe ar asu smaku, hlorūdeņraža ūdens šķīdums; maksimālā koncentrācija ir 38 masas%, šāda šķīduma blīvums ir 1,19 g/cm3. Izmantots ... ... Krievijas darba aizsardzības enciklopēdijā
SĀLSSKĀBE
- (sālsskābe) HCl hlorūdeņraža ūdens šķīdums, spēcīga vienbāziska skābe, gaistošs, ar asu smaku; dzelzs piemaisījumi, hlors nokrāso to dzeltenīgu. Koncentrētais S. pārdot satur 37% ... ... Big Polytechnic Encyclopedia
sālsskābe
— lietvārds, sinonīmu skaits: 1 skābe (171) ASIS Sinonīmu vārdnīca. V.N. Trišins. 2013 ... Sinonīmu vārdnīca
SĀLSSKĀBE
Mūsdienu enciklopēdija
Sālsskābe
- ŪDEŅŠSKĀBE, hlorūdeņraža HCl ūdens šķīdums; kūpošs šķidrums ar asu smaku. Sālsskābi izmanto dažādu hlorīdu iegūšanai, metālu kodināšanai, rūdu apstrādei, hlora, sodas, gumijas uc ražošanā ... ... Ilustrētā enciklopēdiskā vārdnīca
sālsskābe
- (sālsskābe), hlorūdeņraža šķīdums ūdenī; stipra skābe. Bezkrāsains šķidrums, kas "kūp" gaisā (tehniskā sālsskābe ir dzeltenīga Fe, Cl2 uc piemaisījumu dēļ). Maksimālā koncentrācija (pie 20 ° C) 38% pēc masas, ... ... Enciklopēdiskā vārdnīca
Kādas ir intoksikācijas briesmas
Sālsskābe ir īpaši bīstama cilvēka ķermenim. Saindēšanās gadījumā ar šādu vielu var attīstīties nopietnas komplikācijas un organisma funkcionalitātes pārkāpumi.
Komplikācijas:
- Aknu darbības traucējumi toksiska hepatīta rezultātā,
- Asiņošana kuņģī bojāto orgānu sieniņu dēļ,
- Šoks no sāpēm, kad skābe nokļūst lielā platībā,
- Ja nokļūst acīs, redzes traucējumi,
- Nopietni nieru darbības traucējumi,
- Elpošanas mazspēja, nosmakšana, elpas trūkums,
- Komas attīstība.
Līdzīgas sekas attīstās pakāpeniski atkarībā no saindēšanās pakāpes.
Secinājums
Ja ievērosit piesardzības un drošības noteikumus, sālsskābe kļūs par neaizstājamu palīgu ikdienas dzīvē. Un jūs to varat iegādāties par vispieejamākajām cenām mūsu uzņēmumā.
Tāpat kā skābes. Izglītības programma paredz, ka studentiem jāiegaumē sešu šīs grupas pārstāvju vārdi un formulas. Un, pārskatot mācību grāmatas sniegto tabulu, skābju sarakstā pamanāt to, kas ir pirmajā vietā un interesēja pirmajā vietā - sālsskābi. Ak, klasē skolā netiek pētīts ne īpašums, ne cita informācija par to. Tāpēc tie, kuri vēlas iegūt zināšanas ārpus skolas mācību programmas, papildus informāciju meklē visdažādākajos avotos. Taču bieži vien daudzi neatrod vajadzīgo informāciju. Un tāpēc šodienas raksta tēma ir veltīta šai konkrētajai skābei.
Definīcija
Sālsskābe ir spēcīga vienbāziska skābe. Dažos avotos to var saukt par sālsskābi un sālsskābi, kā arī par hlorūdeņradi.
Fizikālās īpašības
Tas ir bezkrāsains un kūpošs kodīgs šķidrums gaisā (foto pa labi). Tomēr tehniskajai skābei ir dzeltenīga krāsa, jo tajā ir dzelzs, hlors un citas piedevas. Tā lielākā koncentrācija 20 ° C temperatūrā ir 38%. Sālsskābes blīvums ar šādiem parametriem ir 1,19 g/cm 3. Bet šim savienojumam dažādās piesātinājuma pakāpēs ir pilnīgi atšķirīgi dati.Samazinoties koncentrācijai, samazinās molaritātes, viskozitātes un kušanas temperatūras skaitliskā vērtība, bet palielinās īpatnējā siltumietilpība un viršanas temperatūra. Jebkuras koncentrācijas sālsskābes sacietēšana dod dažādus kristāliskus hidrātus.
Ķīmiskās īpašības
Visi metāli, kas atrodas pirms ūdeņraža to sprieguma elektroķīmiskajā sērijā, var mijiedarboties ar šo savienojumu, veidojot sāļus un izdalot ūdeņraža gāzi. Ja tos aizstāj ar metālu oksīdiem, tad reakcijas produkti būs šķīstošs sāls un ūdens. Tāda pati ietekme būs sālsskābes mijiedarbībā ar hidroksīdiem. Ja tomēr tam pievieno kādu metālu sāli (piemēram, nātrija karbonātu), kura atlikums ņemts no vājākas skābes (oglekļa), tad šī metāla hlorīds (nātrijs), ūdens un skābei atbilstošā gāze. veidojas atlikums (šajā gadījumā oglekļa dioksīds).
Kvīts
Tagad aplūkotais savienojums veidojas, kad ūdenī izšķīdina ūdeņraža hlorīda gāzi, ko var iegūt, sadedzinot ūdeņradi hlorā. Sālsskābi, kas iegūta, izmantojot šo metodi, sauc par sintētisko. Izplūdes gāzes var kalpot arī kā avots šīs vielas iegūšanai. Un šādu sālsskābi sauks par izplūdes skābi. Nesen sālsskābes ražošanas līmenis, izmantojot šo metodi, ir daudz augstāks nekā tās ražošana ar sintētisko metodi, lai gan pēdējā dod savienojumu tīrākā veidā. Tie visi ir veidi, kā to iegūt rūpniecībā. Tomēr laboratorijās sālsskābi ražo trīs veidos (pirmie divi atšķiras tikai ar temperatūru un reakcijas produktiem), izmantojot dažāda veida ķīmiskās mijiedarbības, piemēram:
- Piesātinātās sērskābes ietekme uz nātrija hlorīdu 150°C temperatūrā.
- Iepriekš minēto vielu mijiedarbība apstākļos, kuru temperatūra ir 550 ° C un augstāka.
- Alumīnija vai magnija hlorīdu hidrolīze.
Pieteikums
Hidrometalurģijā un elektroformēšanā nevar iztikt bez sālsskābes izmantošanas, kur tas ir nepieciešams, lai attīrītu metālu virsmu alvošanas un lodēšanas laikā un iegūtu mangāna, dzelzs, cinka un citu metālu hlorīdus. Pārtikas rūpniecībā šis savienojums ir pazīstams kā pārtikas piedeva E507 - tur tas ir skābuma regulētājs, kas nepieciešams seltzera (sodas) ūdens pagatavošanai. Koncentrēta sālsskābe ir atrodama arī jebkura cilvēka kuņģa sulā un palīdz sagremot pārtiku. Šī procesa laikā tā piesātinājuma pakāpe samazinās, jo. šo sastāvu atšķaida ar pārtiku. Tomēr, ilgstoši badojoties, sālsskābes koncentrācija kuņģī pakāpeniski palielinās. Un, tā kā šis savienojums ir ļoti kodīgs, tas var izraisīt kuņģa čūlu.
Secinājums
Sālsskābe var būt gan labvēlīga, gan kaitīga cilvēkiem. Tā saskare ar ādu izraisa smagus ķīmiskus apdegumus, un šī savienojuma tvaiki kairina elpceļus un acis.
Bet, ja ar šo vielu rīkojaties uzmanīgi, tā var noderēt vairāk nekā vienu reizi