Penggunaan asid hidroklorik
Asid hidroklorik digunakan secara meluas dalam industri untuk mengekstrak logam daripada bijih, logam penjerukan, dll. Ia juga digunakan dalam pembuatan cecair pematerian, dalam pemendapan perak, dan sebagai sebahagian daripada aqua regia.
Skala penggunaan asid hidroklorik dalam industri adalah kurang daripada asid nitrik. Ini disebabkan oleh fakta bahawa asid hidroklorik menyebabkan kakisan peralatan keluli. Selain itu, wapnya yang meruap agak berbahaya dan juga menyebabkan kakisan produk logam. Ini mesti diambil kira semasa menyimpan asid hidroklorik. Asid hidroklorik disimpan dan diangkut dalam tangki dan tong berlapis getah, i.e. dalam kapal, permukaan dalamnya ditutup dengan getah tahan asid, serta dalam botol kaca dan peralatan polietilena.
Asid hidroklorik digunakan untuk menghasilkan klorida zink, mangan, besi dan logam lain, serta ammonium klorida. Asid hidroklorik digunakan untuk membersihkan permukaan logam, bejana, telaga daripada karbonat, oksida dan sedimen dan bahan cemar lain. Dalam kes ini, bahan tambahan khas digunakan - perencat yang melindungi logam daripada pembubaran dan kakisan, tetapi jangan menangguhkan pembubaran oksida, karbonat dan sebatian lain yang serupa.
HCl digunakan dalam pengeluaran industri resin sintetik, getah. Ia digunakan sebagai bahan mentah dalam pengeluaran metil klorida daripada metil alkohol, etil klorida daripada etilena, dan vinil klorida daripada asetilena.
Pertolongan cemas dan kaedah rawatan
Sekiranya tanda-tanda keracunan ditemui, ambulans mesti dipanggil. Di rumah, dibenarkan melakukan aktiviti yang bertujuan untuk memperbaiki keadaan mangsa. Pertolongan cemas untuk keracunan asid hidroklorik harus dilakukan dengan cepat untuk mengurangkan risiko akibat negatif.
Acara:
- Jika sebatian garam terkena pada kulit, kawasan yang rosak dibasuh dengan banyak air sejuk. Masa pemprosesan sekurang-kurangnya setengah jam.
- Sekiranya mabuk dengan wap, mangsa diberikan akses ke udara segar, tingkap dibuka, pakaian ketat dibuka.
- Adalah disyorkan untuk memantau keadaan pesakit, jika tiada tanda-tanda kehidupan, resusitasi dijalankan.
- Mangsa dari wap dibenarkan minum teh suam, air. Adalah disyorkan untuk membilas hidung dan mulut dengan air sejuk.
- Sekiranya berlaku terlebih dos akibat pengambilan asid, pek ais diletakkan pada perut untuk mengelakkan atau mengurangkan kemungkinan pendarahan.
- Tiada produk perubatan dibenarkan. Ia dibenarkan untuk memberi pesakit segelas air (anda boleh mineral alkali). Cecair minuman diperlukan dalam teguk kecil.
- Ia tidak dibenarkan untuk mencuci perut, cuba untuk mendorong muntah di rumah. Pertolongan cemas sedemikian boleh membawa kepada perkembangan luka bakar tekak, pendarahan.
Rawatan dijalankan di institusi perubatan di bawah pengawasan pakar.
Terapi:
- Membersihkan perut dengan probe,
- Penggunaan penitis dengan penyelesaian perubatan,
- Menetapkan ubat untuk melegakan kesakitan
- Penggunaan ubat-ubatan yang bertujuan untuk memulihkan fungsi organ dan sistem,
- Jika perlu, penyedutan oksigen dan pengudaraan buatan paru-paru,
- Menjalankan terapi resusitasi jika tiada tanda-tanda kehidupan,
- Pemilihan vitamin dan pemakanan khas.
Rawatan dijalankan dalam rawatan rapi, dan kemudian di hospital. Tempohnya bergantung pada keadaan pesakit dan tahap keracunan.
Terbakar dan keracunan
Walaupun berkesan ubat ini, ia berbahaya. Asid hidroklorik, bergantung pada kepekatan, boleh mencetuskan luka bakar kimia empat darjah:
- Hanya ada kemerahan dan kesakitan.
- Terdapat lepuh dengan cecair jernih dan bengkak.
- Nekrosis terbentuk pada lapisan atas kulit.Lepuh dipenuhi dengan darah atau kandungan keruh.
- Lesi mencapai tendon dan otot.
Sekiranya bahan itu masuk ke dalam mata, perlu membilasnya dengan air, dan kemudian dengan larutan soda. Tetapi dalam apa jua keadaan, perkara pertama yang perlu dilakukan ialah menghubungi ambulans.
Pengambilan asid di dalam penuh dengan sakit akut di dada dan perut, pembengkakan laring, muntah massa berdarah. Akibatnya, patologi teruk hati dan buah pinggang.
Dan tanda-tanda pertama keracunan secara berpasangan termasuk batuk kerap kering, tercekik, kerosakan pada gigi, terbakar dalam membran mukus dan sakit perut. Bantuan kecemasan pertama ialah membasuh dan membilas mulut dengan air, serta akses kepada udara segar. Hanya ahli toksikologi boleh memberikan bantuan sebenar.
Sifat spektrum kimia
Asid berinteraksi dengan banyak logam, garam. Ia dianggap agak kuat dan setanding dengan chamois. Reaksi utama menunjukkan dirinya dalam semua kumpulan logam yang terletak di sebelah kiri hidrogen (magnesium, besi, zink - potensi elektrik).
Larutan hidrogen klorida dalam bentuk cair bertindak balas dengan garam, tetapi hanya dengan yang dibentuk oleh asid kurang kuat. Dikenali kepada semua natrium dan kalsium karbonat, selepas interaksi dengannya, mereka terurai menjadi air dan karbon monoksida.
Asid nitrik
- tindak balas kualitatif kepada larutan garam. Untuk mendapatkannya, perlu menambah nitrat perak kepada reagen ini, akibatnya, mendakan putih akan terbentuk, dari mana bahan nitrogen diperoleh.
Dengan bantuan campuran air dan hidrogen ini, banyak eksperimen menarik dijalankan. Sebagai contoh, cairkan dengan ammonia. Akibatnya, anda akan mendapat asap putih, tebal, mempunyai konsistensi kristal kecil. Methylamine, aniline, mangan dioksida, kalium karbonat adalah reagen yang juga dipengaruhi oleh asid.
Bagaimana dan mengapa ia digunakan
Mungkin, ini adalah salah satu bahan penting yang ditemui dan diperlukan dalam hampir semua cabang kehidupan manusia.
Penyetempatan kawasan aplikasi:
- Metalurgi. Pembersihan permukaan dari kawasan teroksida, pembubaran karat, rawatan pra-pematerian, tinning. Asid hidroklorik membantu mengekstrak kemasukan kecil logam daripada bijih. Zirkonium dan titanium diperoleh menggunakan kaedah menukar oksida kepada klorida.
- Industri teknologi makanan. Larutan kepekatan rendah digunakan sebagai bahan tambahan makanan. Gelatin, fruktosa untuk pesakit kencing manis mengandungi pengemulsi tulen. Soda biasa juga mempunyai kandungan bahan ini yang tinggi. Pada pembungkusan barangan anda akan melihatnya di bawah nama E507.
- Bidang perubatan. Dengan penunjuk persekitaran berasid yang tidak mencukupi dalam perut dan masalah dengan usus. Ph rendah membawa kepada kanser. Walaupun dengan pemakanan yang betul, vitamin yang banyak, bahaya tidak hilang, adalah perlu untuk menjalankan ujian untuk mendapatkan jus dari saluran gastrik, kerana dalam persekitaran yang tidak berasid, bahan berguna secara praktikal tidak diserap, pencernaan terganggu.
- Larutan garam digunakan sebagai perencat - perlindungan terhadap kotoran dan jangkitan, tindakan antiseptik. Untuk pembuatan campuran pelekat, produk seramik. Ia menyiram penukar haba.
- Prosedur untuk menulenkan air minuman juga tidak lengkap tanpa penyertaan klorin.
- Pengeluaran getah, pelunturan asas fabrik.
- Anda boleh menjaga kanta anda dengan penyelesaian ini.
- Pencuci mulut di rumah
- Bahan tersebut merupakan pengalir elektrik yang sangat baik.
Bagaimana keracunan berlaku
Asid hidroklorik adalah cecair tidak berwarna dengan ciri bau pedas. Salah satu asid terkuat, mampu melarutkan beberapa logam. Mudah bertukar menjadi gas.
Hidrogen klorida digunakan dalam industri tekstil, perniagaan kulit, metalurgi logam berharga, dalam pengeluaran gam, asid.
Bahan tersebut terdapat di dalam perut dalam kepekatan minimum. Asid menyumbang kepada normalisasi proses pencernaan, melindungi tubuh daripada bakteria dan mikroorganisma berbahaya.
Pada kepekatan melebihi 24%, asid hidroklorik boleh menyebabkan kemudaratan yang tidak dapat dipulihkan kepada tubuh manusia. Wap yang terbentuk apabila bersentuhan dengan udara menyebabkan kerengsaan pada organ sistem penglihatan dan pernafasan.
Terdapat beberapa faktor yang boleh mencetuskan perkembangan keracunan.
Faktor:
Keracunan wap adalah mungkin apabila bekerja di dalam bilik dengan pengudaraan yang lemah,
Tertelan oleh kecuaian, lebih biasa pada kanak-kanak,
Kemasukan asid hidroklorik pada epidermis, membran mukus sekiranya tidak mematuhi peraturan untuk menggunakan reagen.
Keracunan oleh bahan di rumah pada orang dewasa berlaku akibat penggunaan tanpa peralatan pelindung kulit, mata, dan organ sistem pernafasan. Keracunan boleh berlaku apabila asid dipindahkan secara tidak tepat dari satu bekas ke bekas yang lain.
Farmakodinamik dan farmakokinetik
Apakah keasidan gastrik? Ini adalah ciri kepekatan asid hidroklorik dalam perut. Keasidan dinyatakan dalam pH
. Biasanya, asid harus dihasilkan dalam komposisi jus gastrik dan mengambil bahagian aktif dalam proses penghadaman. Formula asid hidroklorik: HCl
. Ia dihasilkan oleh sel parietal yang terletak di kelenjar fundik, dengan penyertaan H+/K+-ATPase
. Sel-sel ini melapisi fundus dan badan perut. Keasidan jus gastrik itu sendiri berubah-ubah dan bergantung kepada bilangan sel parietal dan keamatan proses peneutralan bahan oleh komponen alkali jus gastrik. Kepekatan yang dihasilkan kepada - anda stabil dan bersamaan dengan 160 mmol/l. Orang yang sihat biasanya harus menghasilkan tidak lebih daripada 7 dan sekurang-kurangnya 5 mmol bahan setiap jam.
Dengan pengeluaran Asid Hidroklorik yang tidak mencukupi atau berlebihan, penyakit saluran pencernaan berlaku, keupayaan untuk menyerap unsur mikro tertentu, seperti besi, merosot. Ubat ini merangsang rembesan jus gastrik, mengurangkan pH
. Mengaktifkan pepsinogen
, menukarkannya kepada enzim aktif pepsin
. Bahan ini mempunyai kesan yang baik pada refleks asid perut, melambatkan peralihan makanan yang tidak dicerna sepenuhnya ke dalam usus. Proses penapaian kandungan saluran pencernaan melambatkan, rasa sakit dan sendawa hilang, besi diserap dengan lebih baik.
Selepas pentadbiran lisan, ubat ini sebahagiannya dimetabolismekan oleh air liur dan lendir gastrik, kandungan duodenum 12. Bahan yang tidak terikat menembusi ke dalam duodenum, di mana ia dinetralkan sepenuhnya oleh kandungan alkalinya.
Satu lagi kegunaan asid dalam kehidupan seharian
Dengan komposisi berasid, anda boleh dengan mudah membersihkan kerak kapur dan karat daripada paip faience, membuang batu kencing dan bahan cemar lain. Untuk kesan yang lebih besar, perencat (contohnya, urotropin) ditambah kepada agen, yang melambatkan tindak balas kimia.
Prosedur ini dijalankan seperti berikut: asid dicairkan dengan air sehingga kepekatan 5% dicapai dan perencat ditambah pada kadar 0.5 g setiap 1 liter cecair. Permukaan dirawat dengan komposisi yang dihasilkan dan dibiarkan selama 30-40 minit (bergantung pada tahap pencemaran), selepas itu ia dibasuh dengan air.
Larutan asid ringan juga digunakan untuk menanggalkan kesan beri, dakwat atau karat daripada kain. Untuk melakukan ini, bahan itu direndam dalam komposisi untuk seketika, selepas itu dibilas dengan teliti dan dibasuh dengan cara biasa.
Menghilangkan skala dalam cerek
Untuk tujuan ini, larutan asid hidroklorik 3-5% digunakan, yang dituangkan ke dalam cerek dan dipanaskan hingga 60-80°
C selama 1-2 jam atau sehingga deposit skala hancur. Selepas itu, skala menjadi longgar dan mudah dikeluarkan dengan spatula kayu.
Keberkesanan kaedah ini disebabkan oleh fakta bahawa reagen bertindak balas dengan magnesium dan kalsium karbonat dan menukarnya menjadi garam larut. Karbon dioksida yang dikeluarkan pada masa yang sama memusnahkan lapisan skala dan menjadikannya longgar. Selepas mengeluarkan mendapan garam, pinggan mangkuk dibasuh dengan air bersih.
Perkara penting!
Kaedah ini tidak sesuai untuk membersihkan kerak enamel atau cerek aluminium yang sumbing dan retak: ini akan menghakis logam dan merosakkannya dengan teruk.
Mendapat bahan
Sekarang kita boleh bercakap tentang apa yang mereka lakukan untuk membentuk asid hidroklorik.
Pertama, dengan membakar hidrogen dalam klorin, komponen utama, hidrogen klorida gas, diperolehi. yang kemudiannya dilarutkan dalam air. Hasil tindak balas mudah ini ialah pembentukan asid sintetik.
Bahan ini juga boleh didapati daripada gas luar. Ini adalah sisa kimia (samping) gas. Mereka dibentuk oleh pelbagai proses. Contohnya, apabila mengklorin hidrokarbon. Hidrogen klorida dalam komposisinya dipanggil gas luar. Dan asid yang diperolehi, masing-masing.
Perlu diingatkan bahawa dalam beberapa tahun kebelakangan ini bahagian bahan luar gas dalam jumlah keseluruhan pengeluarannya telah meningkat. Dan asid yang terbentuk akibat pembakaran hidrogen dalam klorin disesarkan. Walau bagaimanapun, dalam keadilan, perlu diperhatikan bahawa ia mengandungi lebih sedikit kekotoran.
Penggunaan pengeluaran
Ia mempunyai aplikasi yang luas dalam industri metalurgi, makanan dan perubatan.
- Metalurgi. Gunakan dalam pematerian, tinning dan pembersihan logam.
- Industri Makanan. Aplikasi dalam pengeluaran pengawal selia keasidan makanan, contohnya, E507.
- Elektrotaip. Digunakan untuk jeruk.
- Ubat. Ia mendapati aplikasinya dalam pengeluaran jus gastrik tiruan.
Termasuk dalam pewarna sintetik. Ia digunakan dalam pengeluaran produk pembersihan dan detergen. Tetapi dalam cecair yang dimaksudkan untuk kegunaan domestik, kepekatan asid sulfurik boleh diabaikan.
Bagaimana asid hidroklorik dihasilkan di makmal
Pengeluaran bahan itu berskala besar, jualan adalah percuma. Dalam keadaan eksperimen makmal, penyelesaian dihasilkan oleh tindakan asid sulfurik berkepekatan tinggi pada garam dapur biasa (natrium klorida).
Terdapat 2 kaedah untuk melarutkan hidrogen klorida dalam air:
- Hidrogen dibakar dalam klorin (sintetik).
- Berkaitan (luar gas). Intipatinya adalah dalam menjalankan pengklorinan organik, dehidroklorinasi.
Bahan ini sesuai untuk sintesis semasa pirolisis sisa daripada organoklorin. Ini berlaku akibat pemecahan hidrokarbon dengan kekurangan oksigen sepenuhnya. Anda juga boleh menggunakan klorida logam, yang merupakan bahan mentah bahan bukan organik. Jika tiada asid sulfurik pekat (elektrolit), ambil yang dicairkan.
Bagi pengekstrakan reagen dalam keadaan semula jadi, selalunya campuran kimia ini boleh didapati di perairan sisa gunung berapi. Hidrogen klorida adalah komponen mineral sylvin (kalium klorida, kelihatan seperti tulang untuk permainan), bischofite. Semua ini adalah kaedah untuk mengekstrak bahan dalam industri.
Pada manusia, enzim ini terdapat di dalam perut. Suatu larutan boleh sama ada asid atau bes. Salah satu kaedah pengekstrakan yang paling biasa dipanggil sulfat.
Sifat kimia
Asid hidroklorik, hidrogen klorida atau asid hidroklorik - larutan Hcl
dalam air. Menurut Wikipedia, bahan tersebut tergolong dalam kumpulan to-t monobasic kuat bukan organik. Nama penuh kompaun dalam bahasa Latin: asid hidroklorik.
Formula asid hidroklorik dalam kimia: HCl
. Dalam molekul, atom hidrogen bergabung dengan atom halogen - Cl
. Jika kita mempertimbangkan konfigurasi elektronik molekul-molekul ini, dapat diperhatikan bahawa sebatian mengambil bahagian dalam pembentukan orbital molekul. 1s
-orbital hidrogen dan kedua-duanya 3s
dan 3p
-orbital atom Cl
. Dalam formula kimia asid hidroklorik 1s-
, 3s-
dan 3p
-orbital atom bertindih dan membentuk orbital 1, 2, 3. di mana 3s
-orbital tidak mengikat. Terdapat pergeseran ketumpatan elektron kepada atom Cl
dan kekutuban molekul berkurangan, tetapi tenaga ikatan orbital molekul meningkat (jika kita menganggapnya bersama-sama dengan hidrogen halida
).
Sifat fizikal hidrogen klorida. Ia adalah cecair jernih dan tidak berwarna yang berasap apabila terdedah kepada udara. Jisim molar sebatian kimia = 36.6 gram setiap mol. Di bawah keadaan standard, pada suhu udara 20 darjah Celsius, kepekatan maksimum bahan ialah 38% mengikut berat. Ketumpatan asid hidroklorik pekat dalam larutan ini ialah 1.19 g/cm³. Secara amnya, sifat dan ciri fizikal seperti ketumpatan, kemolaran, kelikatan, muatan haba, takat didih dan pH
, sangat bergantung pada kepekatan larutan. Nilai-nilai ini dibincangkan dengan lebih terperinci dalam jadual ketumpatan. Sebagai contoh, ketumpatan Asid Hidroklorik 10% = 1.048 kg seliter. Apabila pepejal, bahan terbentuk hidrat kristal
gubahan yang berbeza.
Sifat kimia asid hidroklorik. Apakah tindak balas asid hidroklorik? Bahan berinteraksi dengan logam yang berdiri di hadapan hidrogen dalam satu siri potensi elektrokimia (besi, magnesium, zink, dan lain-lain). Dalam kes ini, garam terbentuk dan gas H
. Plumbum, kuprum, emas, perak dan logam lain di sebelah kanan hidrogen tidak bertindak balas dengan asid hidroklorik. Bahan bertindak balas dengan oksida logam menghasilkan air dan garam larut. Natrium hidroksida di bawah tindakan kepada-anda bentuk dan air. Tindak balas peneutralan adalah ciri sebatian ini.
Asid Hidroklorik cair bertindak balas dengan garam logam, yang dibentuk oleh asid lemah. Sebagai contoh, asid propionik
lebih lemah daripada garam. Bahan tidak bertindak balas dengan asid yang lebih kuat. dan natrium karbonat
akan terbentuk selepas tindak balas dengan HCl
klorida, karbon monoksida dan air.
Untuk sebatian kimia, tindak balas dengan agen pengoksidaan kuat adalah ciri, dengan mangan dioksida
, kalium permanganat
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. Bahan bertindak balas dengan ammonia
, yang menghasilkan asap putih tebal, yang terdiri daripada kristal ammonium klorida yang sangat kecil. Pirolusit mineral juga bertindak balas dengan asid hidroklorik, kerana ia mengandungi mangan dioksida
: MnO2+4HCl=Cl2+MnO2+2H2O
(tindak balas pengoksidaan).
Terdapat tindak balas kualitatif terhadap asid hidroklorik dan garamnya. Apabila bahan berinteraksi dengan perak nitrat
mendakan putih perak klorida
dan terbentuk asid nitrik
. Persamaan tindak balas interaksi metilamin
dengan hidrogen klorida kelihatan seperti ini: HCl + CH3NH2 = (CH3NH3)Cl
.
Sesuatu bahan bertindak balas dengan basa lemah aniline
. Selepas melarutkan aniline dalam air, asid hidroklorik ditambah kepada campuran. Akibatnya, asas larut dan terbentuk anilin hidroklorida
(fenilamonium klorida
): (С6Н5NH3)Cl
. Tindak balas interaksi aluminium karbida dengan asid hidroklorik: Al4C3+12HCL=3CH4+4AlCl3
. Persamaan tindak balas kalium karbonat
yang kelihatan seperti ini: K2CO3 + 2HCl = 2KCl + H2O + CO2.
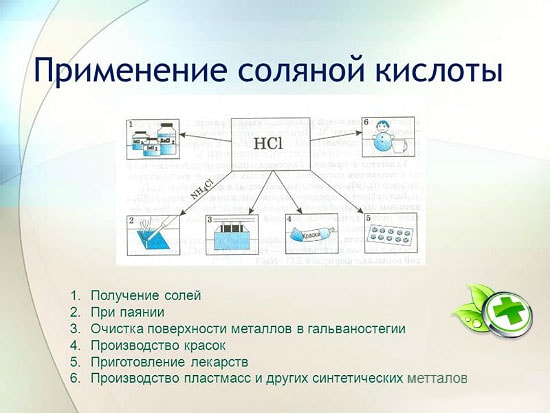
Permohonan
dalam metalurgi untuk pengekstrakan bijih, penyingkiran karat, skala, kotoran dan oksida, pematerian dan tinning;
dalam pembuatan getah dan resin sintetik;
dalam penyaduran elektrik;
sebagai pengawal selia keasidan dalam industri makanan;
untuk mendapatkan logam klorida;
untuk mendapatkan klorin;
dalam perubatan untuk rawatan keasidan yang tidak mencukupi jus gastrik;
sebagai pembersih dan pembasmi kuman.
- (HCl), larutan akueus hidrogen klorida, gas tidak berwarna dengan bau pedas. Diperolehi melalui tindakan asid sulfurik pada garam biasa, sebagai hasil sampingan daripada pengklorinan hidrokarbon, atau oleh tindak balas hidrogen dan klorin. Asid hidroklorik digunakan untuk ... ... Kamus ensiklopedia saintifik dan teknikal
Asid hidroklorik
- - HCl (SC) (asid hidroklorik, asid hidroklorik, hidrogen klorida) ialah larutan hidrogen klorida (HCl) dalam air, bahan tambahan antibeku. Ia adalah cecair tidak berwarna dengan bau pedas, tanpa zarah terampai. ... ... Ensiklopedia istilah, definisi dan penjelasan bahan binaan
ASID HIDROKLORIK
- (asid hidroklorik) larutan hidrogen klorida dalam air; asid kuat. Cecair tidak berwarna berasap di udara (asid hidroklorik teknikal berwarna kekuningan akibat kekotoran Fe, Cl2, dsb.). Kepekatan maksimum (pada 20 ° C) ialah 38% mengikut jisim, ... ... Kamus Ensiklopedia Besar
ASID HIDROKLORIK
- (Acidum muriaticum, Acid, hydrochloricum), larutan hidrogen klorida (HC1) dalam air. Secara semula jadi, ia berlaku di dalam air sumber tertentu dari gunung berapi, dan juga terdapat dalam jus gastrik (sehingga 0.5%). Hidrogen klorida boleh diperolehi ... Ensiklopedia Perubatan Besar
ASID HIDROKLORIK
- (asid hidroklorik, asid hidroklorik) asid meruap monobes yang kuat dengan bau pedas, larutan akueus hidrogen klorida; kepekatan maksimum ialah 38% mengikut jisim, ketumpatan larutan tersebut ialah 1.19 g/cm3. Digunakan dalam ... ... ensiklopedia Rusia perlindungan buruh
ASID HIDROKLORIK
- (asid hidroklorik) HCl larutan akueus hidrogen klorida, asid monobes kuat, meruap, dengan bau pedas; kekotoran besi, klorin mengotorkannya kekuningan. S. yang tertumpu untuk dijual mengandungi 37% ... ... Ensiklopedia Politeknik Besar
asid hidroklorik
— kata nama, bilangan sinonim: 1 asid (171) Kamus Sinonim ASIS. V.N. Trishin. 2013 ... Kamus Sinonim
ASID HIDROKLORIK
Ensiklopedia Moden
Asid hidroklorik
- ASID HIDROGENIK, larutan akueus hidrogen klorida HCl; cecair wasap dengan bau pedas. Asid hidroklorik digunakan untuk mendapatkan pelbagai klorida, logam penjerukan, pemprosesan bijih, dalam penghasilan klorin, soda, getah, dll. ... ... Kamus Ensiklopedia Bergambar
asid hidroklorik
- (asid hidroklorik), larutan hidrogen klorida dalam air; asid kuat. Cecair tidak berwarna "berasap" di udara (asid hidroklorik teknikal berwarna kekuningan kerana kekotoran Fe, Cl2, dll.). Kepekatan maksimum (pada 20 ° C) 38% mengikut jisim, ... ... Kamus Ensiklopedia
Apakah bahaya mabuk
Asid hidroklorik adalah bahaya khusus kepada tubuh manusia. Sekiranya keracunan dengan bahan sedemikian, komplikasi serius dan pelanggaran fungsi badan mungkin berkembang.
Komplikasi:
- Pelanggaran hati, akibat hepatitis toksik,
- Pendarahan dalam perut akibat dinding organ yang musnah,
- Keadaan terkejut akibat kesakitan apabila asid memasuki kawasan yang luas,
- Sekiranya terkena mata, kecacatan penglihatan,
- Kerosakan serius pada buah pinggang,
- Kegagalan pernafasan, sesak nafas, sesak nafas,
- Perkembangan koma.
Akibat yang sama berkembang secara beransur-ansur bergantung pada tahap keracunan.
Kesimpulan
Jika anda mengikuti langkah berjaga-jaga dan peraturan keselamatan, asid hidroklorik akan menjadi pembantu yang sangat diperlukan dalam kehidupan seharian. Dan anda boleh membelinya pada harga yang paling berpatutan di syarikat kami.
Seperti asid. Program pendidikan memperuntukkan hafalan oleh pelajar nama dan formula enam wakil kumpulan ini. Dan, melihat melalui jadual yang disediakan oleh buku teks, anda perhatikan dalam senarai asid yang didahulukan dan menarik minat anda di tempat pertama - asid hidroklorik. Malangnya, di dalam bilik darjah di sekolah, harta benda mahupun maklumat lain mengenainya tidak dipelajari. Oleh itu, mereka yang bersemangat untuk menimba ilmu di luar kurikulum sekolah mencari maklumat tambahan dalam pelbagai sumber. Tetapi selalunya, ramai yang tidak menemui maklumat yang mereka perlukan. Jadi topik artikel hari ini didedikasikan untuk asid tertentu ini.
Definisi
Asid hidroklorik ialah asid monobes yang kuat. Dalam sesetengah sumber, ia boleh dipanggil hidroklorik dan hidroklorik, serta hidrogen klorida.
Ciri-ciri fizikal
Ia adalah cecair kaustik yang tidak berwarna dan berasap di udara (foto di sebelah kanan). Walau bagaimanapun, asid teknikal mempunyai warna kekuningan kerana kehadiran besi, klorin dan bahan tambahan lain di dalamnya. Kepekatan terbesarnya pada suhu 20 ° C ialah 38%. Ketumpatan asid hidroklorik dengan parameter sedemikian ialah 1.19 g/cm 3 . Tetapi sebatian ini dalam pelbagai darjah ketepuan mempunyai data yang sama sekali berbeza.Dengan penurunan kepekatan, nilai berangka kemolaran, kelikatan dan takat lebur berkurangan, tetapi kapasiti haba tentu dan takat didih meningkat. Pemejalan asid hidroklorik bagi sebarang kepekatan memberikan pelbagai hidrat kristal.
Sifat kimia
Semua logam yang datang sebelum hidrogen dalam siri elektrokimia voltannya boleh berinteraksi dengan sebatian ini, membentuk garam dan membebaskan gas hidrogen. Jika ia digantikan oleh oksida logam, maka hasil tindak balas akan menjadi garam dan air yang larut. Kesan yang sama akan berlaku dalam interaksi asid hidroklorik dengan hidroksida. Walau bagaimanapun, jika sebarang garam logam (contohnya, natrium karbonat) ditambah kepadanya, sisanya diambil daripada asid yang lebih lemah (karbonik), maka klorida logam ini (natrium), air dan gas yang sepadan dengan asid sisa (dalam kes ini, karbon dioksida) terbentuk.
resit
Kompaun yang dibincangkan sekarang terbentuk apabila gas hidrogen klorida, yang boleh diperolehi dengan membakar hidrogen dalam klorin, dilarutkan dalam air. Asid hidroklorik, yang diperoleh menggunakan kaedah ini, dipanggil sintetik. Gas luar juga boleh berfungsi sebagai sumber untuk mendapatkan bahan ini. Dan asid hidroklorik sedemikian akan dipanggil off-gas. Baru-baru ini, tahap pengeluaran asid hidroklorik menggunakan kaedah ini jauh lebih tinggi daripada pengeluarannya melalui kaedah sintetik, walaupun yang terakhir memberikan sebatian dalam bentuk yang lebih tulen. Ini semua adalah cara untuk mendapatkannya dalam industri. Walau bagaimanapun, dalam makmal, asid hidroklorik dihasilkan dalam tiga cara (dua yang pertama berbeza hanya dalam suhu dan produk tindak balas) menggunakan pelbagai jenis interaksi kimia, seperti:
- Kesan asid sulfurik tepu pada natrium klorida pada 150°C.
- Interaksi bahan di atas dalam keadaan dengan suhu 550 ° C dan ke atas.
- Hidrolisis aluminium atau magnesium klorida.
Permohonan
Hydrometallurgy dan electroforming tidak boleh dilakukan tanpa menggunakan asid hidroklorik, di mana ia diperlukan, untuk membersihkan permukaan logam semasa tinning dan pematerian dan untuk mendapatkan klorida mangan, besi, zink dan logam lain. Dalam industri makanan, sebatian ini dikenali sebagai bahan tambahan makanan E507 - di sana ia adalah pengatur keasidan yang diperlukan untuk membuat air seltzer (soda). Asid hidroklorik pekat juga terdapat dalam jus gastrik mana-mana orang dan membantu untuk mencerna makanan. Semasa proses ini, tahap ketepuannya berkurangan, kerana. komposisi ini dicairkan dengan makanan. Walau bagaimanapun, dengan berpuasa yang berpanjangan, kepekatan asid hidroklorik dalam perut secara beransur-ansur meningkat. Dan kerana sebatian ini sangat kaustik, ia boleh menyebabkan ulser perut.
Kesimpulan
Asid hidroklorik boleh memberi manfaat dan berbahaya kepada manusia. Sentuhannya dengan kulit membawa kepada luka bakar kimia yang teruk, dan wap sebatian ini merengsakan saluran pernafasan dan mata.
Tetapi jika anda mengendalikan bahan ini dengan berhati-hati, ia boleh menjadi berguna lebih daripada sekali masuk