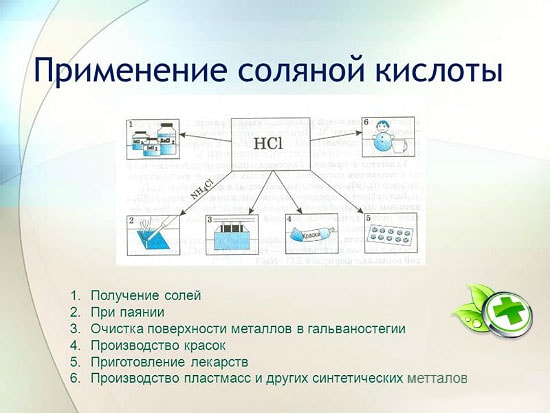
Het gebruik van zoutzuur
Zoutzuur wordt veel gebruikt in de industrie voor het extraheren van metalen uit ertsen, het beitsen van metalen, enz. Het wordt ook gebruikt bij de vervaardiging van soldeervloeistof, bij de afzetting van zilver en als een integraal onderdeel van Aqua Regia.
De omvang van het gebruik van zoutzuur in de industrie is kleiner dan dat van salpeterzuur. Dit komt door het feit dat zoutzuur corrosie van stalen apparatuur veroorzaakt. Bovendien zijn de vluchtige dampen behoorlijk schadelijk en veroorzaken ze ook corrosie van metalen producten. Bij de opslag van zoutzuur moet hiermee rekening worden gehouden. Zoutzuur wordt opgeslagen en vervoerd in met rubber beklede tanks en vaten, d.w.z. in vaten waarvan het binnenoppervlak is bedekt met zuurbestendig rubber, evenals in glazen flessen en keukengerei van polyethyleen.
Zoutzuur wordt gebruikt om chloriden van zink, mangaan, ijzer en andere metalen te produceren, evenals ammoniumchloride. Zoutzuur wordt gebruikt om de oppervlakken van metalen, vaten, putten te reinigen van carbonaten, oxiden en andere sedimenten en verontreinigingen. In dit geval worden speciale additieven gebruikt - remmers die het metaal beschermen tegen oplossen en corrosie, maar het oplossen van oxiden, carbonaten en andere soortgelijke verbindingen niet vertragen.
HCl wordt gebruikt bij de industriële productie van synthetische harsen, rubbers. Het wordt gebruikt als grondstof bij de productie van methylchloride uit methylalcohol, ethylchloride uit ethyleen en vinylchloride uit acetyleen.
Eerste hulp en behandelmethoden
Als er tekenen van vergiftiging worden gevonden, moet een ambulance worden gebeld. Thuis is het toegestaan om activiteiten uit te voeren die gericht zijn op het verbeteren van de toestand van het slachtoffer. Eerste hulp bij zoutzuurvergiftiging moet snel worden uitgevoerd om het risico op negatieve gevolgen te verminderen.
Evenementen:
- Als de zoutverbinding op de huid komt, worden de beschadigde gebieden gewassen met veel koud water. De verwerkingstijd is minimaal een half uur.
- In geval van bedwelming met dampen krijgt het slachtoffer toegang tot frisse lucht, worden ramen geopend, worden strakke kleding losgeknoopt.
- Het wordt aanbevolen om de toestand van de patiënt te controleren, bij afwezigheid van tekenen van leven wordt reanimatie uitgevoerd.
- Het slachtoffer uit de dampen mag warme thee en water drinken. Het wordt aanbevolen om de neus en mond met koud water te spoelen.
- In geval van een overdosis als gevolg van inname van zuur, wordt een ijskompres op de buik geplaatst om mogelijke bloedingen te voorkomen of te verminderen.
- Geneesmiddelen zijn niet toegestaan. Het is toegestaan om de patiënt een glas water te geven (u kunt minerale alkaline gebruiken). Drinkvloeistof is vereist in kleine slokjes.
- Het is niet toegestaan om de maag te wassen, probeer thuis braken op te wekken. Dergelijke eerste hulp kan leiden tot de ontwikkeling van brandwonden aan de keel, bloedingen.
De behandeling wordt uitgevoerd in een medische instelling onder toezicht van specialisten.
Therapie:
- De maag reinigen met een sonde,
- Gebruik van druppelaars met medicinale oplossingen,
- Medicijnen voorschrijven om pijn te verlichten
- Het gebruik van geneesmiddelen gericht op het herstellen van de werking van organen en systemen,
- Indien nodig, zuurstofinhalatie en kunstmatige ventilatie van de longen,
- Reanimatietherapie uitvoeren bij afwezigheid van tekenen van leven,
- Selectie van vitamines en speciale voeding.
De behandeling wordt uitgevoerd op de intensive care en vervolgens in een ziekenhuis. De duur is afhankelijk van de toestand van de patiënt en de mate van vergiftiging.
Brandwonden en vergiftiging
Hoe effectief deze remedie ook is, ze is gevaarlijk. Zoutzuur kan, afhankelijk van de concentratie, chemische brandwonden van vier graden veroorzaken:
- Er is alleen roodheid en pijn.
- Er zijn blaren met een heldere vloeistof en zwelling.
- Gevormde necrose van de bovenste huidlagen.Blaren vullen zich met bloed of troebele inhoud.
- De laesie bereikt de pezen en spieren.
Als de substantie op de een of andere manier in de ogen is gekomen, is het noodzakelijk om ze met water te spoelen en vervolgens met een soda-oplossing. Maar in ieder geval is het eerste wat u moet doen een ambulance bellen.
De inname van zuur binnenin is beladen met acute pijn in de borst en buik, zwelling van het strottenhoofd, braken van bloederige massa's. Dientengevolge, ernstige pathologieën van de lever en de nieren.
En de eerste tekenen van vergiftiging in paren zijn onder meer een droge, frequente hoest, verstikking, schade aan de tanden, brandend gevoel in de slijmvliezen en buikpijn. De eerste noodhulp is het spoelen en spoelen van de mond met water, evenals toegang tot frisse lucht. Alleen een toxicoloog kan echte hulp bieden.
Eigenschappen van het chemische spectrum
Zuur interageert met veel metalen, zouten. Het wordt als vrij sterk beschouwd en is vergelijkbaar met gemzen. De hoofdreactie manifesteert zich in alle groepen metalen die zich links van waterstof bevinden (magnesium, ijzer, zink - elektrische potentialen).
Waterstofchloride-oplossing in verdunde vorm reageert met zouten, maar alleen met die gevormd door minder sterke zuren. Bekend bij alle natrium- en calciumcarbonaat, ontbinden ze na interactie ermee in water en koolmonoxide.
Salpeterzuur
- een kwalitatieve reactie op een zoutoplossing. Om het te verkrijgen, is het noodzakelijk om zilvernitraat aan dit reagens toe te voegen, waardoor zich een wit neerslag zal vormen, waaruit een stikstofsubstantie wordt verkregen.
Met behulp van dit mengsel van water en waterstof worden veel interessante experimenten uitgevoerd. Verdun het bijvoorbeeld met ammoniak. Als resultaat krijg je witte rook, dik, met de consistentie van kleine kristallen. Methylamine, aniline, mangaandioxide, kaliumcarbonaat zijn reagentia die ook door zuur worden aangetast.
Hoe en waarom wordt het gebruikt?
Misschien is dit met recht een van de belangrijke stoffen die in bijna alle takken van het menselijk leven wordt gevonden en nodig is.
Toepassingsgebied lokalisatie:
- Metallurgie. Oppervlaktereiniging van geoxideerde gebieden, oplossen van roest, voorsolderen, vertinnen. Zoutzuur helpt bij het extraheren van kleine insluitsels van metalen uit ertsen. Zirkonium en titanium worden verkregen met behulp van de methode om oxiden om te zetten in chloriden.
- Levensmiddelentechnologie industrie. Een oplossing met een lage concentratie wordt gebruikt als voedseladditief. Gelatine, fructose voor diabetici bevat een pure emulgator. Gewone frisdrank heeft ook een hoog gehalte aan deze stof. Op de verpakking van goederen ziet u deze onder de naam E507.
- Het gebied van de geneeskunde. Met een onvoldoende indicatie van het zure milieu in de maag en problemen met de darmen. Lage Ph leidt tot kanker. Zelfs met de juiste voeding, vitamines in overvloed, verdwijnt het gevaar niet, het is noodzakelijk om tests uit te voeren om sap uit het maagkanaal te verkrijgen, omdat in een onvoldoende zure omgeving nuttige stoffen praktisch niet worden opgenomen, de spijsvertering wordt verstoord.
- Zoutoplossing wordt gebruikt als een remmer - bescherming tegen vuil en infecties, antiseptische werking. Voor de vervaardiging van lijmmengsels, keramische producten. Het spoelt warmtewisselaars door.
- De procedure voor het zuiveren van drinkwater is ook niet compleet zonder de deelname van chloor.
- Productie van rubber, bleken van weefsels.
- Met deze oplossing kunt u uw lenzen verzorgen.
- Mondwater thuis
- De stof is een uitstekende geleider van elektriciteit.
Hoe vergiftiging optreedt
Zoutzuur is een kleurloze vloeistof met een kenmerkende scherpe geur. Een van de sterkste zuren, die sommige metalen kan oplossen. Verandert gemakkelijk in een gas.
Waterstofchloride wordt gebruikt in de textielindustrie, leerindustrie, metallurgie van edele metalen, bij de productie van lijm, zuren.
De stof is in minimale concentratie in de maag aanwezig. Zuur draagt bij aan de normalisatie van het spijsverteringsproces, beschermt het lichaam tegen schadelijke bacteriën en micro-organismen.
Bij een concentratie van meer dan 24% kan zoutzuur onomkeerbare schade toebrengen aan het menselijk lichaam. Dampen gevormd bij contact met lucht veroorzaken irritatie van de organen van het gezichts- en ademhalingssysteem.
Er zijn verschillende factoren die de ontwikkeling van vergiftiging kunnen veroorzaken.
Factoren:
Dampvergiftiging is mogelijk bij het werken in ruimtes met slechte ventilatie,
Inslikken door nalatigheid, komt vaker voor bij kinderen,
Het binnendringen van zoutzuur op de epidermis, slijmvliezen in geval van niet-naleving van de regels voor het gebruik van het reagens.
Vergiftiging door een stof thuis bij volwassenen treedt op als gevolg van het gebruik zonder beschermende uitrusting van de huid, ogen en organen van de luchtwegen. Intoxicatie kan optreden wanneer zuur onnauwkeurig van de ene container naar de andere wordt overgebracht.
Farmacodynamiek en farmacokinetiek
Wat is maagzuur? Dit is een kenmerk van de concentratie zoutzuur in de maag. Zuurgraad wordt uitgedrukt in pH
. Normaal gesproken moet zuur worden geproduceerd in de samenstelling van maagsap en actief deelnemen aan de spijsverteringsprocessen. Formule van zoutzuur: HCl
. Het wordt geproduceerd door pariëtale cellen in de fundusklieren, met de deelname van H+/K+-ATPase
. Deze cellen bekleden de fundus en het lichaam van de maag. De zuurgraad van maagsap zelf is variabel en hangt af van het aantal pariëtale cellen en de intensiteit van de processen van neutralisatie van de stof door de alkalische componenten van maagsap. Concentratie geproduceerd om - je bent stabiel en gelijk aan 160 mmol/l. Een gezond persoon zou normaal gesproken niet meer dan 7 en minimaal 5 mmol van een stof per uur moeten produceren.
Bij onvoldoende of overmatige productie van zoutzuur treden ziekten van het spijsverteringskanaal op, het vermogen om bepaalde micro-elementen, zoals ijzer, te absorberen verslechtert. Het medicijn stimuleert de afscheiding van maagsap, vermindert pH
. Activeert pepsinogeen
, zet het om in een actief enzym pepsine
. De stof heeft een gunstig effect op de zuurreflex van de maag, vertraagt de overgang van onvolledig verteerd voedsel naar de darmen. De processen van fermentatie van de inhoud van het spijsverteringskanaal vertragen, pijn en oprispingen verdwijnen, ijzer wordt beter opgenomen.
Na orale toediening wordt het medicijn gedeeltelijk gemetaboliseerd door speeksel en maagslijm, de inhoud van de twaalfvingerige darm 12. De ongebonden stof dringt door tot in de twaalfvingerige darm, waar het volledig wordt geneutraliseerd door zijn alkalische inhoud.
Een ander gebruik van zuur in het dagelijks leven
Met een zure samenstelling kunt u gemakkelijk kalkaanslag en roest van faience-leidingen verwijderen, urinesteen en andere verontreinigingen verwijderen. Voor een groter effect wordt aan het middel een remmer (bijvoorbeeld urotropine) toegevoegd, die de chemische reactie vertraagt.
De procedure wordt als volgt uitgevoerd: het zuur wordt verdund met water tot een concentratie van 5% is bereikt en een remmer wordt toegevoegd met een snelheid van 0,5 g per 1 liter vloeistof. Het oppervlak wordt behandeld met de resulterende samenstelling en 30-40 minuten gelaten (afhankelijk van de mate van vervuiling), waarna het wordt gewassen met water.
Een milde zuuroplossing wordt ook gebruikt om bessenvlekken, inkt- of roestvlekken van stoffen te verwijderen. Om dit te doen, wordt het materiaal een tijdje in de samenstelling gedrenkt, waarna het op de gebruikelijke manier grondig wordt gespoeld en gewassen.
Kalk in de waterkoker verwijderen
Voor dit doel wordt een 3-5% zoutzuuroplossing gebruikt, die in een ketel wordt gegoten en tot 60-80 wordt verwarmd°
C gedurende 1-2 uur of totdat de kalkafzetting uiteenvalt. Daarna komt de schaal los en is deze gemakkelijk te verwijderen met een houten spatel.
De effectiviteit van de methode is te danken aan het feit dat het reagens reageert met magnesium- en calciumcarbonaten en deze omzet in oplosbare zouten. De daarbij vrijkomende kooldioxide vernietigt de kalklaag en maakt deze los. Na het verwijderen van zoutafzettingen wordt de vaat grondig gewassen met schoon water.
Belangrijk punt!
Deze methode is niet geschikt voor het ontkalken van afgebroken en gebarsten emaille of aluminium ketels: dit zal het metaal aantasten en ernstige schade veroorzaken.
Een stof krijgen
Nu kunnen we praten over wat ze doen om zoutzuur te vormen.
Ten eerste wordt door waterstof in chloor te verbranden het hoofdbestanddeel, gasvormig waterstofchloride, verkregen. die vervolgens wordt opgelost in water. Het resultaat van deze eenvoudige reactie is de vorming van een synthetisch zuur.
Deze stof kan ook worden gewonnen uit afgassen. Dit zijn chemische afval(bij)gassen. Ze worden gevormd door verschillende processen. Bijvoorbeeld bij het chloreren van koolwaterstoffen. Het waterstofchloride in hun samenstelling wordt afgas genoemd. En het aldus verkregen zuur, respectievelijk.
Opgemerkt moet worden dat de laatste jaren het aandeel van de afgasstof in het totale volume van de productie ervan toeneemt. En het zuur dat ontstaat als gevolg van de verbranding van waterstof in chloor wordt verdrongen. Eerlijkheidshalve moet echter worden opgemerkt dat het minder onzuiverheden bevat.
productie gebruik:
Het heeft een brede toepassing in de metallurgische, voedings- en medische industrie.
- Metallurgie. Gebruik bij het solderen, vertinnen en reinigen van metalen.
- Voedselindustrie. Toepassing bij de productie van zuurteregelaars voor voedingsmiddelen, bijvoorbeeld E507.
- Elektrotype. Gebruikt voor beitsen.
- Geneesmiddel. Het vindt zijn toepassing bij de productie van kunstmatig maagsap.
Opgenomen in synthetische kleurstoffen. Het wordt gebruikt bij de productie van reinigings- en wasmiddelen. Maar in vloeistoffen die bedoeld zijn voor huishoudelijk gebruik, is de concentratie van zwavelzuur verwaarloosbaar.
Hoe zoutzuur wordt geproduceerd in het laboratorium
De productie van de stof is grootschalig, de verkoop is gratis. In de omstandigheden van laboratoriumexperimenten wordt een oplossing geproduceerd door de inwerking van zwavelzuur met een hoge concentratie op gewoon keukenzout (natriumchloride).
Er zijn 2 methoden om waterstofchloride in water op te lossen:
- Waterstof wordt verbrand in chloor (synthetisch).
- Bijbehorend (off-gas). De essentie is het uitvoeren van organische chlorering, dehydrochlorering.
De stof leent zich goed voor synthese tijdens de pyrolyse van afval uit organochloor. Dit gebeurt als gevolg van de afbraak van koolwaterstoffen met een volledig gebrek aan zuurstof. Je kunt ook metaalchloriden gebruiken, dat zijn de grondstoffen van anorganische stoffen. Als er geen geconcentreerd zwavelzuur (elektrolyt) is, neem dan verdund.
Wat betreft de extractie van het reagens in natuurlijke omstandigheden, is dit chemische mengsel meestal te vinden in de wateren van vulkanisch afval. Waterstofchloride is een bestanddeel van de mineralen sylvin (kaliumchloride, lijkt op botten voor spelletjes), bischofiet. Dit zijn allemaal methoden om de stof in de industrie te extraheren.
Bij mensen wordt dit enzym in de maag aangetroffen. Een oplossing kan een zuur of een base zijn. Een van de meest gebruikelijke extractiemethoden wordt sulfaat genoemd.
Chemische eigenschappen
Zoutzuur, waterstofchloride of zoutzuur - oplossing HCl
in water. Volgens Wikipedia behoort de stof tot de groep van anorganische sterk monobasisch to-t. De volledige naam van de verbinding in het Latijn: zoutzuur.
Formule van zoutzuur in de chemie: HCl
. In een molecuul combineren waterstofatomen met halogeenatomen - kl
. Als we kijken naar de elektronische configuratie van deze moleculen, kan worden opgemerkt dat verbindingen deelnemen aan de vorming van moleculaire orbitalen 1s
-waterstoforbitalen en beide 3s
en 3p
-orbitalen van een atoom kl
. In de chemische formule van zoutzuur 1s-
, 3s-
en 3r
-atomaire orbitalen overlappen en vormen 1, 2, 3 orbitalen. Waarin 3s
-orbitaal is niet bindend. Er is een verschuiving van de elektronendichtheid naar het atoom kl
en de polariteit van het molecuul neemt af, maar de bindingsenergie van moleculaire orbitalen neemt toe (als we het samen met andere waterstofhalogeniden
).
Fysische eigenschappen van waterstofchloride. Het is een heldere, kleurloze vloeistof die rookt bij blootstelling aan lucht. Molaire massa van een chemische verbinding = 36,6 gram per mol. Onder standaardomstandigheden, bij een luchttemperatuur van 20 graden Celsius, is de maximale concentratie van een stof 38 gew.%. De dichtheid van geconcentreerd zoutzuur in dit soort oplossingen is 1,19 g/cm³. In het algemeen fysieke eigenschappen en kenmerken zoals dichtheid, molariteit, viscositeit, warmtecapaciteit, kookpunt en pH
, zijn sterk afhankelijk van de concentratie van de oplossing. Deze waarden worden in meer detail besproken in de tabel met dichtheden. Bijvoorbeeld de dichtheid van zoutzuur 10% = 1,048 kg per liter. Wanneer gestold, vormt de stof kristallijne hydraten
verschillende composities.
Chemische eigenschappen van zoutzuur. Waar reageert zoutzuur mee? De stof interageert met metalen die voor waterstof staan in een reeks elektrochemische potentialen (ijzer, magnesium, zink en andere). In dit geval worden zouten gevormd en gasvormig H
. Lood, koper, goud, zilver en andere metalen rechts van waterstof reageren niet met zoutzuur. De stof reageert met metaaloxiden met vorming van water en een oplosbaar zout. Natriumhydroxide onder invloed van to-you vormen en water. Kenmerkend voor deze verbinding is de neutralisatiereactie.
Verdund zoutzuur reageert met metaalzouten, die worden gevormd door zwakkere zuren. Bijvoorbeeld, propionzuur
zwakker dan zout. De stof reageert niet met sterkere zuren. en natriumcarbonaat
zal zich vormen na reactie met HCl
chloride, koolmonoxide en water.
Voor een chemische verbinding zijn reacties met sterke oxidatiemiddelen kenmerkend, met mangaandioxide
, kaliumpermanganaat
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. De stof reageert met ammoniak
, die dikke witte rook produceert, die bestaat uit zeer fijne kristallen van ammoniumchloride. Het mineraal pyrolusiet reageert ook met zoutzuur, want het bevat mangaandioxide
: MnO2+4HCl=Cl2+MnO2+2H2O
(oxidatiereactie).
Er is een kwalitatieve reactie op zoutzuur en zijn zouten. Wanneer een stof interageert met zilvernitraat
een witte neerslag zilverchloride
en gevormd salpeterzuur
. Interactie reactievergelijking methylamine
met waterstofchloride ziet er als volgt uit: HCl + CH3NH2 = (CH3NH3)Cl
.
Een stof reageert met een zwakke base aniline
. Na het oplossen van aniline in water wordt zoutzuur aan het mengsel toegevoegd. Als gevolg hiervan lost de basis op en vormt zich aniline hydrochloride
(fenylammoniumchloride
): (С6Н5NH3)Cl
. De reactie van interactie van aluminiumcarbide met zoutzuur: Al4C3+12HCL=3CH4+4AlCl3
. reactie vergelijking kaliumcarbonaat
waarmee het er zo uitziet: K2CO3 + 2HCl = 2KCl + H2O + CO2.
Sollicitatie
in de metallurgie voor de winning van ertsen, verwijdering van roest, aanslag, vuil en oxiden, solderen en vertinnen;
bij de vervaardiging van synthetische rubbers en harsen;
bij galvaniseren;
als zuurteregelaar in de voedingsindustrie;
om metaalchloriden te verkrijgen;
chloor verkrijgen;
in de geneeskunde voor de behandeling van onvoldoende zuurgraad van maagsap;
als reinigings- en desinfectiemiddel.
- (HCl), een waterige oplossing van waterstofchloride, een kleurloos gas met een penetrante geur. Verkregen door de inwerking van zwavelzuur op keukenzout, als bijproduct van de chlorering van koolwaterstoffen, of door de reactie van waterstof en chloor. Zoutzuur wordt gebruikt voor ... ... Wetenschappelijk en technisch encyclopedisch woordenboek
Zoutzuur
- - HCl (SC) (zoutzuur, zoutzuur, waterstofchloride) is een oplossing van waterstofchloride (HCl) in water, een antivriesadditief. Het is een kleurloze vloeistof met een penetrante geur, zonder zwevende deeltjes. ... ... Encyclopedie van termen, definities en verklaringen van bouwmaterialen
ZOUTZUUR
- (zoutzuur) oplossing van waterstofchloride in water; sterk zuur. Een kleurloze vloeistof die in de lucht rookt (technisch zoutzuur is geelachtig door onzuiverheden van Fe, Cl2, enz.). De maximale concentratie (bij 20 ° C) is 38 massa%, ... ... Big Encyclopedic Dictionary
ZOUTZUUR
- (Acidum muriaticum, Acid, hydrochloricum), een oplossing van waterstofchloride (HC1) in water. In de natuur komt het voor in het water van bepaalde bronnen van vulkanische oorsprong en wordt het ook aangetroffen in maagsap (tot 0,5%). Waterstofchloride kan worden verkregen ... Big Medical Encyclopedia
ZOUTZUUR
- (zoutzuur, zoutzuur) een sterk monobasisch vluchtig zuur met een penetrante geur, een waterige oplossing van waterstofchloride; de maximale concentratie is 38 gew.%, de dichtheid van een dergelijke oplossing is 1,19 g/cm3. Gebruikt in ... ... Russische encyclopedie van arbeidsbescherming
ZOUTZUUR
- (zoutzuur) HCl waterige oplossing van waterstofchloride, sterk monobasisch zuur, vluchtig, met een penetrante geur; onzuiverheden van ijzer, chloor kleurt het geelachtig. De geconcentreerde S. om te verkopen bevat 37% ... ... Big Polytechnic Encyclopedia
zoutzuur
— zelfstandig naamwoord, aantal synoniemen: 1 acid (171) ASIS Synoniem Woordenboek. VN Trisjin. 2013 ... Synoniem woordenboek
ZOUTZUUR
Moderne Encyclopedie
Zoutzuur
- WATERSTOFZUUR, waterige oplossing van waterstofchloride HCl; een rokende vloeistof met een penetrante geur. Zoutzuur wordt gebruikt voor het verkrijgen van verschillende chloriden, beitsmetalen, verwerkingsertsen, bij de productie van chloor, soda, rubbers, enz. ... ... Geïllustreerd encyclopedisch woordenboek
zoutzuur
- (zoutzuur), een oplossing van waterstofchloride in water; sterk zuur. Een kleurloze vloeistof die "rookt" in de lucht (technisch zoutzuur is geelachtig door onzuiverheden van Fe, Cl2, enz.). Maximale concentratie (bij 20 ° C) 38% massa, ... ... Encyclopedisch woordenboek
Wat is het gevaar van dronkenschap?
Zoutzuur is een bijzonder gevaar voor het menselijk lichaam. In geval van vergiftiging met een dergelijke stof kunnen zich ernstige complicaties en schendingen van de functionaliteit van het lichaam ontwikkelen.
complicaties:
- Overtreding van de lever, als gevolg van toxische hepatitis,
- Bloeding in de maag als gevolg van de vernietigde wanden van het orgel,
- Schok van pijn wanneer zuur een groot gebied binnendringt,
- Bij contact met de ogen, slechtziendheid,
- Ernstige storing van de nieren,
- Ademhalingsfalen, verstikking, kortademigheid,
- De ontwikkeling van een coma.
Soortgelijke gevolgen ontwikkelen zich geleidelijk, afhankelijk van de mate van vergiftiging.
Gevolgtrekking
Als u zich aan de voorzorgsmaatregelen en veiligheidsregels houdt, wordt zoutzuur een onmisbare assistent in het dagelijks leven. En je kunt het kopen tegen de meest betaalbare prijzen in ons bedrijf.
Zoals zuren. Het onderwijsprogramma voorziet in het memoriseren door studenten van de namen en formules van zes vertegenwoordigers van deze groep. En als je de tabel in het leerboek bekijkt, zie je in de lijst met zuren degene die het eerst komt en die je in de eerste plaats interesseert - zoutzuur. Helaas, in de klas op school wordt noch het onroerend goed, noch enige andere informatie erover bestudeerd. Daarom zoeken degenen die graag kennis willen opdoen buiten het schoolcurriculum, aanvullende informatie op in allerlei bronnen. Maar vaak vinden velen niet de informatie die ze nodig hebben. En dus is het onderwerp van het artikel van vandaag gewijd aan dit specifieke zuur.
Definitie
Zoutzuur is een sterk monobasisch zuur. In sommige bronnen kan het zoutzuur en zoutzuur worden genoemd, evenals waterstofchloride.
Fysieke eigenschappen
Het is een kleurloze en rokende bijtende vloeistof in de lucht (foto rechts). Technisch zuur heeft echter een gelige kleur door de aanwezigheid van ijzer, chloor en andere toevoegingen erin. De grootste concentratie bij een temperatuur van 20 ° C is 38%. De dichtheid van zoutzuur met dergelijke parameters is 1,19 g/cm3. Maar deze verbinding in verschillende mate van verzadiging heeft totaal andere gegevens.Met een afname van de concentratie nemen de numerieke waarde van molariteit, viscositeit en smeltpunt af, maar nemen de soortelijke warmtecapaciteit en het kookpunt toe. Verharding van zoutzuur van elke concentratie geeft verschillende kristallijne hydraten.
Chemische eigenschappen
Alle metalen die vóór waterstof komen in de elektrochemische reeks van hun spanning, kunnen een interactie aangaan met deze verbinding, zouten vormen en waterstofgas vrijgeven. Als ze worden vervangen door metaaloxiden, zijn de reactieproducten oplosbaar zout en water. Hetzelfde effect zal optreden bij de interactie van zoutzuur met hydroxiden. Als er echter een zout van metalen (bijvoorbeeld natriumcarbonaat) aan wordt toegevoegd, waarvan het residu afkomstig is van een zwakker zuur (koolzuur), dan chloride van dit metaal (natrium), water en gas dat overeenkomt met het zuur residu (in dit geval koolstofdioxide) wordt gevormd.
Bon
De nu besproken verbinding wordt gevormd wanneer waterstofchloridegas, dat kan worden verkregen door waterstof in chloor te verbranden, wordt opgelost in water. Zoutzuur, dat met deze methode werd verkregen, wordt synthetisch genoemd. Afgassen kunnen ook dienen als bron voor het verkrijgen van deze stof. En dergelijk zoutzuur wordt afgas genoemd. Onlangs is het productieniveau van zoutzuur met deze methode veel hoger dan de productie met een synthetische methode, hoewel de laatste de verbinding in een zuiverdere vorm geeft. Dit zijn allemaal manieren om het in de industrie te krijgen. In laboratoria wordt zoutzuur echter op drie manieren geproduceerd (de eerste twee verschillen alleen in temperatuur en reactieproducten) met behulp van verschillende soorten chemische interacties, zoals:
- Effect van verzadigd zwavelzuur op natriumchloride bij een temperatuur van 150 o C.
- De interactie van bovenstaande stoffen onder omstandigheden met een temperatuur van 550 ° C en hoger.
- Hydrolyse van aluminium- of magnesiumchloriden.
Sollicitatie
Hydrometallurgie en elektroformering kunnen niet zonder het gebruik van zoutzuur, waar nodig, om het oppervlak van metalen te reinigen tijdens vertinnen en solderen en om chloriden van mangaan, ijzer, zink en andere metalen te verkrijgen. In de voedingsindustrie staat deze verbinding bekend als voedseladditief E507 - daar is een zuurteregelaar nodig om seltzer (soda)water te maken. Geconcentreerd zoutzuur wordt ook aangetroffen in het maagsap van elke persoon en helpt bij het verteren van voedsel. Tijdens dit proces neemt de verzadigingsgraad af, omdat. deze samenstelling wordt verdund met voedsel. Bij langdurig vasten neemt de concentratie van zoutzuur in de maag echter geleidelijk toe. En aangezien deze verbinding erg bijtend is, kan het leiden tot maagzweren.
Gevolgtrekking
Zoutzuur kan zowel gunstig als schadelijk zijn voor de mens. Het contact met de huid leidt tot het optreden van ernstige chemische brandwonden en de dampen van deze verbinding irriteren de luchtwegen en de ogen.
Maar als je voorzichtig met deze stof omgaat, kan het meer dan eens van pas komen