Bruk av saltsyre
Saltsyre er mye brukt i industrien for utvinning av metaller fra malm, beising av metaller osv. Den brukes også til fremstilling av loddevæske, ved avsetning av sølv og som en integrert del av vannvann.
Omfanget av bruken av saltsyre i industrien er mindre enn for salpetersyre. Dette skyldes det faktum at saltsyre forårsaker korrosjon av stålutstyr. I tillegg er dens flyktige damper ganske skadelige og forårsaker også korrosjon av metallprodukter. Dette må tas i betraktning ved lagring av saltsyre. Saltsyre lagres og transporteres i gummiforede tanker og fat, d.v.s. i kar, hvis indre overflate er dekket med syrefast gummi, samt i glassflasker og polyetylenredskaper.
Saltsyre brukes til å produsere klorider av sink, mangan, jern og andre metaller, samt ammoniumklorid. Saltsyre brukes til å rense overflatene til metaller, kar, brønner fra karbonater, oksider og andre sedimenter og forurensninger. I dette tilfellet brukes spesielle tilsetningsstoffer - hemmere som beskytter metallet mot oppløsning og korrosjon, men forsinker ikke oppløsningen av oksider, karbonater og andre lignende forbindelser.
HCl brukes i industriell produksjon av syntetiske harpikser, gummier. Det brukes som råstoff i produksjonen av metylklorid fra metylalkohol, etylklorid fra etylen og vinylklorid fra acetylen.
Førstehjelp og behandlingsmetoder
Hvis det oppdages tegn på forgiftning, må ambulanse tilkalles. Hjemme er det tillatt å utføre aktiviteter rettet mot å forbedre tilstanden til offeret. Førstehjelp ved saltsyreforgiftning bør utføres raskt for å redusere risikoen for negative konsekvenser.
Arrangementer:
- Hvis saltforbindelsen kommer på huden, vaskes de skadede områdene med mye kaldt vann. Behandlingstiden er minst en halvtime.
- Ved rus med damp gis offeret tilgang til frisk luft, vinduer åpnes, stramme klær kneppes opp.
- Det anbefales å overvåke pasientens tilstand, i fravær av tegn på liv utføres gjenopplivning.
- Offeret fra dampene får drikke varm te, vann. Det anbefales å skylle nese og munn med kaldt vann.
- Ved en overdose som følge av inntak av syre, plasseres en ispose på magen for å forhindre eller redusere mulig blødning.
- Ingen legemidler er tillatt. Det er lov å gi pasienten et glass vann (du kan mineral alkalisk). Drikkevæske kreves i små slurker.
- Det er ikke tillatt å vaske magen, prøv å fremkalle brekninger hjemme. Slik førstehjelp kan føre til utvikling av forbrenninger i halsen, blødning.
Behandling utføres i en medisinsk institusjon under tilsyn av spesialister.
Terapi:
- Rensing av magen med en sonde,
- Bruk av droppere med medisinske løsninger,
- Forskrivning av medisiner for å lindre smerte
- Bruk av medisiner rettet mot å gjenopprette funksjonen til organer og systemer,
- Om nødvendig oksygeninnånding og kunstig ventilasjon av lungene,
- Gjennomføring av gjenopplivningsterapi i fravær av tegn på liv,
- Utvalg av vitaminer og spesiell ernæring.
Behandlingen utføres på intensiv, og deretter på sykehus. Varigheten avhenger av pasientens tilstand og graden av forgiftning.
Brannskader og forgiftning
Så effektivt som dette middelet er, er det farlig. Saltsyre kan, avhengig av konsentrasjonen, forårsake kjemiske brannskader på fire grader:
- Det er bare rødhet og smerte.
- Det er blemmer med en klar væske og hevelse.
- Dannet nekrose av de øvre lagene av huden.Blærer fylles med blod eller grumsete innhold.
- Lesjonen når sener og muskler.
Hvis stoffet på en eller annen måte kom inn i øynene, er det nødvendig å skylle dem med vann, og deretter med en brusløsning. Men i alle fall er det første du må gjøre å ringe en ambulanse.
Inntak av syre inne er full av akutte smerter i brystet og magen, hevelse i strupehodet, oppkast av blodige masser. Som et resultat, alvorlige patologier i leveren og nyrene.
Og de første tegnene på forgiftning i par inkluderer en tørr hyppig hoste, kvelning, skade på tennene, svie i slimhinnene og magesmerter. Første nødhjelp er vask og munnskylling med vann, samt tilgang på frisk luft. Bare en toksikolog kan gi reell hjelp.
Egenskaper til det kjemiske spekteret
Syre interagerer med mange metaller, salter. Den regnes som ganske sterk og er på nivå med gems. Hovedreaksjonen manifesterer seg i alle grupper av metaller som ligger til venstre for hydrogen (magnesium, jern, sink - elektriske potensialer).
Hydrogenkloridløsning i fortynnet form reagerer med salter, men bare med de som dannes av mindre sterke syrer. Kjent for alle natrium- og kalsiumkarbonat, etter interaksjon med det, spaltes de til vann og karbonmonoksid.
Salpetersyre
- en kvalitativ reaksjon på saltoppløsning. For å oppnå det er det nødvendig å tilsette sølvnitrat til dette reagenset, som et resultat vil det dannes et hvitt bunnfall, hvorfra et nitrogenstoff oppnås.
Ved hjelp av denne blandingen av vann og hydrogen utføres mange interessante eksperimenter. Fortynn den for eksempel med ammoniakk. Som et resultat vil du få hvit røyk, tykk, med konsistensen av små krystaller. Metylamin, anilin, mangandioksid, kaliumkarbonat er reagenser som også påvirkes av syre.
Hvordan og hvorfor brukes det
Kanskje er dette med rette et av de viktige stoffene som finnes og er nødvendige i nesten alle grener av menneskelivet.
Lokalisering av applikasjonsområde:
- Metallurgi. Overflaterens fra oksiderte områder, rustoppløsning, forloddebehandling, fortinning. Saltsyre hjelper til med å trekke ut små inneslutninger av metaller fra malm. Zirkonium og titan oppnås ved å bruke metoden for å omdanne oksider til klorider.
- Næringsmiddelteknologiindustri. En lavkonsentrasjonsløsning brukes som tilsetningsstoff. Gelatin, fruktose for diabetikere inneholder en ren emulgator. Vanlig brus har også et høyt innhold av dette stoffet. På emballasjen til varer vil du se det under navnet E507.
- Medisinfeltet. Med en utilstrekkelig indikator på det sure miljøet i magen og problemer med tarmen. Lav Ph fører til kreft. Selv med riktig ernæring, vitaminer i overflod, forsvinner ikke faren, det er nødvendig å utføre tester for å få juice fra magekanalen, fordi i et utilstrekkelig surt miljø absorberes nyttige stoffer praktisk talt ikke, fordøyelsen blir forstyrret.
- Saltløsning brukes som en inhibitor - beskyttelse mot smuss og infeksjoner, antiseptisk virkning. For fremstilling av limblandinger, keramiske produkter. Den spyler varmevekslere.
- Prosedyren for å rense drikkevann er heller ikke komplett uten deltakelse av klor.
- Produksjon av gummi, bleking av stoffunderlag.
- Du kan ta vare på linsene dine med denne løsningen.
- Munnvann hjemme
- Stoffet er en utmerket leder av elektrisitet.
Hvordan forgiftning oppstår
Saltsyre er en fargeløs væske med en karakteristisk skarp lukt. En av de sterkeste syrene, i stand til å løse opp noen metaller. Blir enkelt en gass.
Hydrogenklorid brukes i tekstilindustrien, lærbransjen, metallurgi av edle metaller, i produksjon av lim, syrer.
Stoffet er tilstede i magen i minimal konsentrasjon. Syre bidrar til normalisering av fordøyelsesprosessen, beskytter kroppen mot skadelige bakterier og mikroorganismer.
Ved en konsentrasjon over 24 % kan saltsyre forårsake irreversibel skade på menneskekroppen. Damper dannet ved kontakt med luft forårsaker irritasjon av organene i syns- og luftveiene.
Det er flere faktorer som kan provosere utviklingen av forgiftning.
Faktorer:
Dampforgiftning er mulig ved arbeid i rom med dårlig ventilasjon,
Svelging ved uaktsomhet, mer vanlig hos barn,
Inntrengning av saltsyre på epidermis, slimhinner i tilfelle manglende overholdelse av reglene for bruk av reagenset.
Forgiftning av et stoff hjemme hos voksne oppstår som et resultat av bruk uten verneutstyr for hud, øyne og organer i luftveiene. Forgiftning kan oppstå når syre overføres unøyaktig fra en beholder til en annen.
Farmakodynamikk og farmakokinetikk
Hva er surhet i magen? Dette er karakteristisk for konsentrasjonen av saltsyre i magen. Surhet uttrykkes i pH
. Normalt bør syre produseres i sammensetningen av magesaft og ta en aktiv del i fordøyelsesprosessene. Formel for saltsyre: HCl
. Det produseres av parietalceller lokalisert i fundic kjertler, med deltakelse av H+/K+-ATPase
. Disse cellene langs fundus og magesekken. Surheten til selve magesaften er variabel og avhenger av antall parietalceller og intensiteten av prosessene for nøytralisering av stoffet av de alkaliske komponentene i magesaften. Konsentrasjon produsert til - du er stabil og lik 160 mmol/l. En frisk person skal normalt ikke produsere mer enn 7 og minst 5 mmol av et stoff i timen.
Med utilstrekkelig eller overdreven produksjon av saltsyre oppstår sykdommer i fordøyelseskanalen, evnen til å absorbere visse mikroelementer, som jern, forverres. Legemidlet stimulerer utskillelsen av magesaft, reduserer pH
. Aktiverer pepsinogen
, konverterer det til et aktivt enzym pepsin
. Stoffet har en gunstig effekt på syrerefleksen i magen, bremser overgangen av ufullstendig fordøyd mat inn i tarmen. Prosessene med gjæring av innholdet i fordøyelseskanalen reduseres, smerte og raping forsvinner, jern absorberes bedre.
Etter oral administrering metaboliseres stoffet delvis av spytt og mageslim, innholdet i tolvfingertarmen 12. Det ubundne stoffet trenger inn i tolvfingertarmen, hvor det nøytraliseres fullstendig av dets alkaliske innhold.
En annen bruk av syre i hverdagen
Med en sur sammensetning kan du enkelt rense kalk og rust fra fajanse VVS, fjerne urinstein og andre forurensninger. For en større effekt tilsettes en inhibitor (for eksempel urotropin) til midlet, som bremser den kjemiske reaksjonen.
Prosedyren utføres som følger: syren fortynnes med vann til en 5% konsentrasjon er nådd, og en inhibitor tilsettes med en hastighet på 0,5 g per 1 liter væske. Overflaten behandles med den resulterende sammensetningen og får stå i 30-40 minutter (avhengig av graden av forurensning), hvoretter den vaskes med vann.
En mild syreløsning brukes også for å fjerne bærflekker, blekk eller rustflekker fra tekstiler. For å gjøre dette blir materialet gjennomvåt i sammensetningen en stund, hvoretter det skylles grundig og vaskes på vanlig måte.
Bli kvitt kalk i vannkokeren
Til dette formål brukes en 3-5% saltsyreløsning, som helles i en kjele og varmes opp til 60-80°
C i 1-2 timer eller til kalkavleiringer går i oppløsning. Etter det blir skalaen løs og fjernes lett med en trespatel.
Effektiviteten til metoden skyldes det faktum at reagenset reagerer med magnesium- og kalsiumkarbonater og omdanner dem til løselige salter. Karbondioksidet som frigjøres samtidig ødelegger avleiringslaget og gjør det løs. Etter fjerning av saltavleiringer, vaskes oppvasken grundig med rent vann.
Viktig poeng!
Denne metoden er ikke egnet for avkalking av sprukket og sprukket emalje eller aluminiumskjeler: dette vil korrodere metallet og forårsake alvorlig skade.
Å få et stoff
Nå kan vi snakke om hva de gjør for å danne saltsyre.
Først, ved å brenne hydrogen i klor, oppnås hovedkomponenten, gassformig hydrogenklorid. som deretter løses opp i vann. Resultatet av denne enkle reaksjonen er dannelsen av en syntetisk syre.
Dette stoffet kan også fås fra avgasser. Dette er kjemiske avfallsgasser (side)gasser. De dannes av en rekke prosesser. For eksempel ved klorering av hydrokarboner. Hydrogenkloridet i deres sammensetning kalles avgass. Og den således oppnådde syren hhv.
Det skal bemerkes at de siste årene har andelen av avgassstoffet i det totale volumet av produksjonen økt. Og syren som dannes som følge av brenning av hydrogen i klor, fortrenges. Men i rettferdighet bør det bemerkes at den inneholder færre urenheter.
Produksjonsbruk
Den har en bred anvendelse i metallurgisk, mat- og medisinsk industri.
- Metallurgi. Brukes til lodding, fortinning og rengjøring av metaller.
- Mat industri. Anvendelse i produksjon av mat surhetsregulatorer, for eksempel E507.
- Elektrotype. Brukes til sylting.
- Medisin. Den finner sin anvendelse i produksjonen av kunstig magesaft.
Inkludert i syntetiske fargestoffer. Den brukes i produksjon av rengjørings- og vaskemidler. Men i væsker beregnet på husholdningsbruk er konsentrasjonen av svovelsyre ubetydelig.
Hvordan saltsyre produseres i laboratoriet
Produksjonen av stoffet er storskala, salget er gratis. Under laboratorieeksperimenter produseres en løsning ved virkningen av høykonsentrasjons svovelsyre på vanlig kjøkkensalt (natriumklorid).
Det er 2 metoder for å løse opp hydrogenklorid i vann:
- Hydrogen brennes i klor (syntetisk).
- Tilknyttet (avgass). Dens essens er å utføre organisk klorering, dehydroklorering.
Stoffet egner seg godt til syntese under pyrolysen av avfall fra organoklor. Dette skjer som et resultat av nedbrytning av hydrokarboner med fullstendig mangel på oksygen. Du kan også bruke metallklorider, som er råvarene til uorganiske stoffer. Hvis det ikke er konsentrert svovelsyre (elektrolytt), ta fortynnet.
Når det gjelder utvinning av reagenset under naturlige forhold, kan denne kjemiske blandingen oftest finnes i vannet i vulkansk avfall. Hydrogenklorid er en komponent av mineralene sylvin (kaliumklorid, ser ut som bein for spill), bischofitt. Alt dette er metoder for å utvinne stoffet i industrien.
Hos mennesker finnes dette enzymet i magen. En løsning kan enten være en syre eller en base. En av de vanligste metodene for utvinning kalles sulfat.
Kjemiske egenskaper
Saltsyre, hydrogenklorid eller saltsyre - løsning HCl
i vann. Ifølge Wikipedia tilhører stoffet gruppen av uorganiske sterke monobasiske to-t. Det fulle navnet på forbindelsen på latin: saltsyre.
Formel for saltsyre i kjemi: HCl
. I et molekyl kombineres hydrogenatomer med halogenatomer - Cl
. Hvis vi vurderer den elektroniske konfigurasjonen av disse molekylene, kan det bemerkes at forbindelser deltar i dannelsen av molekylære orbitaler 1s
-hydrogenorbitaler og begge deler 3s
og 3 s
-orbitaler til et atom Cl
. I den kjemiske formelen for saltsyre 1s-
, 3s-
og 3r
-atomorbitaler overlapper hverandre og danner 1, 2, 3 orbitaler. Hvori 3s
-orbital er ikke bindende. Det er en forskyvning av elektrontettheten til atomet Cl
og polariteten til molekylet avtar, men bindingsenergien til molekylære orbitaler øker (hvis vi vurderer det sammen med andre hydrogenhalogenider
).
Fysiske egenskaper til hydrogenklorid. Det er en klar, fargeløs væske som ryker når den utsettes for luft. Molar masse av en kjemisk forbindelse = 36,6 gram per mol. Under standardforhold, ved en lufttemperatur på 20 grader Celsius, er den maksimale konsentrasjonen av et stoff 38 vekt%. Tettheten av konsentrert saltsyre i denne typen løsning er 1,19 g/cm³. Generelt gjelder fysiske egenskaper og egenskaper som tetthet, molaritet, viskositet, varmekapasitet, kokepunkt og pH
, sterkt avhengig av konsentrasjonen av løsningen. Disse verdiene er diskutert mer detaljert i tabellen over tettheter. For eksempel tettheten av saltsyre 10% = 1,048 kg per liter. Når det er størknet, dannes stoffet krystallinske hydrater
forskjellige komposisjoner.
Kjemiske egenskaper til saltsyre. Hva reagerer saltsyre med? Stoffet interagerer med metaller som står foran hydrogen i en rekke elektrokjemiske potensialer (jern, magnesium, sink og andre). I dette tilfellet dannes salter og gassformige H
. Bly, kobber, gull, sølv og andre metaller til høyre for hydrogen reagerer ikke med saltsyre. Stoffet reagerer med metalloksider og produserer vann og et løselig salt. Natriumhydroksid under påvirkning av til-deg-former og vann. Nøytraliseringsreaksjonen er karakteristisk for denne forbindelsen.
Fortynnet saltsyre reagerer med metallsalter, som dannes av svakere syrer. For eksempel, propionsyre
svakere enn salt. Stoffet reagerer ikke med sterkere syrer. og natriumkarbonat
vil dannes etter reaksjon med HCl
klorid, karbonmonoksid og vann.
For en kjemisk forbindelse er reaksjoner med sterke oksidasjonsmidler karakteristiske, med mangandioksid
, kaliumpermanganat
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. Stoffet reagerer med ammoniakk
, som produserer tykk hvit røyk, som består av veldig fine krystaller av ammoniumklorid. Mineralet pyrolusitt reagerer også med saltsyre, da det inneholder mangandioksid
: MnO2+4HCl=Cl2+MnO2+2H2O
(oksidasjonsreaksjon).
Det er en kvalitativ reaksjon på saltsyre og dens salter. Når et stoff interagerer med Sølvnitrat
et hvitt bunnfall sølvklorid
og dannet salpetersyre
. Interaksjonsreaksjonsligning metylamin
med hydrogenklorid ser slik ut: HCl + CH3NH2 = (CH3NH3)Cl
.
Et stoff reagerer med en svak base anilin
. Etter oppløsning av anilin i vann tilsettes saltsyre til blandingen. Som et resultat oppløses basen og dannes anilinhydroklorid
(fenylammoniumklorid
): (C6N5NH3)Cl
. Reaksjonen av interaksjon av aluminiumkarbid med saltsyre: Al4C3+12HCL=3CH4+4AlCl3
. Reaksjonsligning kaliumkarbonat
som det ser slik ut med: K2CO3 + 2HCl = 2KCl + H2O + CO2.
applikasjon
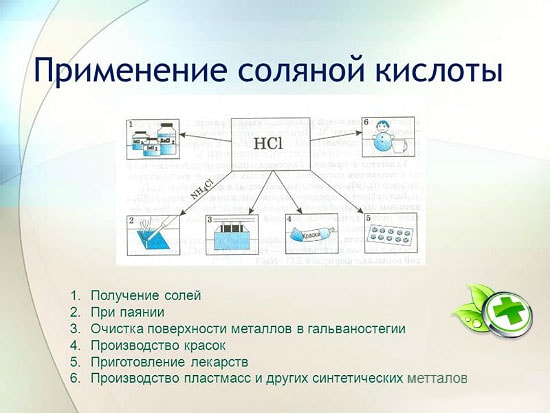
i metallurgi for utvinning av malm, fjerning av rust, belegg, smuss og oksider, lodding og fortinning;
i produksjon av syntetisk gummi og harpiks;
i galvanisering;
som surhetsregulator i næringsmiddelindustrien;
for å oppnå metallklorider;
for å oppnå klor;
i medisin for behandling av utilstrekkelig surhet av magesaft;
som rengjørings- og desinfeksjonsmiddel.
- (HCl), en vandig løsning av hydrogenklorid, en fargeløs gass med en skarp lukt. Oppnådd ved virkningen av svovelsyre på vanlig salt, som et biprodukt av klorering av hydrokarboner, eller ved omsetning av hydrogen og klor. Saltsyre brukes til ... ... Vitenskapelig og teknisk encyklopedisk ordbok
Saltsyre
- - HCl (SC) (saltsyre, saltsyre, hydrogenklorid) er en løsning av hydrogenklorid (HCl) i vann, et frostvæsketilsetningsstoff. Det er en fargeløs væske med en skarp lukt, uten suspenderte partikler ... ... Leksikon med begreper, definisjoner og forklaringer av byggematerialer
SALTSYRE
- (saltsyre) løsning av hydrogenklorid i vann; sterk syre. En fargeløs væske som ryker i luften (teknisk saltsyre er gulaktig på grunn av urenheter av Fe, Cl2, etc.). Den maksimale konsentrasjonen (ved 20 ° C) er 38 % av massen, ... ... Big Encyclopedic Dictionary
SALTSYRE
- (Acidum muriaticum, Acid, hydrochloricum), en løsning av hydrogenklorid (HC1) i vann. I naturen forekommer det i vannet av visse kilder av vulkansk opprinnelse, og finnes også i magesaft (opptil 0,5%). Hydrogenklorid kan fås ... Big Medical Encyclopedia
SALTSYRE
- (saltsyre, saltsyre) en sterk monobasisk flyktig syre med en skarp lukt, en vandig løsning av hydrogenklorid; den maksimale konsentrasjonen er 38% av massen, tettheten til en slik løsning er 1,19 g/cm3. Brukt i ... ... russisk leksikon om arbeidsbeskyttelse
SALTSYRE
- (saltsyre) HCl vandig løsning av hydrogenklorid, sterk monobasisk syre, flyktig, med en skarp lukt; urenheter av jern, klor flekker det gulaktig. Den konsentrerte S. å selge inneholder 37% ... ... Big Polytechnic Encyclopedia
saltsyre
— substantiv, antall synonymer: 1 syre (171) ASIS Synonymordbok. V.N. Trishin. 2013 ... Synonymordbok
SALTSYRE
Moderne leksikon
Saltsyre
- HYDROGENSYRE, vandig løsning av hydrogenklorid HCl; en rykende væske med en skarp lukt. Saltsyre brukes til å oppnå ulike klorider, beising av metaller, bearbeiding av malm, i produksjon av klor, brus, gummi, etc. ... ... Illustrated Encyclopedic Dictionary
saltsyre
- (saltsyre), en løsning av hydrogenklorid i vann; sterk syre. En fargeløs væske "ryker" i luft (teknisk saltsyre er gulaktig på grunn av urenheter av Fe, Cl2, etc.). Maksimal konsentrasjon (ved 20 ° C) 38 % etter masse, ... ... Encyclopedic Dictionary
Hva er faren for rus
Saltsyre er en spesiell fare for menneskekroppen. Ved forgiftning med et slikt stoff kan det utvikles alvorlige komplikasjoner og brudd på funksjonaliteten til kroppen.
Komplikasjoner:
- Krenkelse av leveren, som et resultat av giftig hepatitt,
- Blødning i magen på grunn av de ødelagte veggene i organet,
- Sjokk fra smerte når syre kommer inn i et stort område,
- Ved kontakt med øynene, synshemming,
- Alvorlig funksjonsfeil i nyrene,
- Respirasjonssvikt, kvelning, kortpustethet,
- Utviklingen av koma.
Lignende konsekvenser utvikler seg gradvis avhengig av graden av forgiftning.
Konklusjon
Hvis du følger forholdsreglene og sikkerhetsreglene, vil saltsyre bli en uunnværlig assistent i hverdagen. Og du kan kjøpe det til de rimeligste prisene i vårt selskap.
Som syrer. Utdanningsprogrammet sørger for at studentene kan huske navn og formler til seks representanter for denne gruppen. Og når du ser gjennom tabellen i læreboken, legger du merke til i listen over syrer den som kommer først og interesserte deg i utgangspunktet - saltsyre. Akk, i klasserommet på skolen blir verken eiendommen eller annen informasjon om den studert. Derfor leter de som er ivrige etter å få kunnskap utenfor skolens læreplan etter tilleggsinformasjon i alle slags kilder. Men ofte er det mange som ikke finner informasjonen de trenger. Og så temaet for dagens artikkel er dedikert til denne spesielle syren.
Definisjon
Saltsyre er en sterk monobasisk syre. I noen kilder kan det kalles saltsyre og saltsyre, samt hydrogenklorid.
Fysiske egenskaper
Det er en fargeløs og rykende kaustisk væske i luften (bildet til høyre). Imidlertid har teknisk syre en gulaktig farge på grunn av tilstedeværelsen av jern, klor og andre tilsetningsstoffer i den. Dens største konsentrasjon ved en temperatur på 20 ° C er 38%. Tettheten av saltsyre med slike parametere er 1,19 g/cm 3 . Men denne forbindelsen i varierende grad av metning har helt andre data.Med en reduksjon i konsentrasjonen reduseres den numeriske verdien av molaritet, viskositet og smeltepunkt, men den spesifikke varmekapasiteten og kokepunktet øker. Størkning av saltsyre i en hvilken som helst konsentrasjon gir forskjellige krystallinske hydrater.
Kjemiske egenskaper
Alle metaller som kommer før hydrogen i den elektrokjemiske serien av spenningen deres kan samhandle med denne forbindelsen, danne salter og frigjøre hydrogengass. Hvis de erstattes av metalloksider, vil reaksjonsproduktene være løselig salt og vann. Den samme effekten vil være i samspillet mellom saltsyre og hydroksyder. Hvis imidlertid et salt av metaller (for eksempel natriumkarbonat) tilsettes det, hvis rest ble tatt fra en svakere syre (karbonsyre), så klorid av dette metallet (natrium), vann og gass som tilsvarer syren rester (i dette tilfellet karbondioksid) dannes. .
Kvittering
Forbindelsen som nå diskuteres dannes når hydrogenkloridgass, som kan oppnås ved å brenne hydrogen i klor, løses opp i vann. Saltsyre, som ble oppnådd ved hjelp av denne metoden, kalles syntetisk. Avgasser kan også tjene som en kilde for å oppnå dette stoffet. Og slik saltsyre vil bli kalt avgass. Nylig er produksjonsnivået av saltsyre ved bruk av denne metoden mye høyere enn produksjonen ved en syntetisk metode, selv om sistnevnte gir forbindelsen i en renere form. Dette er alle måter å få det til i industrien. Imidlertid produseres saltsyre i laboratorier på tre måter (de to første skiller seg bare i temperatur og reaksjonsprodukter) ved bruk av forskjellige typer kjemiske interaksjoner, for eksempel:
- Effekt av mettet svovelsyre på natriumklorid ved en temperatur på 150 o C.
- Samspillet mellom de ovennevnte stoffene under forhold med en temperatur på 550 ° C og over.
- Hydrolyse av aluminium- eller magnesiumklorider.
applikasjon
Hydrometallurgi og elektroforming kan ikke klare seg uten bruk av saltsyre, der det er nødvendig, for å rense overflaten for metaller under fortinning og lodding og for å oppnå klorider av mangan, jern, sink og andre metaller. I næringsmiddelindustrien er denne forbindelsen kjent som mattilsetningsstoffet E507 - der er det en surhetsregulator som er nødvendig for å lage seltzer (sodavann). Konsentrert saltsyre finnes også i magesaften til enhver person og hjelper til med å fordøye mat. I løpet av denne prosessen reduseres graden av metning, fordi. denne sammensetningen fortynnes med mat. Men med langvarig faste øker konsentrasjonen av saltsyre i magen gradvis. Og siden denne forbindelsen er veldig etsende, kan den føre til magesår.
Konklusjon
Saltsyre kan være både gunstig og skadelig for mennesker. Dens kontakt med huden fører til utseende av alvorlige kjemiske brannskader, og dampene til denne forbindelsen irriterer luftveiene og øynene.
Men hvis du håndterer dette stoffet forsiktig, kan det komme godt med mer enn én gang