Utnyttelse

I vanadiumstrømbatterier er begge referanseelektrodene i tillegg koblet til lagertanker og pumper slik at svært store volumer elektrolytt kan sirkuleres gjennom cellen. Sirkulasjonen av flytende elektrolytt er noe vanskelig og begrenser bruken av vanadiumstrømbatterier i industrier som krever mobilitet, noe som gjør dem effektive i store stasjonære bygninger.
Når et vanadiumbatteri lades, blir VO2+-ionene i den positivt ladede referanseelektroden til VO2+-ioner når elektronene løsnes fra den positive batteripolen. På samme måte, i den negative referanseelektroden, konverterer elektroner V3+ ioner til V2+. Under utlading reverseres denne prosessen, noe som resulterer i en åpen kretsspenning på 1,41 V ved 25°C.
Andre nyttige egenskaper til vanadium-strømbatterier inkluderer en veldig rask respons på lastendringer og en ekstremt høy overbelastningskapasitet. Forskning ved University of New South Wales har vist at de kan oppnå responstider på mindre enn et halvt millisekund ved 100 % lastendringer og tåle 400 % overbelastning i over 10 sekunder. Responstiden er i de fleste tilfeller begrenset av det elektriske utstyret. Vanadiumbatterier basert på svovelsyre fungerer kun ved temperaturer på 10-40C. Hvis temperaturen er under dette området, krystalliserer svovelsyreioner. Effektiviteten i frem- og tilbakegående bevegelse i daglig bruk forblir på nivået 65-75%.
Funksjoner ved lading og utlading
Ladealgoritmer avhenger direkte av hvordan batteriet er ordnet og hvilken type det tilhører. For eksempel kan noen batterier trygt fylle opp kapasiteten fra konstantspenningskilder. Andre fungerer bare med en justerbar strømkilde som kan endre parametere avhengig av ladenivået.
En feil organisert ladeprosess kan skade batteriet. I ekstreme tilfeller kan batteriet antennes eller eksplodere. Det finnes smarte batterier utstyrt med spenningsovervåkingsenheter. Hovedparametrene som bør tas i betraktning når du bruker reversible galvaniske batterier er:
- Levetid. Selv med riktig håndtering er antallet ladesykluser for et batteri begrenset. Ulike batterisystemer slites ikke alltid ut av de samme grunnene. Men generelt sett begrenses batterilevetiden først og fremst av antall fulle ladnings-utladingssykluser, og for det andre av designlevetiden uten referanse til bruksintensiteten.
- Ladetid. Den grunnleggende utformingen av batteriet innebærer ikke lading med en vilkårlig høy hastighet: den indre motstanden til den galvaniske cellen vil føre til konvertering av overflødig ladestrøm til varme, noe som kan skade enheten irreversibelt. Fra et fysisk synspunkt er ladetiden begrenset av den maksimale diffusjonshastigheten til det aktive materialet gjennom elektrolytten.Forenklet sett kan vi anta at gjenoppretting av full kapasitet på en time er en god indikator.
- Utløpsdybde. Spesifisert som en prosentandel av merkeeffekten. Beskriver brukbar kapasitet. For forskjellige typer batterier kan det anbefalte utladingsnivået variere. På grunn av endringer i drift eller aldring, mister indikatoren for maksimal dybde sin opprinnelige verdi.
diffusjonsprosess.
På grunn av diffusjonsprosessen, justeringen av elektrolytttettheten i hulrommet til batterihuset og i porene til den aktive massen til platene, kan elektrodepolarisasjonen opprettholdes i batteriet når den eksterne kretsen er slått av.
Diffusjonshastigheten avhenger direkte av elektrolyttens temperatur, jo høyere temperatur, jo raskere går prosessen og kan variere mye i tid, fra to timer til et døgn. Tilstedeværelsen av to komponenter av elektrodepotensialet under forbigående forhold førte til inndelingen i likevekt og ikke-likevekts EMF for batteriet. Batteriets likevekts-EMF påvirkes av innholdet og konsentrasjonen av ioner av aktive stoffer i elektrolytten, samt de kjemiske og fysiske egenskapene til aktive stoffer. Hovedrollen i størrelsen på EMF spilles av tettheten til elektrolytten, og temperaturen påvirker den praktisk talt ikke. Avhengigheten av EMF av tetthet kan uttrykkes med formelen:
Batteriets emf er ikke lik batterispenningen, som avhenger av tilstedeværelsen eller fraværet av en belastning på terminalene.
admin25/07/2011
En kommentar
Navn *
Nettstedet
Denne siden bruker Akismet for å bekjempe spam. Finn ut hvordan kommentardataene dine behandles.
«Mekanisk turteller
Batterispenning »
Tagger
VAZ, VAZ funksjonsfeil Sensorer Tenning Injektorenheter Starterskjema Elbiler Strømforsyning vaz 2110 gazelle gaselle forretningsregistratorer bilreparasjoner
Nylige oppføringer
- Sensorer i bilen: typer og formål
- Verdens største elbil EDumper,
- Laserlys.
- Fordeler og ulemper med halogenlamper
- Enheten og prinsippet for drift av parkeringssensorer
Arkiv
Arkiv Velg september 2019 august 2017 juli 2017 juni 2017 mai 2017 april 2017 mars 2017 desember 2016 november 2016 oktober 2016 september 2016 august 2016 juli 2016 juni 2016 mai 2016 april 2016 mars 2016 februar 2016 november 2015 oktober 2015 august 2015 juli 2015 juni 2015 mai 2015 januar 2015 desember 2014 november 2014 oktober 2014 september 2014 august 2014 juli 2014 juni 2014 mai 2014 april 2014 februar 2014 januar 2014 desember 2013 november 2013 oktober 2013 august 2013 august 2012 12012012012012012 12012 12013 12012 12013 12013 12012 september 120123 120123 12012 september 2012, 2011 2011, 2012, 2011, 2012, 2011 2011, 2011, 2011, 2011 2011, 2011 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011 2011, 2011, 2011, 2011 2011, 2011, 2011, 2011, 2011, 2011 september 2012, 2011, 2011, 2011, 2011, 2011, 2011
Kategorier
- Akkumulatorbatteri
- Video
- Generator
- Sensorer
- Diagnostikk
- Tenning
- nyheter
- Utstyr
- Enheter
- Reparere
- Tennplugg
- Starter
- Opplegg
- Enheter
- elektriske biler
- Strømforsyning
Vi er i sosiale nettverk
Auto Electrician@ Alle rettigheter forbeholdt. Når du kopierer nettstedsmateriale, må du oppgi en lenke til nettstedet.
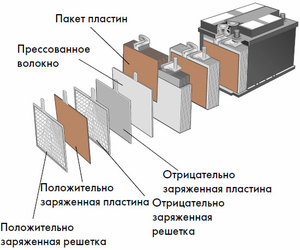
Enhet og operasjonsprinsipp
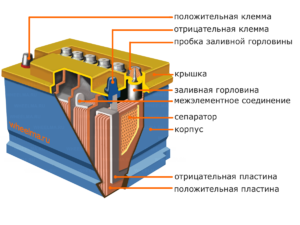
Hver slik celle har en katode (positiv elektrode) og en anode (negativ). Disse elektrodene er adskilt av en elektrolytt som sørger for utveksling av ioner mellom dem. Elektrodematerialer og elektrolyttsammensetning er valgt for å gi tilstrekkelig elektromotorisk kraft mellom batteripolene.
Siden elektrodene inneholder et begrenset potensial for kjemisk energi, vil batteriet bli utladet under drift. Typen galvaniske celler, som er tilpasset for påfyll etter delvis eller fullstendig utlading, kalles et batteri. En sammenstilling av slike sammenkoblede celler er et batteri.Batteridrift innebærer en syklisk endring av to tilstander:
- Lading - batteriet fungerer som en mottaker av elektrisitet, inne i cellene realiseres den elektriske energien i kjemiske endringer.
- Utlading - enheten fungerer som en kilde til elektrisk strøm ved å konvertere energien fra kjemiske reaksjoner til elektrisk energi.
Bruksområder
Den ultrahøye kapasitetsegenskapen til vanadiumredoksbatterier gjør dem godt egnet for bruk i industrier som krever høy energilagring. For eksempel hjelpe til med å balansere produksjonsvolumet av slike energikilder som vind eller sol, eller hjelpe generatorer med å absorbere store bølger av energi når det er nødvendig, eller balansere tilbud og etterspørsel etter energi for fjerntliggende områder.
De begrensede selvutladningsegenskapene til vanadiumredoksbatterier gjør dem nyttige i bransjer der batterier må lagres i lange perioder med minimalt vedlikehold og beredskap. Dette førte til at de ble brukt i noen typer militærelektronikk, for eksempel i sensorene til GATOR-gruvesystemet. Deres evne til å sykle gjennom og holde seg på null gjør dem egnet for solenergiapplikasjoner og industrier der batterier må starte dagen tomme og lades opp basert på belastning og vær. For eksempel blir litiumion-batterier ofte skadet når de får lades ut under 20 % av volumet, så de opererer oftest i området 20 til 100 %, noe som betyr at de bare kan bruke 20 % av den nominelle kapasiteten.
Deres ekstremt raske responstid gjør dem også praktisk talt uunnværlige for avbruddsfri strømforsyning, der de kan brukes i stedet for blybatterier og til og med dieselgeneratorer. Også den raske responstiden gjør dem egnet for frekvenskontroll. For øyeblikket er verken UPS eller frekvensstyringstiltak effektive alene, men det er sannsynlig at batteriet vil være i stand til å finne applikasjoner i disse bransjene når de aktiveres fra ulike finansieringskilder. I tillegg gjør disse egenskapene vanadiumredoks-batterier til en effektiv "one-piece"-løsning for små strømnett som er avhengig av pålitelig drift, frekvenskontroll og behov for belastningsbytte (som høy penetrasjon av fornybare energikilder, svært svingende belastninger, eller ønsket om å optimalisere generatoreffektiviteten ved å endre responstiden).
De største fungerende vanadiumredoksbatteriene
Transformatorstasjon "Minami Hyakita":
- Lanseringsdato: desember 2015
- Energi: 60 MWh
- Effekt: 15 MW
- Arbeidstid: 4 timer
- Land: Japan
Stinky, Liaoning-provinsen
- Lanseringsdato: N/A
- Energi: 10 MWh
- Effekt: 5 MW
- Arbeidstid: 2 timer
- Land: Kina
Tomamae vindpark
- Lanseringsdato: 2005
- Energi: 6 MWh
- Effekt: 4 MW
- Arbeidstid: 1 time 30 minutter
- Land: Japan
Zhangbei-prosjektet
- Lanseringsdato 2016
- Energi: 8 MWh
- Effekt: 2 MW
- Arbeidstid: 4 timer.
- Land: Kina
SnoPUD MESA 2-prosjektet
- Lanseringsdato: mars 2017
- Energi: 8 MWh
- Effekt: 2 MW
- Arbeidstid: 4 timer.
- Land: USA
Transformatorstasjon i Escondido
- Lanseringsdato: 2017
- Energi: 8 MWh
- Effekt: 2 MW
- Arbeidstid: 4 timer.
- Land: USA
Transformatorstasjon i Pullman, Washington
- Lanseringsdato: april 2015
- Energi: 4 MWh
- Effekt: 1 MW
- Arbeidstid: 4 timer
- Land: USA
Innen 2018 forventes utviklingen av et vanadiumredoksbatteri å være fullført i Kina. Dens energi vil være 800 MWh, effekt - 200 MW, og driftstid - 4 timer.
Vilkår
- Sekvensielle - elementer følger etter hverandre.
- Elektromotorisk kraft (EMF) er spenningen generert av et batteri eller magnetisk kraft i samsvar med Faradays lov.
- Parallell - Elektriske komponenter er arrangert slik at strømmen flyter langs to eller flere baner.
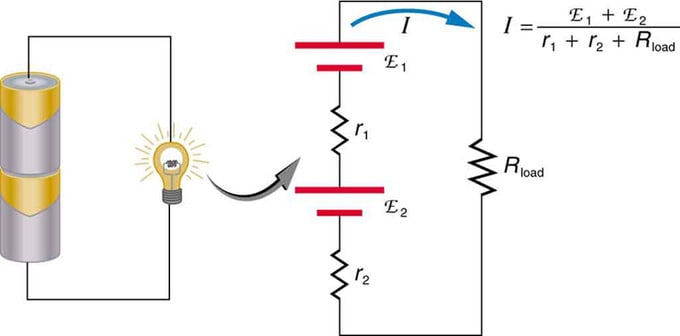
Hvis du bruker flere spenningskilder, kan de kobles i serie eller parallelt. Med serieversjonen er de innstilt i samme retning, den indre motstanden pluss på, og den elektromotoriske kraften legges til algebraisk. Lignende typer er vanlige i lommelykter, leker og en rekke andre apparater. Celler plasseres i serie for å øke den totale emf.
Seriekobling av to spenningskilder i samme retning. Diagrammet viser en lanterne med to celler og en lampe
Batteri - multippel tilkobling av voltelementer. Men det er en ulempe ved seriekobling, ettersom interne motstander legges til. Noen ganger skaper dette problemer. La oss si at du har to 6V batterier som du setter inn i stedet for de vanlige 12V. Som et resultat har du lagt til ikke bare EMF, men også den interne motstanden fra hvert batteri.
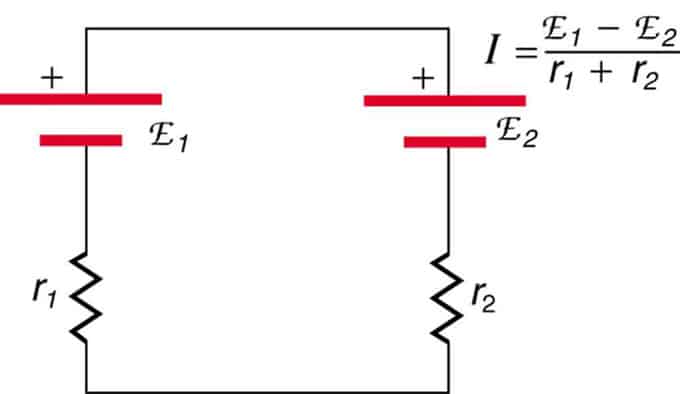
Hvis cellene er plassert i opposisjon (den ene er plassert bak den andre), vil den totale EMF reduseres.
Dette er to spenningskilder koblet i serie med motsatte utslipp. Strømmen flyter i retning av større EMF og begrenses av summeringen av interne motstander. Et eksempel er en lader. Den må ha mer emf enn batteriet
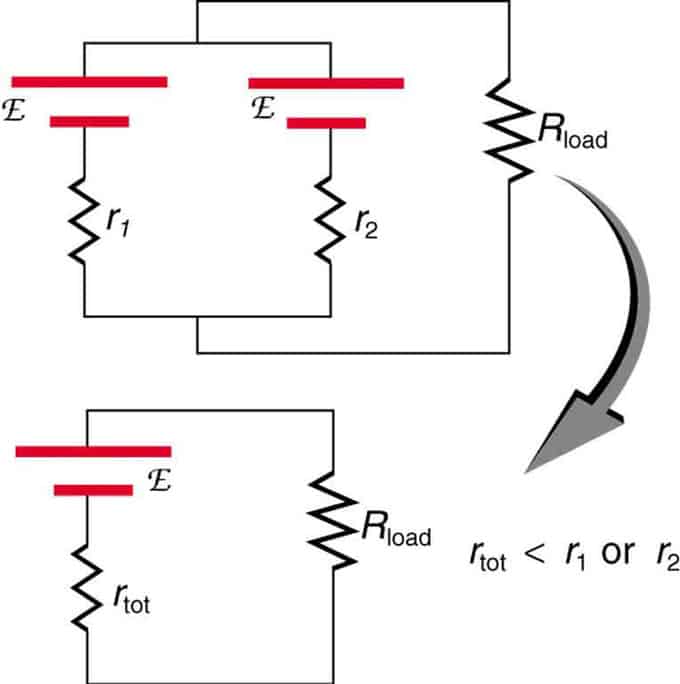
Hvis to kilder med samme elektromotoriske kraft er plassert parallelt og koblet til lastmotstanden, forblir den totale EMF den samme som de enkelte. Imidlertid vil den totale indre motstanden reduseres. Det viser seg at parallellversjonen kan generere mer strøm.
To spenningskilder med en enkelt EMF er kombinert i parallellkopling. De danner én EMF, men har mindre total motstand enn hver for seg. Lignende kombinasjoner brukes hvis du trenger å oppnå mer strøm.
| Oversikt |
|
| Parallell- og seriekobling av motstander |
|
| Kirchhoff regjerer |
|
| Voltmeter og amperemeter |
|
| RC-kretser |
|
Historisk oversikt
Utviklingen av den første galvaniske cellen er kreditert den italienske fysikeren Alessandro Volta. Han gjennomførte en rekke eksperimenter med elektrokjemiske fenomener i løpet av 1790-årene og rundt 1800 skapte han det første batteriet, som hans samtidige kalte "voltaisk kolonne". Enheten besto av alternerende sink- og sølvskiver atskilt av lag med papir eller tøy som ble dynket i en natriumhydroksidløsning.
Disse eksperimentene ble grunnlaget for Michael Faradays arbeid med elektrokjemiens kvantitative lover. Han beskrev prinsippet for drift av batteriet, og basert på arbeidet til forskeren ble de første kommersielle elektriske cellene opprettet. Videre utvikling så slik ut:
- I 1836 presenterte den britiske kjemikeren John Daniel en forbedret modell av cellen, bestående av kobber- og sinkelektroder nedsenket i saltsyre. Daniels element var i stand til å gi konstant spenning uforlignelig mer effektivt enn Volts enheter.
- 1839 Ytterligere fremgang ble gjort av fysikeren Grove med sin to-væskecelle, bestående av sink nedsenket i fortynnet svovelsyre i en porøs beholder. Sistnevnte separerte svovelsyre fra et kar som inneholdt salpetersyre med en platinakatode plassert i den. Salpetersyren tjente som et oksidasjonsmiddel for å forhindre spenningstap på grunn av hydrogenakkumulering ved katoden.Den tyske kjemikeren Robert Bunsen erstattet platina med billig karbon i Grove-cellen og fremmet dermed den utbredte aksepten av denne typen batterier.
- I 1859 oppfant Gaston Plante blysyrecellen, forløperen til det moderne bilbatteriet. Plantes enhet var i stand til å produsere en uvanlig stor strøm, men ble kun brukt til eksperimenter i laboratorier i nesten to tiår.
- 1895-1905 år. Oppfinnelse av nikkel-kadmium og nikkel-jern alkaliske elementer. Dette gjorde det mulig å lage systemer med et betydelig antall lade-utladingssykluser.
- Siden 1930-tallet begynte utviklingen av sølv-sink og kvikksølv-sink alkaliske batterier, som ga høy energitetthet per vekt- og volumenhet.
- Siden midten av 1900-tallet har fremskritt innen produksjonsteknologi og fremkomsten av nye materialer ført til enda kraftigere og kompaktere batterier. Mest bemerkelsesverdig var introduksjonen av nikkel-metallhydrid- og litiumbatterier på markedet.
Lader batterier
Hovedartikkel: Lader
Ettersom den kjemiske energien er oppbrukt, faller spenningen og strømmen, og batteriet slutter å fungere. Du kan lade batteriet (batteri av batterier) fra en hvilken som helst DC-kilde med høyere spenning mens du begrenser strømmen. Den vanligste er ladestrømmen (i ampere), proporsjonal med 1/10 av den betingede nominelle kapasiteten til batteriet (i amperetimer).
Basert på den tekniske beskrivelsen distribuert av produsenter av mye brukte elektriske batterier (NiMH, NiCd), kan det imidlertid antas at denne lademodusen, ofte referert til som standard, beregnes ut fra varigheten av en åtte timers arbeidsdag, når batteriet, utladet ved slutten av arbeidsdagen, kobles til nettladeren før starten av en ny arbeidsdag. Bruken av en slik lademodus for disse typer batterier med systematisk bruk lar deg opprettholde en kvalitets-kostnadsbalanse i driften av produktet. Derfor, etter forslag fra produsenten, kan denne modusen bare brukes for nikkel-kadmium- og nikkel-metallhydrid-batterier.
Mange typer batterier har ulike begrensninger som må tas i betraktning under lading og etterfølgende bruk, for eksempel er NiMH-batterier følsomme for overlading, litiumbatterier er følsomme for overutlading, spenning og temperatur. NiCd- og NiMH-batterier har en såkalt minneeffekt, som består i en reduksjon i kapasiteten når ladingen utføres når batteriet ikke er helt utladet. Disse batteritypene har også en merkbar selvutladning, det vil si at de gradvis mister ladningen uten å være koblet til lasten. For å bekjempe denne effekten kan drypplading brukes.
Metoder for batterilading
Det brukes flere metoder for å lade batterier; Generelt avhenger lademetoden av batteritypen.
- Langsom DC-lading
Lad med likestrøm proporsjonal med 0,1-0,2 av den betingede nominelle kapasiteten Q i henholdsvis ca. 15-7 timer.
Den lengste og sikreste lademetoden. Passer for de fleste typer batterier.
- hurtiglading
Lad med likestrøm proporsjonalt med 1/3 Q i ca. 3-5 timer.
- Akselerert eller "delta-V" ladning
En ladning med en initial ladestrøm proporsjonal med den nominelle nominelle kapasiteten til batteriet, hvor batterispenningen hele tiden måles og ladningen avsluttes etter at batteriet er fulladet. Ladetiden er omtrent en og en halv time. Batteriet kan overopphetes og til og med ødelegge det.
- omvendt lading
Den utføres ved å alternere lange ladepulser med korte utladningspulser. Den omvendte metoden er mest nyttig for lading av NiCd- og NiMH-batterier, som er preget av den såkalte.n. "minneeffekt".