Punkt zamarzania wody
Następuje proces zamrażania po schłodzeniu do zera stopni w skali Celsjusza. Nie dotyczy to całej wody. Cząsteczki przyczepiają się do zanieczyszczeń, którymi są drobinki kurzu, soli itp. Dlatego woda czysta lub destylowana, bez obecności tych samych zanieczyszczeń, pod wpływem niskich temperatur w kolumnie Celsjusza może dłużej pozostawać w stanie ciekłym niż zwykła woda.
Interesujące jest również to, że podczas gdy inne substancje zmniejszają swoją objętość podczas zamrażania, woda wręcz przeciwnie, zwiększa się. Dzieje się tak, ponieważ odległość między cząsteczkami zwiększa się podczas przejścia do stanu stałego. Pomimo tego, że zwiększa się objętość, masa nie zwiększa się podczas zamrażania i waży tyle, co ciepła woda.
Wiele osób zastanawia się, dlaczego woda nie zamarza pod grubą warstwą lodu. Każdy fizyk odpowie, że pod warstwą lodu woda nie zamarza, ponieważ powierzchnia lodu służy jako izolator ciepła.

Dlaczego gorąca woda zamarza szybciej niż zimna?
Wiadomo, że gorąca lub ciepła woda zamarza szybciej niż zimna. Niewiarygodne, ale prawdziwe. Odkrycia tego dokonał Erasto Mpemba. Przeprowadził eksperymenty z zamrożoną masą i stwierdził, że jeśli masa jest ciepła, zamarznie szybciej. Powodem tego, jak wykazały badania, jest wysoki transfer ciepła gorącej i ciepłej wody.

Czy temperatura zamarzania wody i wysokość są powiązane?
Jak wiadomo, ciśnienie zmienia się na wysokości, więc temperatura przejścia w stan stały wszystkich roztworów wodnych na wysokości różni się od temperatury na normalnej powierzchni.
Przykłady zmian temperatury na wysokości:
- wysokość 500 m - temperatura zamarzania wody nie wynosi zero ° C, jak w normalnych warunkach, ale w obecności już jednego ° C;
- wysokość 1500 m - krystalizacja zachodzi w obecności około 3 °C itp.

Jak ciśnienie wpływa na proces krystalizacji wody
Jeśli rozumiesz związek między ciśnieniem a krystalizacją wody, wszystko jest dość proste.
Ciekawy! Im wyższe ciśnienie, tym mniejsza szybkość przemiany wody w kryształki lodu i wyższa temperatura wrzenia!
To cała tajemnica, a jeśli myślisz logicznie, to wraz ze spadkiem ciśnienia wszystkie wskaźniki idą w przeciwnym kierunku. Dlatego w górach trudno coś ugotować, skoro temperatura wrzenia wody nie sięga stu stopni Celsjusza. I odwrotnie, lód topi się nawet w niskich temperaturach.
Temperatura krystalizacji roztworów wodnych
Woda jest dobrym rozpuszczalnikiem i dlatego łatwo łączy się z innymi substancjami. Powstałe rozwiązania oczywiście zamarzną w różnych warunkach. Rozważ kilka opcji kryteriów temperaturowych do zamrażania różnych roztworów opartych na wodzie.
Woda i alkohol. Przy dużej ilości alkoholu w wodzie proces zamrażania rozpocznie się w obecności bardzo niskich temperatur. Na przykład przy stosunku 60% wody do 40% alkoholu krystalizacja rozpocznie się w obecności minus 22,5°C.
Woda i sól. Temperatura, w której następuje zamarzanie, jest bezpośrednio związana ze stopniem zasolenia wody. Zasada jest taka, że im więcej soli w wodzie, tym niższa temperatura krystalizacji. Sposób zamarzania wody morskiej jest bezpośrednio związany z zawartością soli.
Woda i soda. Temperatura krystalizacji roztworu wynosi 44 procent plus 7°C.
Woda i gliceryna, w stosunku 80% do 20%, gdzie 80 to gliceryna, a 20 to woda, do zamrożenia roztworu wymagana jest obecność -20 ° C.
Wszystkie wartości temperatur zmieniają się w zależności od stopnia stężenia roztworów obcych lub innych substancji w wodzie.
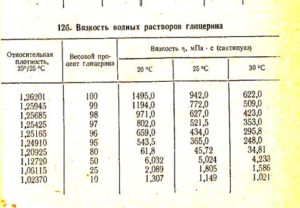
Pomiar lepkości cieczy za pomocą wiskozymetru Ostwalda
W celu wyznaczenia współczynnika lepkości ηhis badanej cieczy za pomocą wiskozymetru kapilarnego Ostwalda (rys. 6), należy znać:
- η0 to lepkość wody,
- t0 to czas przepływu wody między znakami a i b,
- tx to czas przepływu badanej cieczy pomiędzy znakami a i b,
- ρ0 to gęstość wody,
- ρx jest gęstością badanej cieczy.
Ryż. 6. Wiskozymetr kapilarny Ostwalda (a, b, d - oznaczenia ograniczające poziom cieczy, c - kapilara).
Lepkość badanej cieczy określa wzór (9).
Porządek pracy
Zadanie 1. Określ lepkość roztworów o różnych stężeniach.
-
Wlej wodę do nogi wiskozymetru, która nie ma kapilary (rys. 6) do oznaczenia d.
-
Za pomocą gruszki wciągnij płyn przez kapilarę, aby zaznaczyć a. Po wyjęciu gruszki zamknij otwór lewego kolana wiskozymetru (ręką, korkiem, wacikiem itp.) (patrz ryc. 6). Przygotuj i włącz stoper otwierając otwór lewego kolana i wyłącz go, gdy wypłynie znak b, wyznaczając w ten sposób t0 - czas przepływu wody między znakami a i b.
-
Powtórz pomiary 4-5 razy, znajdź średni czas.
-
Wykonaj kroki 1-3 dla wszystkich płynów testowych.
-
Oblicz współczynniki lepkości badanych cieczy ze wzoru (9).
-
Wprowadź dane w tabeli 1.
Tabela 1
| № | Stężenie, % | t1 | t2 | t3 | t4 | t5 | | |
| 1 | ||||||||
| 2 | ||||||||
| 3 | ||||||||
| 4 | ||||||||
| 5 | ||||||||
| 6 |
Zadanie 2. Określ stężenie nieznanego roztworu.
-
Wykres współczynnika lepkości a stężenie roztworu
-
Znając lepkość nieznanego roztworu, określ jego stężenie z wykresu.
Tabela 2
Gęstość wody w różnych temperaturach
| ρ, kg/m3 | t, 0C | ρ, kg/m3 | t, 0C |
| 999,13 | 15 | 998,02 | 21 |
| 998,97 | 16 | 997,80 | 22 |
| 998,80 | 17 | 997,57 | 23 |
| 998,43 | 19 | 997,32 | 24 |
| 998,23 | 20 | 997,07 | 25 |
Tabela 3
Lepkość wody w różnych temperaturach
| η, Pas | t, 0C | η, Pas | t, 0C |
| 0,00114 | 15 | 0,00098 | 21 |
| 0,00111 | 16 | 0,00096 | 22 |
| 0,00108 | 17 | 0,00093 | 23 |
| 0,00103 | 19 | 0,00091 | 24 |
| 0,00100 | 20 | 0,00089 | 25 |
Tabela 4
Gęstość roztworów gliceryny o różnych stężeniach
| Z, % | ρ, kg/m3 | Z, % | ρ, kg/m3 |
| 5 | 1012,5 | 45 | 1112,5 |
| 10 | 1025,0 | 50 | 1125,0 |
| 15 | 1037,5 | 55 | 1137,5 |
| 20 | 1042,5 | 60 | 1150,0 |
| 25 | 1052,5 | 65 | 1162,5 |
| 30 | 1075,0 | 70 | 1175,0 |
| 35 | 1087,5 | 75 | 1187,5 |
| 40 | 1100,0 | 80 | 1200,0 |
Niezależna praca nad tematem:
– rozwiązywanie problemów sytuacyjnych;
- słuchanie abstraktów
Ostateczna kontrola wiedzy:
– rozwiązywanie problemów z biletami;
– odpowiedzi na kwity kontroli końcowej;
- podsumowując.
Praca domowa, aby zrozumieć temat lekcji
Pytania kontrolne na temat lekcji:
1. Jak nazywa się lepkość cieczy?
2. Jaki rodzaj przepływu płynu nazywa się laminarnym?turbulentnym?
3. Co charakteryzuje formułę Reynoldsa?
4. Napisz wzór Newtona i wyjaśnij fizyczne znaczenie zawartych w nim wielkości?
5. Jaki jest współczynnik lepkości dynamicznej? W jakich jednostkach jest mierzony?
6. Jakie płyny nazywają się newtonowskimi? Od czego zależy ich współczynnik lepkości?
7. Jakie ciecze nazywamy nienewtonowskimi i co decyduje o ich współczynniku lepkości?
8. Napisz wzór Poiseuille'a, wyjaśnij fizyczne znaczenie zawartych w nim wielkości.
9. Jakimi metodami określa się lepkość cieczy?
10. Opowiedz o właściwościach reologicznych krwi i innych płynów biologicznych, o zastosowaniu analiz reologicznych w medycynie.
11. Co pokazuje gradient prędkości? Pokaż graficznie.
12. Jakie zjawisko nazywamy tarciem wewnętrznym?
Zadania testowe na ten temat:
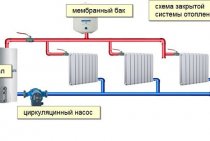
CZY STOSOWANIE GLICERYNY W OGRZEWANIU JEST UZASADNIONE?
Na płyn chłodzący do systemów grzewczych stawiane są dość wysokie wymagania. Musi być przeciwpożarowy i przeciwwybuchowy, zapewniać dobre parametry termiczne, a także nie może zawierać niedozwolonych do stosowania dodatków. Glikol etylenowy lub glikol propylenowy jest używany jako podstawa do produkcji wysokiej jakości nośnika ciepła, który zapewnia również przyjazność dla środowiska.
Ostatnio na rynku pojawiły się płyny chłodzące przeciw zamarzaniu na bazie gliceryny. Produkt ten jest promowany głównie przez małe, mało znane firmy na rynku płynów niezamarzających. Powstaje pytanie: gliceryna i płyn chłodzący - czy ich połączenie jest odpowiednie?
I rzeczywiście, pierwsze płyny przeciw zamarzaniu, które pojawiły się w naszym kraju w latach dwudziestych ubiegłego wieku, powstały na bazie gliceryny. Ich słabościami była niewystarczająca płynność i wyjątkowo wysoka lepkość, z którą pompy nie mogły sobie poradzić. Próbowali rozwiązać problem za pomocą alkoholu, w tym alkoholu metylowego. Jednak wraz z poprawą płynności pojawiło się wiele problemów. Faktem jest, że metanol jest silną trucizną psychotropową.W rezultacie zachowanie kierowców, którzy mimowolnie wąchali taki płyn niezamarzający, czasami kłóciło się z logiką i stanowiło zagrożenie dla zdrowia i życia innych. Ponadto alkohol metylowy ma niską temperaturę wrzenia i gdy odparowuje, lepkość produktu natychmiast wzrasta. Problem został rozwiązany dopiero wtedy, gdy podstawą chłodziwa stał się glikol etylenowy. A pod koniec lat trzydziestych, na początku lat czterdziestych, glikol etylenowy prawie całkowicie wyparł płyny glicerynowo-metanolowe.
Ponadto gliceryna jest niestabilna termicznie, rozkłada się podczas długotrwałego ogrzewania, tworząc trującą lotną substancję - akroleinę, która ma ostry nieprzyjemny zapach, który powoduje łzawienie. Produkty rozkładu są toksyczne, a wytrącanie się zwiększa aktywność korozyjną chłodziwa. W rezultacie rosną wymagania dotyczące uszczelek i części wykonanych z niepolarnych gum i tworzyw sztucznych. Oprócz dużej lepkości gliceryna również mocno się pieni, co prowadzi do wietrzenia układu i słabego odprowadzania ciepła.
Producenci płynów glicerynowych starają się zrekompensować wszystkie powyższe wady, dodając różne dodatki, w tym alkohole alifatyczne - metanol, etanol, propanol. Alkohole te mogą znacznie zmniejszyć lepkość lub gęstość płynu chłodzącego zapobiegającego zamarzaniu. Ale gotują się już w temperaturach powyżej 65 stopni, co prowadzi do pogorszenia wydajności termicznej chłodziwa. Alkohole te są zdolne do rozpuszczania gumy i polimerów, a także są podatne na kawitację i silne parowanie. Ponadto metanol jest silną trucizną i nie wolno go stosować do produkcji płynów przeciw zamarzaniu.
Zapewnienie jakości chłodziw glicerynowych, zwłaszcza z metanolem, wymaga dodania do mieszanki drogich pakietów dodatków. I chociaż koszt gliceryny jest teraz niższy niż koszt glikoli, pakiet dodatków do wytwarzania wysokiej jakości glicerynowych płynów przenoszących ciepło jest droższy niż pakiet dodatków do płynu niezamarzającego na bazie glikolu etylenowego i glikolu propylenowego. A jeśli koszt glicerynowego środka przeciw zamarzaniu na rynku jest niższy niż glikolu, oznacza to, że producent po prostu zaoszczędził na jakości i nie dodał do produktu niezbędnych drogich dodatków!
Wybór należy więc do kupującego: albo niezawodny i sprawdzony płyn chłodzący na bazie glikoli, albo glicerynowa „świnia w worku”.
Wybór naszej firmy, podobnie jak większości czołowych producentów płynów niezamarzających, jest zasadniczo jednoznaczny – gliceryny nie można stosować w czystej postaci, ale zmieszanie z metanolem jest niebezpieczne i przestępcze!
Głównym argumentem potwierdzającym nasze stanowisko w tej kwestii jest to, że w każdym ważnym i dużym obiekcie stosowanie gliceryny w systemach grzewczych i chłodniczych jest NIEDOZWOLONE przez obowiązujące normy!
MEG
Glikol etylenowy jest produktem hydratacji tlenku etylenu w obecności kwasu siarkowego lub fosforowego. Odnosi się do alkoholi wielowodorotlenowych. Nie zamarza w niskich temperaturach i obniża temperaturę zamarzania wody. Zdolne do pochłaniania wody z powietrza.
Sprzedawany jest w metalowych i plastikowych beczkach do 227 litrów. Jak również kostki plastikowe 1000l.
Konieczne jest przechowywanie substancji w szczelnym pojemniku wykonanym z aluminium lub stali z zabezpieczeniem antykorozyjnym w magazynie zamkniętym bez ogrzewania. Okres przydatności do spożycia dla klasy najwyższej 12 miesięcy, dla klasy pierwszej 3 lata od daty produkcji.
Nazwa wskaźnika Norma
Wygląd, zapach Klarowna, bezbarwna ciecz o oleistej konsystencji. Bez zapachu.
Rozpuszczalny w wodzie, alkoholach, toluenie, benzenie
Gęstość 1,112 g/cm?.
Temperatura topnienia 12,9 stopni Celsjusza
Temperatura wrzenia 197,3 stopni Celsjusza
Podanie
Ze względu na zdolność do obniżania temperatury zamarzania glikol monoetylenowy wykorzystywany jest do produkcji płynów niezamarzających i hamulcowych do samochodów, a także do produkcji celofanu i poliuretanu. W mniejszym stopniu wykorzystywany jest do produkcji tuszy i farb drukarskich.
Klasa zagrożenia
Odnosi się do substancji palnych. Samozapłon następuje w temperaturze 380 stopni, błysk pary po podgrzaniu do 120 stopni. Toksyczny. Przetwarzanie jest niedozwolone. Pary są mniej szkodliwe.
Glicerol
Wzór chemiczny: HOCH2CH(OH)CH2OH
Nazwa międzynarodowa: Gliceryna
NR CAS: 56-81-5
Kwalifikacja: Chochlik. "h", GOST 6259-75
Wygląd zewnętrzny: klarowna, bezwonna ciecz
Uszczelka: Puszki 25 kg, beczki 250 kg, 1500 kostek
Warunki przechowywania: w wentylowanym suchym pomieszczeniu w niskiej temperaturze
Synonimy: 1,2,3-trioksypropan
Oferujemy glicerynę w puszkach, beczkach, kostkach w konkurencyjnych cenach.
| Specyfikacja | |
| Waga molekularna | 92.10 |
| Substancja podstawowa, nie mniej niż | 99,5% (rzeczywiste 99,8%) |
| Zawartość popiołu, nie więcej | 0,01% (w rzeczywistości mniej niż 0,1%) |
| Zawartość wody, nie więcej | 0,5% (w rzeczywistości 0,1%) |
| Zawartość chlorków, nie więcej | 0,001 % |
| Zawartość siarczanów, nie więcej | 0,002 % |
| Metale ciężkie, nie więcej | 0,0005% (w rzeczywistości mniej niż 0,00005%) |
| Związki chloru (jako CL), nie więcej | 0,003 % |
| Arsen, nie więcej | 0,00015% (rzeczywiste mniej niż 0,00001%) |
| Kolor (APHA), nie więcej | 20 (w rzeczywistości mniej niż 10) |
Gliceryna jest bezbarwną, higroskopijną, lepką, bezwonną cieczą o słodkim smaku. Mieszalny w dowolnym stosunku z wodą, etanolem, metanolem, acetonem, nierozpuszczalny w chloroformie i eterze. Gdy glicerol jest mieszany z wodą, uwalniane jest ciepło i następuje skurcz (zmniejszenie objętości). Gdy glicerol oddziałuje z kwasami halogenowodorowymi lub halogenkami fosforu, powstają mono- lub dihalohydryny; z kwasami nieorganicznymi i karboksylowymi - estrami całkowitymi i niepełnymi, z odwodnieniem - akroleiną. Glicerol można utlenić iw zależności od warunków i charakteru środka utleniającego można otrzymać aldehyd glicerynowy, kwas glicerynowy, kwas tartronowy, dihydroksyaceton, kwas mezoksalowy. Gliceryna występuje w naturalnych tłuszczach i olejach jako mieszane trójglicerydy kwasów karboksylowych.
Podanie Gliceryna ma szerokie zastosowanie • w przemyśle farmaceutycznym, np. do produkcji nitrogliceryny, maści leczniczych; • w przemyśle spożywczym, np. przy produkcji likierów, wyrobów cukierniczych; • w przemyśle kosmetycznym, w produkcji perfum i kosmetyków, • w produkcji żywic gliptalnych; • jako zmiękczacz do tkanin, skóry, papieru; • jako składnik emulgatorów, płynów niezamarzających, smarów, past do butów, mydeł i klejów, • jako surowiec do produkcji polialkoholi, które znajdują zastosowanie w różnych piankach. • jako plastyfikator do celofanu itp.
W jakiej temperaturze zamarza woda w rurach grzewczych w budynku mieszkalnym
Jeśli temperatura w domu utrzymuje się przez kilka dni -10, aw rurach jest woda, może ona zamarznąć, co doprowadzi do pęknięcia rur. Wielu prawdopodobnie widziało nowoczesne baterie grzewcze z funkcją odprowadzania wody. Prawie wszystkie nowoczesne akumulatory są wyposażone w możliwość spuszczania wody. Odbywa się to tak, że w razie awarii, gdy temperatura w domu wynosi -10, woda nie zamarza i nie rozrywa rur. Jeśli do tego doszło, bardzo nam współczujemy, najprawdopodobniej będziesz musiał wymienić baterie, ponieważ podczas zamarzania wody prawdopodobnie wystąpiły mikropęknięcia, które sprawiają, że dalsza eksploatacja tych baterii jest niebezpieczna.
Dlaczego woda może zamarzać w rurach. Jeśli w sezonie grzewczym, akurat podczas napełniania akumulatorów, nastąpi awaria i woda ostygnie, a temperatura na zewnątrz gwałtownie spadnie, może to doprowadzić do zamarznięcia rur.
Odpowiedzieliśmy już na pytanie, w jakiej temperaturze woda zamarza, w ramach eksperymentu weź małą szklankę, napełnij ją do połowy wodą i włóż do zamrażarki na kilka godzin, wystarczą dwie godziny, aby woda częściowo zamieniła się w lód.
Woda jest jedną z najważniejszych substancji na naszej planecie. Posiada wiele właściwości, które czynią go w pewnym stopniu wyjątkowym. Jedną z najbardziej znanych właściwości, o których wie nawet małe dziecko, jest zamrażanie wody.Wiadomo, że 0 stopni Celsjusza to temperatura krystalizacji wody. Ale nie wszystko jest takie proste. W dalszej części rozważymy niektóre subtelności tego procesu.

Gęstość roztworu gliceryny w 25
Średnia arytmetyczna gęstości alkoholu i glicerolu.
209.4. 1.047. 25.265.0. 1.060. ... Zobacz jaka jest Gęstość wodnych roztworów gliceryny w innych słownikach E236 File Kwas mrówkowy.svg Wzór strukturalny kwasu mrówkowego Kwas mrówkowy Kwas mrówkowy jest pierwszym...
Jaka jest gęstość gliceryny w 17 stopniach Celsjusza?
8
Gęstość w 25 C, g cm. ... Roztwór gliceryny o stężeniu 25% lub wyższym nie naraża skażenia mikrobiologicznego, w bardziej rozcieńczonych roztworach dobrze się w nim rozmnażają drobnoustroje.
3,14
Który płyn ma wyższą gęstość, glicerynę czy alkohol? wyjaśniać
Ssss
TK-kwiecień na miejscu w całej Rosji. Stężenie, gęstość i współczynnik załamania roztworów glicerolu 15 С. … 1,0594. 1.3633. 25.1.0620.
Oblicz masę molową obu substancji. W przypadku alkoholu jest to mniej (92 g / mol w porównaniu z 46 g / mol w przypadku alkoholu), a gęstość jest odpowiednio niższa. Jeśli chodzi o alkohol etylowy.
Jaki jest sens takich pytań? Informacje znajdują się w wyszukiwarkach
Średnia arytmetyczna gęstości składników mieszaniny.
Określ, jaką masę glicerolu o gęstości 1,26 g ml należy pobrać, aby przygotować roztwór wodny c.42. ... 111 g bezwodnika ftalowego i 46 g gliceryny o gęstości 28 V umieszczono w szklanej zlewce o pojemności 0,25 l.
Jak obliczyć gęstość i lepkość cieczy zawierającej wodę, alkohol i glicerynę?
W tym celu sprzedawane są reometry. nie musisz nic liczyć. po prostu zamrozić.
glikol trietylenowy. glikol propylenowy. Glicerol. …glikol propylenowy 40%. -25 C. ... Gęstość wodnych roztworów glikolu etylenowego w różnych temperaturach.
Musisz znać procent wszystkich składników mieszanki (przynajmniej!)
Nie ma mowy. Poszukaj danych otrzymanych przez kogoś.
Proszę o pomoc, czy kawałek lodu będzie pływał w benzynie, nafcie, glicerynie? czemu?
Będzie w glicerynie, nie unosi się w whisky - gęstość jest mniej więcej taka sama jak w benzynie
Zwiększa również gęstość gotowego roztworu i poprawia jakość bąbelków. ... Roztwór gliceryny 25g butelkaTula Pharmaceutical Factory LLC. … Roztwór tetraboranu sodu w fiolce glicerynowej 20% 30g, Samara FF, Samara Rosja.
Lód jest mniej gęsty niż olej, więc będzie.
Porównaj gęstość lodu z gęstością tych cieczy. jeśli gęstość lodu jest mniejsza, unosi się, a jeśli jest większa, opada.
Nie wiem. zależy od tego, który kawałek. jeśli w lodzie jest wystarczająco dużo powietrza, aby utrzymać go na powierzchni, będzie unosił się, a jeśli nie, to nie będzie. Spróbuj sam. nafta jest tania.
W zależności od temperatury, do której ten lód jest schładzany
Temperatura wrzenia wodnych roztworów gliceryny spada wraz ze spadkiem stężenia glicerolu o zawartości 5% wody, temperatura wrzenia 160-161, jej gęstość wynosi 1,26362 g cm3. … 25 25 C . ZnCl2.
Nigdy nie widziałem lodu pływającego w baku i kanistrze. I na pewno jest))). Więc prawdopodobnie jest na dole. Widziałem glicerynę tylko w fiolce i w upale))).
Ojej!
X ilość rozcieńczonej glicerolu, g Gęstość destylowanej glicerolu, g ml ... Roztwory glicerolu o stężeniu 25% i wyższym nie podlegają zanieczyszczeniu mikrobiologicznemu, bardziej rozcieńczone roztwory są ...
Czy kawałek lodu unosi się w benzynie, nafcie, glicerynie?
Sprawdź gęstość i to wszystko!
Gęstość wodnych roztworów alkoholi. Gęstości roztworów wodnych g cm3 w temperaturze 20 C podano dla następujących substancji: etanol, 1-propanol, 2-propanol, glikol etylenowy, glicerol, D-mannitol.
Tak)))
Jeśli gęstość lodu jest mniejsza niż gęstość cieczy, lód będzie się unosił
Jaka jest gęstość gliceryny w temperaturze 24 gr. Z?
Gliceryna Stopnie Celsjusza020406080100120140169180Gęstość g/cm3126712591250123812241208118811631126
Dla temperatury 24 stopni = określić przez interpolację między 20 a 40 stopni
Oblicz temperaturę wrzenia 8% roztworu glicerolu C3H6O3 w acetonie. Odpowiedź to 57,7oC. 4.Roztwór, którego 100 ml zawiera 2,3 g ... Przyjmij gęstość roztworu równą jeden. Odpowiedź 608 Pa. Bilet 14 25 1. Ile gramów BaCl2 2H2O...
Pytania dotyczące chemii))) i fizyki. Która ciecz jest gęstsza od wody i również przewodzi prąd, ale nie metal?
Gliceryna, glikole etylenowe, formamidy, butyrolakton, prawie wszystkie kwasy, aminy. i wiele więcej.
Stężenie kwasu siarkowego, % mas. Gęstość w 25 C, g cm ... 25,60-0,1950 0,000 8 - wilgotność względna,% - współczynnik załamania wodnego roztworu glicerolu w 25 C dla sodu linii D - temperatura roztworu, C ...