Exploatare

În bateriile cu flux de vanadiu, ambii electrozi de referință sunt conectați suplimentar la rezervoarele de stocare și la pompe, astfel încât volume foarte mari de electrolit să poată fi circulate prin celulă. Circulația electrolitului lichid este oarecum dificilă și limitează utilizarea bateriilor cu flux de vanadiu în industriile care necesită mobilitate, făcându-le eficiente în clădirile staționare mari.
Când o baterie de vanadiu este încărcată, ionii VO2+ din electrodul de referință încărcat pozitiv se transformă în ioni VO2+ atunci când electronii sunt detașați de la borna pozitivă a bateriei. În mod similar, în electrodul de referință negativ, electronii convertesc ionii V3+ în V2+. În timpul descărcării, acest proces este invers, rezultând o tensiune în circuit deschis de 1,41 V la 25°C.
Alte proprietăți utile ale bateriilor cu flux de vanadiu includ un răspuns foarte rapid la schimbările de sarcină și o capacitate de suprasarcină extrem de mare. Cercetările de la Universitatea din New South Wales au arătat că pot atinge timpi de răspuns de mai puțin de jumătate de milisecundă la schimbări de sarcină de 100% și pot rezista la suprasarcină de 400% timp de peste 10 secunde. Timpul de răspuns este în majoritatea cazurilor limitat de echipamentul electric. Bateriile cu vanadiu pe bază de acid sulfuric funcționează doar la temperaturi de 10-40C. Dacă temperatura este sub acest interval, ionii de acid sulfuric cristalizează. Eficiența mișcării alternative în utilizarea de zi cu zi rămâne la nivelul de 65-75%.
Caracteristici de încărcare și descărcare
Algoritmii de încărcare depind direct de modul în care este aranjată bateria și de ce tip aparține. De exemplu, unele baterii își pot completa în siguranță capacitatea din surse de tensiune constantă. Altele funcționează doar cu o sursă de curent reglabilă care poate modifica parametrii în funcție de nivelul de încărcare.
Un proces de încărcare organizat incorect poate deteriora bateria. În cazuri extreme, bateria se poate aprinde sau exploda. Există baterii inteligente echipate cu dispozitive de monitorizare a tensiunii. Principalii parametri care ar trebui luați în considerare la operarea bateriilor galvanice reversibile sunt:
- Durată de viață. Chiar și cu o manipulare adecvată, numărul de cicluri de încărcare pentru o baterie este limitat. Sistemele de baterii diferite nu se uzează întotdeauna din aceleași motive. Dar, în general, durata de viață a bateriei este limitată în primul rând de numărul de cicluri complete de încărcare-descărcare și, în al doilea rând, de durata de viață de proiectare fără referire la intensitatea utilizării.
- Timp de incarcare. Designul fundamental al bateriei nu implică încărcarea la o viteză arbitrar de mare: rezistența internă a celulei galvanice va duce la conversia curentului de încărcare în exces în căldură, care poate deteriora ireversibil dispozitivul. Din punct de vedere fizic, timpul de încărcare este limitat de viteza maximă de difuzie a materialului activ prin electrolit.Simplist, putem presupune că restabilirea capacității maxime într-o oră este un indicator bun.
- Adâncimea de descărcare. Specificat ca procent din puterea nominală. Descrie capacitatea utilizabilă. Pentru diferite tipuri de baterii, nivelul recomandat de descărcare de funcționare poate varia. Din cauza modificărilor de funcționare sau a îmbătrânirii, indicatorul de adâncime maximă își pierde valoarea inițială.
proces de difuzie.
Datorită procesului de difuzie, alinierea densității electrolitului în cavitatea carcasei bateriei și în porii masei active a plăcilor, polarizarea electrodului poate fi menținută în baterie atunci când circuitul extern este oprit.
Viteza de difuzie depinde direct de temperatura electrolitului, cu cât temperatura este mai mare, cu atât procesul are loc mai rapid și poate varia foarte mult în timp, de la două ore la o zi. Prezența a două componente ale potențialului electrodului în condiții tranzitorii a condus la împărțirea în EMF de echilibru și de neechilibru a bateriei. EMF de echilibru al bateriei este afectată de conținutul și concentrația de ioni ai substanțelor active din electrolit, precum și de proprietățile chimice și fizice ale substanțelor active. Rolul principal în mărimea EMF este jucat de densitatea electrolitului, iar temperatura practic nu îl afectează. Dependența EMF de densitate poate fi exprimată prin formula:
Femeia bateriei nu este egală cu tensiunea bateriei, care depinde de prezența sau absența unei sarcini la bornele sale.
admin25/07/2011
Un comentariu
Nume *
Site
Acest site folosește Akismet pentru a lupta împotriva spamului. Aflați cum sunt procesate datele comentariilor dvs.
« Tahometru mecanic
Voltajul bateriei "
Etichete
Defecțiuni VAZ, VAZ Senzori Aprindere Injector Dispozitive Starter Scheme Mașini electrice Alimentare vaz 2110 gazelle gazelle registratori de afaceri reparații auto
Intrări recente
- Senzorii din mașină: tipuri și scop
- Cea mai mare mașină electrică EDumper din lume,
- Lumini laser.
- Avantajele și dezavantajele lămpilor cu halogen
- Dispozitivul și principiul de funcționare a senzorilor de parcare
Arhive
Arhive Selecteaza septembrie 2019 August 2017 Iulie 2017 Martie 2017 Septembrie 2016 August 2016 Iulie 2016 In luna mai 2016 Aprilie 2016 Martie 2016 Februarie 2016 Noiembrie 2015 Octombrie 2015 August 2015 Iulie 2015 Iunie 2015 Mai 2015 ianuarie 2015 decembrie 2014 noiembrie 2014 octombrie 2014 septembrie 2014 august 2014 iulie 2014 iunie 2014 mai 2014 aprilie 2014 februarie 2014 ianuarie 2014 decembrie 2013 noiembrie 2013 octombrie 2013 august 2013 03. 2012, 2012, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, septembrie 2012, 2011, 2011, 2011, 2011, 2011, 2011
Categorii
- Acumulator baterie
- Video
- Generator
- Senzori
- Diagnosticare
- Aprindere
- știri
- Echipamente
- Dispozitive
- Reparație
- Bujie
- Incepator
- Sistem
- Dispozitive
- mașini electrice
- Alimentare electrică
Suntem în rețelele de socializare
Electrician auto@ Toate drepturile rezervate. Când copiați materialele site-ului, trebuie să furnizați un link către site.
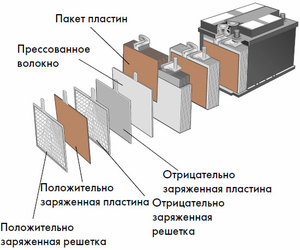
Dispozitiv și principiu de funcționare
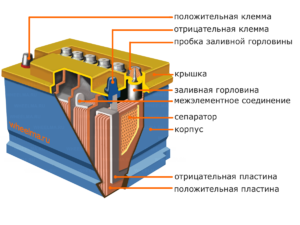
Fiecare astfel de celulă are un catod (electrod pozitiv) și un anod (negativ). Acești electrozi sunt separați de un electrolit care asigură schimbul de ioni între ei. Materialele electrozilor și compoziția electroliților sunt alese pentru a asigura o forță electromotoare suficientă între bornele bateriei.
Deoarece electrozii conțin un potențial limitat de energie chimică, bateria se va epuiza în timpul funcționării. Tipul de celule galvanice, care este adaptat pentru reumplere după o descărcare parțială sau completă, se numește baterie. Un ansamblu de astfel de celule interconectate este o baterie.Funcționarea bateriei implică o schimbare ciclică a două stări:
- Încărcare - bateria funcționează ca un receptor de energie electrică, în interiorul celulelor energia electrică se realizează prin modificări chimice.
- Descărcare - dispozitivul funcționează ca sursă de curent electric prin transformarea energiei reacțiilor chimice în energie electrică.
Domenii de utilizare
Caracteristica de capacitate ultra-înaltă a bateriilor redox cu vanadiu le face potrivite pentru utilizarea în industriile care necesită stocare mare de energie. De exemplu, ajutând la echilibrarea volumului producției unor astfel de surse de energie, cum ar fi eolianul sau solarul, sau ajutând generatorii să absoarbă supratensiuni mari de energie atunci când este necesar, sau echilibrând oferta și cererea de energie pentru zonele îndepărtate.
Caracteristicile limitate de auto-descărcare ale bateriilor redox cu vanadiu le fac utile în industriile în care bateriile trebuie depozitate pentru perioade lungi de timp cu întreținere și pregătire minimă. Acest lucru a condus la utilizarea lor în unele tipuri de electronice militare, de exemplu, în senzorii sistemului de minerit GATOR. Capacitatea lor de a rula și de a rămâne la zero le face potrivite pentru aplicații solare și industrii în care bateriile trebuie să înceapă ziua goale și să se reîncarce în funcție de sarcină și vreme. De exemplu, bateriile cu ioni de litiu sunt adesea deteriorate atunci când li se permite să se descarce sub 20% din volumul lor, așa că cel mai adesea funcționează în intervalul 20 până la 100%, ceea ce înseamnă că pot folosi doar 20% din capacitatea lor nominală.
Timpul lor de răspuns extrem de rapid le face, de asemenea, practic indispensabile pentru sursele de alimentare neîntreruptibile, unde pot fi folosite în locul bateriilor plumb-acid și chiar a generatoarelor diesel. De asemenea, timpul de răspuns rapid le face potrivite pentru controlul frecvenței. Momentan, nici UPS-urile, nici măsurile de gestionare a frecvenței nu sunt eficiente de la sine, dar este probabil ca bateria să poată găsi aplicații în aceste industrii atunci când este valorificată din diverse surse de finanțare. În plus, aceste capacități fac din bateriile redox cu vanadiu o soluție eficientă „unică” pentru rețelele electrice mici, care depind de funcționarea fiabilă, controlul frecvenței și nevoile de comutare a sarcinii (cum ar fi penetrarea mare a surselor regenerabile, sarcinile foarte fluctuante sau dorința de a optimizarea eficienței generatorului prin schimbarea timpului de răspuns).
Cele mai mari baterii redox cu vanadiu care funcționează
Substația „Minami Hyakita”:
- Data lansării: decembrie 2015
- Energie: 60 MWh
- Putere: 15 MW
- Timp de lucru: 4 ore
- Țara: Japonia
Stinky, provincia Liaoning
- Data lansării: N/A
- Energie: 10 MWh
- Putere: 5 MW
- Timp de lucru: 2 ore
- Țara: China
Parcul eolian Tomamae
- Data lansării: 2005
- Energie: 6 MWh
- Putere: 4 MW
- Timp de lucru: 1 ora 30 minute
- Țara: Japonia
Proiectul Zhangbei
- Data lansării 2016
- Energie: 8 MWh
- Putere: 2 MW
- Timp de lucru: 4 ore.
- Țara: China
Proiectul SnoPUD MESA 2
- Data lansării: martie 2017
- Energie: 8 MWh
- Putere: 2 MW
- Timp de lucru: 4 ore.
- Țara: Statele Unite ale Americii
Substație din Escondido
- Data lansării: 2017
- Energie: 8 MWh
- Putere: 2 MW
- Timp de lucru: 4 ore.
- Țara: Statele Unite ale Americii
Substație din Pullman, Washington
- Data lansării: aprilie 2015
- Energie: 4 MWh
- Putere: 1 MW
- Timp de lucru: 4 ore
- Țara: Statele Unite ale Americii
Până în 2018, dezvoltarea unei baterii redox cu vanadiu este de așteptat să fie finalizată în China. Energia sa va fi de 800 MWh, puterea - 200 MW, iar durata de funcționare - 4 ore.
Termeni
- Secvenţial - elementele urmează una după alta.
- Forța electromotoare (EMF) este tensiunea generată de o baterie sau de o forță magnetică în conformitate cu legea lui Faraday.
- Paralel - Componentele electrice sunt aranjate astfel încât curentul să circule pe două sau mai multe căi.
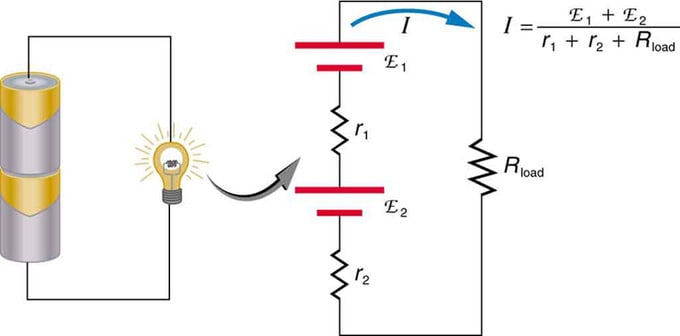
Dacă utilizați mai multe surse de tensiune, acestea pot fi conectate în serie sau în paralel. Cu versiunea de serie, acestea sunt reglate în aceeași direcție, rezistența internă este plusată, iar forța electromotoare este adăugată algebric. Tipuri similare sunt comune în lanterne, jucării și o varietate de alte aparate. Celulele sunt plasate în serie pentru a crește EMF total.
Conectarea în serie a două surse de tensiune în aceeași direcție. Diagrama prezintă un felinar cu două celule și o lampă
Baterie - conexiune multiplă a elementelor de volți. Dar există un dezavantaj în conexiunea în serie, deoarece se adaugă rezistențe interne. Uneori, acest lucru creează probleme. Să presupunem că aveți două baterii de 6V pe care le puneți în loc de cele obișnuite de 12V. Drept urmare, ați adăugat nu numai EMF, ci și rezistența internă de la fiecare baterie.
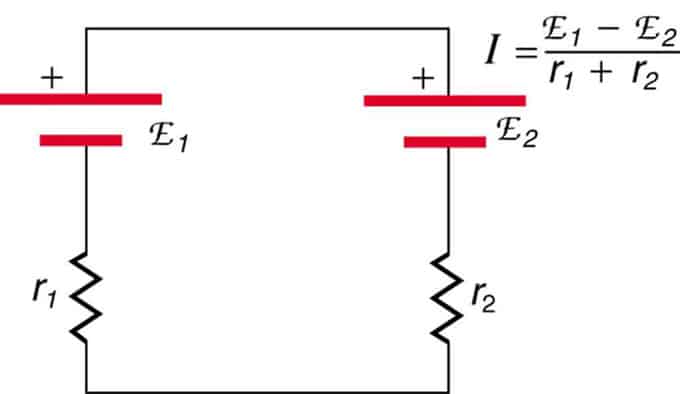
Dacă celulele sunt situate în opoziție (una este situată în spatele celeilalte), atunci EMF total va scădea.
Acestea sunt două surse de tensiune conectate în serie cu emisii opuse. Curentul circulă în direcția EMF mai mare și este limitat de însumarea rezistențelor interne. Un exemplu este un încărcător. Trebuie să aibă mai multe fem decât bateria
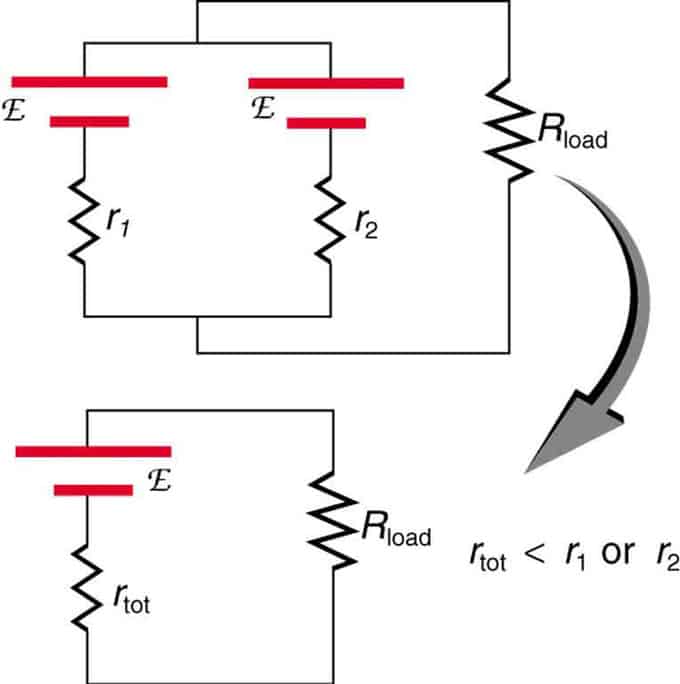
Dacă două surse cu aceeași forță electromotoare sunt situate în paralel și conectate la rezistența de sarcină, atunci EMF totală rămâne aceeași cu cele individuale. Cu toate acestea, rezistența internă totală va fi redusă. Se pare că versiunea paralelă poate genera mai mult curent.
Două surse de tensiune cu un singur EMF sunt combinate în paralel. Ele formează un singur EMF, dar au o rezistență totală mai mică decât individual. Combinații similare sunt folosite dacă trebuie să obțineți mai mult curent.
| Prezentare generală |
|
| Conectarea în paralel și în serie a rezistențelor |
|
| Kirchhoff guvernează |
|
| Voltmetre și ampermetre |
|
| Circuite RC |
|
Prezentare istorică
Dezvoltarea primei celule galvanice este creditată de fizicianul italian Alessandro Volta. A efectuat o serie de experimente cu fenomene electrochimice în timpul anilor 1790 și în jurul anului 1800 a creat prima baterie, pe care contemporanii săi o numeau „coloana voltaică”. Dispozitivul consta din discuri alternative de zinc și argint separate prin straturi de hârtie sau pânză care erau înmuiate într-o soluție de hidroxid de sodiu.
Aceste experimente au devenit baza lucrării lui Michael Faraday privind legile cantitative ale electrochimiei. El a descris principiul de funcționare al bateriei și, pe baza muncii omului de știință, au fost create primele celule electrice comerciale. Evoluția ulterioară a arătat astfel:
- În 1836, chimistul britanic John Daniel a prezentat un model îmbunătățit al celulei, constând din electrozi de cupru și zinc scufundați în acid clorhidric. Elementul lui Daniel a fost capabil să furnizeze tensiune constantă incomparabil mai eficient decât dispozitivele lui Volt.
- 1839 Progrese suplimentare au fost făcute de fizicianul Grove cu celula sa cu două fluide, constând din zinc scufundat în acid sulfuric diluat într-un recipient poros. Acesta din urmă a separat acidul sulfuric dintr-un vas care conținea acid azotic cu un catod de platină plasat în el. Acidul azotic a servit ca agent de oxidare pentru a preveni pierderea de tensiune din cauza acumulării de hidrogen la catod.Chimistul german Robert Bunsen a înlocuit platina cu carbon ieftin în celula Grove și a promovat astfel acceptarea pe scară largă a acestui tip de baterie.
- În 1859, Gaston Plante a inventat celula plumb-acid, precursorul bateriei auto moderne. Dispozitivul lui Plante a fost capabil să producă un curent neobișnuit de mare, dar a fost folosit doar pentru experimente în laboratoare timp de aproape două decenii.
- 1895-1905 ani. Invenția elementelor alcaline de nichel-cadmiu și nichel-fier. Acest lucru a făcut posibilă crearea unor sisteme cu un număr semnificativ de cicluri de încărcare-descărcare.
- Începând cu anii 1930, a început dezvoltarea bateriilor alcaline argint-zinc și mercur-zinc, care au furnizat o densitate mare de energie pe unitate de greutate și volum.
- De la mijlocul secolului al XX-lea, progresele în tehnologia de fabricație și apariția de noi materiale au condus la baterii și mai puternice și mai compacte. Cea mai notabilă a fost introducerea pe piață a bateriilor nichel-hidrură metalică și litiu.
Încărcarea bateriilor
Articolul principal: Încărcător
Pe măsură ce energia chimică se epuizează, tensiunea și curentul scad, iar bateria încetează să funcționeze. Puteți încărca bateria (bateria bateriilor) de la orice sursă DC cu o tensiune mai mare limitând în același timp curentul. Cel mai frecvent este curentul de încărcare (în amperi), proporțional cu 1/10 din capacitatea nominală condiționată a bateriei (în amperi oră).
Cu toate acestea, pe baza descrierii tehnice distribuite de producătorii de baterii electrice utilizate pe scară largă (NiMH, NiCd), se poate presupune că acest mod de încărcare, denumit în mod obișnuit ca standard, se calculează pe baza duratei unei zile lucrătoare de opt ore, când bateria, descărcată la sfârşitul zilei de lucru, este conectată la încărcătorul de reţea înainte de începerea unei noi zile lucrătoare. Utilizarea unui astfel de mod de încărcare pentru aceste tipuri de baterii cu utilizare sistematică vă permite să mențineți un echilibru calitate-cost în funcționarea produsului. Astfel, la sugestia producătorului, acest mod poate fi utilizat doar pentru bateriile nichel-cadmiu și nichel-hidrură metalică.
Multe tipuri de baterii au limitări diferite care trebuie luate în considerare în timpul încărcării și utilizării ulterioare, de exemplu, bateriile NiMH sunt sensibile la supraîncărcare, bateriile cu litiu sunt sensibile la supradescărcare, tensiune și temperatură. Bateriile NiCd și NiMH au așa-numitul efect de memorie, care constă într-o scădere a capacității atunci când încărcarea se efectuează atunci când bateria nu este complet descărcată. De asemenea, aceste tipuri de baterii au o auto-descărcare vizibilă, adică își pierd treptat încărcarea fără a fi conectate la sarcină. Pentru a combate acest efect, se poate folosi reîncărcarea prin picurare.
Metode de încărcare a bateriei
Se folosesc mai multe metode pentru a încărca bateriile; În general, metoda de încărcare depinde de tipul bateriei.
- Încărcare DC lentă
Încărcați cu un curent continuu proporțional cu 0,1-0,2 din capacitatea nominală condiționată Q pentru aproximativ 15-7 ore, respectiv.
Cea mai lungă și sigură metodă de încărcare. Potrivit pentru majoritatea tipurilor de baterii.
- încărcare rapidă
Încărcați cu curent continuu proporțional cu 1/3 Q timp de aproximativ 3-5 ore.
- Încărcare accelerată sau „delta-V”.
O încărcare cu un curent de încărcare inițial proporțional cu capacitatea nominală nominală a bateriei, la care tensiunea bateriei este măsurată în mod constant și încărcarea se termină după ce bateria este complet încărcată. Timpul de încărcare este de aproximativ o oră și jumătate. Bateria se poate supraîncălzi și chiar distruge.
- taxare inversă
Se realizează prin alternarea impulsurilor lungi de încărcare cu impulsuri scurte de descărcare. Metoda inversă este cea mai utilă pentru încărcarea bateriilor NiCd și NiMH, care se caracterizează prin așa-numitele.n. „efect de memorie”.