Trebuie să împământesc suportul pentru prosoape încălzit
Mai întâi trebuie să știți că împământarea (construcția buclelor de pământ cu propriile mâini) nu este necesară dacă:
- 1. Utilizați un suport electric pentru prosoape încălzit (astfel de suporturi pentru prosoape încălzite sunt de obicei echipate cu prize speciale în care există un fir de împământare, toate acestea sunt conectate la o priză, iar prizele în sine trebuie să fie deja conectate la bucla de împământare) .
- 2. Locuiesti intr-o casa sau apartament privat si ai un sistem de incalzire separat.
Împământarea suportului de prosoape încălzit este obligatorie în următoarele cazuri:
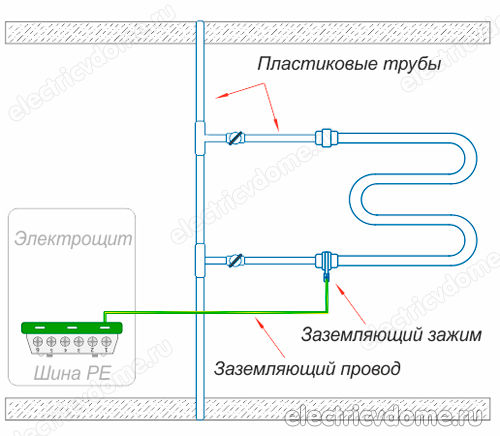
- 1. Dacă uscătorul dumneavoastră este conectat la sistemul de încălzire cu o conductă de plastic. În interiorul țevii metal-plastic se află aluminiu, care conduce curentul electric: la joncțiunile în care sunt amplasate fitingurile, circuitul electric este întrerupt. În consecință, un astfel de suport pentru prosoape încălzit trebuie să fie conectat la bucla de împământare sau la nivelul de apă caldă.
- 2. Dacă sistemul dumneavoastră de apă caldă este realizat din țevi de plastic.
Cum să împămânți un suport pentru prosoape încălzit
Toate suporturile electrice pentru prosoape încălzite, așa cum s-a menționat mai sus, sunt conectate la o priză cu împământare, în timp ce astfel de uscătoare au un fir de împământare cu un contact separat pe priză. Deoarece suporturile de prosoape încălzite sunt de obicei instalate în baie, ar trebui să inspectați priza la care va fi conectată. O astfel de priză trebuie să fie într-o carcasă de protecție specială care împiedică umiditatea să pătrundă în priza în sine.
Există 2 moduri principale de a împământa un suport pentru prosoape încălzit:
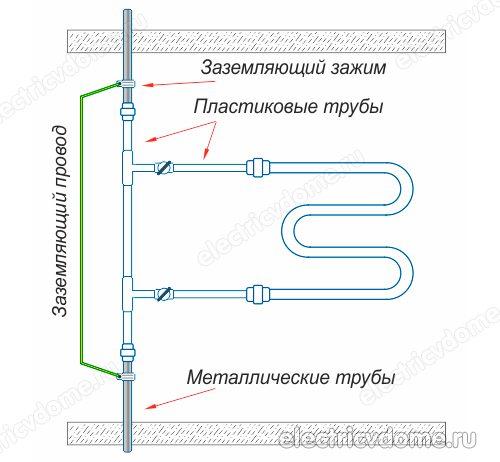
- 1. Folosind un sistem de egalizare a potențialului, care trebuie instalat manual, apoi împămânțiți acest sistem la masa comună a tabloului electric. Acest lucru ar trebui făcut dacă comunicațiile din polimeri (țevi metal-plastic) sunt utilizate în locul comunicațiilor metalice într-o casă sau apartament.
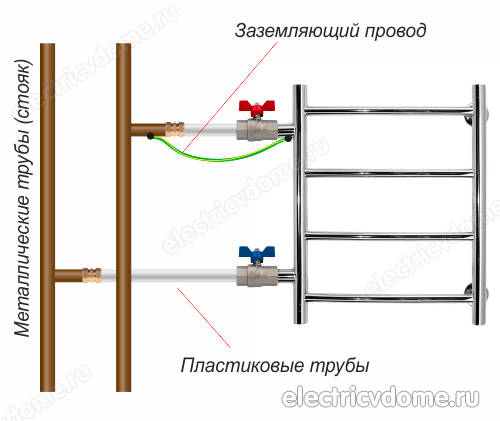
- 2. Împământarea directă a țevii corpului suportului de prosoape încălzit cu un fir convențional la o coloană de oțel.
Pentru a implementa împământarea suportului de prosoape încălzit în al doilea mod, mai întâi trebuie să obțineți o clemă, după ce ați îndepărtat toate materialele izolatoare de pe aceasta. Această clemă trebuie să aibă un terminal pentru conectarea firului. Apoi clema este atașată la conducta corpului șinelor de prosoape încălzite.
Se ia un fir de cupru obișnuit, care ar trebui să aibă o secțiune transversală de 4 mm2. Acest fir este conectat pe o parte la borna de clemă, celălalt capăt al acestuia trebuie conectat fie la pământul panoului electric, fie la o coloană de oțel. În plus, nu uitați să conectați alte dispozitive din baie la bucla de masă.
| Astfel de metode nu necesită mult timp pentru implementarea lor, dar în schimb obțin o funcționare lungă și neîntreruptă a suportului de prosoape încălzit, iar în viitor întrebarea „cum să împămânți suportul de prosoape încălzit” nu va cauza dificultăți. |
Prietenii urmăresc, de asemenea, videoclipul pentru ceea ce aveți nevoie pentru împământarea suportului de prosoape încălzit.
Conținut similar de pe site:
- Despre împământarea în cuvinte simple
- De ce este impamantata baia?
- Proiectarea dispozitivului de împământare
Cauzele electrocoroziunii
Apariția curenților turbionari Foucault este un fenomen destul de complex și imprevizibil. În sistemele de alimentare cu apă caldă și, uneori, în sistemul de încălzire, astfel de curenți apar din multe motive care par să nu aibă legătură.
În general, curenții turbionari se formează cu o diferență de potențial. La construirea unei case, toate structurile metalice sunt conectate la o buclă comună de împământare, iar mai devreme în construcție foloseau împământarea de-a lungul buclei, dar acum se mulțumesc cu metoda de egalizare potențială.
Atunci când sistemele din plastic sunt instalate într-un apartament în locul sistemului metalic existent, diferența de potențial apare din cauza unei rupturi de sol (de exemplu, există un potențial pe o șină de prosoape încălzită și unul complet diferit pe un colț). De aici diferența de potențial, de aici și curenții vagabonzi. Ele pot apărea și ca urmare a unui scurtcircuit, a lipsei de împământare a aparatelor electrocasnice din apropiere, fie că este vorba despre o mașină de spălat și așa mai departe.
Chiar și prezența/absența șinelor de tramvai în imediata apropiere joacă un rol. Curenții vagabonzi apar și atunci când există o încălcare a izolației cablajului electric, o întrerupere a rețelei sau o împământare efectuată la sistemul de încălzire.
Toate acestea conduc la coroziunea electrică a instalațiilor sanitare, aceasta fiind cauzată și de apropierea a două materiale diferite, în special oțel inoxidabil și negru. Locul prin care sarcina trece în suportul pentru prosoape încălzit, ca urmare, suferă o reacție electrochimică, astfel încât acolo apar daune. Astfel de probleme sunt de obicei rezolvate prin împământarea directă a suportului de prosoape încălzit.
Când cumpărați un suport pentru prosoape încălzit cu apă, este necesar să vă familiarizați cu regulile de funcționare a acestuia, în special, să acordați atenție dacă este necesar să împămânțiți sau nu suportul pentru prosoape încălzit, pentru a ține cont de acest punct în timpul reparație și nu după finalizarea reparației
De ce măcinați un suport pentru prosoape încălzit cu apă
După ce țevile din plastic au început să le înlocuiască pe cele metalice obișnuite, au început să ignore împământarea lor, crezând în mod eronat că o țeavă metalică și o țeavă metal-plastic au aceeași conductivitate electrică. Nu este adevarat. Nu există contact între țeava metal-plastic și aluminiu: acestea nu sunt conectate.
Practica arată că 90 la sută dintre suporturile pentru prosoape încălzite încep să curgă tocmai în cazul înlocuirii sistemelor metalice de apă caldă cu omoloagele lor din plastic (de exemplu, polipropilena). Tevile metalice vechi sunt inlocuite cu unele moderne din plastic pentru a reduce curentii turbionari. Cu toate acestea, coroziunea continuă să se arate.
Primele simptome ale coroziunii electrice sunt apariția petelor de rugină pe suportul pentru prosoape încălzit, iar rugina apare chiar și pe dispozitivele din oțel inoxidabil. În general, toate produsele metalice electrice în contact cu apa sunt supuse atât coroziunii electrochimice, cât și galvanice. Electrocoroziunea apare în prezența curenților vagabonzi. Ca urmare, metalul este expus simultan curentului electric și apei, după care apar defecțiuni ale metalului, iar coroziunea începe să se răspândească de acolo.
Când două metale diferite intră în contact, dintre care unul este mai reactiv decât celălalt, ambele metale intră într-o reacție chimică. Apa pură este un foarte slab conductor de curent electric (dielectric), dar datorită concentrației mari de diverse impurități, apa se transformă într-un fel de electrolit.
Nu uitați că temperatura are o mare influență asupra conductivității electrice: cu cât temperatura apei este mai mare, cu atât mai bine conduce electricitatea. Acest fenomen este cunoscut sub numele de „coroziunea galvanică”, ea este cea care face metodic suportul pentru prosoape încălzit inutilizabil.
Necesitatea protecției anticorozive
Protejarea metalului de influențele care au un efect distructiv asupra suprafeței sale este una dintre sarcinile principale cu care se confruntă acei oameni care lucrează cu mecanisme, unități și mașini, nave și procese de construcție.

Cu cât un dispozitiv sau o piesă este utilizat mai activ, cu atât este mai probabil să fie expus la efectele distructive ale condițiilor atmosferice, lichide pe care le întâlnim în timpul funcționării.Multe ramuri ale științei și producției industriale lucrează la protejarea metalului împotriva coroziunii, dar principalele metode rămân neschimbate și constau în crearea de acoperiri de protecție:
- metal;
- nemetalice;
- chimic.
Acoperirile nemetalice sunt create folosind compuși organici și anorganici, principiul lor de funcționare este destul de eficient și diferă de alte tipuri de protecție. Pentru a crea protecție nemetalice în producția industrială și de construcții, se folosesc vopsele și lacuri, beton și bitum și compuși cu molecule înalte, care au fost adoptați în mod deosebit activ în ultimii ani, când chimia polimerilor a atins cote mari.

Chimia a contribuit la crearea straturilor de protecție prin metode:
- oxidare (crearea unei pelicule protectoare pe metal folosind filme de oxid);
- fosfatare (filme de fosfat);
- nitrurare (saturarea suprafeței oțelului cu azot);
- cimentare (compuși cu carbon);
- albăstruire (compuși cu substanțe organice);
- modificarea compoziției metalului prin introducerea de aditivi anticorozivi în el);
- modificarea mediului corosiv înconjurător prin introducerea de inhibitori care îl afectează.
Protecția împotriva coroziunii electrochimice este procesul invers al coroziunii electrochimice. În funcție de deplasarea potențialului metalului către partea pozitivă sau negativă, există protecție anodică și catodică. Prin conectarea unui protector sau a unei surse de curent continuu la un produs metalic, pe suprafața metalului se creează polarizare catodică, care împiedică distrugerea metalului prin anod.
Metodele de protecție electrochimică constau în două opțiuni:
- învelișul metalic este protejat de un alt metal, care are un potențial mai negativ (adică metalul protector este mai puțin stabil decât cel protejat), iar aceasta se numește anodizare;
- acoperirea este aplicată dintr-un metal mai puțin activ, iar apoi este și se numește catodic.

Protecția anticorozivă a anodului este, de exemplu, fier galvanizat. Până la epuizarea întregului zinc din stratul protector, fierul va fi relativ sigur.
Protecția catodică este placarea cu nichel sau placarea cu cupru. În acest caz, distrugerea stratului protector duce la distrugerea stratului pe care îl protejează. Atașarea unui protector pentru a proteja un produs metalic nu este diferită de reacția în alte cazuri. Protectorul acționează ca un anod, iar ceea ce se află sub protectoratul său rămâne intact, folosind condițiile create pentru acesta.
Ce este coroziunea
Procesul de distrugere a stratului superior al unui material metalic sub influența influențelor externe se numește coroziune în sens larg.

Termenul de coroziune în acest caz este doar o caracteristică a faptului că suprafața metalului intră într-o reacție chimică și își pierde proprietățile originale sub influența sa.
4 semne principale prin care puteți determina că acest proces există:
- un proces care se dezvoltă la suprafață și în cele din urmă pătrunde în produsul metalic;
- reacția apare spontan din faptul că stabilitatea echilibrului termodinamic dintre mediu și sistemul de atomi din aliaj sau monolit este perturbată;
- chimia percepe acest proces nu doar ca o reacție de distrugere, ci ca o reacție de reducere și oxidare: la intrarea într-o reacție, unii atomi îi înlocuiesc pe alții;
- proprietățile și caracteristicile metalului în timpul unei astfel de reacții suferă modificări semnificative sau se pierd acolo unde are loc.
Metode de protecție a metalelor
Coroziunea electrochimică este unul dintre principalele obstacole întâlnite în calea activității umane. Protecția împotriva impactului proceselor distructive și a fluxului acestora pe suprafața structurilor și structurilor este una dintre sarcinile permanente și urgente ale oricărei producții industriale și ale oricărei activități casnice a unei persoane.

Au fost dezvoltate mai multe metode de astfel de protecție și toate sunt utilizate în mod activ în ciclul de viață de zi cu zi:
- Protecție electrochimică - electrolitică conform principiului de funcționare, folosirea legilor chimice, protejează metalul folosind principiul anodului, catodului și benzii de rulare.
- Prelucrare electrospark folosind diverse instalații - fără contact, de contact, anod-mecanic.
- Pulverizarea cu arc electric este principalul avantaj în grosimea stratului aplicat și relativ ieftinitatea procesului.
- Tratamentul anticoroziv eficient este îndepărtarea contaminanților și curățarea suprafeței tratate, urmată de aplicarea unui strat anticoroziv și apoi a unui strat protector suplimentar pe suprafață.
Toate aceste metode au fost dezvoltate în procesul activității umane cu scopul de a proteja uneltele, vehiculele și mijloacele de transport la joncțiunea mai multor sectoare industriale, și folosind realizările științifice.
Coroziunea electrochimică, care este un proces natural de distrugere a suprafeței metalice sub influența factorilor de mediu neutri sau agresivi, este o problemă complexă. Întreprinderile de construcție de mașini, transport și industriale, vehiculele suferă pierderi din cauza acesteia. Și aceasta este o problemă care necesită rezolvare zilnică.
Tipuri de coroziune
În funcție de tipul de metal și de reacția redox care are loc cu acesta, coroziunea poate fi:
- uniformă sau neuniformă;
- local și punct (unele secțiuni din anumite motive au reacționat, în timp ce altele nu);
- ulcerativ, cunoscut și sub denumirea de pitting;
- subterană;
- cracare;
- intercristalin, care se ridică de-a lungul limitelor cristalului metalic.
De asemenea, în funcție de ce fel de factori externi afectează suprafața, coroziunea poate fi chimică și electrochimică. Coroziunea chimică apare ca urmare a unor reacții sub influența interacțiunilor chimice, dar fără participarea curentului electric și poate fi chiar inerentă petrolului și gazelor. Electrochimicul se distinge prin anumite procese, este mai complex decât chimic.

În videoclip: coroziunea metalelor.
Cauze și semne ale coroziunii electrochimice
Coroziunea electrochimică diferă de coroziunea chimică prin aceea că procesul de distrugere are loc în sistemul electrolitic, ceea ce determină apariția unui curent electric în interiorul acestui sistem. Două procese conjugate, anodic și catodic, duc la îndepărtarea atomilor instabili din rețeaua cristalină a metalului. În timpul procesului anodic, ionii intră în soluție, iar electronii din procesul anodic cad într-o capcană la o substanță oxidantă și sunt legați de un depolarizator.
Astfel, depolarizarea este îndepărtarea electronilor liberi din situsurile catodice, iar depolarizarea este substanța care este responsabilă pentru acest proces. Principalele reacții apar cu participarea hidrogenului și oxigenului ca depolarizatori.
Există multe exemple de coroziune electrochimică de diferite tipuri, care afectează suprafețele metalice în natură și sub influența diferitelor condiții. Hidrogenul funcționează într-un mediu acid, în timp ce oxigenul funcționează într-un mediu neutru.
Aproape toate metalele suferă coroziune electrochimică și, pe această bază, sunt împărțite în 4 grupuri, se determină valoarea potențialului electrodului lor:
- cele active corodează chiar și într-un mediu în care nu există agenți oxidanți;
- mediu activ intră într-o reacție de oxidare într-un mediu acid;
- cei inactivi nu reacţionează în absenţa agenţilor oxidanţi atât în mediul neutru, cât şi în cel acid;
- nu reacționează - stabilitate ridicată (metale nobile, paladiu, aur, platină, iridiu).
Dar aceeași reacție poate avea loc și în apă, în soluții de baze, săruri și acizi. În diferența foarte specializată de coroziune atmosferică, sol și aerare, se disting cele marine și biologice (care apar sub influența bacteriilor).
Există chiar și coroziune electrică, care are loc sub influența curentului electric și este rezultatul curenților paraziți care apar acolo unde curentul electric este folosit de o persoană pentru a desfășura anumite activități.
În acest caz, suprafața metalică omogenă este distrusă din cauza instabilității termodinamice față de mediu. Și eterogen - datorită compoziției rețelei cristaline, în care atomii unui metal sunt ținuți mai strânși decât atomii incluziunilor străine.Aceste reacții diferă în ceea ce privește viteza de ionizare a ionilor și reducerea componentelor oxidative ale mediului.
Distrugerea suprafețelor metalice în timpul coroziunii electrochimice constă în apariția simultană a două procese: anodic și catodic, iar diferențele dintre procese sunt că dizolvarea are loc la anozi, care sunt în contact cu mediul prin mulți microelectrozi care fac parte din suprafața oricărui metal și sunt închise pentru mine însumi.