Användningen av saltsyra
Saltsyra används i stor utsträckning inom industrin för att utvinna metaller ur malmer, betning av metaller etc. Den används också vid tillverkning av lödvätska, vid avsättning av silver och som en integrerad del av aqua regia.
Omfattningen av användningen av saltsyra i industrin är mindre än för salpetersyra. Detta beror på det faktum att saltsyra orsakar korrosion av stålutrustning. Dessutom är dess flyktiga ångor ganska skadliga och orsakar också korrosion av metallprodukter. Detta måste beaktas vid lagring av saltsyra. Saltsyra lagras och transporteras i gummiklädda tankar och fat, d.v.s. i kärl, vars inre yta är täckt med syrabeständigt gummi, samt i glasflaskor och polyetenredskap.
Saltsyra används för att producera klorider av zink, mangan, järn och andra metaller, samt ammoniumklorid. Saltsyra används för att rengöra ytorna på metaller, kärl, brunnar från karbonater, oxider och andra sediment och föroreningar. I det här fallet används speciella tillsatser - inhibitorer som skyddar metallen från upplösning och korrosion, men försenar inte upplösningen av oxider, karbonater och andra liknande föreningar.
HCl används i industriell produktion av syntetiska hartser, gummin. Det används som råmaterial vid tillverkning av metylklorid från metylalkohol, etylklorid från etylen och vinylklorid från acetylen.
Första hjälpen och behandlingsmetoder
Hittas tecken på förgiftning ska ambulans tillkallas. Hemma är det tillåtet att utföra aktiviteter som syftar till att förbättra tillståndet för offret. Första hjälpen vid saltsyraförgiftning bör utföras snabbt för att minska risken för negativa konsekvenser.
Evenemang:
- Om saltföreningen kommer på huden tvättas de skadade områdena med mycket kallt vatten. Handläggningstiden är minst en halvtimme.
- Vid berusning av ångor ges offret tillgång till frisk luft, fönster öppnas, åtsittande kläder knäpps upp.
- Det rekommenderas att övervaka patientens tillstånd, i avsaknad av tecken på liv utförs återupplivning.
- Offret från ångorna får dricka varmt te, vatten. Det rekommenderas att skölja näsa och mun med kallt vatten.
- I händelse av en överdos till följd av intag av syra, placeras en ispåse på buken för att förhindra eller minska eventuell blödning.
- Inga läkemedel är tillåtna. Det är tillåtet att ge patienten ett glas vatten (du kan mineralalkaliskt). Dricksvätska krävs i små klunkar.
- Det är inte tillåtet att tvätta magen, försök att framkalla kräkningar hemma. Sådan första hjälpen kan leda till utveckling av brännskador i halsen, blödning.
Behandling utförs i en medicinsk institution under överinseende av specialister.
Terapi:
- Rengör magen med en sond,
- Användning av droppar med medicinska lösningar,
- Förskrivning av mediciner för att lindra smärta
- Användning av läkemedel som syftar till att återställa funktionen hos organ och system,
- Om nödvändigt, inandning av syre och konstgjord ventilation av lungorna,
- Genomföra återupplivningsterapi i avsaknad av tecken på liv,
- Urval av vitaminer och specialnäring.
Behandlingen utförs på intensivvård och sedan på sjukhus. Varaktigheten beror på patientens tillstånd och graden av förgiftning.
Brännskador och förgiftning
Så effektivt som detta botemedel är, är det farligt. Saltsyra, beroende på koncentrationen, kan provocera fram kemiska brännskador på fyra grader:
- Det finns bara rodnad och smärta.
- Det finns blåsor med en klar vätska och svullnad.
- Bildade nekros av de övre skikten av huden.Blåsor fylls med blod eller grumligt innehåll.
- Lesionen når senor och muskler.
Om ämnet på något sätt kom in i ögonen är det nödvändigt att skölja dem med vatten och sedan med en sodalösning. Men i alla fall är det första du ska göra att ringa en ambulans.
Intaget av syra inuti är fyllt med akuta smärtor i bröstet och buken, svullnad av struphuvudet, kräkningar blodiga massor. Som ett resultat, allvarliga patologier i levern och njurarna.
Och de första tecknen på förgiftning i par inkluderar en torr frekvent hosta, kvävning, skador på tänderna, sveda i slemhinnorna och buksmärtor. Första nödhjälpen är att tvätta och skölja munnen med vatten, samt tillgång till frisk luft. Endast en toxikolog kan ge verklig hjälp.
Det kemiska spektrumets egenskaper
Syra interagerar med många metaller, salter. Den anses vara ganska stark och är i nivå med sämskskinn. Huvudreaktionen manifesterar sig i alla grupper av metaller som ligger till vänster om väte (magnesium, järn, zink - elektriska potentialer).
Klorvätelösning i utspädd form reagerar med salter, men endast med de som bildas av mindre starka syror. Kända för alla natrium- och kalciumkarbonat, efter interaktion med det, sönderdelas de till vatten och kolmonoxid.
Salpetersyra
- en kvalitativ reaktion på saltlösning. För att erhålla det är det nödvändigt att tillsätta silvernitrat till detta reagens, som ett resultat kommer en vit fällning att bildas, från vilken en kvävesubstans erhålls.
Med hjälp av denna blandning av vatten och väte genomförs många intressanta experiment. Späd till exempel med ammoniak. Som ett resultat kommer du att få vit rök, tjock, med konsistensen av små kristaller. Metylamin, anilin, mangandioxid, kaliumkarbonat är reagenser som också påverkas av syra.
Hur och varför används det
Kanske är detta med rätta ett av de viktiga ämnena som finns och är nödvändiga i nästan alla grenar av mänskligt liv.
Applikationsområdets lokalisering:
- Metallurgi. Ytrengöring från oxiderade områden, rostupplösning, förlödningsbehandling, förtenning. Saltsyra hjälper till att extrahera små inneslutningar av metaller från malmer. Zirkonium och titan erhålls med metoden att omvandla oxider till klorider.
- Livsmedelsteknikindustrin. En lågkoncentrationslösning används som livsmedelstillsats. Gelatin, fruktos för diabetiker innehåller ett rent emulgeringsmedel. Vanlig läsk har också ett högt innehåll av detta ämne. På varornas förpackning ser du det under namnet E507.
- Medicinens område. Med en otillräcklig indikator på den sura miljön i magen och problem med tarmarna. Lågt pH leder till cancer. Även med rätt näring, vitaminer i överflöd, försvinner inte faran, det är nödvändigt att utföra tester för att få juice från magkanalen, för i en otillräckligt sur miljö absorberas användbara ämnen praktiskt taget inte, matsmältningen störs.
- Saltlösning används som en inhibitor - skydd mot smuts och infektioner, antiseptisk verkan. För tillverkning av limblandningar, keramiska produkter. Den spolar värmeväxlare.
- Förfarandet för att rena dricksvatten är inte heller komplett utan medverkan av klor.
- Tillverkning av gummi, blekning av tygunderlag.
- Du kan ta hand om dina linser med denna lösning.
- Munvatten hemma
- Ämnet är en utmärkt ledare av elektricitet.
Hur förgiftning uppstår
Saltsyra är en färglös vätska med en karakteristisk stickande lukt. En av de starkaste syrorna som kan lösa upp vissa metaller. Förvandlas lätt till en gas.
Klorväte används i textilindustrin, läderbranschen, metallurgi av ädla metaller, vid tillverkning av lim, syror.
Ämnet finns i magen i minimal koncentration. Syra bidrar till normalisering av matsmältningsprocessen, skyddar kroppen från skadliga bakterier och mikroorganismer.
Vid en koncentration som överstiger 24 % kan saltsyra orsaka irreversibel skada på människokroppen. Ångor som bildas vid kontakt med luft orsakar irritation av organen i syn- och andningsorganen.
Det finns flera faktorer som kan provocera utvecklingen av förgiftning.
Faktorer:
Ångförgiftning är möjlig vid arbete i rum med dålig ventilation,
Förtäring av oaktsamhet, vanligare hos barn,
Inträngande av saltsyra på epidermis, slemhinnor i händelse av bristande efterlevnad av reglerna för användning av reagenset.
Förgiftning av ett ämne hemma hos vuxna uppstår som ett resultat av användning utan skyddsutrustning för hud, ögon och organ i andningsorganen. Berusning kan uppstå när syra överförs på ett felaktigt sätt från en behållare till en annan.
Farmakodynamik och farmakokinetik
Vad är magsyra? Detta är ett kännetecken för koncentrationen av saltsyra i magen. Surhet uttrycks i pH
. Normalt bör syra produceras i sammansättningen av magsaft och ta en aktiv del i matsmältningsprocesserna. Formel för saltsyra: HCl
. Det produceras av parietalceller som finns i funduskörtlarna, med deltagande av H+/K+-ATPas
. Dessa celler kantar fundus och magkropp. Surheten i magsaften i sig är variabel och beror på antalet parietalceller och intensiteten i processerna för neutralisering av ämnet av de alkaliska komponenterna i magsaften. Koncentration produceras till - du är stabil och lika med 160 mmol/l. En frisk person bör normalt inte producera mer än 7 och minst 5 mmol av ett ämne per timme.
Med otillräcklig eller överdriven produktion av saltsyra uppstår sjukdomar i matsmältningskanalen, förmågan att absorbera vissa mikroelement, såsom järn, försämras. Läkemedlet stimulerar utsöndringen av magsaft, minskar pH
. Aktiveras pepsinogen
, omvandlar det till ett aktivt enzym pepsin
. Ämnet har en gynnsam effekt på syrareflexen i magen, saktar ner övergången av ofullständigt smält mat till tarmarna. Processerna för jäsning av innehållet i matsmältningskanalen saktar ner, smärta och rapningar försvinner, järn absorberas bättre.
Efter oral administrering metaboliseras läkemedlet delvis av saliv och magslem, innehållet i tolvfingertarmen 12. Det obundna ämnet tränger in i tolvfingertarmen, där det helt neutraliseras av dess alkaliska innehåll.
En annan användning av syra i vardagen
Med en sur sammansättning kan du enkelt rengöra kalk och rost från fajans VVS, ta bort urinsten och andra föroreningar. För en större effekt tillsätts en inhibitor (till exempel urotropin) till medlet, vilket bromsar den kemiska reaktionen.
Förfarandet utförs enligt följande: syran späds med vatten tills en koncentration av 5 % uppnås och en inhibitor tillsätts med en hastighet av 0,5 g per 1 liter vätska. Ytan behandlas med den resulterande kompositionen och lämnas i 30-40 minuter (beroende på graden av förorening), varefter den tvättas med vatten.
En mild syralösning används också för att ta bort bärfläckar, bläck eller rostfläckar från tyger. För att göra detta blötläggs materialet i kompositionen ett tag, varefter det sköljs noggrant och tvättas på vanligt sätt.
Att bli av med kalk i vattenkokaren
För detta ändamål används en 3-5% saltsyralösning, som hälls i en vattenkokare och värms till 60-80°
C i 1-2 timmar eller tills kalkavlagringar sönderfaller. Därefter lossnar fjället och tas enkelt bort med en träspatel.
Metodens effektivitet beror på det faktum att reagenset reagerar med magnesium- och kalciumkarbonater och omvandlar dem till lösliga salter. Koldioxiden som frigörs samtidigt förstör skalskiktet och gör det löst. Efter att ha tagit bort saltavlagringar tvättas disken noggrant med rent vatten.
Viktig poäng!
Denna metod är inte lämplig för avkalkning av flisad och sprucken emalj eller aluminiumgrytor: detta kommer att fräta metallen och skada den allvarligt.
Att få ett ämne
Nu kan vi prata om vad de gör för att bilda saltsyra.
Först, genom att bränna väte i klor, erhålls huvudkomponenten, gasformig väteklorid. som sedan löses i vatten. Resultatet av denna enkla reaktion är bildandet av en syntetisk syra.
Detta ämne kan också erhållas från avgaser. Dessa är kemiska avfallsgaser. De bildas av en mängd olika processer. Till exempel vid klorering av kolväten. Vätekloriden i deras sammansättning kallas avgas. Och den sålunda erhållna syran resp.
Det bör noteras att under senare år har avgasämnets andel av den totala volymen av dess produktion ökat. Och syran som bildas till följd av att väte förbränns i klor förskjuts. Men i rättvisans namn bör det noteras att det innehåller färre föroreningar.
Produktionsanvändning
Den har en bred tillämpning inom metallurgisk, livsmedels- och medicinsk industri.
- Metallurgi. Används vid lödning, förtenning och rengöring av metaller.
- Livsmedelsindustrin. Användning vid produktion av surhetsreglerande medel för livsmedel, till exempel E507.
- Elektrotyp. Används för betning.
- Medicin. Det finner sin tillämpning vid produktion av konstgjord magsaft.
Ingår i syntetiska färgämnen. Det används vid tillverkning av rengörings- och rengöringsmedel. Men i vätskor avsedda för hushållsbruk är koncentrationen av svavelsyra försumbar.
Hur saltsyra framställs i laboratoriet
Tillverkningen av ämnet är storskalig, försäljningen är gratis. Under betingelserna för laboratorieexperiment produceras en lösning genom inverkan av högkoncentrationssvavelsyra på vanligt kökssalt (natriumklorid).
Det finns två metoder för att lösa klorväte i vatten:
- Väte förbränns i klor (syntetiskt).
- Tillhörande (avgas). Dess väsen är att utföra organisk klorering, dehydroklorering.
Ämnet lämpar sig väl för syntes under pyrolys av avfall från klororganiskt. Detta sker som ett resultat av nedbrytning av kolväten med fullständig syrebrist. Du kan också använda metallklorider, som är råvaror av oorganiska ämnen. Om det inte finns någon koncentrerad svavelsyra (elektrolyt), ta utspädd.
När det gäller utvinning av reagenset under naturliga förhållanden, kan denna kemiska blandning oftast hittas i vattnet i vulkaniskt avfall. Klorväte är en komponent i mineralerna sylvin (kaliumklorid, ser ut som ben för spel), bischofit. Allt detta är metoder för att utvinna ämnet i industrin.
Hos människor finns detta enzym i magen. En lösning kan vara antingen en syra eller en bas. En av de vanligaste metoderna för extraktion kallas sulfat.
Kemiska egenskaper
Saltsyra, väteklorid eller saltsyra - lösning HCl
i vatten. Enligt Wikipedia tillhör ämnet gruppen oorganiska starka monobasiska to-t. Sammansättningens fullständiga namn på latin: saltsyra.
Formel för saltsyra i kemi: HCl
. I en molekyl kombineras väteatomer med halogenatomer - Cl
. Om vi betraktar den elektroniska konfigurationen av dessa molekyler, kan det noteras att föreningar deltar i bildandet av molekylära orbitaler 1s
-väteorbitaler och båda 3s
och 3p
-orbitaler av en atom Cl
. I den kemiska formeln för saltsyra 1s-
, 3s-
och 3r
-atomära orbitaler överlappar varandra och bildar 1, 2, 3 orbitaler. Vart i 3s
-orbital är inte bindande. Det sker en förskjutning av elektrondensiteten till atomen Cl
och molekylens polaritet minskar, men bindningsenergin för molekylära orbitaler ökar (om vi betraktar det tillsammans med andra vätehalogenider
).
Fysikaliska egenskaper hos klorväte. Det är en klar, färglös vätska som ryker när den utsätts för luft. Molvikt av en kemisk förening = 36,6 gram per mol. Under standardförhållanden, vid en lufttemperatur på 20 grader Celsius, är den maximala koncentrationen av ett ämne 38 viktprocent. Densiteten för koncentrerad saltsyra i denna typ av lösning är 1,19 g/cm³. I allmänhet gäller fysikaliska egenskaper och egenskaper såsom densitet, molaritet, viskositet, värmekapacitet, kokpunkt och pH
, starkt beroende av koncentrationen av lösningen. Dessa värden diskuteras mer i detalj i tabellen över densiteter. Till exempel, densiteten av saltsyra 10% = 1,048 kg per liter. När det stelnat bildas ämnet kristallina hydrater
olika sammansättningar.
Kemiska egenskaper hos saltsyra. Vad reagerar saltsyra med? Ämnet interagerar med metaller som står framför väte i en serie elektrokemiska potentialer (järn, magnesium, zink och andra). I detta fall bildas salter och gasformiga H
. Bly, koppar, guld, silver och andra metaller till höger om väte reagerar inte med saltsyra. Ämnet reagerar med metalloxider och bildar vatten och ett lösligt salt. Natriumhydroxid under inverkan av till-dig-former och vatten. Neutralisationsreaktionen är karakteristisk för denna förening.
Utspädd saltsyra reagerar med metallsalter, som bildas av svagare syror. Till exempel, propionsyra
svagare än salt. Ämnet reagerar inte med starkare syror. och natriumkarbonat
kommer att bildas efter reaktion med HCl
klorid, kolmonoxid och vatten.
För en kemisk förening är reaktioner med starka oxidationsmedel karakteristiska, med mangandioxid
, kaliumpermanganat
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. Ämnet reagerar med ammoniak
, som producerar tjock vit rök, som består av mycket små kristaller av ammoniumklorid. Mineralet pyrolusit reagerar även med saltsyra, eftersom det innehåller mangandioxid
: MnO2+4HCl=Cl2+MnO2+2H2O
(oxidationsreaktion).
Det finns en kvalitativ reaktion på saltsyra och dess salter. När ett ämne interagerar med silvernitrat
en vit fällning silverklorid
och bildades salpetersyra
. Interaktionsreaktionsekvation metylamin
med väteklorid ser ut så här: HCl + CH3NH2 = (CH3NH3)Cl
.
Ett ämne reagerar med en svag bas anilin
. Efter att ha löst anilin i vatten tillsätts saltsyra till blandningen. Som ett resultat löses basen och bildas anilinhydroklorid
(fenylammoniumklorid
): (C6N5NH3)Cl
. Reaktionen av interaktion av aluminiumkarbid med saltsyra: Al4C3+12HCL=3CH4+4AlCl3
. Reaktionsekvation kaliumkarbonat
som det ser ut så här: K2CO3 + 2HCl = 2KCl + H2O + CO2.
Ansökan
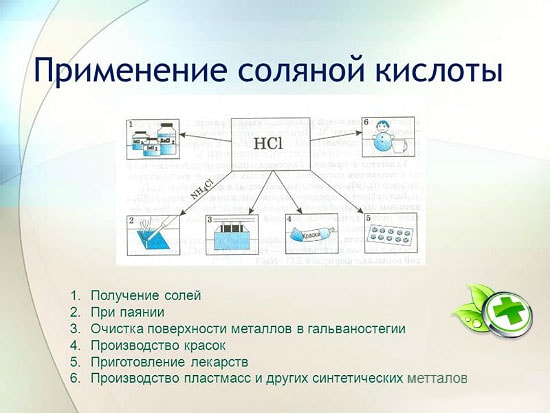
inom metallurgi för utvinning av malm, avlägsnande av rost, glödskal, smuts och oxider, lödning och förtenning;
vid tillverkning av syntetiska gummin och hartser;
vid elektroplätering;
som surhetsreglerande medel inom livsmedelsindustrin;
för att erhålla metallklorider;
för att erhålla klor;
inom medicin för behandling av otillräcklig surhet i magsaft;
som rengöringsmedel och desinfektionsmedel.
- (HCl), en vattenlösning av väteklorid, en färglös gas med en stickande lukt. Erhålls genom inverkan av svavelsyra på vanligt salt, som en biprodukt av klorering av kolväten, eller genom reaktion av väte och klor. Saltsyra används för ... ... Vetenskaplig och teknisk encyklopedisk ordbok
Saltsyra
- - HCl (SC) (saltsyra, saltsyra, väteklorid) är en lösning av väteklorid (HCl) i vatten, en frostskyddsmedelstillsats. Det är en färglös vätska med en stickande lukt, utan suspenderade partiklar ... ... Encyklopedi med termer, definitioner och förklaringar av byggmaterial
SALTSYRA
- (saltsyra) lösning av väteklorid i vatten; stark syra. En färglös vätska som ryker i luften (teknisk saltsyra är gulaktig på grund av föroreningar av Fe, Cl2, etc.). Den maximala koncentrationen (vid 20 ° C) är 38 viktprocent, ... ... Big Encyclopedic Dictionary
SALTSYRA
- (Acidum muriaticum, Acid, hydrochloricum), en lösning av väteklorid (HC1) i vatten. I naturen förekommer det i vattnet från vissa källor av vulkaniskt ursprung och finns också i magsaft (upp till 0,5%). Klorväte kan erhållas ... Big Medical Encyclopedia
SALTSYRA
- (saltsyra, saltsyra) en stark monobasisk flyktig syra med en skarp lukt, en vattenlösning av väteklorid; den maximala koncentrationen är 38 viktprocent, densiteten för en sådan lösning är 1,19 g/cm3. Används i ... ... ryska uppslagsverket om arbetarskydd
SALTSYRA
- (saltsyra) HCl vattenlösning av väteklorid, stark monobasisk syra, flyktig, med en stickande lukt; föroreningar av järn, klor fläckar det gulaktigt. Den koncentrerade S. att sälja innehåller 37% ... ... Big Polytechnic Encyclopedia
saltsyra
— substantiv, antal synonymer: 1 syra (171) ASIS Synonymordbok. V.N. Trishin. 2013 ... Synonymordbok
SALTSYRA
Modern Encyclopedia
Saltsyra
- VÄTESYRA, vattenlösning av väteklorid HCl; en rykande vätska med en stickande lukt. Saltsyra används för att erhålla olika klorider, betning av metaller, bearbetning av malmer, vid framställning av klor, soda, gummi, etc. ... ... Illustrated Encyclopedic Dictionary
saltsyra
- (saltsyra), en lösning av väteklorid i vatten; stark syra. En färglös vätska som "ryker" i luften (teknisk saltsyra är gulaktig på grund av föroreningar av Fe, Cl2, etc.). Maximal koncentration (vid 20 ° C) 38 viktprocent, ... ... Encyclopedic Dictionary
Vad är faran för berusning
Saltsyra är en särskild fara för människokroppen. Vid förgiftning med ett sådant ämne kan allvarliga komplikationer och kränkningar av kroppens funktionalitet utvecklas.
Komplikationer:
- Brott mot levern, som ett resultat av giftig hepatit,
- blödning i magen på grund av de förstörda väggarna i organet,
- Ett tillstånd av chock från smärta när syra kommer in i ett stort område,
- Vid kontakt med ögonen, synnedsättning,
- Allvarlig funktionsstörning i njurarna,
- Andningssvikt, kvävning, andnöd,
- Utvecklingen av koma.
Liknande konsekvenser utvecklas gradvis beroende på graden av förgiftning.
Slutsats
Om du följer försiktighetsåtgärderna och säkerhetsreglerna kommer saltsyra att bli en oumbärlig assistent i vardagen. Och du kan köpa det till de mest överkomliga priserna i vårt företag.
Som syror. Utbildningsprogrammet ger eleverna möjlighet att memorera namnen och formlerna för sex representanter för denna grupp. Och när du tittar igenom tabellen i läroboken märker du i listan över syror den som kommer först och som intresserade dig i första hand - saltsyra. Tyvärr, i klassrummet på skolan studeras varken fastigheten eller någon annan information om den. Därför söker de som är sugna på att få kunskap utanför skolans läroplan ytterligare information i alla möjliga källor. Men ofta hittar många inte den information de behöver. Och så är ämnet för dagens artikel tillägnat just denna syra.
Definition
Saltsyra är en stark monobasisk syra. I vissa källor kan det kallas saltsyra och saltsyra, samt väteklorid.
Fysikaliska egenskaper
Det är en färglös och rykande frätande vätska i luften (foto till höger). Teknisk syra har dock en gulaktig färg på grund av närvaron av järn, klor och andra tillsatser i den. Dess största koncentration vid en temperatur på 20 ° C är 38%. Densiteten för saltsyra med sådana parametrar är 1,19 g/cm 3 . Men denna förening i olika grader av mättnad har helt andra data.Med en minskning av koncentrationen minskar det numeriska värdet av molaritet, viskositet och smältpunkt, men den specifika värmekapaciteten och kokpunkten ökar. Solidifiering av saltsyra av vilken koncentration som helst ger olika kristallina hydrater.
Kemiska egenskaper
Alla metaller som kommer före väte i den elektrokemiska serien av deras spänning kan interagera med denna förening, bilda salter och frigöra vätgas. Om de ersätts med metalloxider kommer reaktionsprodukterna att vara lösligt salt och vatten. Samma effekt kommer att vara i växelverkan mellan saltsyra och hydroxider. Om emellertid något salt av metaller (till exempel natriumkarbonat) tillsätts, vars återstod togs från en svagare syra (kolsyra), då klorid av denna metall (natrium), vatten och gas som motsvarar syran rester (i detta fall koldioxid) bildas.
Mottagande
Den nu diskuterade föreningen bildas när vätekloridgas, som kan erhållas genom att bränna väte i klor, löses i vatten. Saltsyra, som erhölls med denna metod, kallas syntetisk. Avgaser kan också tjäna som en källa för att erhålla detta ämne. Och sådan saltsyra kommer att kallas avgassyra. Nyligen har produktionen av saltsyra med denna metod varit mycket högre än dess produktion med en syntetisk metod, även om den senare ger föreningen i en renare form. Dessa är alla sätt att få det i industrin. Men i laboratorier produceras saltsyra på tre sätt (de två första skiljer sig endast i temperatur och reaktionsprodukter) med hjälp av olika typer av kemiska interaktioner, såsom:
- Effekt av mättad svavelsyra på natriumklorid vid en temperatur av 150 o C.
- Interaktionen mellan ovanstående ämnen under förhållanden med en temperatur på 550 ° C och över.
- Hydrolys av aluminium- eller magnesiumklorider.
Ansökan
Hydrometallurgi och elektroformning klarar sig inte utan användning av saltsyra, där det behövs, för att rengöra ytan från metaller under förtenning och lödning och för att erhålla klorider av mangan, järn, zink och andra metaller. Inom livsmedelsindustrin är denna förening känd som livsmedelstillsats E507 - där är det en surhetsreglerande medel som behövs för att göra seltzer (soda) vatten. Koncentrerad saltsyra finns också i magsaften hos någon person och hjälper till att smälta mat. Under denna process minskar dess mättnadsgrad, eftersom. denna komposition späds ut med mat. Men med långvarig fasta ökar koncentrationen av saltsyra i magen gradvis. Och eftersom denna förening är mycket frätande, kan den leda till magsår.
Slutsats
Saltsyra kan vara både nyttigt och skadligt för människor. Dess kontakt med huden leder till allvarliga kemiska brännskador, och ångorna från denna förening irriterar luftvägarna och ögonen.
Men om du hanterar detta ämne försiktigt kan det komma till nytta mer än en gång