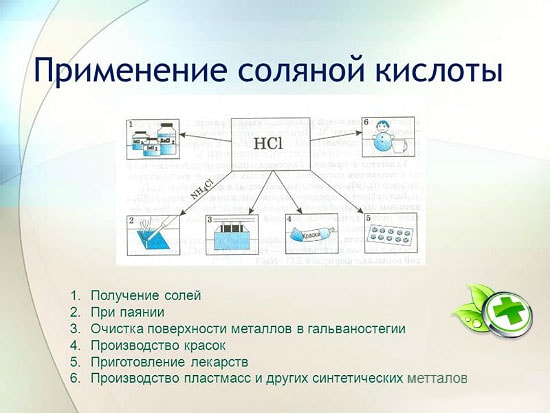
Ang paggamit ng hydrochloric acid
Ang hydrochloric acid ay malawakang ginagamit sa industriya para sa pagkuha ng mga metal mula sa ores, pag-aatsara ng mga metal, atbp. Ginagamit din ito sa paggawa ng paghihinang likido, sa pag-deposito ng pilak, at bilang isang mahalagang bahagi ng aqua regia.
Ang sukat ng paggamit ng hydrochloric acid sa industriya ay mas mababa kaysa sa nitric acid. Ito ay dahil sa ang katunayan na ang hydrochloric acid ay nagiging sanhi ng kaagnasan ng mga kagamitan sa bakal. Bilang karagdagan, ang mga pabagu-bago ng singaw nito ay medyo nakakapinsala at nagdudulot din ng kaagnasan ng mga produktong metal. Dapat itong isaalang-alang kapag nag-iimbak ng hydrochloric acid. Ang hydrochloric acid ay iniimbak at dinadala sa mga tanke at bariles na may linya ng goma, i.e. sa mga sisidlan, ang panloob na ibabaw nito ay natatakpan ng goma na lumalaban sa acid, gayundin sa mga bote ng salamin at mga kagamitang polyethylene.
Ang hydrochloric acid ay ginagamit upang makagawa ng mga chlorides ng zinc, manganese, iron at iba pang mga metal, pati na rin ang ammonium chloride. Ang hydrochloric acid ay ginagamit upang linisin ang mga ibabaw ng mga metal, sisidlan, mga balon mula sa mga carbonate, oxide at iba pang mga sediment at contaminants. Sa kasong ito, ginagamit ang mga espesyal na additives - mga inhibitor na nagpoprotekta sa metal mula sa paglusaw at kaagnasan, ngunit hindi antalahin ang paglusaw ng mga oxide, carbonate at iba pang katulad na mga compound.
Ang HCl ay ginagamit sa pang-industriyang produksyon ng mga sintetikong resin, rubber. Ginagamit ito bilang hilaw na materyal sa paggawa ng methyl chloride mula sa methyl alcohol, ethyl chloride mula sa ethylene, at vinyl chloride mula sa acetylene.
Mga paraan ng pangunang lunas at paggamot
Kung may nakitang mga palatandaan ng pagkalason, dapat tumawag ng ambulansya. Sa bahay, pinapayagan na magsagawa ng mga aktibidad na naglalayong mapabuti ang kalagayan ng biktima. Ang pangunang lunas para sa pagkalason ng hydrochloric acid ay dapat na isagawa nang mabilis upang mabawasan ang panganib ng mga negatibong kahihinatnan.
Mga kaganapan:
- Kung ang tambalan ng asin ay nakukuha sa balat, ang mga nasirang lugar ay hinuhugasan ng maraming malamig na tubig. Ang oras ng pagproseso ay hindi bababa sa kalahating oras.
- Sa kaso ng pagkalasing sa mga singaw, ang biktima ay binibigyan ng access sa sariwang hangin, binuksan ang mga bintana, ang mga masikip na damit ay hindi naka-button.
- Inirerekomenda na subaybayan ang kondisyon ng pasyente, sa kawalan ng mga palatandaan ng buhay, ang resuscitation ay isinasagawa.
- Ang biktima mula sa mga singaw ay pinahihintulutan na uminom ng mainit na tsaa, tubig. Inirerekomenda na banlawan ang ilong at bibig ng malamig na tubig.
- Sa kaso ng labis na dosis na nagreresulta mula sa paglunok ng acid, isang ice pack ang inilalagay sa tiyan upang maiwasan o mabawasan ang posibleng pagdurugo.
- Hindi pinapayagan ang mga produktong panggamot. Pinapayagan na bigyan ang pasyente ng isang baso ng tubig (maaari kang mineral alkaline). Ang pag-inom ng likido ay kinakailangan sa maliliit na sips.
- Hindi pinapayagan na hugasan ang tiyan, subukang pukawin ang pagsusuka sa bahay. Ang ganitong pangunang lunas ay maaaring humantong sa pag-unlad ng mga paso sa lalamunan, pagdurugo.
Ang paggamot ay isinasagawa sa isang institusyong medikal sa ilalim ng pangangasiwa ng mga espesyalista.
Therapy:
- Nililinis ang tiyan gamit ang isang probe,
- Paggamit ng mga dropper na may mga solusyong panggamot,
- Pagrereseta ng mga gamot para maibsan ang pananakit
- Ang paggamit ng mga gamot na naglalayong ibalik ang paggana ng mga organo at sistema,
- Kung kinakailangan, paglanghap ng oxygen at artipisyal na bentilasyon ng mga baga,
- Ang pagsasagawa ng resuscitation therapy sa kawalan ng mga palatandaan ng buhay,
- Pagpili ng mga bitamina at espesyal na nutrisyon.
Ang paggamot ay isinasagawa sa intensive care, at pagkatapos ay sa isang ospital. Ang tagal ay depende sa kondisyon ng pasyente at sa antas ng pagkalason.
Mga paso at pagkalason
Kung gaano kabisa ang lunas na ito, ito ay mapanganib. Ang hydrochloric acid, depende sa konsentrasyon, ay maaaring makapukaw ng mga pagkasunog ng kemikal na apat na degree:
- Ang pamumula at sakit lamang ang mayroon.
- May mga paltos na may malinaw na likido at pamamaga.
- Nabuo ang nekrosis ng itaas na mga layer ng balat.Ang mga paltos ay puno ng dugo o maulap na nilalaman.
- Ang sugat ay umabot sa mga tendon at kalamnan.
Kung ang sangkap sa paanuman ay nakapasok sa mga mata, kinakailangan na banlawan ang mga ito ng tubig, at pagkatapos ay may solusyon sa soda. Ngunit sa anumang kaso, ang unang bagay na dapat gawin ay tumawag ng ambulansya.
Ang paglunok ng acid sa loob ay puno ng matinding pananakit sa dibdib at tiyan, pamamaga ng larynx, pagsusuka ng madugong masa. Bilang isang resulta, malubhang pathologies ng atay at bato.
At ang mga unang palatandaan ng pagkalason sa mga pares ay kinabibilangan ng isang tuyo na madalas na ubo, nabulunan, pinsala sa mga ngipin, nasusunog sa mauhog na lamad at sakit ng tiyan. Ang unang pang-emerhensiyang tulong ay ang paghuhugas at pagbabanlaw ng bibig ng tubig, pati na rin ang pag-access sa sariwang hangin. Tanging isang toxicologist lamang ang makakapagbigay ng tunay na tulong.
Mga katangian ng spectrum ng kemikal
Nakikipag-ugnayan ang acid sa maraming metal, asin. Ito ay itinuturing na medyo malakas at katumbas ng chamois. Ang pangunahing reaksyon ay nagpapakita ng sarili sa lahat ng mga grupo ng mga metal na matatagpuan sa kaliwa ng hydrogen (magnesium, iron, zinc - mga potensyal na elektrikal).
Ang hydrogen chloride solution sa dilute form ay tumutugon sa mga asing-gamot, ngunit sa mga nabuo lamang ng hindi gaanong malakas na mga acid. Kilala sa lahat ng sodium at calcium carbonate, pagkatapos ng pakikipag-ugnayan dito, nabubulok sila sa tubig at carbon monoxide.
Nitric acid
- isang husay na reaksyon sa solusyon ng asin. Upang makuha ito, kinakailangan upang magdagdag ng pilak na nitrate sa reagent na ito, bilang isang resulta, isang puting namuo ang bubuo, kung saan nakuha ang isang nitrogen substance.
Sa tulong ng pinaghalong tubig at hydrogen na ito, maraming mga kagiliw-giliw na eksperimento ang isinasagawa. Halimbawa, palabnawin ito ng ammonia. Bilang resulta, makakakuha ka ng puting usok, makapal, na may pagkakapare-pareho ng maliliit na kristal. Methylamine, aniline, manganese dioxide, potassium carbonate ay mga reagents na apektado din ng acid.
Paano at bakit ito ginagamit
Marahil, ito ay nararapat na isa sa mga mahahalagang sangkap na matatagpuan at kinakailangan sa halos lahat ng sangay ng buhay ng tao.
Lokalisasyon ng lugar ng aplikasyon:
- Metalurhiya. Paglilinis ng ibabaw mula sa mga na-oxidized na lugar, paglusaw ng kalawang, paggamot sa pre-soldering, tinning. Ang hydrochloric acid ay tumutulong upang kunin ang maliliit na inklusyon ng mga metal mula sa mga ores. Ang zirconium at titanium ay nakuha gamit ang paraan ng pag-convert ng mga oxide sa chlorides.
- Industriya ng teknolohiya ng pagkain. Ang isang mababang konsentrasyon na solusyon ay ginagamit bilang isang additive ng pagkain. Ang gelatin, fructose para sa mga diabetic ay naglalaman ng purong emulsifier. Ang ordinaryong soda ay mayroon ding mataas na nilalaman ng sangkap na ito. Sa packaging ng mga kalakal makikita mo ito sa ilalim ng pangalang E507.
- Ang larangan ng medisina. Na may hindi sapat na tagapagpahiwatig ng acidic na kapaligiran sa tiyan at mga problema sa bituka. Ang mababang Ph ay humahantong sa kanser. Kahit na may wastong nutrisyon, ang mga bitamina sa kasaganaan, ang panganib ay hindi nawawala, kinakailangan na magsagawa ng mga pagsubok upang makakuha ng juice mula sa gastric tract, dahil sa isang hindi sapat na acidic na kapaligiran, ang mga kapaki-pakinabang na sangkap ay halos hindi nasisipsip, ang panunaw ay nabalisa.
- Ang solusyon sa asin ay ginagamit bilang isang inhibitor - proteksyon laban sa dumi at mga impeksyon, antiseptikong pagkilos. Para sa paggawa ng mga malagkit na mixtures, mga produktong ceramic. Nag-flush ito ng mga heat exchanger.
- Ang pamamaraan para sa paglilinis ng inuming tubig ay hindi rin kumpleto nang walang paglahok ng murang luntian.
- Produksyon ng goma, pagpapaputi ng mga base ng tela.
- Maaari mong pangalagaan ang iyong mga lente gamit ang solusyon na ito.
- Mouthwash sa bahay
- Ang sangkap ay isang mahusay na konduktor ng kuryente.
Paano nangyayari ang pagkalason
Ang hydrochloric acid ay isang walang kulay na likido na may katangian na masangsang na amoy. Isa sa pinakamalakas na acid, na may kakayahang matunaw ang ilang mga metal. Madaling nagiging gas.
Ginagamit ang hydrogen chloride sa industriya ng tela, negosyo ng katad, metalurhiya ng mga mahalagang metal, sa paggawa ng pandikit, mga acid.
Ang sangkap ay naroroon sa tiyan sa kaunting konsentrasyon. Ang acid ay nag-aambag sa normalisasyon ng proseso ng pagtunaw, pinoprotektahan ang katawan mula sa mga nakakapinsalang bakterya at mikroorganismo.
Sa isang konsentrasyon na higit sa 24%, ang hydrochloric acid ay maaaring magdulot ng hindi maibabalik na pinsala sa katawan ng tao. Ang mga singaw na nabuo kapag nadikit sa hangin ay nagdudulot ng pangangati sa mga organo ng visual at respiratory system.
Mayroong ilang mga kadahilanan na maaaring makapukaw ng pag-unlad ng pagkalason.
Mga salik:
Posible ang pagkalasing sa singaw kapag nagtatrabaho sa mga silid na may mahinang bentilasyon,
Paglunok sa pamamagitan ng kapabayaan, mas karaniwan sa mga bata,
Ang pagpasok ng hydrochloric acid sa epidermis, mauhog lamad sa kaso ng hindi pagsunod sa mga patakaran para sa paggamit ng reagent.
Ang pagkalason ng isang sangkap sa bahay sa mga nasa hustong gulang ay nangyayari bilang resulta ng paggamit nang walang kagamitan sa proteksyon ng balat, mata, at mga organo ng respiratory system. Maaaring mangyari ang pagkalasing kapag ang acid ay hindi tumpak na inilipat mula sa isang lalagyan patungo sa isa pa.
Pharmacodynamics at pharmacokinetics
Ano ang gastric acidity? Ito ay isang katangian ng konsentrasyon ng hydrochloric acid sa tiyan. Ang kaasiman ay ipinahayag sa pH
. Karaniwan, ang acid ay dapat gawin sa komposisyon ng gastric juice at aktibong bahagi sa mga proseso ng panunaw. Formula ng hydrochloric acid: HCl
. Ito ay ginawa ng mga parietal cells na matatagpuan sa fundic glands, na may partisipasyon ng H+/K+-ATPase
. Ang mga cell na ito ay nakahanay sa fundus at katawan ng tiyan. Ang kaasiman ng gastric juice mismo ay variable at depende sa bilang ng mga parietal cells at ang intensity ng mga proseso ng neutralization ng substance ng mga alkaline na bahagi ng gastric juice. Konsentrasyon na ginawa sa - ikaw ay matatag at katumbas ng 160 mmol/l. Ang isang malusog na tao ay dapat na karaniwang gumagawa ng hindi hihigit sa 7 at hindi bababa sa 5 mmol ng isang sangkap kada oras.
Sa hindi sapat o labis na produksyon ng Hydrochloric Acid, nangyayari ang mga sakit sa digestive tract, ang kakayahang sumipsip ng ilang microelement, tulad ng iron, ay lumalala. Pinasisigla ng gamot ang pagtatago ng gastric juice, binabawasan pH
. Nag-activate pepsinogen
, ginagawa itong aktibong enzyme pepsin
. Ang sangkap ay may kapaki-pakinabang na epekto sa acid reflex ng tiyan, pinapabagal ang paglipat ng hindi kumpletong natutunaw na pagkain sa mga bituka. Ang mga proseso ng pagbuburo ng mga nilalaman ng digestive tract ay bumagal, ang sakit at belching ay nawawala, ang bakal ay mas mahusay na hinihigop.
Pagkatapos ng oral administration, ang gamot ay bahagyang na-metabolize ng laway at gastric mucus, ang mga nilalaman ng duodenum 12. Ang hindi nakatali na sangkap ay tumagos sa duodenum, kung saan ganap itong na-neutralize ng mga alkaline na nilalaman nito.
Isa pang paggamit ng acid sa pang-araw-araw na buhay
Sa isang acidic na komposisyon, madali mong linisin ang limescale at kalawang mula sa faience plumbing, alisin ang bato sa ihi at iba pang mga contaminants. Para sa isang mas malaking epekto, isang inhibitor (halimbawa, urotropin) ay idinagdag sa ahente, na nagpapabagal sa reaksyon ng kemikal.
Ang pamamaraan ay isinasagawa bilang mga sumusunod: ang acid ay natunaw ng tubig hanggang sa maabot ang isang 5% na konsentrasyon at isang inhibitor ay idinagdag sa rate na 0.5 g bawat 1 litro ng likido. Ang ibabaw ay ginagamot sa nagresultang komposisyon at iniwan ng 30-40 minuto (depende sa antas ng kontaminasyon), pagkatapos nito ay hugasan ng tubig.
Ginagamit din ang mild acid solution para alisin ang mga mantsa ng berry, tinta o kalawang sa mga tela. Upang gawin ito, ang materyal ay ibabad sa komposisyon nang ilang sandali, pagkatapos nito ay lubusan itong hugasan at hugasan sa karaniwang paraan.
Pag-alis ng kaliskis sa takure
Para sa layuning ito, ang isang 3-5% hydrochloric acid solution ay ginagamit, na ibinuhos sa isang takure at pinainit sa 60-80°
C sa loob ng 1-2 oras o hanggang sa masira ang mga deposito ng scale. Pagkatapos nito, ang sukat ay nagiging maluwag at madaling maalis gamit ang isang kahoy na spatula.
Ang pagiging epektibo ng pamamaraan ay dahil sa ang katunayan na ang reagent ay tumutugon sa magnesium at calcium carbonates at binago ang mga ito sa mga natutunaw na asing-gamot. Ang carbon dioxide na inilabas sa parehong oras ay sumisira sa scale layer at ginagawa itong maluwag. Pagkatapos alisin ang mga deposito ng asin, ang mga pinggan ay lubusan na hinugasan ng malinis na tubig.
Mahalagang punto!
Ang pamamaraang ito ay hindi angkop para sa pag-alis ng mga nabasag at basag na enamel o mga aluminum kettle: ito ay makakasira sa metal at masisira ito nang husto.
Pagkuha ng substance
Ngayon ay maaari nating pag-usapan kung ano ang ginagawa nila upang bumuo ng hydrochloric acid.
Una, sa pamamagitan ng pagsunog ng hydrogen sa chlorine, ang pangunahing bahagi, ang gaseous hydrogen chloride, ay nakuha. na pagkatapos ay natunaw sa tubig. Ang resulta ng simpleng reaksyong ito ay ang pagbuo ng isang sintetikong acid.
Ang sangkap na ito ay maaari ding makuha mula sa mga off-gas. Ito ay mga chemical waste (side) na gas. Ang mga ito ay nabuo sa pamamagitan ng iba't ibang mga proseso. Halimbawa, kapag nag-chlorinate ng mga hydrocarbon. Ang hydrogen chloride sa kanilang komposisyon ay tinatawag na off-gas. At ang acid kaya nakuha, ayon sa pagkakabanggit.
Dapat pansinin na sa mga nakaraang taon ang bahagi ng off-gas substance sa kabuuang dami ng produksyon nito ay tumataas. At ang acid na nabuo bilang resulta ng pagsunog ng hydrogen sa chlorine ay inilipat. Gayunpaman, sa pagiging patas, dapat tandaan na naglalaman ito ng mas kaunting mga impurities.
Paggamit ng produksyon
Ito ay may malawak na aplikasyon sa metalurhiko, pagkain at industriyang medikal.
- Metalurhiya. Gamitin sa paghihinang, tinning at paglilinis ng mga metal.
- Industriya ng pagkain. Application sa paggawa ng mga regulator ng acidity ng pagkain, halimbawa, E507.
- Electrotype. Ginagamit para sa pag-aatsara.
- Gamot. Natagpuan nito ang aplikasyon nito sa paggawa ng artipisyal na gastric juice.
Kasama sa mga sintetikong tina. Ginagamit ito sa paggawa ng mga produktong panlinis at panlaba. Ngunit sa mga likido na inilaan para sa domestic na paggamit, ang konsentrasyon ng sulfuric acid ay bale-wala.
Paano ginawa ang hydrochloric acid sa laboratoryo
Ang paggawa ng sangkap ay malakihan, ang pagbebenta ay libre. Sa mga kondisyon ng mga eksperimento sa laboratoryo, ang isang solusyon ay ginawa sa pamamagitan ng pagkilos ng mataas na konsentrasyon ng sulfuric acid sa ordinaryong asin sa kusina (sodium chloride).
Mayroong 2 paraan para sa pagtunaw ng hydrogen chloride sa tubig:
- Ang hydrogen ay sinusunog sa chlorine (synthetic).
- Nauugnay (off-gas). Ang kakanyahan nito ay sa pagsasagawa ng organic chlorination, dehydrochlorination.
Ang sangkap ay nagpapahiram nang mabuti sa synthesis sa panahon ng pyrolysis ng basura mula sa organochlorine. Nangyayari ito bilang resulta ng pagkasira ng mga hydrocarbon na may kumpletong kakulangan ng oxygen. Maaari mo ring gamitin ang mga metal chlorides, na mga hilaw na materyales ng mga di-organikong sangkap. Kung walang puro sulfuric acid (electrolyte), kumuha ng diluted.
Tulad ng para sa pagkuha ng reagent sa mga natural na kondisyon, kadalasan ang pinaghalong kemikal na ito ay matatagpuan sa mga tubig ng basura ng bulkan. Ang hydrogen chloride ay isang bahagi ng mga mineral na sylvin (potassium chloride, mukhang buto para sa mga laro), bischofite. Ang lahat ng ito ay mga paraan upang kunin ang sangkap sa industriya.
Sa mga tao, ang enzyme na ito ay matatagpuan sa tiyan. Ang solusyon ay maaaring acid o base. Ang isa sa mga pinaka-karaniwang paraan ng pagkuha ay tinatawag na sulfate.
Mga katangian ng kemikal
Hydrochloric acid, hydrogen chloride o hydrochloric acid - solusyon Hcl
sa tubig. Ayon sa Wikipedia, ang substance ay kabilang sa grupo ng inorganic strong monobasic to-t. Ang buong pangalan ng tambalan sa Latin: hydrochloric acid.
Formula ng hydrochloric acid sa kimika: HCl
. Sa isang molekula, ang mga atomo ng hydrogen ay pinagsama sa mga atomo ng halogen - Cl
. Kung isasaalang-alang natin ang elektronikong pagsasaayos ng mga molekulang ito, mapapansin na ang mga compound ay nakikibahagi sa pagbuo ng mga molecular orbital. 1s
-hydrogen orbitals at pareho 3s
at 3p
-orbital ng isang atom Cl
. Sa chemical formula ng hydrochloric acid 1s-
, 3s-
at 3p
-Ang mga atomic na orbital ay nagsasapawan at bumubuo ng 1, 2, 3 orbital. Kung saan 3s
-orbital ay hindi nagbubuklod. Mayroong paglipat ng density ng elektron sa atom Cl
at ang polarity ng molekula ay bumababa, ngunit ang nagbubuklod na enerhiya ng molecular orbitals ay tumataas (kung isasaalang-alang natin ito kasama ng iba pang hydrogen halides
).
Mga pisikal na katangian ng hydrogen chloride. Ito ay isang malinaw at walang kulay na likido na umuusok kapag nakalantad sa hangin. Molar mass ng isang chemical compound = 36.6 gramo bawat mole. Sa ilalim ng karaniwang mga kondisyon, sa temperatura ng hangin na 20 degrees Celsius, ang maximum na konsentrasyon ng isang sangkap ay 38% ayon sa timbang. Ang density ng concentrated hydrochloric acid sa ganitong uri ng solusyon ay 1.19 g/cm³. Sa pangkalahatan, ang mga pisikal na katangian at katangian tulad ng density, molarity, lagkit, kapasidad ng init, punto ng kumukulo at pH
, malakas na nakasalalay sa konsentrasyon ng solusyon. Ang mga halagang ito ay tinalakay nang mas detalyado sa talahanayan ng mga density. Halimbawa, ang density ng Hydrochloric Acid 10% = 1.048 kg bawat litro. Kapag pinatigas, nabubuo ang sangkap crystalline hydrates
iba't ibang komposisyon.
Mga kemikal na katangian ng hydrochloric acid. Ano ang reaksyon ng hydrochloric acid? Nakikipag-ugnayan ang substance sa mga metal na nakatayo sa harap ng hydrogen sa isang serye ng mga potensyal na electrochemical (iron, magnesium, zinc, at iba pa). Sa kasong ito, ang mga asing-gamot ay nabuo at puno ng gas H
. Ang tingga, tanso, ginto, pilak at iba pang mga metal sa kanan ng hydrogen ay hindi tumutugon sa hydrochloric acid. Ang sangkap ay tumutugon sa mga metal oxide na gumagawa ng tubig at isang natutunaw na asin. Sodium hydroxide sa ilalim ng pagkilos ng to-you forms at tubig. Ang reaksyon ng neutralisasyon ay katangian ng tambalang ito.
Ang Dilute Hydrochloric Acid ay tumutugon sa mga metal na asing-gamot, na nabubuo ng mas mahinang mga asido. Halimbawa, propionic acid
mas mahina kaysa sa asin. Ang sangkap ay hindi tumutugon sa mas malakas na mga acid. at sodium carbonate
mabubuo pagkatapos ng reaksyon sa HCl
chloride, carbon monoxide at tubig.
Para sa isang kemikal na tambalan, ang mga reaksyon na may malakas na oxidizing agent ay katangian, na may mangganeso dioxide
, potasa permanganeyt
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. Ang sangkap ay tumutugon sa ammonia
, na gumagawa ng makapal na puting usok, na binubuo ng napakaliit na kristal ng ammonium chloride. Ang mineral pyrolusite ay tumutugon din sa hydrochloric acid, dahil naglalaman ito mangganeso dioxide
: MnO2+4HCl=Cl2+MnO2+2H2O
(reaksyon ng oksihenasyon).
Mayroong isang husay na reaksyon sa hydrochloric acid at mga asin nito. Kapag ang isang sangkap ay nakikipag-ugnayan sa pilak nitrayd
isang puting namuo pilak klorido
at nabuo nitric acid
. Equation ng reaksyon ng pakikipag-ugnayan methylamine
na may hydrogen chloride ay ganito ang hitsura: HCl + CH3NH2 = (CH3NH3)Cl
.
Ang isang sangkap ay tumutugon sa isang mahinang base aniline
. Pagkatapos matunaw ang aniline sa tubig, ang hydrochloric acid ay idinagdag sa pinaghalong. Bilang isang resulta, ang base ay natutunaw at bumubuo aniline hydrochloride
(phenylammonium chloride
): (С6Н5NH3)Cl
. Ang reaksyon ng pakikipag-ugnayan ng aluminum carbide na may hydrochloric acid: Al4C3+12HCL=3CH4+4AlCl3
. Equation ng reaksyon potassium carbonate
kung saan ganito ang hitsura: K2CO3 + 2HCl = 2KCl + H2O + CO2.
Aplikasyon
sa metalurhiya para sa pagkuha ng mga ores, pag-alis ng kalawang, sukat, dumi at mga oksido, paghihinang at tinning;
sa paggawa ng mga sintetikong goma at resin;
sa electroplating;
bilang isang acidity regulator sa industriya ng pagkain;
upang makakuha ng mga metal chloride;
upang makakuha ng chlorine;
sa gamot para sa paggamot ng hindi sapat na kaasiman ng gastric juice;
bilang panlinis at disinfectant.
- (HCl), isang may tubig na solusyon ng hydrogen chloride, isang walang kulay na gas na may masangsang na amoy. Nakuha sa pamamagitan ng pagkilos ng sulfuric acid sa karaniwang asin, bilang isang by-product ng chlorination ng hydrocarbons, o sa pamamagitan ng reaksyon ng hydrogen at chlorine. Ang hydrochloric acid ay ginagamit para sa ... ... Siyentipiko at teknikal na encyclopedic na diksyunaryo
Hydrochloric acid
- - Ang HCl (SC) (hydrochloric acid, hydrochloric acid, hydrogen chloride) ay isang solusyon ng hydrogen chloride (HCl) sa tubig, isang antifreeze additive. Ito ay isang walang kulay na likido na may masangsang na amoy, walang nasuspinde na mga particle. ... ... Encyclopedia ng mga termino, kahulugan at paliwanag ng mga materyales sa gusali
HYDROCHLORIC ACID
- (hydrochloric acid) solusyon ng hydrogen chloride sa tubig; malakas na asido. Isang walang kulay na likidong umuusok sa hangin (ang teknikal na hydrochloric acid ay madilaw-dilaw dahil sa mga dumi ng Fe, Cl2, atbp.). Ang maximum na konsentrasyon (sa 20 ° C) ay 38% ayon sa masa, ... ... Big Encyclopedic Dictionary
HYDROCHLORIC ACID
- (Acidum muriaticum, Acid, hydrochloricum), isang solusyon ng hydrogen chloride (HC1) sa tubig. Sa likas na katangian, ito ay nangyayari sa tubig ng ilang mga mapagkukunan ng bulkan na pinagmulan, at matatagpuan din sa gastric juice (hanggang sa 0.5%). Maaaring makuha ang hydrogen chloride ... Big Medical Encyclopedia
HYDROCHLORIC ACID
- (hydrochloric acid, hydrochloric acid) malakas na monobasic volatile acid na may masangsang na amoy, isang may tubig na solusyon ng hydrogen chloride; ang maximum na konsentrasyon ay 38% sa pamamagitan ng masa, ang density ng naturang solusyon ay 1.19 g / cm3. Ginamit sa ... ... Russian encyclopedia of labor protection
HYDROCHLORIC ACID
- (hydrochloric acid) HCl aqueous solution ng hydrogen chloride, malakas na monobasic acid, pabagu-bago ng isip, na may masangsang na amoy; impurities ng bakal, chlorine mantsa ito madilaw-dilaw. Ang puro S. na ibebenta ay naglalaman ng 37% ... ... Big Polytechnic Encyclopedia
hydrochloric acid
— pangngalan, bilang ng mga kasingkahulugan: 1 acid (171) ASIS Synonym Dictionary. V.N. Trishin. 2013 ... Diksyunaryo ng kasingkahulugan
HYDROCHLORIC ACID
Modern Encyclopedia
Hydrochloric acid
- HYDROGENIC ACID, may tubig na solusyon ng hydrogen chloride HCl; isang umuusok na likido na may masangsang na amoy. Ang hydrochloric acid ay ginagamit upang makakuha ng iba't ibang chlorides, pag-aatsara ng mga metal, pagproseso ng mga ores, sa paggawa ng chlorine, soda, rubbers, atbp. ... ... Illustrated Encyclopedic Dictionary
hydrochloric acid
- (hydrochloric acid), isang solusyon ng hydrogen chloride sa tubig; malakas na asido. Isang walang kulay na likidong "nagpapausok" sa hangin (ang teknikal na hydrochloric acid ay madilaw-dilaw dahil sa mga dumi ng Fe, Cl2, atbp.). Pinakamataas na konsentrasyon (sa 20 ° C) 38% ayon sa masa, ... ... Encyclopedic Dictionary
Ano ang panganib ng pagkalasing
Ang hydrochloric acid ay isang partikular na panganib sa katawan ng tao. Sa kaso ng pagkalason sa naturang sangkap, maaaring magkaroon ng malubhang komplikasyon at paglabag sa pag-andar ng katawan.
Mga komplikasyon:
- Paglabag sa atay, bilang resulta ng nakakalason na hepatitis,
- Pagdurugo sa tiyan dahil sa nawasak na mga dingding ng organ,
- Isang estado ng pagkabigla mula sa sakit kapag ang acid ay pumasok sa isang malaking lugar,
- Sa kaso ng pagkakadikit sa mga mata, kapansanan sa paningin,
- Malubhang malfunction ng mga bato,
- Kabiguan sa paghinga, pagkahilo, igsi ng paghinga,
- Ang pagbuo ng isang pagkawala ng malay.
Ang mga katulad na kahihinatnan ay unti-unting nabubuo depende sa antas ng pagkalason.
Konklusyon
Kung susundin mo ang mga pag-iingat at panuntunan sa kaligtasan, ang hydrochloric acid ay magiging isang kailangang-kailangan na katulong sa pang-araw-araw na buhay. At mabibili mo ito sa pinaka-abot-kayang presyo sa aming kumpanya.
Tulad ng mga acid. Ang programang pang-edukasyon ay nagbibigay para sa pagsasaulo ng mga mag-aaral ng mga pangalan at pormula ng anim na kinatawan ng pangkat na ito. At, sa pagtingin sa talahanayan na ibinigay ng aklat-aralin, napansin mo sa listahan ng mga acid ang nauuna at interesado ka sa unang lugar - hydrochloric acid. Naku, sa silid-aralan sa paaralan, hindi pinag-aaralan ang ari-arian o anumang iba pang impormasyon tungkol dito. Samakatuwid, ang mga taong sabik na makakuha ng kaalaman sa labas ng kurikulum ng paaralan ay naghahanap ng karagdagang impormasyon sa lahat ng uri ng mga mapagkukunan. Ngunit kadalasan, marami ang hindi nakakahanap ng impormasyong kailangan nila. At kaya ang paksa ng artikulo ngayon ay nakatuon sa partikular na acid na ito.
Kahulugan
Ang hydrochloric acid ay isang malakas na monobasic acid. Sa ilang mga mapagkukunan, maaari itong tawaging hydrochloric at hydrochloric, pati na rin ang hydrogen chloride.
Mga katangiang pisikal
Ito ay isang walang kulay at umuusok na caustic liquid sa hangin (larawan sa kanan). Gayunpaman, ang teknikal na acid ay may madilaw-dilaw na kulay dahil sa pagkakaroon ng iron, chlorine at iba pang mga additives sa loob nito. Ang pinakamalaking konsentrasyon nito sa temperatura na 20 ° C ay 38%. Ang density ng hydrochloric acid na may ganitong mga parameter ay 1.19 g/cm 3 . Ngunit ang tambalang ito sa iba't ibang antas ng saturation ay may ganap na magkakaibang data.Sa isang pagbawas sa konsentrasyon, ang numerical na halaga ng molarity, lagkit at natutunaw na punto ay bumaba, ngunit ang tiyak na kapasidad ng init at pagtaas ng punto ng kumukulo. Ang solidification ng hydrochloric acid ng anumang konsentrasyon ay nagbibigay ng iba't ibang mga crystalline hydrates.
Mga katangian ng kemikal
Ang lahat ng mga metal na nauuna sa hydrogen sa electrochemical series ng kanilang boltahe ay maaaring makipag-ugnayan sa tambalang ito, na bumubuo ng mga asing-gamot at naglalabas ng hydrogen gas. Kung ang mga ito ay pinalitan ng mga metal oxide, ang mga produkto ng reaksyon ay magiging natutunaw na asin at tubig. Ang parehong epekto ay magiging sa pakikipag-ugnayan ng hydrochloric acid sa hydroxides. Kung, gayunpaman, ang anumang asin ng mga metal (halimbawa, sodium carbonate) ay idinagdag dito, ang nalalabi ay kinuha mula sa isang mas mahinang acid (carbonic), kung gayon ang chloride ng metal na ito (sodium), tubig at gas na naaayon sa acid nalalabi (sa kasong ito, carbon dioxide) ay nabuo. .
Resibo
Ang tambalang tinatalakay ngayon ay nabuo kapag ang hydrogen chloride gas, na maaaring makuha sa pamamagitan ng pagsunog ng hydrogen sa chlorine, ay natunaw sa tubig. Ang hydrochloric acid, na nakuha gamit ang pamamaraang ito, ay tinatawag na synthetic. Ang mga off-gas ay maaari ding magsilbi bilang isang mapagkukunan para sa pagkuha ng sangkap na ito. At ang naturang hydrochloric acid ay tatawaging off-gas. Kamakailan lamang, ang antas ng produksyon ng hydrochloric acid gamit ang pamamaraang ito ay mas mataas kaysa sa produksyon nito sa pamamagitan ng isang sintetikong pamamaraan, bagaman ang huli ay nagbibigay ng tambalan sa isang mas dalisay na anyo. Ang lahat ng ito ay mga paraan upang makuha ito sa industriya. Gayunpaman, sa mga laboratoryo, ang hydrochloric acid ay ginawa sa tatlong paraan (ang unang dalawa ay naiiba lamang sa mga produkto ng temperatura at reaksyon) gamit ang iba't ibang uri ng pakikipag-ugnayan ng kemikal, tulad ng:
- Epekto ng saturated sulfuric acid sa sodium chloride sa 150°C.
- Ang pakikipag-ugnayan ng mga sangkap sa itaas sa ilalim ng mga kondisyon na may temperatura na 550 ° C at sa itaas.
- Hydrolysis ng aluminum o magnesium chloride.
Aplikasyon
Ang hydrometallurgy at electroforming ay hindi maaaring gawin nang walang paggamit ng hydrochloric acid, kung saan kinakailangan, upang linisin ang ibabaw ng mga metal sa panahon ng tinning at paghihinang at upang makakuha ng mga chlorides ng manganese, iron, zinc at iba pang mga metal. Sa industriya ng pagkain, ang tambalang ito ay kilala bilang food additive E507 - mayroong isang acidity regulator na kinakailangan upang makagawa ng seltzer (soda) na tubig. Ang concentrated hydrochloric acid ay matatagpuan din sa gastric juice ng sinumang tao at tumutulong sa pagtunaw ng pagkain. Sa panahon ng prosesong ito, ang antas ng saturation nito ay bumababa, dahil. ang komposisyon na ito ay diluted sa pagkain. Gayunpaman, sa matagal na pag-aayuno, ang konsentrasyon ng hydrochloric acid sa tiyan ay unti-unting tumataas. At dahil ang tambalang ito ay napaka-caustic, maaari itong humantong sa mga ulser sa tiyan.
Konklusyon
Ang hydrochloric acid ay maaaring maging kapaki-pakinabang at nakakapinsala sa mga tao. Ang pagkakadikit nito sa balat ay humahantong sa matinding pagkasunog ng kemikal, at ang mga singaw ng tambalang ito ay nakakairita sa respiratory tract at mga mata.
Ngunit kung maingat mong hahawakan ang sangkap na ito, maaari itong magamit nang higit sa isang beses