Pagsasamantala

Sa vanadium flow na mga baterya, ang parehong mga reference na electrodes ay karagdagang konektado sa mga storage tank at pump upang ang napakalaking volume ng electrolyte ay maaaring mailipat sa cell. Ang sirkulasyon ng likidong electrolyte ay medyo mahirap at nililimitahan ang paggamit ng vanadium flow na mga baterya sa mga industriyang nangangailangan ng mobility, na ginagawang epektibo ang mga ito sa malalaking nakatigil na gusali.
Kapag na-charge ang isang vanadium na baterya, ang mga VO2+ ions sa positively charged reference electrode ay magiging VO2+ ions kapag ang mga electron ay natanggal mula sa positibong terminal ng baterya. Katulad nito, sa negatibong reference electrode, ang mga electron ay nagko-convert ng mga V3+ ions sa V2+. Sa panahon ng discharge, ang prosesong ito ay binabaligtad, na nagbibigay ng open circuit na boltahe na 1.41 V sa 25°C.
Ang iba pang mga kapaki-pakinabang na katangian ng mga baterya ng daloy ng vanadium ay kinabibilangan ng napakabilis na pagtugon sa mga pagbabago sa pagkarga at napakataas na kapasidad ng overload. Ipinakita ng pananaliksik sa Unibersidad ng New South Wales na makakamit nila ang mga oras ng pagtugon na mas mababa sa kalahating millisecond sa 100% na pagbabago sa pag-load at makatiis ng 400% na labis na karga nang higit sa 10 segundo. Ang oras ng pagtugon sa karamihan ng mga kaso ay limitado ng mga de-koryenteng kagamitan. Ang mga bateryang Vanadium na batay sa sulfuric acid ay gumagana lamang sa temperaturang 10-40C. Kung ang temperatura ay mas mababa sa saklaw na ito, ang mga ion ng sulfuric acid ay nag-kristal. Ang kahusayan sa reciprocating motion sa pang-araw-araw na paggamit ay nananatili sa antas ng 65-75%.
Mga tampok ng pag-charge at pagdiskarga
Direktang nakadepende ang mga algorithm sa pag-charge sa kung paano nakaayos ang baterya at kung saang uri ito nabibilang. Halimbawa, ang ilang mga baterya ay maaaring ligtas na mapunan ang kanilang kapasidad mula sa patuloy na pinagmumulan ng boltahe. Ang iba ay gumagana lamang sa isang regulated current source na maaaring magbago ng mga parameter depende sa antas ng pagsingil.
Maaaring makapinsala sa baterya ang hindi maayos na proseso ng pag-charge. Sa matinding mga kaso, ang baterya ay maaaring mag-apoy o sumabog. May mga matalinong baterya na nilagyan ng mga aparato sa pagsubaybay sa boltahe. Ang mga pangunahing parameter na dapat isaalang-alang kapag nagpapatakbo ng mga reversible galvanic na baterya ay:
- Haba ng buhay. Kahit na may wastong paghawak, ang bilang ng mga cycle ng pag-charge para sa isang baterya ay limitado. Ang iba't ibang mga sistema ng baterya ay hindi palaging napuputol para sa parehong mga kadahilanan. Ngunit sa pangkalahatan, ang buhay ng baterya ay nalilimitahan pangunahin sa pamamagitan ng bilang ng mga full charge-discharge cycle, at pangalawa sa pamamagitan ng disenyo ng buhay ng serbisyo nang walang pagtukoy sa intensity ng paggamit.
- Oras ng pag-charge. Ang pangunahing disenyo ng baterya ay hindi nagpapahiwatig ng pagsingil sa isang di-makatwirang mataas na bilis: ang panloob na pagtutol ng galvanic cell ay hahantong sa pag-convert ng labis na kasalukuyang singilin sa init, na maaaring hindi maibabalik na makapinsala sa aparato. Mula sa pisikal na pananaw, ang oras ng pagsingil ay nililimitahan ng pinakamataas na rate ng pagsasabog ng aktibong materyal sa pamamagitan ng electrolyte.Sa simpleng paraan, maaari nating ipagpalagay na ang pagpapanumbalik ng buong kapasidad sa loob ng isang oras ay isang magandang tagapagpahiwatig.
- Lalim ng paglabas. Tinukoy bilang isang porsyento ng na-rate na kapangyarihan. Inilalarawan ang kakayahang magamit. Para sa iba't ibang uri ng mga baterya, ang inirerekomendang antas ng paglabas ng operating ay maaaring mag-iba. Dahil sa mga pagbabago sa operasyon o pagtanda, nawawala ang orihinal na halaga ng indicator ng maximum depth.
proseso ng pagsasabog.
Dahil sa proseso ng pagsasabog, ang pagkakahanay ng density ng electrolyte sa lukab ng kaso ng baterya at sa mga pores ng aktibong masa ng mga plato, ang polarization ng elektrod ay maaaring mapanatili sa baterya kapag ang panlabas na circuit ay naka-off.
Ang diffusion rate ay direktang nakasalalay sa temperatura ng electrolyte, mas mataas ang temperatura, mas mabilis ang proseso na nagaganap at maaaring mag-iba nang malaki sa oras, mula dalawang oras hanggang isang araw. Ang pagkakaroon ng dalawang bahagi ng potensyal ng elektrod sa mga lumilipas na kondisyon ay humantong sa paghahati sa equilibrium at non-equilibrium EMF ng baterya. Ang equilibrium EMF ng baterya ay apektado ng nilalaman at konsentrasyon ng mga ions ng mga aktibong sangkap sa electrolyte, pati na rin ang kemikal at pisikal na mga katangian ng mga aktibong sangkap. Ang pangunahing papel sa magnitude ng EMF ay nilalaro ng density ng electrolyte at ang temperatura ay halos hindi nakakaapekto dito. Ang pag-asa ng EMF sa density ay maaaring ipahayag ng formula:
Ang baterya emf ay hindi katumbas ng boltahe ng baterya, na nakasalalay sa pagkakaroon o kawalan ng pagkarga sa mga terminal nito.
admin25/07/2011
Komento
Pangalan *
Lugar
Ang site na ito ay gumagamit ng Akismet upang labanan ang spam. Alamin kung paano pinoproseso ang iyong data ng komento.
"Mechanical tachometer
Boltahe ng baterya »
Mga tag
VAZ, VAZ malfunctions Mga Sensor Ignition Injector Device Starter Schematics Mga de-kuryenteng sasakyan Power supply vaz 2110 gazelle gazelle business registrar pagkumpuni ng kotse
Mga Kamakailang Entri
- Mga sensor sa kotse: mga uri at layunin
- Ang pinakamalaking de-koryenteng kotse sa mundo na Edumper,
- Mga ilaw ng laser.
- Mga kalamangan at kawalan ng halogen lamp
- Ang aparato at prinsipyo ng pagpapatakbo ng mga sensor ng paradahan
Mga archive
Mga Archive Piliin ang Setyembre 2019 Agosto 2017 Abril 2017 Marso 2017 Disyembre 2016 November 2016 Oktubre 2016 Septiyembre 2016 Agosto 2016 Marso 2016 Pebrero 2016 Nobyembre 2015 Oktubre 2015 Agosto 2015 Hulyo 2015 Hunyo 2015 Mayo 2015 Enero 2015 Disyembre 2014 Nobyembre 2014 Oktubre 2014 Setyembre 2014 Agosto 2014 Hulyo 2014 Hunyo 2014 Mayo 2014 Abril 2014 Pebrero 2014 Enero 2014 Disyembre 2013 Nobyembre 2013 Oktubre 2013 Agosto 2, 2013 Mayo 10, 2013 Mayo 12, 2013 Mayo 12, 2013 2012, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, Setyembre 2012, 2011, 2011, 2011, 2011, 2011, 2011
Mga kategorya
- Baterya ng accumulator
- Video
- Generator
- Mga sensor
- Mga diagnostic
- Pag-aapoy
- balita
- Kagamitan
- Mga device
- Pagkukumpuni
- Spark plug
- Panimula
- Scheme
- Mga device
- kotseng dekuryente
- Power supply
Nasa mga social network tayo
Auto Electrician@ All rights reserved. Kapag kinokopya ang mga materyal ng site, dapat kang magbigay ng link sa site.
Device at prinsipyo ng pagpapatakbo
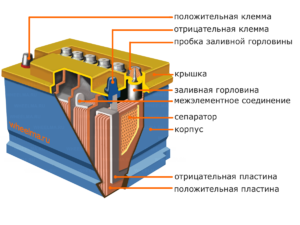
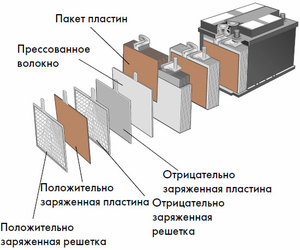
Ang bawat naturang cell ay may isang cathode (positibong elektrod) at isang anode (negatibo). Ang mga electrodes na ito ay pinaghihiwalay ng isang electrolyte na nagsisiguro sa pagpapalitan ng mga ion sa pagitan nila. Ang mga materyales sa electrode at komposisyon ng electrolyte ay pinili upang magbigay ng sapat na puwersa ng electromotive sa pagitan ng mga terminal ng baterya.
Dahil ang mga electrodes ay naglalaman ng isang limitadong potensyal ng kemikal na enerhiya, ang baterya ay mauubos sa panahon ng operasyon. Ang uri ng mga galvanic cell, na inangkop para sa muling pagdadagdag pagkatapos ng bahagyang o kumpletong paglabas, ay tinatawag na baterya. Ang isang pagpupulong ng naturang magkakaugnay na mga cell ay isang baterya.Ang pagpapatakbo ng baterya ay nagsasangkot ng paikot na pagbabago ng dalawang estado:
- Nagcha-charge - ang baterya ay gumagana bilang isang receiver ng kuryente, sa loob ng mga cell ang elektrikal na enerhiya ay natanto sa mga pagbabago sa kemikal.
- Discharging - gumagana ang device bilang pinagmumulan ng electrical current sa pamamagitan ng pag-convert ng enerhiya ng mga kemikal na reaksyon sa elektrikal na enerhiya.
Mga lugar ng paggamit
Ang napakataas na kapasidad na katangian ng mga bateryang vanadium redox ay ginagawang angkop ang mga ito para gamitin sa mga industriyang nangangailangan ng mataas na imbakan ng enerhiya. Halimbawa, pagtulong na balansehin ang dami ng produksyon ng naturang mga mapagkukunan ng enerhiya tulad ng hangin o solar, o pagtulong sa mga generator na sumipsip ng malalaking surge ng enerhiya kapag kinakailangan, o pagbabalanse ng supply at demand para sa enerhiya para sa mga malalayong lugar.
Ang limitadong self-discharge na mga katangian ng vanadium redox na mga baterya ay ginagawa itong kapaki-pakinabang sa mga industriya kung saan ang mga baterya ay dapat na nakaimbak sa mahabang panahon na may kaunting pagpapanatili at kahandaan. Ito ay humantong sa kanilang paggamit sa ilang mga uri ng electronics ng militar, halimbawa, sa mga sensor ng sistema ng pagmimina ng GATOR. Dahil sa kanilang kakayahang umikot at manatili sa zero, angkop ang mga ito para sa mga solar application at industriya kung saan dapat simulan ng mga baterya ang araw na walang laman at mag-recharge batay sa pagkarga at lagay ng panahon. Halimbawa, ang mga baterya ng lithium ion ay kadalasang nasisira kapag pinahintulutan silang mag-discharge nang mas mababa sa 20% ng kanilang volume, kaya kadalasang gumagana ang mga ito sa hanay na 20 hanggang 100%, na nangangahulugang magagamit lang nila ang 20% ng kanilang na-rate na kapasidad.
Ang kanilang napakabilis na oras ng pagtugon ay ginagawa din silang praktikal na kailangang-kailangan para sa mga walang patid na suplay ng kuryente, kung saan magagamit ang mga ito bilang kapalit ng mga lead-acid na baterya at maging ang mga generator ng diesel. Gayundin ang mabilis na oras ng pagtugon ay ginagawa silang angkop para sa kontrol ng dalas. Sa ngayon, alinman sa UPS o frequency management ay hindi epektibo sa kanilang sarili, ngunit malamang na ang baterya ay makakahanap ng mga aplikasyon sa mga industriyang ito kapag na-capitalize mula sa iba't ibang mapagkukunan ng pagpopondo. Bilang karagdagan, ginagawa ng mga kakayahang ito ang mga bateryang vanadium redox na isang epektibong "one-piece" na solusyon para sa maliliit na grids ng kuryente na umaasa sa maaasahang operasyon, kontrol sa dalas, at mga pangangailangan sa paglipat ng load (tulad ng mataas na pagtagos ng mga nababagong, mataas na pabagu-bagong load, o ang pagnanais na i-optimize ang kahusayan ng generator sa pamamagitan ng paglilipat ng oras ng pagtugon).
Ang pinakamalaking gumaganang vanadium redox na baterya
Substation na "Minami Hyakita":
- Petsa ng paglulunsad: Disyembre 2015
- Enerhiya: 60 MWh
- Kapangyarihan: 15 MW
- Oras ng pagtatrabaho: 4 na oras
- Bansa: Japan
Mabaho, Liaoning Province
- Petsa ng Paglunsad: N/A
- Enerhiya: 10 MWh
- Kapangyarihan: 5 MW
- Oras ng pagtatrabaho: 2 oras
- Bansa: China
Tomamae Wind Farm
- Petsa ng paglunsad: 2005
- Enerhiya: 6 MWh
- Kapangyarihan: 4 MW
- Oras ng pagtatrabaho: 1 oras 30 minuto
- Bansa: Japan
Zhangbei Project
- Petsa ng paglunsad 2016
- Enerhiya: 8 MWh
- Kapangyarihan: 2 MW
- Oras ng pagtatrabaho: 4 na oras.
- Bansa: China
Proyekto ng SnoPUD MESA 2
- Petsa ng Paglunsad: Marso 2017
- Enerhiya: 8 MWh
- Kapangyarihan: 2 MW
- Oras ng pagtatrabaho: 4 na oras.
- Bansa: USA
Substation sa Escondido
- Petsa ng paglulunsad: 2017
- Enerhiya: 8 MWh
- Kapangyarihan: 2 MW
- Oras ng pagtatrabaho: 4 na oras.
- Bansa: USA
Substation sa Pullman, Washington
- Petsa ng paglulunsad: Abril 2015
- Enerhiya: 4 MWh
- Kapangyarihan: 1 MW
- Oras ng pagtatrabaho: 4 na oras
- Bansa: USA
Sa pamamagitan ng 2018, ang pagbuo ng isang vanadium redox na baterya ay inaasahang matatapos sa China. Ang enerhiya nito ay magiging 800 MWh, kapangyarihan - 200 MW, at oras ng operasyon - 4 na oras.
Mga tuntunin
- Sequential - sunud-sunod ang mga elemento.
- Ang electromotive force (EMF) ay ang boltahe na nabuo ng isang baterya o magnetic force alinsunod sa batas ng Faraday.
- Parallel - Ang mga de-koryenteng bahagi ay inayos upang ang kasalukuyang daloy sa dalawa o higit pang mga landas.
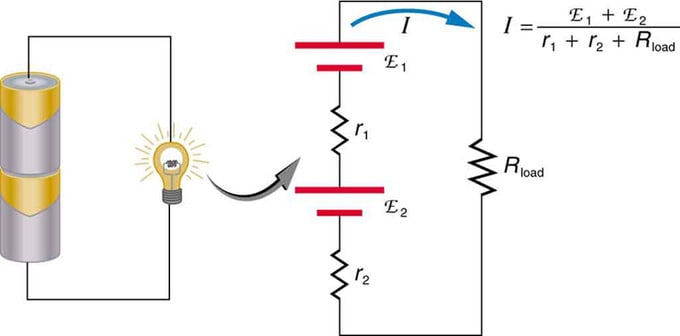
Kung gumagamit ka ng maraming pinagmumulan ng boltahe, maaari silang konektado sa serye o kahanay. Sa bersyon ng serye, ang mga ito ay nakatutok sa parehong direksyon, ang panloob na pagtutol ay idinagdag, at ang electromotive na puwersa ay idinagdag sa algebraically. Ang mga katulad na uri ay karaniwan sa mga flashlight, mga laruan, at iba't ibang mga appliances. Ang mga cell ay inilalagay sa serye upang mapataas ang kabuuang emf.
Serial na koneksyon ng dalawang pinagmumulan ng boltahe sa parehong direksyon. Ang diagram ay nagpapakita ng isang parol na may dalawang cell at isang lampara
Baterya - maramihang koneksyon ng mga elemento ng volt. Ngunit mayroong isang kawalan sa serial connection, dahil ang mga panloob na pagtutol ay idinagdag. Minsan lumilikha ito ng mga problema. Sabihin nating mayroon kang dalawang 6V na baterya na inilagay mo sa halip na ang karaniwang 12V. Bilang resulta, idinagdag mo hindi lamang ang EMF, kundi pati na rin ang panloob na pagtutol mula sa bawat baterya.
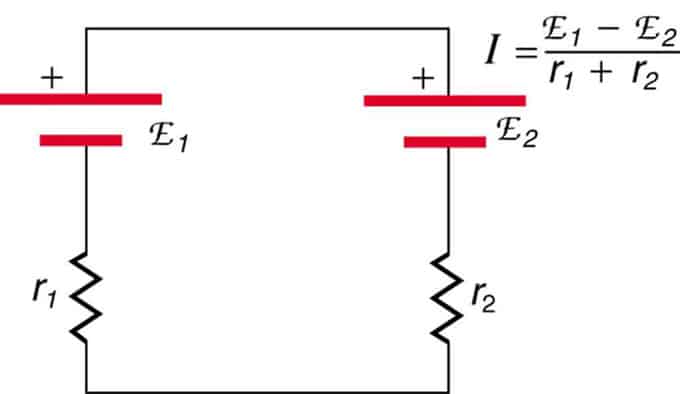
Kung ang mga cell ay matatagpuan sa pagsalungat (ang isa ay matatagpuan sa likod ng isa), pagkatapos ay ang kabuuang EMF ay bababa.
Ito ay dalawang pinagmumulan ng boltahe na konektado sa serye na may magkasalungat na mga emisyon. Ang kasalukuyang dumadaloy sa direksyon ng mas malaking EMF at nililimitahan ng kabuuan ng mga panloob na pagtutol. Ang isang halimbawa ay isang charger. Dapat itong magkaroon ng mas maraming emf kaysa sa baterya
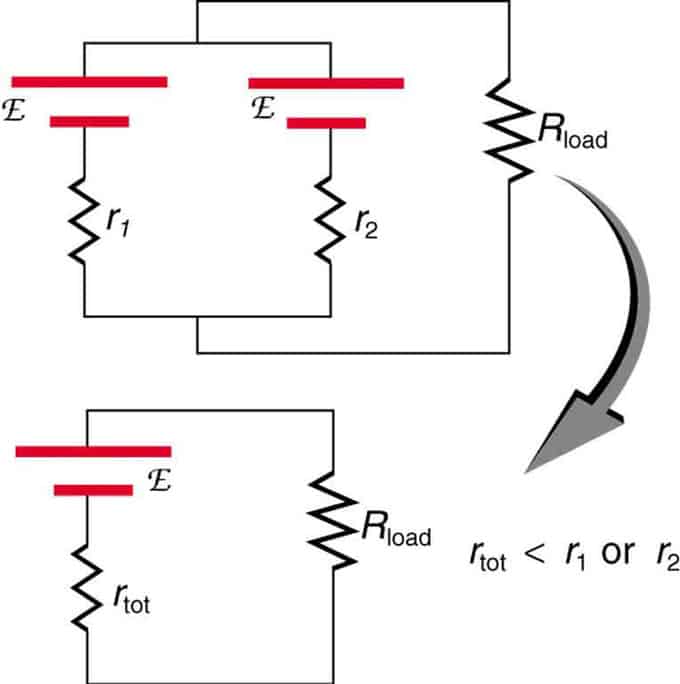
Kung ang dalawang pinagmumulan na may parehong electromotive force ay matatagpuan sa parallel at konektado sa load resistance, kung gayon ang kabuuang EMF ay nananatiling pareho sa mga indibidwal. Gayunpaman, ang kabuuang panloob na pagtutol ay mababawasan. Lumalabas na ang parallel na bersyon ay maaaring makabuo ng mas kasalukuyang.
Dalawang pinagmumulan ng boltahe na may isang solong EMF ay pinagsama sa parallel na koneksyon. Bumubuo sila ng isang EMF, ngunit may mas kaunting kabuuang pagtutol kaysa sa indibidwal. Ang mga katulad na kumbinasyon ay ginagamit kung kailangan mong makamit ang mas kasalukuyang.
| Pangkalahatang-ideya |
|
| Parallel at serye na koneksyon ng mga resistors |
|
| Mga panuntunan ng Kirchhoff |
|
| Mga voltmeter at ammeter |
|
| Mga RC Circuit |
|
Makasaysayang pangkalahatang-ideya
Ang pag-unlad ng unang galvanic cell ay na-kredito sa Italyano physicist na si Alessandro Volta. Nagsagawa siya ng isang serye ng mga eksperimento sa mga electrochemical phenomena noong 1790s at noong mga 1800 ay nilikha niya ang unang baterya, na tinawag ng kanyang mga kontemporaryo na "voltaic column". Ang aparato ay binubuo ng mga alternating zinc at silver disc na pinaghihiwalay ng mga layer ng papel o tela na ibinabad sa isang sodium hydroxide solution.
Ang mga eksperimentong ito ay naging batayan para sa trabaho ni Michael Faraday sa mga quantitative na batas ng electrochemistry. Inilarawan niya ang prinsipyo ng pagpapatakbo ng baterya at, batay sa gawain ng siyentipiko, ang unang komersyal na mga de-koryenteng selula ay nilikha. Ang karagdagang ebolusyon ay ganito ang hitsura:
- Noong 1836, ang British chemist na si John Daniel ay nagpakita ng isang pinahusay na modelo ng cell, na binubuo ng tanso at zinc electrodes na nahuhulog sa hydrochloric acid. Ang elemento ni Daniel ay nakapagbigay ng pare-parehong boltahe na hindi maihahambing nang mas mahusay kaysa sa mga aparato ng Volt.
- 1839 Ang karagdagang pag-unlad ay ginawa ng physicist na si Grove sa kanyang dalawang-likido na cell, na binubuo ng zinc na nahuhulog sa dilute sulfuric acid sa isang porous na lalagyan. Ang huli ay naghiwalay ng sulfuric acid mula sa isang sisidlan na naglalaman ng nitric acid na may platinum cathode na nakalagay dito. Ang nitric acid ay nagsilbi bilang isang oxidizing agent upang maiwasan ang pagkawala ng boltahe dahil sa hydrogen accumulation sa cathode.Pinalitan ng German chemist na si Robert Bunsen ang platinum ng murang carbon sa Grove cell at sa gayon ay itinaguyod ang malawakang pagtanggap ng ganitong uri ng baterya.
- Noong 1859, naimbento ni Gaston Plante ang lead-acid cell, ang nangunguna sa modernong baterya ng kotse. Ang aparato ni Plante ay nakagawa ng isang hindi karaniwang malaking kasalukuyang, ngunit ginamit lamang para sa mga eksperimento sa mga laboratoryo sa loob ng halos dalawang dekada.
- 1895-1905 taon. Pag-imbento ng mga elemento ng nickel-cadmium at nickel-iron alkaline. Ginawa nitong posible na lumikha ng mga system na may malaking bilang ng mga cycle ng charge-discharge.
- Mula noong 1930s, nagsimula ang pagbuo ng mga bateryang silver-zinc at mercury-zinc alkaline, na nagbigay ng mataas na density ng enerhiya sa bawat yunit ng timbang at dami.
- Mula noong kalagitnaan ng ika-20 siglo, ang mga pag-unlad sa teknolohiya ng pagmamanupaktura at ang pagdating ng mga bagong materyales ay humantong sa mas malakas at compact na mga baterya. Ang pinaka-kapansin-pansin ay ang pagpapakilala ng nickel-metal hydride at lithium na mga baterya sa merkado.
Nagcha-charge ng mga baterya
Pangunahing artikulo: Charger
Habang nauubos ang enerhiya ng kemikal, bumababa ang boltahe at kasalukuyang, at hindi na gumagana ang baterya. Maaari mong i-charge ang baterya (baterya ng mga baterya) mula sa anumang pinagmumulan ng DC na may mas mataas na boltahe habang nililimitahan ang kasalukuyang. Ang pinakakaraniwan ay ang charging current (sa amperes), proporsyonal sa 1/10 ng conditional nominal na kapasidad ng baterya (sa ampere hours).
Gayunpaman, batay sa teknikal na paglalarawan na ibinahagi ng mga tagagawa ng malawakang ginagamit na mga de-koryenteng baterya (NiMH, NiCd), maaaring ipagpalagay na ang mode ng pagsingil na ito, na karaniwang tinutukoy bilang pamantayan, ay kinakalkula batay sa tagal ng isang walong oras na araw ng trabaho, kapag ang baterya, na na-discharge sa pagtatapos ng araw ng trabaho, ay nakakonekta sa mains charger bago magsimula ang isang bagong araw ng trabaho. Ang paggamit ng naturang mode ng pagsingil para sa mga ganitong uri ng mga baterya na may sistematikong paggamit ay nagbibigay-daan sa iyo upang mapanatili ang balanse ng kalidad sa gastos sa pagpapatakbo ng produkto. Kaya, sa mungkahi ng tagagawa, ang mode na ito ay magagamit lamang para sa mga baterya ng nickel-cadmium at nickel-metal hydride.
Maraming mga uri ng mga baterya ang may iba't ibang limitasyon na dapat isaalang-alang sa panahon ng pagcha-charge at kasunod na paggamit, halimbawa, ang mga baterya ng NiMH ay sensitibo sa sobrang pagkarga, ang mga baterya ng lithium ay sensitibo sa labis na paglabas, boltahe at temperatura. Ang mga baterya ng NiCd at NiMH ay may tinatawag na memory effect, na binubuo sa pagbaba ng kapasidad kapag ang pagsingil ay isinasagawa kapag ang baterya ay hindi ganap na na-discharge. Gayundin, ang mga ganitong uri ng mga baterya ay may kapansin-pansing paglabas sa sarili, iyon ay, unti-unti silang nawawalan ng singil nang hindi nakakonekta sa pagkarga. Upang labanan ang epektong ito, maaaring gamitin ang drip recharging.
Mga Paraan ng Pag-charge ng Baterya
Maraming mga paraan ang ginagamit upang singilin ang mga baterya; Sa pangkalahatan, ang paraan ng pagsingil ay depende sa uri ng baterya.
- Mabagal na singil sa DC
Singilin gamit ang direktang kasalukuyang proporsyonal sa 0.1-0.2 ng conditional nominal na kapasidad Q para sa mga 15-7 oras, ayon sa pagkakabanggit.
Ang pinakamatagal at pinakaligtas na paraan ng pagsingil. Angkop para sa karamihan ng mga uri ng mga baterya.
- mabilis na singilin
Mag-charge gamit ang direktang kasalukuyang proporsyonal sa 1/3 Q para sa mga 3-5 oras.
- Pinabilis o "delta-V" na singil
Isang singil na may paunang singil na kasalukuyang proporsyonal sa nominal na nominal na kapasidad ng baterya, kung saan ang boltahe ng baterya ay patuloy na sinusukat at ang singil ay nagtatapos pagkatapos na ganap na ma-charge ang baterya. Ang oras ng pag-charge ay halos isang oras at kalahati. Ang baterya ay maaaring mag-overheat at kahit na sirain ito.
- baligtarin ang singil
Ginagawa ito sa pamamagitan ng paghahalili ng mahabang pulso ng singil na may mga maikling pulso sa paglabas. Ang reverse method ay pinaka-kapaki-pakinabang para sa pag-charge ng NiCd at NiMH na mga baterya, na nailalarawan sa tinatawag na.n. "epekto sa memorya".