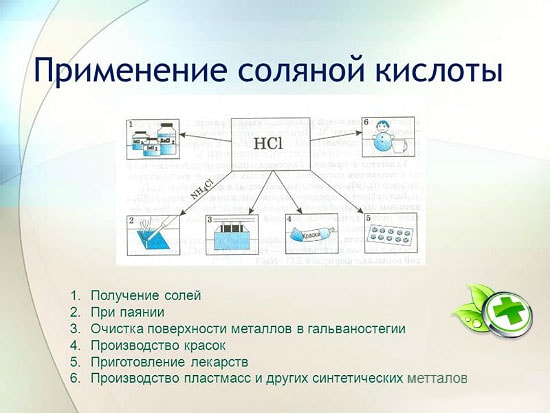
Việc sử dụng axit clohydric
Axit clohydric được sử dụng rộng rãi trong công nghiệp để chiết xuất kim loại từ quặng, tẩy kim loại, vv Nó cũng được sử dụng trong sản xuất chất lỏng hàn, trong lắng đọng bạc, và là một phần không thể thiếu của cường thủy.
Quy mô sử dụng axit clohiđric trong công nghiệp ít hơn axit nitric. Điều này là do thực tế là axit clohydric gây ăn mòn thiết bị thép. Ngoài ra, hơi dễ bay hơi của nó khá có hại và cũng là nguyên nhân gây ăn mòn các sản phẩm kim loại. Điều này phải được tính đến khi bảo quản axit clohydric. Axit clohydric được lưu trữ và vận chuyển trong các thùng và thùng có lót cao su, tức là trong bình, bề mặt bên trong được phủ bằng cao su chịu axit, cũng như trong chai thủy tinh và đồ dùng bằng polyetylen.
Axit clohydric được sử dụng để sản xuất clorua kẽm, mangan, sắt và các kim loại khác, cũng như amoni clorua. Axit clohydric được sử dụng để làm sạch bề mặt của kim loại, tàu thuyền, giếng từ các muối cacbonat, oxit và các chất cặn và chất gây ô nhiễm khác. Trong trường hợp này, các chất phụ gia đặc biệt được sử dụng - chất ức chế bảo vệ kim loại khỏi bị hòa tan và ăn mòn, nhưng không làm chậm quá trình hòa tan các oxit, cacbonat và các hợp chất tương tự khác.
HCl được sử dụng trong công nghiệp sản xuất nhựa tổng hợp, cao su. Nó được sử dụng làm nguyên liệu trong sản xuất metyl clorua từ rượu metylic, etyl clorua từ etylen và vinyl clorua từ axetylen.
Phương pháp sơ cứu và điều trị
Nếu phát hiện có dấu hiệu ngộ độc, phải gọi xe cấp cứu. Tại nhà, nó được phép thực hiện các hoạt động nhằm cải thiện tình trạng của nạn nhân. Sơ cứu ngộ độc axit clohydric cần được thực hiện nhanh chóng để giảm nguy cơ hậu quả tiêu cực.
Sự kiện:
- Nếu hợp chất muối dính trên da, các vùng bị tổn thương được rửa sạch bằng nhiều nước mát. Thời gian xử lý ít nhất là nửa giờ.
- Trong trường hợp say hơi, nạn nhân được tiếp cận với không khí trong lành, mở cửa sổ, cởi cúc quần áo kín.
- Khuyến cáo theo dõi tình trạng của bệnh nhân, trong trường hợp không có dấu hiệu của sự sống, tiến hành hồi sức.
- Nạn nhân khỏi hơi được cho uống nước ấm pha trà. Nên rửa mũi và miệng bằng nước mát.
- Trong trường hợp quá liều do ăn phải axit, một túi nước đá được đặt trên bụng để ngăn ngừa hoặc giảm chảy máu có thể xảy ra.
- Không có sản phẩm thuốc nào được phép sử dụng. Được phép cho bệnh nhân uống một cốc nước (bạn có thể khoáng kiềm). Uống chất lỏng được yêu cầu thành từng ngụm nhỏ.
- Nó không được phép rửa dạ dày, cố gắng gây nôn tại nhà. Cách sơ cứu như vậy có thể dẫn đến bỏng họng, chảy máu.
Việc điều trị được thực hiện trong cơ sở y tế dưới sự giám sát của các bác sĩ chuyên khoa.
Trị liệu:
- Làm sạch dạ dày bằng một đầu dò,
- Sử dụng ống nhỏ giọt với các dung dịch thuốc,
- Kê đơn thuốc để giảm đau
- Việc sử dụng thuốc nhằm phục hồi hoạt động của các cơ quan và hệ thống,
- Nếu cần, hít thở oxy và thông khí nhân tạo cho phổi,
- Tiến hành liệu pháp hồi sức trong trường hợp không có dấu hiệu của sự sống,
- Lựa chọn các loại vitamin và dinh dưỡng đặc biệt.
Điều trị được thực hiện trong chăm sóc đặc biệt, và sau đó trong bệnh viện. Thời gian kéo dài phụ thuộc vào tình trạng bệnh nhân và mức độ ngộ độc.
Bỏng và ngộ độc
Hiệu quả như phương thuốc này nhưng nó là nguy hiểm. Axit clohydric, tùy thuộc vào nồng độ, có thể gây bỏng hóa chất ở bốn độ:
- Chỉ có vết đỏ và đau.
- Có bong bóng với chất lỏng trong suốt và sưng lên.
- Hình thành hoại tử các lớp trên của da.Các vết phồng rộp chứa đầy máu hoặc chất đục.
- Tổn thương đến gân và cơ.
Nếu chất nào đó dính vào mắt, cần phải rửa sạch chúng bằng nước, sau đó bằng dung dịch soda. Nhưng trong mọi trường hợp, điều đầu tiên cần làm là gọi xe cấp cứu.
Việc ăn phải axit bên trong sẽ gây ra những cơn đau cấp tính ở ngực và bụng, sưng tấy thanh quản, nôn ra máu. Kết quả là, các bệnh lý nghiêm trọng của gan và thận.
Và các dấu hiệu đầu tiên của ngộ độc theo cặp bao gồm ho khan thường xuyên, nghẹt thở, tổn thương răng, nóng rát niêm mạc và đau bụng. Cách sơ cứu khẩn cấp là rửa và súc miệng bằng nước, cũng như tiếp cận với không khí trong lành. Chỉ một nhà nghiên cứu chất độc mới có thể giúp đỡ thực sự.
Tính chất của quang phổ hóa học
Axit tương tác với nhiều kim loại, muối. Nó được coi là khá mạnh và ngang hàng với sơn dương. Phản ứng chính thể hiện ở tất cả các nhóm kim loại nằm bên trái hydro (magiê, sắt, kẽm - thế điện).
Dung dịch hiđro clorua ở dạng loãng phản ứng với muối, nhưng chỉ phản ứng với muối tạo bởi axit kém mạnh hơn. Được biết đến với tất cả natri và canxi cacbonat, sau khi tương tác với nó, chúng phân hủy thành nước và cacbon monoxit.
Axit nitric
- phản ứng định tính với dung dịch muối. Để có được nó, người ta phải thêm bạc nitrat vào thuốc thử này, kết quả sẽ tạo thành kết tủa trắng, từ đó thu được một chất nitơ.
Với sự trợ giúp của hỗn hợp nước và hydro này, nhiều thí nghiệm thú vị đã được thực hiện. Ví dụ, pha loãng nó với amoniac. Kết quả là bạn sẽ thu được khói trắng, đặc, có độ đặc của các tinh thể nhỏ. Metylamin, anilin, mangan đioxit, kali cacbonat là những thuốc thử cũng tác dụng với axit.
Làm thế nào và tại sao nó được sử dụng
Có lẽ, đây đúng là một trong những chất quan trọng được tìm thấy và cần thiết trong hầu hết các lĩnh vực của cuộc sống con người.
Bản địa hóa khu vực ứng dụng:
- Luyện kim. Làm sạch bề mặt khỏi các khu vực bị oxy hóa, đánh tan rỉ sét, xử lý trước khi hàn, đóng hộp thiếc. Axit clohydric giúp tách các tạp kim loại nhỏ ra khỏi quặng. Zirconi và titan thu được bằng cách sử dụng phương pháp chuyển ôxít thành clorua.
- Ngành công nghệ thực phẩm. Dung dịch có nồng độ thấp được dùng làm phụ gia thực phẩm. Gelatin, fructose cho người tiểu đường có chứa chất nhũ hóa tinh khiết. Soda thông thường cũng có hàm lượng chất này khá cao. Trên bao bì hàng hóa, bạn sẽ thấy nó dưới tên E507.
- Lĩnh vực y học. Với một chỉ số không đủ về môi trường axit trong dạ dày và các vấn đề với đường ruột. Ph thấp dẫn đến ung thư. Ngay cả khi có chế độ dinh dưỡng hợp lý, lượng vitamin dồi dào, nguy cơ không biến mất, cần phải thực hiện các xét nghiệm để lấy dịch vị từ dạ dày, bởi vì trong môi trường không đủ axit, các chất hữu ích thực tế không được hấp thụ, tiêu hóa bị rối loạn.
- Dung dịch muối được sử dụng như một chất ức chế - bảo vệ chống lại bụi bẩn và nhiễm trùng, tác dụng khử trùng. Để sản xuất hỗn hợp chất kết dính, các sản phẩm gốm sứ. Nó tuôn ra các bộ trao đổi nhiệt.
- Quy trình lọc nước uống cũng không hoàn chỉnh nếu không có sự tham gia của clo.
- Sản xuất cao su, tẩy trắng vải nền.
- Bạn có thể chăm sóc ống kính của mình bằng giải pháp này.
- Nước súc miệng tại nhà
- Chất là một chất dẫn điện tuyệt vời.
Ngộ độc xảy ra như thế nào
Axit clohydric là chất lỏng không màu, có mùi hắc đặc trưng. Một trong những axit mạnh nhất, có khả năng hòa tan một số kim loại. Dễ dàng biến thành chất khí.
Hiđro clorua được dùng trong công nghiệp dệt, kinh doanh da, luyện kim loại quý, sản xuất keo, axit.
Chất này có trong dạ dày với nồng độ tối thiểu. Axit góp phần bình thường hóa quá trình tiêu hóa, bảo vệ cơ thể khỏi vi khuẩn và vi sinh vật có hại.
Ở nồng độ vượt quá 24%, axit clohydric có thể gây ra những tác hại không thể phục hồi cho cơ thể con người. Hơi được hình thành khi tiếp xúc với không khí gây kích ứng các cơ quan của hệ thống hô hấp và thị giác.
Có một số yếu tố có thể kích thích sự phát triển của ngộ độc.
Các nhân tố:
Có thể bị say khi làm việc trong phòng có hệ thống thông gió kém,
Nuốt phải do sơ suất, phổ biến hơn ở trẻ em,
Sự xâm nhập của axit clohydric lên biểu bì, màng nhầy trong trường hợp không tuân thủ các quy tắc sử dụng thuốc thử.
Ngộ độc bởi một chất tại nhà ở người lớn xảy ra do sử dụng mà không có thiết bị bảo vệ da, mắt và các cơ quan của hệ hô hấp. Nhiễm độc có thể xảy ra khi axit được chuyển không chính xác từ thùng chứa này sang thùng chứa khác.
Dược lực học và dược động học
Độ chua của dạ dày là gì? Đây là một đặc điểm của nồng độ axit clohydric trong dạ dày. Tính axit được thể hiện ở độ pH
. Thông thường, axit nên được tạo ra trong thành phần của dịch vị và tham gia tích cực vào quá trình tiêu hóa. Công thức của axit clohydric: HCl
. Nó được sản xuất bởi các tế bào thành nằm trong các tuyến cơ bản, với sự tham gia của H + / K + -ATPase
. Những tế bào này lót nền và thân của dạ dày. Bản thân độ axit của dịch vị có thể thay đổi và phụ thuộc vào số lượng tế bào thành và cường độ của các quá trình trung hòa chất bởi các thành phần kiềm của dịch vị. Nồng độ tạo ra - bạn ổn định và bằng 160 mmol / l. Một người khỏe mạnh bình thường nên sản xuất không quá 7 và ít nhất 5 mmol chất mỗi giờ.
Khi sản xuất không đủ hoặc quá nhiều Axit clohydric, các bệnh về đường tiêu hóa sẽ xảy ra, khả năng hấp thụ một số nguyên tố vi lượng như sắt bị suy giảm. Thuốc kích thích tiết dịch vị, giảm độ pH
. Kích hoạt pepsinogen
, chuyển đổi nó thành một enzym hoạt động pepsin
. Chất này có tác dụng hữu ích đối với phản xạ axit của dạ dày, làm chậm quá trình chuyển hóa thức ăn chưa tiêu hóa hết vào ruột. Quá trình lên men của các chất trong đường tiêu hóa chậm lại, cơn đau và ợ hơi biến mất, sắt được hấp thụ tốt hơn.
Sau khi uống, thuốc được chuyển hóa một phần qua nước bọt và chất nhầy dạ dày, thành phần của tá tràng. Chất không liên kết thâm nhập vào tá tràng, nơi nó được trung hòa hoàn toàn bởi chất kiềm của nó.
Một công dụng khác của axit trong cuộc sống hàng ngày
Với thành phần có tính axit, bạn có thể dễ dàng làm sạch cặn vôi và rỉ sét khỏi hệ thống ống nước, loại bỏ sỏi tiết niệu và các chất gây ô nhiễm khác. Để có tác dụng lớn hơn, chất ức chế (ví dụ, urotropin) được thêm vào tác nhân, chất này làm chậm phản ứng hóa học.
Quy trình được thực hiện như sau: axit được pha loãng với nước cho đến khi đạt được nồng độ 5% và thêm chất ức chế với tỷ lệ 0,5 g trên 1 lít chất lỏng. Bề mặt được xử lý với chế phẩm thu được và để trong vòng 30 - 40 phút (tùy thuộc vào mức độ ô nhiễm), sau đó được rửa sạch bằng nước.
Dung dịch axit nhẹ cũng được sử dụng để tẩy vết quả mọng, vết mực hoặc vết rỉ sét trên vải. Để làm điều này, vật liệu được ngâm trong chế phẩm một thời gian, sau đó được rửa kỹ và rửa theo cách thông thường.
Loại bỏ cặn trong ấm đun nước
Với mục đích này, dung dịch axit clohydric 3-5% được sử dụng, được đổ vào ấm đun nước và đun nóng đến 60-80°
C trong 1-2 giờ hoặc cho đến khi các cặn bẩn tan hết. Sau đó, cáu cặn trở nên lỏng lẻo và dễ dàng loại bỏ bằng thìa gỗ.
Hiệu quả của phương pháp là do thuốc thử phản ứng với magie và canxi cacbonat và chuyển chúng thành muối hòa tan. Carbon dioxide được giải phóng đồng thời phá hủy lớp cáu cặn và làm cho nó trở nên lỏng lẻo. Sau khi loại bỏ cặn muối, bát đĩa được rửa kỹ bằng nước sạch.
Tâm điểm!
Phương pháp này không thích hợp để tẩy cặn các loại ấm tráng men hoặc ấm nhôm bị sứt và nứt: điều này sẽ làm ăn mòn kim loại và làm hỏng nó nghiêm trọng.
Nhận một chất
Bây giờ chúng ta có thể nói về những gì họ làm để tạo thành axit clohiđric.
Đầu tiên, bằng cách đốt cháy hiđro trong clo, thành phần chính là hiđro clorua ở thể khí. sau đó được hòa tan trong nước. Kết quả của phản ứng đơn giản này là sự hình thành một axit tổng hợp.
Chất này cũng có thể được thu được từ khí ngoài. Đây là những chất thải hóa học (phụ) khí. Chúng được hình thành bởi nhiều quá trình khác nhau. Ví dụ: khi clo hóa hiđrocacbon. Hydro clorua trong thành phần của chúng được gọi là khí tắt. Và do đó thu được axit tương ứng.
Cần lưu ý rằng trong những năm gần đây, tỷ trọng của chất không khí trong tổng khối lượng sản xuất của nó ngày càng tăng. Và axit được tạo thành do quá trình đốt cháy hiđro trong clo bị chuyển vị. Tuy nhiên, xét một cách công bằng, cần lưu ý rằng nó chứa ít tạp chất hơn.
Sử dụng sản xuất
Nó có ứng dụng rộng rãi trong các ngành công nghiệp luyện kim, thực phẩm và y tế.
- Luyện kim. Sử dụng trong hàn, luyện thiếc và làm sạch kim loại.
- Công nghiệp thực phẩm. Ứng dụng trong sản xuất chất điều chỉnh độ chua của thực phẩm, ví dụ, E507.
- Loại điện tử. Dùng để ngâm chua.
- Thuốc. Nó tìm thấy ứng dụng của nó trong sản xuất dịch vị nhân tạo.
Có trong thuốc nhuộm tổng hợp. Nó được sử dụng trong sản xuất các sản phẩm tẩy rửa và tẩy rửa. Nhưng trong chất lỏng dùng trong sinh hoạt, nồng độ axit sunfuric là không đáng kể.
Axit clohydric được sản xuất như thế nào trong phòng thí nghiệm
Việc sản xuất chất này ở quy mô lớn, việc mua bán là tự do. Trong điều kiện thí nghiệm trong phòng thí nghiệm, dung dịch được tạo ra do tác dụng của axit sunfuric nồng độ cao với muối ăn thông thường (natri clorua).
Có 2 phương pháp để hòa tan hiđro clorua trong nước:
- Hiđro được đốt cháy trong clo (tổng hợp).
- Liên kết (off-gas). Bản chất của nó là thực hiện quá trình khử clo hữu cơ, khử clo.
Chất này có lợi cho quá trình tổng hợp trong quá trình nhiệt phân chất thải từ clo hữu cơ. Điều này xảy ra do sự phân hủy các hydrocacbon khi thiếu oxy hoàn toàn. Bạn cũng có thể sử dụng clorua kim loại, là nguyên liệu thô của các chất vô cơ. Nếu không có axit sunfuric đặc (chất điện li) thì đem pha loãng.
Đối với việc chiết xuất thuốc thử trong điều kiện tự nhiên, thông thường hỗn hợp hóa chất này có thể được tìm thấy trong vùng nước thải của núi lửa. Hydro clorua là một thành phần của khoáng chất sylvin (kali clorua, trông giống như xương cho các trò chơi), bischofite. Tất cả đây là những phương pháp để chiết xuất chất trong công nghiệp.
Ở người, enzym này được tìm thấy trong dạ dày. Dung dịch có thể là axit hoặc bazơ. Một trong những phương pháp chiết xuất phổ biến nhất được gọi là sulfat.
Tính chất hóa học
Axit clohydric, hydro clorua hoặc axit clohydric - dung dịch Hcl
trong nước. Theo Wikipedia, chất này thuộc nhóm chất vô cơ monobasic to-t. Tên đầy đủ của hợp chất bằng tiếng Latinh: axit hydrochloric.
Công thức của axit clohydric trong hóa học: HCl
. Trong phân tử, nguyên tử hydro kết hợp với nguyên tử halogen - Cl
. Nếu chúng ta xem xét cấu hình điện tử của các phân tử này, có thể lưu ý rằng các hợp chất tham gia vào quá trình hình thành các obitan phân tử 1 giây
-các obitan hydro và cả hai 3 giây
và 3p
-orbitals của một nguyên tử Cl
. Trong công thức hóa học của axit clohiđric 1s-
, 3 giây-
và 3p
-các obitan nguyên tử xen phủ nhau và tạo thành obitan 1, 2, 3. Trong đó 3 giây
-ital không liên kết. Có sự chuyển dịch mật độ electron trong nguyên tử Cl
và độ phân cực của phân tử giảm, nhưng năng lượng liên kết của các obitan phân tử lại tăng (nếu chúng ta xem xét nó cùng với hydro halogenua
).
Tính chất vật lý của hiđro clorua. Nó là một chất lỏng trong suốt, không màu, bốc khói khi tiếp xúc với không khí. Khối lượng mol của một hợp chất hóa học = 36,6 gam / mol. Ở điều kiện tiêu chuẩn, ở nhiệt độ không khí 20 độ C, nồng độ tối đa của một chất là 38% khối lượng. Khối lượng riêng của axit clohydric đậm đặc trong loại dung dịch này là 1,19 g / cm³. Nói chung, các tính chất và đặc điểm vật lý như tỷ trọng, nồng độ mol, độ nhớt, nhiệt dung, điểm sôi và độ pH
, phụ thuộc nhiều vào nồng độ của dung dịch. Các giá trị này được thảo luận chi tiết hơn trong bảng mật độ. Ví dụ, tỷ trọng của Axit clohydric 10% = 1,048 kg mỗi lít. Khi đông đặc, chất tạo thành hydrat kết tinh
các sáng tác khác nhau.
Tính chất hóa học của axit clohiđric. Axit clohiđric phản ứng với chất gì? Chất này tương tác với các kim loại đứng trước hiđro theo một loạt các thế điện hóa (sắt, magiê, kẽm và các kim loại khác). Trong trường hợp này, các muối được tạo thành và ở dạng khí H
. Chì, đồng, vàng, bạc và các kim loại khác ở bên phải hiđro không phản ứng với axit clohiđric. Chất phản ứng với oxit kim loại tạo ra nước và một muối tan. Natri hydroxit dưới tác dụng của các dạng đối với bạn và nước. Phản ứng trung hòa là đặc trưng của hợp chất này.
Axit clohydric loãng phản ứng với muối kim loại, được tạo thành bởi axit yếu hơn. Ví dụ, axit propionic
yếu hơn muối. Chất không phản ứng với axit mạnh hơn. và sô đa
sẽ hình thành sau khi phản ứng với HCl
clorua, cacbon monoxit và nước.
Đối với một hợp chất hóa học, phản ứng với chất oxi hóa mạnh là đặc trưng, với Mangan dioxide
, thuốc tím
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. Chất phản ứng với amoniac
, tạo ra khói trắng dày, bao gồm các tinh thể rất nhỏ của amoni clorua. Khoáng chất pyrolusit cũng phản ứng với axit clohydric, vì nó chứa Mangan dioxide
: MnO2 + 4HCl = Cl2 + MnO2 + 2H2O
(phản ứng oxi hóa).
Có phản ứng định tính với axit clohiđric và các muối của nó. Khi một chất tương tác với bạc nitrat
kết tủa trắng bạc clorua
và hình thành axit nitric
. Phương trình phản ứng tương tác metylamin
với hydro clorua trông như thế này: HCl + CH3NH2 = (CH3NH3) Cl
.
Một chất phản ứng với một bazơ yếu anilin
. Sau khi hòa tan anilin vào nước, người ta cho axit clohiđric vào hỗn hợp. Kết quả là, bazơ tan và hình thành anilin hydroclorua
(phenylamoni clorua
): (С6Н5NH3) Cl
. Phản ứng tương tác của nhôm cacbua với axit clohiđric: Al4C3 + 12HCL = 3CH4 + 4AlCl3
. Phương trình phản ứng kali cacbonat
mà nó trông như thế này: K2CO3 + 2HCl = 2KCl + H2O + CO2.
Đơn xin
trong luyện kim để khai thác quặng, tẩy rỉ sét, cáu cặn, bụi bẩn và ôxít, hàn và luyện thiếc;
trong sản xuất cao su và nhựa tổng hợp;
trong mạ điện;
như một chất điều chỉnh độ chua trong ngành công nghiệp thực phẩm;
để thu được clorua kim loại;
để thu được clo;
trong y học để điều trị không đủ độ axit của dịch vị;
như một chất làm sạch và khử trùng.
- (HCl), dung dịch nước hiđro clorua, là chất khí không màu, mùi hắc. Thu được khi cho axit sunfuric tác dụng với muối thông thường, dưới dạng sản phẩm phụ của quá trình clo hóa hydrocacbon, hoặc bằng phản ứng của hydro và clo. Axit clohydric được sử dụng cho ... ... Từ điển bách khoa toàn thư khoa học và kỹ thuật
Axit hydrochloric
- - HCl (SC) (axit clohydric, axit clohydric, hydro clorua) là một dung dịch của hydro clorua (HCl) trong nước, một chất phụ gia chống đông vón. Nó là một chất lỏng không màu, mùi hắc, không có các hạt lơ lửng. ... ... Từ điển bách khoa về thuật ngữ, định nghĩa và giải thích về vật liệu xây dựng
AXIT HYDROCHLORIC
- (axit clohydric) dung dịch hiđro clorua trong nước; axit mạnh. Là chất lỏng không màu bốc khói trong không khí (axit clohydric kỹ thuật có màu vàng do lẫn tạp chất Fe, Cl2, v.v.). Nồng độ tối đa (ở 20 ° C) là 38% khối lượng, ... ... Big Encyclopedic Dictionary
AXIT HYDROCHLORIC
- (Acidum muriaticum, Acid, hydrochloricum), dung dịch hydro clorua (HC1) trong nước. Trong tự nhiên, nó xuất hiện trong nước của một số nguồn có nguồn gốc núi lửa, và cũng được tìm thấy trong dịch dạ dày (lên đến 0,5%). Hiđro clorua có thể thu được ... Từ điển Bách khoa Y học lớn
AXIT HYDROCHLORIC
- (axit clohydric, axit clohiđric) axit đơn bazơ mạnh, có mùi hắc, là dung dịch nước của hiđro clorua; nồng độ tối đa là 38% theo khối lượng, khối lượng riêng của dung dịch đó là 1,19 g / cm3. Được sử dụng trong ... ... Từ điển bách khoa toàn thư về bảo hộ lao động của Nga
AXIT HYDROCHLORIC
- (axit clohidric) Dung dịch nước HCl gồm hiđro clorua, axit đơn chức mạnh, dễ bay hơi, có mùi hắc; tạp chất của sắt, clo làm ố vàng. S. đậm đặc để bán chứa 37% ... ... Từ điển Bách khoa Bách khoa Lớn
axit hydrochloric
- danh từ, số lượng từ đồng nghĩa: 1 axit (171) Từ điển Từ đồng nghĩa ASIS. V.N. Trishin. 2013 ... Từ điển đồng nghĩa
AXIT HYDROCHLORIC
Bách khoa toàn thư hiện đại
Axit hydrochloric
- AXIT THỦY LỰC, dung dịch nước của hiđro clorua HCl; chất lỏng bốc khói có mùi hắc. Axit clohydric được sử dụng để thu nhận các clorua khác nhau, tẩy kim loại, chế biến quặng, trong sản xuất clo, sôđa, cao su, vv ... ...
axit hydrochloric
- (axit clohydric), dung dịch hydro clorua trong nước; axit mạnh. Là chất lỏng không màu "bốc khói" trong không khí (axit clohydric kỹ thuật có màu hơi vàng do lẫn tạp chất Fe, Cl2, v.v.). Nồng độ tối đa (ở 20 ° C) 38% theo khối lượng, ... ... Từ điển Bách khoa toàn thư
Sự nguy hiểm của say là gì
Axit clohydric là một mối nguy hiểm đặc biệt đối với cơ thể con người. Trong trường hợp ngộ độc với một chất như vậy, các biến chứng nghiêm trọng và vi phạm chức năng của cơ thể có thể phát triển.
Các biến chứng:
- Vi phạm gan, do viêm gan nhiễm độc,
- Chảy máu trong dạ dày do các bức tường của cơ quan bị phá hủy,
- Tình trạng sốc vì đau khi axit xâm nhập vào một khu vực rộng lớn,
- Trong trường hợp tiếp xúc với mắt, suy giảm thị lực,
- Sự cố nghiêm trọng của thận,
- Suy hô hấp, ngạt thở, khó thở,
- Sự phát triển của một cơn hôn mê.
Hậu quả tương tự phát triển dần dần tùy thuộc vào mức độ ngộ độc.
Sự kết luận
Nếu bạn tuân thủ các biện pháp phòng ngừa và quy tắc an toàn, axit clohydric sẽ trở thành một trợ thủ đắc lực không thể thiếu trong cuộc sống hàng ngày. Và bạn có thể mua nó với giá cả phải chăng nhất tại công ty chúng tôi.
Giống như axit. Chương trình giáo dục cung cấp cho học sinh khả năng ghi nhớ tên và công thức của sáu đại diện của nhóm này. Và, nhìn qua bảng do sách giáo khoa cung cấp, bạn nhận thấy trong danh sách các axit, axit xuất hiện đầu tiên và khiến bạn quan tâm nhất - axit clohiđric. Than ôi, trong lớp học ở trường, cả tài sản và bất kỳ thông tin nào khác về nó đều không được nghiên cứu. Vì vậy, những người mong muốn có được kiến thức bên ngoài chương trình học ở trường đang tìm kiếm thông tin bổ sung trong tất cả các nguồn. Nhưng thông thường, nhiều người không tìm thấy thông tin họ cần. Và vì vậy chủ đề của bài viết hôm nay là dành riêng cho loại axit đặc biệt này.
Sự định nghĩa
Axit clohydric là một axit đơn chức mạnh. Trong một số nguồn, nó có thể được gọi là hydrochloric và hydrochloric, cũng như hydro clorua.
Tính chất vật lý
Nó là một chất lỏng ăn da không màu và bốc khói trong không khí (ảnh bên phải). Tuy nhiên, axit kỹ thuật có màu hơi vàng do sự hiện diện của sắt, clo và các chất phụ gia khác trong đó. Nồng độ lớn nhất của nó ở nhiệt độ 20 ° C là 38%. Khối lượng riêng của axit clohydric với các thông số như vậy là 1,19 g / cm 3. Nhưng hợp chất này ở các mức độ bão hòa khác nhau có dữ liệu hoàn toàn khác nhau.Khi giảm nồng độ, trị số của số mol, độ nhớt và nhiệt độ nóng chảy giảm, nhưng nhiệt dung riêng và nhiệt độ sôi tăng lên. Sự đông đặc của axit clohydric ở bất kỳ nồng độ nào sẽ tạo ra các hyđrat kết tinh khác nhau.
Tính chất hóa học
Tất cả các kim loại đứng trước hydro trong dãy điện hóa về hiệu điện thế của chúng đều có thể tương tác với hợp chất này, tạo thành muối và giải phóng khí hydro. Nếu thay chúng bằng oxit kim loại thì sản phẩm sau phản ứng sẽ là muối tan và nước. Hiệu ứng tương tự sẽ xảy ra trong tương tác của axit clohydric với các hydroxit. Tuy nhiên, nếu người ta thêm bất kỳ muối nào của kim loại (ví dụ, natri cacbonat) vào nó, thì phần còn lại được lấy từ một axit yếu hơn (cacbonic), sau đó là clorua của kim loại này (natri), nước và khí tương ứng với axit cặn (trong trường hợp này là khí cacbonic) được tạo thành.
Biên lai
Hợp chất hiện đang được thảo luận được tạo thành khi khí hydro clorua, có thể thu được bằng cách đốt cháy hydro trong clo, được hòa tan trong nước. Axit clohydric thu được bằng phương pháp này được gọi là tổng hợp. Khí thải cũng có thể đóng vai trò như một nguồn để thu được chất này. Và axit clohiđric như vậy sẽ được gọi là khí tắt. Gần đây, mức độ sản xuất axit clohydric bằng phương pháp này cao hơn nhiều so với sản xuất bằng phương pháp tổng hợp, mặc dù phương pháp sau cho hợp chất ở dạng tinh khiết hơn. Đây là tất cả những cách để đạt được nó trong ngành công nghiệp. Tuy nhiên, trong các phòng thí nghiệm, axit clohydric được sản xuất theo ba cách (hai cách đầu tiên chỉ khác nhau về nhiệt độ và sản phẩm phản ứng) bằng cách sử dụng các loại tương tác hóa học khác nhau, chẳng hạn như:
- Tác dụng của axit sunfuric bão hòa với natri clorua ở 150 ° C.
- Tương tác của các chất trên trong điều kiện có nhiệt độ từ 550 ° C trở lên.
- Thủy phân nhôm hoặc magie clorua.
Đơn xin
Luyện kim thủy lực và điện định hình không thể thực hiện được nếu không sử dụng axit clohydric, khi cần thiết, để làm sạch bề mặt của kim loại trong quá trình luyện thiếc và hàn và để thu được clorua của mangan, sắt, kẽm và các kim loại khác. Trong ngành công nghiệp thực phẩm, hợp chất này được gọi là phụ gia thực phẩm E507 - có một chất điều chỉnh độ axit cần thiết để tạo ra nước seltzer (soda). Axit clohydric đậm đặc cũng được tìm thấy trong dịch dạ dày của bất kỳ người nào và giúp tiêu hóa thức ăn. Trong quá trình này, mức độ bão hòa của nó giảm đi, bởi vì. chế phẩm này được pha loãng với thức ăn. Tuy nhiên, nếu nhịn ăn kéo dài, nồng độ axit clohydric trong dạ dày tăng dần. Và vì hợp chất này rất ăn da, nó có thể dẫn đến loét dạ dày.
Sự kết luận
Axit clohydric có thể vừa có lợi vừa có hại cho con người. Sự tiếp xúc của nó với da dẫn đến bỏng hóa chất nghiêm trọng và hơi của hợp chất này gây kích ứng đường hô hấp và mắt.
Nhưng nếu bạn xử lý chất này cẩn thận, nó có thể có ích hơn một lần trong