Explotación

En las baterías de flujo de vanadio, ambos electrodos de referencia están conectados adicionalmente a tanques de almacenamiento y bombas para que grandes volúmenes de electrolito puedan circular a través de la celda. La circulación del electrolito líquido es algo difícil y limita el uso de baterías de flujo de vanadio en industrias que requieren movilidad, haciéndolas efectivas en grandes edificios estacionarios.
Cuando se carga una batería de vanadio, los iones VO2+ en el electrodo de referencia con carga positiva se convierten en iones VO2+ cuando los electrones se separan del terminal positivo de la batería. De manera similar, en el electrodo de referencia negativo, los electrones convierten los iones V3+ en V2+. Durante la descarga, este proceso se invierte, lo que da como resultado un voltaje de circuito abierto de 1,41 V a 25 °C.
Otras propiedades útiles de las baterías de flujo de vanadio incluyen una respuesta muy rápida a los cambios de carga y una capacidad de sobrecarga extremadamente alta. La investigación de la Universidad de Nueva Gales del Sur ha demostrado que pueden lograr tiempos de respuesta de menos de medio milisegundo con cambios de carga del 100 % y soportar una sobrecarga del 400 % durante más de 10 segundos. En la mayoría de los casos, el tiempo de respuesta está limitado por el equipo eléctrico. Las baterías de vanadio basadas en ácido sulfúrico solo funcionan a temperaturas de 10-40C. Si la temperatura está por debajo de este rango, los iones de ácido sulfúrico cristalizan. La eficiencia en el movimiento alternativo en el uso diario se mantiene en un nivel de 65-75%.
Características de carga y descarga.
Los algoritmos de carga dependen directamente de cómo está dispuesta la batería y a qué tipo pertenece. Por ejemplo, algunas baterías pueden recargar su capacidad de manera segura a partir de fuentes de voltaje constante. Otros funcionan solo con una fuente de corriente ajustable que puede cambiar los parámetros según el nivel de carga.
Un proceso de carga mal organizado puede dañar la batería. En casos extremos, la batería puede encenderse o explotar. Hay baterías inteligentes equipadas con dispositivos de monitoreo de voltaje. Los principales parámetros que se deben tener en cuenta al operar baterías galvánicas reversibles son:
- Esperanza de vida. Incluso con el manejo adecuado, el número de ciclos de carga de una batería es limitado. Los diferentes sistemas de baterías no siempre se desgastan por las mismas razones. Pero, en general, la vida útil de la batería está limitada principalmente por la cantidad de ciclos completos de carga y descarga y, en segundo lugar, por la vida útil del diseño sin referencia a la intensidad de uso.
- Tiempo de carga. El diseño fundamental de la batería no implica cargar a una velocidad arbitrariamente alta: la resistencia interna de la celda galvánica conducirá a la conversión del exceso de corriente de carga en calor, lo que puede dañar irreversiblemente el dispositivo. Desde un punto de vista físico, el tiempo de carga está limitado por la velocidad máxima de difusión del material activo a través del electrolito.De manera simplista, podemos suponer que la restauración de la capacidad total en una hora es un buen indicador.
- Profundidad de descarga. Especificado como un porcentaje de la potencia nominal. Describe la capacidad utilizable. Para diferentes tipos de baterías, el nivel de descarga operativo recomendado puede variar. Por cambios de funcionamiento o envejecimiento, el indicador de profundidad máxima pierde su valor original.
proceso de difusión.
Debido al proceso de difusión, la alineación de la densidad del electrolito en la cavidad de la caja de la batería y en los poros de la masa activa de las placas, la polarización del electrodo se puede mantener en la batería cuando se apaga el circuito externo.
La velocidad de difusión depende directamente de la temperatura del electrolito, cuanto mayor sea la temperatura, más rápido será el proceso y puede variar mucho en el tiempo, desde dos horas hasta un día. La presencia de dos componentes del potencial de electrodo en condiciones transitorias condujo a la división en EMF de equilibrio y no equilibrio de la batería. El equilibrio EMF de la batería se ve afectado por el contenido y la concentración de iones de sustancias activas en el electrolito, así como por las propiedades químicas y físicas de las sustancias activas. El papel principal en la magnitud del EMF lo juega la densidad del electrolito y la temperatura prácticamente no lo afecta. La dependencia de EMF en la densidad se puede expresar mediante la fórmula:
La fem de la batería no es igual al voltaje de la batería, que depende de la presencia o ausencia de carga en sus terminales.
administración25/07/2011
Un comentario
Nombre *
Sitio
Este sitio utiliza Akismet para combatir el spam. Descubra cómo se procesan los datos de sus comentarios.
« Tacómetro mecánico
Voltaje de la batería "
Etiquetas
Mal funcionamiento de VAZ, VAZ Sensores Dispositivos de inyector de encendido Esquemas de arranque Automóviles eléctricos Fuente de alimentación vaz 2110 gacela gacela registradores comerciales reparación de automóviles
entradas recientes
- Sensores en el automóvil: tipos y propósito.
- El coche eléctrico más grande del mundo EDumper,
- Luces láser.
- Ventajas y desventajas de las lámparas halógenas.
- El dispositivo y el principio de funcionamiento de los sensores de estacionamiento.
Archivo
Archivos Seleccionar septiembre de 2019 Agosto 2017 Julio de 2017 Mayo 2017 Abril de 2017 Marzo de 2016 Noviembre de 2016 de noviembre de 2016 DE SEPTIEMBRE DE 2016 DE SEPTIEMBRE DE 2016 DE SEPTIEMBRE DE 2016 JUECE DE 2016 DE JUNIO DE 2016 DE MAYO DE 2016 Abril de 2016 Abril de 2016 Abril de 2016 Febrero de 2016 Noviembre de 2015 Octubre de 2015 Agosto 2015 Julio de 2015 Junio 2015 may 2015 enero 2015 diciembre 2014 noviembre 2014 octubre 2014 septiembre 2014 agosto 2014 julio 2014 junio 2014 mayo 2014 abril 2014 febrero 2014 enero 2014 diciembre 2013 noviembre 2013 octubre 2013 agosto 2013 junio 2013 mayo 2013 mart septiembre 2012, 2013, 2012, 2012, 2012 2012, 2012, 2011, 2012, 2011, 2012, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011. Septiembre 2012, 2011, 2011, 2011, 2011, 2011, 2011
Categorías
- batería acumuladora
- Video
- Generador
- Sensores
- Diagnóstico
- Encendido
- Noticias
- Equipo
- Dispositivos
- Reparar
- Bujía
- Inicio
- Esquema
- Dispositivos
- coches eléctricos
- Fuente de alimentación
estamos en redes sociales
Electricista de automóviles@ Todos los derechos reservados. Al copiar materiales del sitio, debe proporcionar un enlace al sitio.
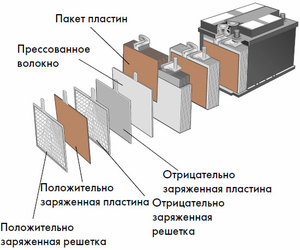
Dispositivo y principio de funcionamiento.
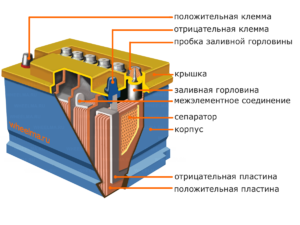
Cada una de estas celdas tiene un cátodo (electrodo positivo) y un ánodo (negativo). Estos electrodos están separados por un electrolito que asegura el intercambio de iones entre ellos. Los materiales de los electrodos y la composición del electrolito se eligen para proporcionar suficiente fuerza electromotriz entre los terminales de la batería.
Dado que los electrodos contienen un potencial limitado de energía química, la batería se agotará durante el funcionamiento. El tipo de celdas galvánicas, que se adapta para la recarga después de una descarga parcial o completa, se denomina batería. Un conjunto de tales celdas interconectadas es una batería.El funcionamiento con batería implica un cambio cíclico de dos estados:
- Carga - la batería funciona como receptora de electricidad, dentro de las celdas la energía eléctrica se realiza en cambios químicos.
- Descarga: el dispositivo funciona como una fuente de corriente eléctrica al convertir la energía de las reacciones químicas en energía eléctrica.
áreas de uso
La característica de ultra alta capacidad de las baterías redox de vanadio las hace muy adecuadas para su uso en industrias que requieren almacenamiento de alta energía. Por ejemplo, ayudar a equilibrar el volumen de producción de fuentes de energía como la eólica o la solar, o ayudar a los generadores a absorber grandes picos de energía cuando sea necesario, o equilibrar la oferta y la demanda de energía en áreas remotas.
Las características limitadas de autodescarga de las baterías redox de vanadio las hacen útiles en industrias donde las baterías deben almacenarse durante largos períodos de tiempo con un mantenimiento y preparación mínimos. Esto llevó a su uso en algunos tipos de electrónica militar, por ejemplo, en los sensores del sistema de minería GATOR. Su capacidad para circular y permanecer en cero las hace adecuadas para aplicaciones e industrias solares donde las baterías deben comenzar el día vacías y recargarse según la carga y el clima. Por ejemplo, las baterías de iones de litio a menudo se dañan cuando se permite que se descarguen por debajo del 20 % de su volumen, por lo que suelen operar en el rango del 20 al 100 %, lo que significa que solo pueden usar el 20 % de su capacidad nominal.
Su tiempo de respuesta extremadamente rápido también los hace prácticamente indispensables para sistemas de alimentación ininterrumpida, donde pueden usarse en lugar de baterías de plomo-ácido e incluso generadores diésel. Además, el rápido tiempo de respuesta los hace adecuados para el control de frecuencia. Por el momento, ni el SAI ni las medidas de gestión de frecuencia son eficaces por sí solos, pero es probable que la batería pueda encontrar aplicaciones en estas industrias cuando se capitalice a partir de diversas fuentes de financiación. Además, estas capacidades hacen que las baterías redox de vanadio sean una solución eficaz de "una pieza" para redes eléctricas pequeñas que dependen de una operación confiable, control de frecuencia y necesidades de conmutación de carga (como alta penetración de energías renovables, cargas altamente fluctuantes o el deseo de optimizar la eficiencia del generador cambiando el tiempo de respuesta).
Las baterías redox de vanadio más grandes que funcionan
Subestación "Minami Hyakita":
- Fecha de lanzamiento: diciembre de 2015
- Energía: 60 MWh
- Potencia: 15 MW
- Tiempo de trabajo: 4 horas
- País: Japón
Stinky, provincia de Liaoning
- Fecha de lanzamiento: N/A
- Energía: 10 MWh
- Potencia: 5 MW
- Tiempo de trabajo: 2 horas
- País: China
Parque eólico Tomamae
- Fecha de lanzamiento: 2005
- Energía: 6 MWh
- Potencia: 4 MW
- Tiempo de trabajo: 1 hora 30 minutos
- País: Japón
Proyecto Zhangbei
- Fecha de lanzamiento 2016
- Energía: 8 MWh
- Potencia: 2 MW
- Tiempo de trabajo: 4 horas.
- País: China
Proyecto SnoPUD MESA 2
- Fecha de lanzamiento: marzo de 2017
- Energía: 8 MWh
- Potencia: 2 MW
- Tiempo de trabajo: 4 horas.
- País: Estados Unidos
Subestación en Escondido
- Fecha de lanzamiento: 2017
- Energía: 8 MWh
- Potencia: 2 MW
- Tiempo de trabajo: 4 horas.
- País: Estados Unidos
Subestación en Pullman, Washington
- Fecha de lanzamiento: abril de 2015
- Energía: 4 MWh
- Potencia: 1 MW
- Tiempo de trabajo: 4 horas
- País: Estados Unidos
Para 2018, se espera que se complete el desarrollo de una batería redox de vanadio en China. Su energía será de 800 MWh, potencia - 200 MW y tiempo de operación - 4 horas.
Condiciones
- Secuencial: los elementos se suceden uno tras otro.
- La fuerza electromotriz (EMF) es el voltaje generado por una batería o fuerza magnética de acuerdo con la ley de Faraday.
- Paralelo: los componentes eléctricos están dispuestos de modo que la corriente fluya a lo largo de dos o más caminos.
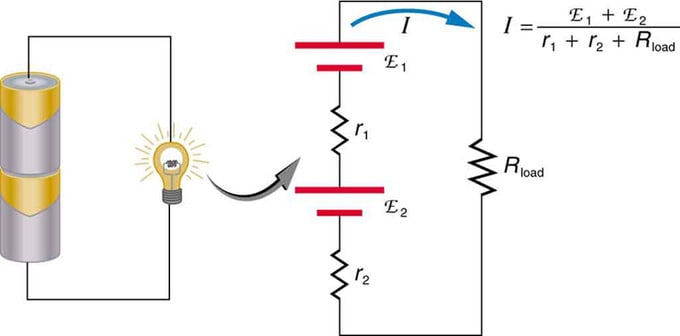
Si está utilizando múltiples fuentes de voltaje, se pueden conectar en serie o en paralelo. Con la versión en serie, se sintonizan en la misma dirección, se suma la resistencia interna y se suma algebraicamente la fuerza electromotriz. Tipos similares son comunes en linternas, juguetes y una variedad de otros electrodomésticos. Las celdas se colocan en serie para aumentar la fem total.
Conexión en serie de dos fuentes de voltaje en la misma dirección. El diagrama muestra una linterna con dos celdas y una lámpara.
Batería: conexión múltiple de elementos de voltaje. Pero hay una desventaja en la conexión en serie, ya que se agregan resistencias internas. A veces esto crea problemas. Digamos que tiene dos baterías de 6V que coloca en lugar de las habituales de 12V. Como resultado, ha agregado no solo el EMF, sino también la resistencia interna de cada batería.
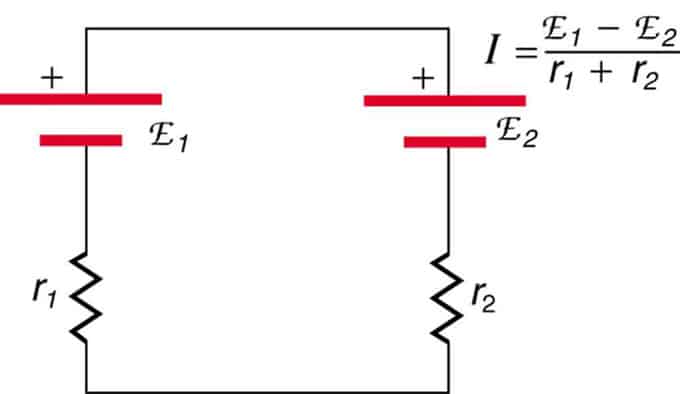
Si las celdas están ubicadas en oposición (una está ubicada detrás de la otra), entonces el EMF total disminuirá.
Estas son dos fuentes de voltaje conectadas en serie con emisiones opuestas. La corriente fluye en la dirección de mayor EMF y está limitada por la suma de las resistencias internas. Un ejemplo es un cargador. Debe tener más fem que la batería.
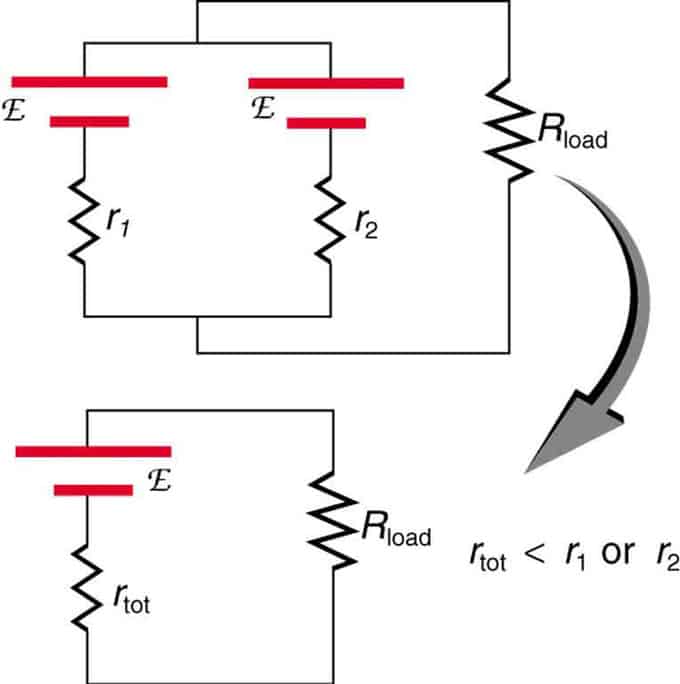
Si dos fuentes con la misma fuerza electromotriz se ubican en paralelo y se conectan a la resistencia de carga, entonces la FEM total sigue siendo la misma que las individuales. Sin embargo, la resistencia interna total se reducirá. Resulta que la versión paralela puede generar más corriente.
Dos fuentes de voltaje con un solo EMF se combinan en una conexión paralela. Forman un EMF, pero tienen menos resistencia total que individualmente. Se utilizan combinaciones similares si necesita lograr más corriente.
| Descripción general |
|
| Conexión en paralelo y en serie de resistencias. |
|
| Reglas de Kirchhoff |
|
| voltímetros y amperímetros |
|
| Circuitos RC |
|
Panorama historico
El desarrollo de la primera celda galvánica se atribuye al físico italiano Alessandro Volta. Realizó una serie de experimentos con fenómenos electroquímicos durante la década de 1790 y alrededor de 1800 creó la primera batería, que sus contemporáneos llamaron "columna voltaica". El dispositivo consistía en discos alternos de zinc y plata separados por capas de papel o tela que se empapaban en una solución de hidróxido de sodio.
Estos experimentos se convirtieron en la base del trabajo de Michael Faraday sobre las leyes cuantitativas de la electroquímica. Describió el principio de funcionamiento de la batería y, basándose en el trabajo del científico, se crearon las primeras celdas eléctricas comerciales. La evolución posterior se veía así:
- En 1836, el químico británico John Daniel presentó un modelo mejorado de la celda, consistente en electrodos de cobre y zinc sumergidos en ácido clorhídrico. El elemento de Daniel pudo proporcionar un voltaje constante incomparablemente más eficiente que los dispositivos de Volt.
- 1839 El físico Grove hizo más progresos con su celda de dos fluidos, que consiste en zinc sumergido en ácido sulfúrico diluido en un recipiente poroso. Este último separaba el ácido sulfúrico de un recipiente que contenía ácido nítrico con un cátodo de platino colocado en él. El ácido nítrico sirvió como agente oxidante para evitar la pérdida de voltaje debido a la acumulación de hidrógeno en el cátodo.El químico alemán Robert Bunsen reemplazó el platino con carbono de bajo costo en la celda Grove y, por lo tanto, promovió la aceptación generalizada de este tipo de batería.
- En 1859, Gaston Plante inventó la pila de plomo-ácido, precursora de la batería de automóvil moderna. El dispositivo de Plante pudo producir una corriente inusualmente grande, pero se usó solo para experimentos en laboratorios durante casi dos décadas.
- 1895-1905 años. Invención de los elementos alcalinos de níquel-cadmio y níquel-hierro. Esto hizo posible crear sistemas con un número significativo de ciclos de carga y descarga.
- A partir de la década de 1930 se inició el desarrollo de las pilas alcalinas de plata-zinc y mercurio-zinc, que proporcionaban alta densidad de energía por unidad de peso y volumen.
- Desde mediados del siglo XX, los avances en la tecnología de fabricación y la llegada de nuevos materiales han dado lugar a baterías aún más potentes y compactas. Lo más notable fue la introducción de baterías de litio e hidruro metálico de níquel en el mercado.
Carga de baterías
Articulo principal: Cargador
A medida que se agota la energía química, el voltaje y la corriente caen, y la batería deja de funcionar. Puede cargar la batería (batería de baterías) desde cualquier fuente de CC con un voltaje más alto mientras limita la corriente. La más común es la corriente de carga (en amperios), proporcional a 1/10 de la capacidad nominal condicional de la batería (en amperios hora).
Sin embargo, en base a la descripción técnica distribuida por los fabricantes de baterías eléctricas de uso generalizado (NiMH, NiCd), se puede suponer que este modo de carga, comúnmente denominado estándar, se calcula sobre la base de la duración de una jornada laboral de ocho horas, cuando la batería, descargada al final de la jornada laboral, se conecta al cargador de red antes del inicio de una nueva jornada laboral. El uso de tal modo de carga para este tipo de baterías con un uso sistemático permite mantener un equilibrio calidad-costo en el funcionamiento del producto. Por lo tanto, a sugerencia del fabricante, este modo solo se puede utilizar para baterías de níquel-cadmio e hidruro de níquel-metal.
Muchos tipos de baterías tienen diferentes limitaciones que deben tenerse en cuenta durante la carga y el uso posterior, por ejemplo, las baterías de NiMH son sensibles a la sobrecarga, las baterías de litio son sensibles a la sobredescarga, el voltaje y la temperatura. Las baterías de NiCd y NiMH tienen el llamado efecto memoria, que consiste en una disminución de la capacidad cuando se realiza la carga cuando la batería no está completamente descargada. Además, este tipo de baterías tienen una autodescarga notable, es decir, pierden carga gradualmente sin estar conectadas a la carga. Para combatir este efecto se puede utilizar la recarga por goteo.
Métodos de carga de la batería
Se utilizan varios métodos para cargar las baterías; Generalmente, el método de carga depende del tipo de batería.
- Carga CC lenta
Cargue con una corriente continua proporcional a 0,1-0,2 de la capacidad nominal condicional Q durante unas 15-7 horas, respectivamente.
El método de carga más largo y seguro. Adecuado para la mayoría de los tipos de baterías.
- carga rápida
Cargue con corriente continua proporcional a 1/3 Q durante unas 3-5 horas.
- Carga acelerada o "delta-V"
Una carga con una corriente de carga inicial proporcional a la capacidad nominal nominal de la batería, en la que se mide constantemente el voltaje de la batería y la carga finaliza una vez que la batería está completamente cargada. El tiempo de carga es de aproximadamente una hora y media. La batería puede sobrecalentarse e incluso destruirla.
- Carga inversa
Se realiza alternando pulsos largos de carga con pulsos cortos de descarga. El método inverso es más útil para cargar baterías NiCd y NiMH, que se caracterizan por los llamados.norte. "efecto memoria".