Korištenje klorovodične kiseline
Klorovodična kiselina ima široku primjenu u industriji za vađenje metala iz ruda, kiseljenje metala itd. Također se koristi u proizvodnji tekućine za lemljenje, u taloženju srebra i kao sastavni dio carske vode.
Opseg upotrebe klorovodične kiseline u industriji manji je od one dušične kiseline. To je zbog činjenice da klorovodična kiselina uzrokuje koroziju čelične opreme. Osim toga, njegove hlapljive pare su prilično štetne i također uzrokuju koroziju metalnih proizvoda. To se mora uzeti u obzir pri skladištenju klorovodične kiseline. Klorovodonična kiselina se skladišti i transportira u tankovima i bačvama obloženim gumom, t.j. u posudama čija je unutarnja površina prekrivena gumom otpornom na kiseline, kao iu staklenim bocama i posuđem od polietilena.
Klorovodična kiselina se koristi za proizvodnju klorida cinka, mangana, željeza i drugih metala, kao i amonijevog klorida. Klorovodična kiselina se koristi za čišćenje površina metala, posuda, bunara od karbonata, oksida i drugih sedimenata i onečišćenja. U ovom slučaju koriste se posebni aditivi - inhibitori koji štite metal od otapanja i korozije, ali ne odgađaju otapanje oksida, karbonata i drugih sličnih spojeva.
HCl se koristi u industrijskoj proizvodnji sintetičkih smola, gume. Koristi se kao sirovina u proizvodnji metil klorida iz metilnog alkohola, etil klorida iz etilena i vinil klorida iz acetilena.
Prva pomoć i metode liječenja
Ako se pronađu znakovi trovanja, potrebno je pozvati hitnu pomoć. Kod kuće je dopušteno provoditi aktivnosti usmjerene na poboljšanje stanja žrtve. Prvu pomoć kod trovanja klorovodičnom kiselinom treba provesti brzo kako bi se smanjio rizik od negativnih posljedica.
Događaji:
- Ako spoj soli dospije na kožu, oštećena mjesta se isperu s puno hladne vode. Vrijeme obrade je najmanje pola sata.
- U slučaju opijenosti parama, žrtvi se osigurava pristup svježem zraku, otvaraju se prozori, otkopčava se uska odjeća.
- Preporuča se pratiti stanje bolesnika, u nedostatku znakova života provodi se reanimacija.
- Žrtva od para smije piti topli čaj, vodu. Preporuča se isprati nos i usta hladnom vodom.
- U slučaju predoziranja uslijed gutanja kiseline, na trbuh se stavlja ledena obloga kako bi se spriječilo ili smanjilo moguće krvarenje.
- Nisu dopušteni nikakvi lijekovi. Dopušteno je dati pacijentu čašu vode (možete mineralno alkalnu). Tekućina je potrebna u malim gutljajima.
- Nije dopušteno oprati želudac, pokušajte izazvati povraćanje kod kuće. Takva prva pomoć može dovesti do razvoja opeklina grla, krvarenja.
Liječenje se provodi u zdravstvenoj ustanovi pod nadzorom stručnjaka.
Terapija:
- Čišćenje želuca sondom,
- Upotreba kapaljki s ljekovitim otopinama,
- Propisivanje lijekova za ublažavanje boli
- Upotreba lijekova usmjerenih na obnavljanje rada organa i sustava,
- Ako je potrebno, inhalacija kisika i umjetna ventilacija pluća,
- Provođenje terapije reanimacije u nedostatku znakova života,
- Izbor vitamina i posebne prehrane.
Liječenje se provodi na intenzivnoj njezi, a zatim u bolnici. Trajanje ovisi o stanju bolesnika i stupnju trovanja.
Opekline i trovanja
Koliko god ovaj lijek bio učinkovit, opasan je. Klorovodična kiselina, ovisno o koncentraciji, može izazvati kemijske opekline četiri stupnja:
- Postoji samo crvenilo i bol.
- Postoje mjehurići s bistrom tekućinom i oteklina.
- Formirana nekroza gornjih slojeva kože.Mjehurići se pune krvlju ili zamućenim sadržajem.
- Lezija doseže tetive i mišiće.
Ako je tvar nekako dospjela u oči, potrebno ih je isprati vodom, a zatim otopinom sode. Ali u svakom slučaju, prva stvar koju treba učiniti je pozvati hitnu pomoć.
Gutanje kiseline iznutra je ispunjeno akutnim bolovima u prsima i trbuhu, oticanjem grkljana, povraćanjem krvavih masa. Kao rezultat toga, teške patologije jetre i bubrega.
A prvi znakovi trovanja u paru su suhi česti kašalj, gušenje, oštećenje zuba, peckanje u sluznici i bol u trbuhu. Prva hitna pomoć je pranje i ispiranje usta vodom, kao i pristup svježem zraku. Pravu pomoć može pružiti samo toksikolog.
Svojstva kemijskog spektra
Kiselina stupa u interakciju s mnogim metalima, solima. Smatra se prilično jakim i u rangu je s divokozom. Glavna reakcija se očituje u svim skupinama metala koji se nalaze lijevo od vodika (magnezij, željezo, cink – električni potencijali).
Otopina klorovodika u razrijeđenom obliku reagira sa solima, ali samo s onima koje stvaraju manje jake kiseline. Svima poznati natrijev i kalcijev karbonat, nakon interakcije s njim, razgrađuju se na vodu i ugljični monoksid.
Dušična kiselina
- kvalitativna reakcija na fiziološku otopinu. Da biste ga dobili, potrebno je ovom reagensu dodati srebrni nitrat, kao rezultat toga će se formirati bijeli talog iz kojeg se dobiva dušična tvar.
Uz pomoć ove mješavine vode i vodika provode se mnogi zanimljivi pokusi. Na primjer, razrijedite ga amonijakom. Kao rezultat, dobit ćete bijeli dim, gust, koji ima konzistenciju malih kristala. Metilamin, anilin, manganov dioksid, kalijev karbonat su reagensi na koje također djeluje kiselina.
Kako i zašto se koristi
Možda je to s pravom jedna od važnih supstanci koje se nalaze i potrebne u gotovo svim granama ljudskog života.
Lokalizacija područja primjene:
- Metalurgija. Površinsko čišćenje od oksidiranih područja, otapanje hrđe, obrada predlemljenjem, kalajisanje. Klorovodična kiselina pomaže u izdvajanju malih inkluzija metala iz ruda. Cirkonij i titan dobivaju se metodom pretvorbe oksida u kloride.
- Industrija prehrambene tehnologije. Kao dodatak hrani koristi se otopina niske koncentracije. Želatina, fruktoza za dijabetičare sadrže čisti emulgator. Obična soda također ima visok sadržaj ove tvari. Na pakiranju robe vidjet ćete ga pod imenom E507.
- Područje medicine. S nedovoljnim pokazateljem kiselog okoliša u želucu i problemima s crijevima. Nizak Ph dovodi do raka. Čak i uz pravilnu prehranu, vitamine u izobilju, opasnost ne nestaje, potrebno je provesti testove za dobivanje soka iz želučanog trakta, jer se u nedovoljno kiselom okruženju korisne tvari praktički ne apsorbiraju, probava je poremećena.
- Otopina soli koristi se kao inhibitor - zaštita od prljavštine i infekcija, antiseptičko djelovanje. Za proizvodnju ljepljivih smjesa, keramičkih proizvoda. Ispira izmjenjivače topline.
- Postupak pročišćavanja pitke vode također nije potpun bez sudjelovanja klora.
- Proizvodnja gume, izbjeljivanje podloga od tkanine.
- S ovom otopinom možete njegovati svoje leće.
- Voda za ispiranje usta kod kuće
- Tvar je izvrstan vodič električne energije.
Kako dolazi do trovanja
Klorovodonična kiselina je bezbojna tekućina karakterističnog oštrog mirisa. Jedna od najjačih kiselina, sposobna otopiti neke metale. Lako se pretvara u plin.
Klorovodik se koristi u tekstilnoj industriji, kožarstvu, metalurgiji plemenitih metala, u proizvodnji ljepila, kiselina.
Tvar je prisutna u želucu u minimalnoj koncentraciji. Kiselina pridonosi normalizaciji probavnog procesa, štiti tijelo od štetnih bakterija i mikroorganizama.
U koncentraciji većoj od 24%, klorovodična kiselina može uzrokovati nepovratnu štetu ljudskom tijelu. Pare nastale u dodiru sa zrakom uzrokuju iritaciju organa vidnog i dišnog sustava.
Postoji nekoliko čimbenika koji mogu izazvati razvoj trovanja.
Čimbenici:
Opijenost parom je moguća pri radu u prostorijama s lošom ventilacijom,
Gutanje iz nemara, češće kod djece,
Ulazak klorovodične kiseline na epidermu, sluznicu u slučaju nepoštivanja pravila za korištenje reagensa.
Trovanje nekom tvari kod kuće kod odraslih nastaje kao posljedica uporabe bez zaštitne opreme kože, očiju i organa dišnog sustava. Do intoksikacije može doći kada se kiselina netočno prenosi iz jedne posude u drugu.
Farmakodinamika i farmakokinetika
Što je želučana kiselost? Ovo je karakteristika koncentracije klorovodične kiseline u želucu. Kiselost se izražava u pH
. Normalno, kiselina bi se trebala proizvoditi u sastavu želučanog soka i aktivno sudjelovati u procesima probave. Formula klorovodične kiseline: HCl
. Proizvode ga parijetalne stanice smještene u fundicnim žlijezdama, uz sudjelovanje H+/K+-ATPaza
. Ove stanice oblažu fundus i tijelo želuca. Sama kiselost želučanog soka je promjenjiva i ovisi o broju parijetalnih stanica i intenzitetu procesa neutralizacije tvari alkalnim komponentama želučanog soka. Koncentracija proizvedena na - vi ste stabilni i jednaki 160 mmol/l. Zdrava osoba normalno ne bi trebala proizvoditi više od 7 i najmanje 5 mmol tvari na sat.
Kod nedovoljne ili prekomjerne proizvodnje klorovodične kiseline nastaju bolesti probavnog trakta, pogoršava se sposobnost apsorpcije određenih mikroelemenata, poput željeza. Lijek potiče izlučivanje želučanog soka, smanjuje pH
. Aktivira pepsinogen
, pretvara ga u aktivni enzim pepsin
. Tvar ima blagotvoran učinak na kiselinski refleks želuca, usporava prijelaz nepotpuno probavljene hrane u crijeva. Procesi fermentacije sadržaja probavnog trakta usporavaju, bol i podrigivanje nestaju, željezo se bolje apsorbira.
Nakon oralne primjene, lijek se djelomično metabolizira slinom i želučanom sluzi, sadržajem duodenuma 12. Nevezana tvar prodire u duodenum, gdje se svojim alkalnim sadržajem potpuno neutralizira.
Još jedna upotreba kiseline u svakodnevnom životu
S kiselim sastavom možete jednostavno očistiti kamenac i hrđu s fajanse vodovoda, ukloniti mokraćni kamen i druge nečistoće. Za veći učinak, sredstvu se dodaje inhibitor (na primjer, urotropin), koji usporava kemijsku reakciju.
Postupak se provodi na sljedeći način: kiselina se razrijedi vodom dok se ne postigne koncentracija od 5% i dodaje se inhibitor brzinom od 0,5 g na 1 litru tekućine. Površina se tretira dobivenim sastavom i ostavi 30-40 minuta (ovisno o stupnju onečišćenja), nakon čega se ispere vodom.
Blaga otopina kiseline također se koristi za uklanjanje mrlja od bobica, mrlja od tinte ili hrđe s tkanina. Da biste to učinili, materijal se neko vrijeme natopi u sastav, nakon čega se temeljito ispere i ispere na uobičajeni način.
Riješite se kamenca u kuhalu za vodu
U tu svrhu koristi se 3-5% otopina klorovodične kiseline, koja se ulije u kotlić i zagrije na 60-80°C.°
C 1-2 sata ili dok se naslage kamenca ne raspadnu. Nakon toga ljuska postaje labava i lako se uklanja drvenom lopaticom.
Učinkovitost metode je zbog činjenice da reagens reagira s magnezijevim i kalcijevim karbonatima i pretvara ih u topive soli. Ugljični dioksid koji se oslobađa u isto vrijeme uništava sloj kamenca i čini ga labavim. Nakon uklanjanja naslaga soli, posuđe se temeljito ispere čistom vodom.
Važna točka!
Ova metoda nije prikladna za uklanjanje kamenca od napuklih i napuklih caklinskih ili aluminijskih kuhala za vodu: to će korodirati metal i uzrokovati ozbiljna oštećenja.
Dobivanje tvari
Sada možemo razgovarati o tome što oni čine za stvaranje klorovodične kiseline.
Prvo, spaljivanjem vodika u kloru, dobiva se glavna komponenta, plinoviti klorovodik. koji se zatim otopi u vodi. Rezultat ove jednostavne reakcije je stvaranje sintetske kiseline.
Ova tvar se također može dobiti iz otpadnih plinova. To su kemijski otpadni (bočni) plinovi. Nastaju raznim procesima. Na primjer, kod kloriranja ugljikovodika. Klorovodik u njihovom sastavu naziva se otpadni plin. I tako dobivena kiselina, respektivno.
Treba napomenuti da se posljednjih godina povećava udio otpadnih plinova u ukupnom obujmu njegove proizvodnje. I kiselina nastala kao rezultat izgaranja vodika u kloru se istiskuje. Međutim, pošteno radi, treba napomenuti da sadrži manje nečistoća.
Upotreba u proizvodnji
Ima široku primjenu u metalurškoj, prehrambenoj i medicinskoj industriji.
- Metalurgija. Koristi se za lemljenje, kalajisanje i čišćenje metala.
- Industrija hrane. Primjena u proizvodnji regulatora kiselosti hrane, na primjer, E507.
- Elektrotipija. Koristi se za kiseljenje.
- Lijek. Svoju primjenu nalazi u proizvodnji umjetnog želučanog soka.
Uključeno u sintetičke boje. Koristi se u proizvodnji sredstava za čišćenje i deterdžent. Ali u tekućinama namijenjenim za kućnu upotrebu, koncentracija sumporne kiseline je zanemariva.
Kako se klorovodična kiselina proizvodi u laboratoriju
Proizvodnja tvari je velika, prodaja je besplatna. U uvjetima laboratorijskih pokusa, otopina se dobiva djelovanjem sumporne kiseline visoke koncentracije na običnu kuhinjsku sol (natrijev klorid).
Postoje 2 metode za otapanje klorovodika u vodi:
- Vodik se spaljuje u kloru (sintetski).
- Povezani (ispusni plin). Njegova je bit u provođenju organskog kloriranja, dehidrokloracije.
Tvar se dobro može sintetizirati tijekom pirolize otpada iz organoklor. To se događa kao rezultat razgradnje ugljikovodika s potpunim nedostatkom kisika. Također možete koristiti metalne kloride, koji su sirovine za anorganske tvari. Ako nema koncentrirane sumporne kiseline (elektrolita), uzimajte razrijeđenu.
Što se tiče ekstrakcije reagensa u prirodnim uvjetima, najčešće se ova kemijska smjesa može naći u vodama vulkanskog otpada. Klorovodik je sastavni dio minerala silvin (kalijev klorid, izgleda kao kosti za igre), bišofit. Sve su to metode za ekstrakciju tvari u industriji.
Kod ljudi se ovaj enzim nalazi u želucu. Otopina može biti kiselina ili baza. Jedna od najčešćih metoda ekstrakcije naziva se sulfat.
Kemijska svojstva
Klorovodična kiselina, klorovodik ili klorovodična kiselina - otopina HCl
u vodi. Prema Wikipediji, tvar pripada skupini anorganskih jakih jednobaznih to-t. Puni naziv spoja na latinskom: klorovodična kiselina.
Formula klorovodične kiseline u hemiji: HCl
. U molekuli se atomi vodika kombiniraju s atomima halogena - Cl
. Ako uzmemo u obzir elektroničku konfiguraciju ovih molekula, može se primijetiti da spojevi sudjeluju u formiranju molekularnih orbitala 1s
-vodikove orbitale i oboje 3s
i 3p
-orbitale atoma Cl
. U kemijskoj formuli klorovodične kiseline 1s-
, 3s-
i 3r
-atomske orbitale se preklapaju i tvore 1, 2, 3 orbitale. Pri čemu 3s
-orbitala nije obvezujuća. Dolazi do pomaka elektronske gustoće na atom Cl
a polaritet molekule se smanjuje, ali se energija vezanja molekularnih orbitala povećava (ako je uzmemo u obzir zajedno s drugim vodikovi halogenidi
).
Fizikalna svojstva klorovodika. To je bistra, bezbojna tekućina koja se dimi kada je izložena zraku. Molarna masa kemijskog spoja = 36,6 grama po molu. U standardnim uvjetima, pri temperaturi zraka od 20 stupnjeva Celzija, maksimalna koncentracija tvari je 38% težinski. Gustoća koncentrirane klorovodične kiseline u ovoj vrsti otopine je 1,19 g/cm³. Općenito, fizička svojstva i karakteristike kao što su gustoća, molarnost, viskozitet, toplinski kapacitet, vrelište i pH
, jako ovise o koncentraciji otopine. Ove vrijednosti su detaljnije obrađene u tablici gustoća. Na primjer, gustoća klorovodične kiseline 10% = 1,048 kg po litri. Kada se skrući, tvar se formira kristalni hidrati
različite kompozicije.
Kemijska svojstva klorovodične kiseline. S čime reagira klorovodična kiselina? Tvar u interakciji s metalima koji stoje ispred vodika u nizu elektrokemijskih potencijala (željezo, magnezij, cink i drugi). U tom slučaju nastaju soli i plinovite H
. Olovo, bakar, zlato, srebro i drugi metali desno od vodika ne reagiraju sa klorovodičnom kiselinom. Tvar reagira s metalnim oksidima stvarajući vodu i topljivu sol. Natrijev hidroksid pod djelovanjem to-ti formira i vode. Reakcija neutralizacije je karakteristična za ovaj spoj.
Razrijeđena klorovodična kiselina reagira s metalnim solima, koje nastaju slabijim kiselinama. Na primjer, propionska kiselina
slabije od soli. Tvar ne reagira s jačim kiselinama. i natrijev karbonat
nastat će nakon reakcije s HCl
klorid, ugljični monoksid i voda.
Za kemijski spoj karakteristične su reakcije s jakim oksidantima, s manganov dioksid
, kalijev permanganat
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. Tvar reagira sa amonijak
, koji proizvodi gusti bijeli dim, koji se sastoji od vrlo finih kristala amonijevog klorida. Mineral piroluzit također reagira sa klorovodičnom kiselinom, jer sadrži manganov dioksid
: MnO2+4HCl=Cl2+MnO2+2H2O
(oksidacijska reakcija).
Postoji kvalitativna reakcija na klorovodičnu kiselinu i njezine soli. Kada je tvar u interakciji s srebrni nitrat
bijeli talog srebrni klorid
i formirana dušična kiselina
. Jednadžba reakcije interakcije metilamin
sa klorovodikom izgleda ovako: HCl + CH3NH2 = (CH3NH3)Cl
.
Tvar reagira sa slabom bazom anilin
. Nakon otapanja anilina u vodi, smjesi se dodaje klorovodična kiselina. Kao rezultat toga, baza se otapa i formira anilin hidroklorid
(fenilamonijev klorid
): (S6N5NH3)Cl
. Reakcija interakcije aluminijevog karbida sa klorovodičnom kiselinom: Al4C3+12HCL=3CH4+4AlCl3
. Jednadžba reakcije kalijev karbonat
s kojim to izgleda ovako: K2CO3 + 2HCl = 2KCl + H2O + CO2.
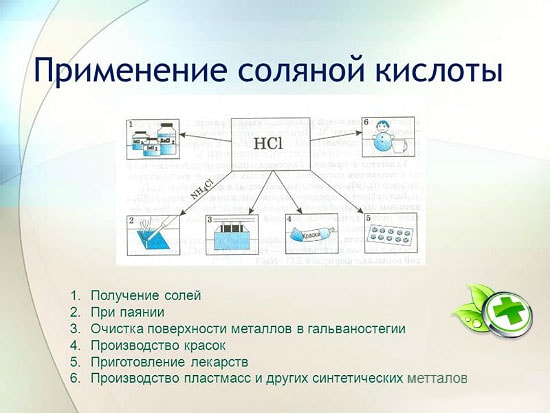
Primjena
u metalurgiji za vađenje ruda, uklanjanje hrđe, kamenca, prljavštine i oksida, lemljenje i kalajisanje;
u proizvodnji sintetičkih guma i smola;
u galvanizaciji;
kao regulator kiselosti u prehrambenoj industriji;
za dobivanje metalnih klorida;
za dobivanje klora;
u medicini za liječenje nedovoljne kiselosti želučanog soka;
kao sredstvo za čišćenje i dezinfekciju.
- (HCl), vodena otopina klorovodika, bezbojni plin oštrog mirisa. Dobiva se djelovanjem sumporne kiseline na običnu sol, kao nusprodukt kloriranja ugljikovodika, ili reakcijom vodika i klora. Klorovodična kiselina se koristi za ... ... Znanstveno-tehnički enciklopedijski rječnik
Klorovodična kiselina
- - HCl (SC) (klorovodična kiselina, klorovodična kiselina, klorovodik) je otopina klorovodika (HCl) u vodi, aditiv protiv smrzavanja. To je bezbojna tekućina oštrog mirisa, bez suspendiranih čestica. ... ... Enciklopedija pojmova, definicija i objašnjenja građevinskih materijala
KLOROVODIČNA KISELINA
- (klorovodična kiselina) otopina klorovodika u vodi; jaka kiselina. Bezbojna tekućina koja dimi na zraku (tehnička klorovodična kiselina je žućkasta zbog nečistoća Fe, Cl2 itd.). Maksimalna koncentracija (na 20 °C) je 38% mase, ... ... Veliki enciklopedijski rječnik
KLOROVODIČNA KISELINA
- (Acidum muriaticum, Acid, hydrochloricum), otopina klorovodika (HC1) u vodi. U prirodi se javlja u vodi određenih izvora vulkanskog porijekla, a nalazi se i u želučanom soku (do 0,5%). Klorovodik se može dobiti ... Velika medicinska enciklopedija
KLOROVODIČNA KISELINA
- (klorovodična kiselina, klorovodična kiselina) jaka jednobazna hlapljiva kiselina oštrog mirisa, vodena otopina klorovodika; maksimalna koncentracija je 38% mase, gustoća takve otopine je 1,19 g/cm3. Koristi se u ... ... ruskoj enciklopediji zaštite rada
KLOROVODIČNA KISELINA
- (klorovodična kiselina) HCl vodena otopina klorovodika, jaka jednobazna kiselina, hlapljiva, oštrog mirisa; nečistoće željeza, klor ga boje žućkasto. Koncentrirani S. za prodaju sadrži 37% ... ... Velika politehnička enciklopedija
klorovodična kiselina
— imenica, broj sinonima: 1 acid (171) Rječnik sinonima ASIS. V.N. Trishin. 2013 ... Rječnik sinonima
KLOROVODIČNA KISELINA
Moderna enciklopedija
Klorovodična kiselina
- VODONIČNA KISELINA, vodena otopina klorovodika HCl; dimljiva tekućina oštrog mirisa. Klorovodična kiselina se koristi za dobivanje raznih klorida, kiseljenje metala, preradu ruda, u proizvodnji klora, sode, gume itd. ... ... Ilustrirani enciklopedijski rječnik
klorovodična kiselina
- (klorovodična kiselina), otopina klorovodika u vodi; jaka kiselina. Bezbojna tekućina koja "dimi" na zraku (tehnička klorovodična kiselina je žućkasta zbog nečistoća Fe, Cl2 itd.). Maksimalna koncentracija (pri 20 °C) 38% mase, ... ... Enciklopedijski rječnik
Koja je opasnost od opijenosti
Solna kiselina je posebna opasnost za ljudski organizam. U slučaju trovanja takvom tvari mogu se razviti ozbiljne komplikacije i kršenja funkcionalnosti tijela.
komplikacije:
- Povreda jetre, kao posljedica toksičnog hepatitisa,
- Krvarenje u želucu zbog uništenih zidova organa,
- Šok od boli kada kiselina uđe u veliko područje,
- U slučaju kontakta s očima, oštećenje vida,
- Ozbiljni poremećaj u radu bubrega,
- Zatajenje disanja, gušenje, nedostatak daha,
- Razvoj kome.
Slične posljedice razvijaju se postupno ovisno o stupnju trovanja.
Zaključak
Ako se pridržavate mjera opreza i sigurnosnih pravila, klorovodična kiselina postat će nezamjenjiv pomoćnik u svakodnevnom životu. A možete ga kupiti po najpovoljnijim cijenama u našoj tvrtki.
Poput kiselina. Programom edukacije predviđeno je pamćenje od strane učenika imena i formula šest predstavnika ove skupine. I, pregledavajući tablicu koju pruža udžbenik, na popisu kiselina uočavate onu koja je prva i koja vas je prije svega zanimala - klorovodičnu kiselinu. Jao, u učionici u školi se ne proučava ni imovina ni bilo koji drugi podaci o njoj. Stoga oni koji su željni znanja izvan školskog programa traže dodatne informacije u svim mogućim izvorima. Ali često, mnogi ne pronađu informacije koje su im potrebne. I tako je tema današnjeg članka posvećena ovoj kiselini.
Definicija
Klorovodonična kiselina je jaka jednobazna kiselina. U nekim se izvorima može nazvati klorovodikom i klorovodikom, kao i klorovodikom.
Fizička svojstva
To je bezbojna i dimljiva kaustična tekućina u zraku (slika desno). Međutim, tehnička kiselina ima žućkastu boju zbog prisutnosti željeza, klora i drugih aditiva u njoj. Njegova najveća koncentracija na temperaturi od 20 °C iznosi 38%. Gustoća klorovodične kiseline s takvim parametrima je 1,19 g/cm 3 . Ali ovaj spoj u različitim stupnjevima zasićenosti ima potpuno različite podatke.Sa smanjenjem koncentracije smanjuje se brojčana vrijednost molarnosti, viskoznosti i tališta, ali se povećava specifični toplinski kapacitet i vrelište. Stvrdnjavanje klorovodične kiseline bilo koje koncentracije daje različite kristalne hidrate.
Kemijska svojstva
Svi metali koji dolaze prije vodika u elektrokemijskom nizu njihovog napona mogu komunicirati s ovim spojem, tvoreći soli i oslobađajući plinoviti vodik. Ako su zamijenjeni metalnim oksidima, tada će produkti reakcije biti topljiva sol i voda. Isti učinak bit će u interakciji klorovodične kiseline s hidroksidima. Međutim, ako joj se doda bilo koja sol metala (na primjer, natrijev karbonat), čiji je ostatak uzet iz slabije kiseline (ugljične), tada klorid tog metala (natrij), voda i plin koji odgovaraju kiselini nastaju ostaci (u ovom slučaju ugljični dioksid).
Priznanica
Spoj o kojem se sada raspravlja nastaje kada se plinoviti klorovodik, koji se može dobiti spaljivanjem vodika u kloru, otopi u vodi. Klorovodična kiselina, koja je dobivena ovom metodom, naziva se sintetičkom. Izlazni plinovi također mogu poslužiti kao izvor za dobivanje ove tvari. I takva klorovodična kiselina će se zvati otpadnim plinom. Nedavno je razina proizvodnje klorovodične kiseline ovom metodom mnogo veća od njezine proizvodnje sintetskom metodom, iako potonja daje spoj u čišćem obliku. Sve su to načini da se to dobije u industriji. Međutim, u laboratorijima se klorovodična kiselina proizvodi na tri načina (prva dva se razlikuju samo po temperaturi i produktima reakcije) korištenjem različitih vrsta kemijskih interakcija, kao što su:
- Utjecaj zasićene sumporne kiseline na natrijev klorid pri temperaturi od 150 o C.
- Interakcija gore navedenih tvari u uvjetima s temperaturom od 550 ° C i više.
- Hidroliza aluminijskih ili magnezijevih klorida.
Primjena
Hidrometalurgija i elektroformiranje ne mogu bez upotrebe klorovodične kiseline, gdje je to potrebno, za čišćenje površine metala tijekom kalajisanja i lemljenja te za dobivanje klorida mangana, željeza, cinka i drugih metala. U prehrambenoj industriji ovaj spoj je poznat kao aditiv za hranu E507 - tamo je regulator kiselosti neophodan za proizvodnju sode vode. Koncentrirana klorovodična kiselina također se nalazi u želučanom soku svake osobe i pomaže u probavi hrane. Tijekom tog procesa smanjuje se njegov stupanj zasićenosti, jer. ovaj sastav se razrijedi hranom. Međutim, s produljenim gladovanjem koncentracija klorovodične kiseline u želucu postupno raste. A budući da je ovaj spoj vrlo zajedljiv, može dovesti do čira na želucu.
Zaključak
Klorovodična kiselina može biti i korisna i štetna za ljude. Njegov dodir s kožom dovodi do pojave teških kemijskih opeklina, a pare ovog spoja nadražuju dišne putove i oči.
Ali ako pažljivo rukujete ovom tvari, može vam više puta doći