Eksploitasi

Dalam bateri aliran vanadium, kedua-dua elektrod rujukan disambungkan tambahan kepada tangki simpanan dan pam supaya jumlah elektrolit yang sangat besar boleh diedarkan melalui sel. Peredaran elektrolit cecair agak sukar dan mengehadkan penggunaan bateri aliran vanadium dalam industri yang memerlukan mobiliti, menjadikannya berkesan dalam bangunan pegun yang besar.
Apabila bateri vanadium dicas, ion VO2+ dalam elektrod rujukan bercas positif bertukar menjadi ion VO2+ apabila elektron tertanggal daripada terminal bateri positif. Begitu juga, dalam elektrod rujukan negatif, elektron menukar ion V3+ kepada V2+. Semasa nyahcas, proses ini diterbalikkan, menghasilkan voltan litar terbuka 1.41 V pada 25°C.
Ciri-ciri berguna lain bagi bateri aliran vanadium termasuk tindak balas yang sangat pantas terhadap perubahan beban dan kapasiti beban lampau yang sangat tinggi. Penyelidikan di Universiti New South Wales telah menunjukkan bahawa mereka boleh mencapai masa tindak balas kurang daripada setengah milisaat pada 100% perubahan beban dan menahan 400% lebihan beban selama lebih 10 saat. Masa tindak balas dalam kebanyakan kes dihadkan oleh peralatan elektrik. Bateri vanadium berasaskan asid sulfurik hanya berfungsi pada suhu 10-40C. Jika suhu di bawah julat ini, ion asid sulfurik akan menghablur. Kecekapan dalam gerakan berbalas-balas dalam kegunaan harian kekal pada tahap 65-75%.
Ciri-ciri mengecas dan menyahcas
Algoritma pengecasan secara langsung bergantung pada cara bateri disusun dan jenisnya. Sebagai contoh, sesetengah bateri boleh mengisi semula kapasitinya dengan selamat daripada sumber voltan malar. Yang lain hanya berfungsi dengan sumber arus boleh laras yang boleh menukar parameter bergantung pada tahap cas.
Proses pengecasan yang tidak teratur boleh merosakkan bateri. Dalam kes yang melampau, bateri mungkin menyala atau meletup. Terdapat bateri pintar yang dilengkapi dengan peranti pemantauan voltan. Parameter utama yang perlu diambil kira semasa mengendalikan bateri galvanik boleh balik ialah:
- Jangka hayat. Walaupun dengan pengendalian yang betul, bilangan kitaran pengecasan untuk bateri adalah terhad. Sistem bateri yang berbeza tidak selalu haus atas sebab yang sama. Tetapi secara umum, hayat bateri dihadkan terutamanya oleh bilangan kitaran cas-nyahcas penuh, dan kedua oleh hayat perkhidmatan reka bentuk tanpa merujuk kepada intensiti penggunaan.
- Masa mengecas. Reka bentuk asas bateri tidak membayangkan pengecasan pada kelajuan tinggi yang sewenang-wenangnya: rintangan dalaman sel galvanik akan membawa kepada penukaran arus pengecasan yang berlebihan kepada haba, yang boleh merosakkan peranti secara tidak dapat dipulihkan. Dari sudut fizikal, masa pengecasan dihadkan oleh kadar resapan maksimum bahan aktif melalui elektrolit.Secara ringkasnya, kita boleh menganggap bahawa pemulihan kapasiti penuh dalam satu jam adalah penunjuk yang baik.
- Kedalaman pelepasan. Dinyatakan sebagai peratusan kuasa undian. Menerangkan kapasiti boleh guna. Untuk jenis bateri yang berbeza, paras nyahcas operasi yang disyorkan mungkin berbeza-beza. Disebabkan oleh perubahan dalam operasi atau penuaan, penunjuk kedalaman maksimum kehilangan nilai asalnya.
proses resapan.
Disebabkan oleh proses penyebaran, penjajaran ketumpatan elektrolit dalam rongga bekas bateri dan dalam liang jisim aktif plat, polarisasi elektrod boleh dikekalkan dalam bateri apabila litar luaran dimatikan.
Kadar resapan secara langsung bergantung pada suhu elektrolit, semakin tinggi suhu, semakin cepat proses berlaku dan boleh berubah dengan banyak dalam masa, dari dua jam hingga sehari. Kehadiran dua komponen potensi elektrod dalam keadaan sementara membawa kepada pembahagian EMF kepada keseimbangan dan bukan keseimbangan bateri. EMF keseimbangan bateri dipengaruhi oleh kandungan dan kepekatan ion bahan aktif dalam elektrolit, serta sifat kimia dan fizikal bahan aktif. Peranan utama dalam magnitud EMF dimainkan oleh ketumpatan elektrolit dan suhu secara praktikal tidak menjejaskannya. Kebergantungan EMF pada ketumpatan boleh dinyatakan dengan formula:
Emf bateri tidak sama dengan voltan bateri, yang bergantung pada kehadiran atau ketiadaan beban pada terminalnya.
admin25/07/2011
Satu komen
Nama *
Tapak
Laman web ini menggunakan Akismet untuk melawan spam. Ketahui cara data ulasan anda diproses.
« Takometer mekanikal
Voltan bateri »
Tag
VAZ, VAZ pincang fungsi Penderia Pencucuh Pencucuh Peranti Skema Pemula Kereta elektrik Bekalan kuasa vaz 2110 gazelle gazelle pendaftar perniagaan pembaikan kereta
Entri Terkini
- Sensor di dalam kereta: jenis dan tujuan
- Edumper kereta elektrik terbesar di dunia,
- Lampu laser.
- Kebaikan dan keburukan lampu halogen
- Peranti dan prinsip operasi penderia tempat letak kereta
Arkib
Arkib Pilih September 2019 Ogos 2017 Julai 2017 Jun 2017 Mei 2017 April 2017 Mac 2017 Disember 2016 November 2016 Oktober 2016 September 2016 Ogos 2016 Julai 2016 Februari 2015 Jun 2015 Mei 2015 Januari 2015 Disember 2014 November 2014 Oktober 2014 September 2014 Ogos 2014 Julai 2014 Jun 2014 Mei 2014 April 2014 Februari 2014 Januari 2014 Disember 2013 November 2013 Ogos 2014 Julai 2014 Jun 2014 Mei 2014 April 2014 Februari 2014 Januari 2014 Disember 2013 November 2013 Oktober 2013 Ogos 2013 Jun 10 Mac 2, 2013 Mei 12, 2013 Mei 12, 2013 Mei 12, 2013 Mei 12, 2013 Mei 12, 2013 Mei 12 2012, 2012, 2011, 2012, 2011, 2012, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, September 2012, 2011, 2011, 2011, 2011, 2011, 2011
Kategori
- Bateri akumulator
- Video
- Penjana
- Penderia
- Diagnostik
- Pencucuhan
- berita
- peralatan
- Peranti
- baiki
- Palam pencucuh
- Pemula
- Skim
- Peranti
- kereta elektrik
- Bekalan kuasa
Kami berada dalam rangkaian sosial
Auto Electrician@ Hak cipta terpelihara. Apabila menyalin bahan tapak, anda mesti menyediakan pautan ke tapak tersebut.
Peranti dan prinsip operasi
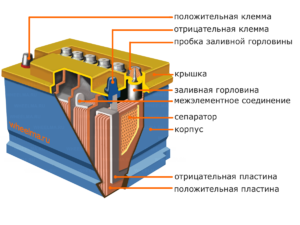
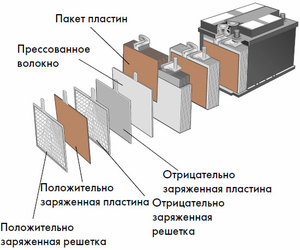
Setiap sel tersebut mempunyai katod (elektrod positif) dan anod (negatif). Elektrod ini dipisahkan oleh elektrolit yang memastikan pertukaran ion antara mereka. Bahan elektrod dan komposisi elektrolit dipilih untuk memberikan daya gerak elektrik yang mencukupi antara terminal bateri.
Oleh kerana elektrod mengandungi potensi tenaga kimia yang terhad, bateri akan habis semasa operasi. Jenis sel galvanik, yang disesuaikan untuk pengisian semula selepas pelepasan separa atau lengkap, dipanggil bateri. Himpunan sel yang saling berkait itu ialah bateri.Operasi bateri melibatkan perubahan kitaran dua keadaan:
- Mengecas - bateri berfungsi sebagai penerima elektrik, di dalam sel tenaga elektrik direalisasikan dalam perubahan kimia.
- Nyahcas - peranti berfungsi sebagai sumber arus elektrik dengan menukar tenaga tindak balas kimia kepada tenaga elektrik.
Kawasan kegunaan
Ciri kapasiti ultra tinggi bagi bateri vanadium redoks menjadikannya sangat sesuai untuk digunakan dalam industri yang memerlukan penyimpanan tenaga yang tinggi. Contohnya, membantu mengimbangi jumlah pengeluaran sumber tenaga seperti angin atau suria, atau membantu penjana menyerap lonjakan tenaga yang besar apabila diperlukan, atau mengimbangi bekalan dan permintaan tenaga untuk kawasan terpencil.
Ciri-ciri nyahcas sendiri terhad bagi bateri vanadium redoks menjadikannya berguna dalam industri di mana bateri mesti disimpan untuk jangka masa yang lama dengan penyelenggaraan dan kesediaan yang minimum. Ini membawa kepada penggunaannya dalam beberapa jenis elektronik ketenteraan, contohnya, dalam penderia sistem perlombongan GATOR. Keupayaan mereka untuk berbasikal dan kekal pada sifar menjadikannya sesuai untuk aplikasi solar dan industri di mana bateri mesti memulakan hari dengan kosong dan mengecas semula berdasarkan beban dan cuaca. Sebagai contoh, bateri ion litium sering rosak apabila ia dibenarkan menyahcas di bawah 20% daripada jumlahnya, jadi ia paling kerap beroperasi dalam julat 20 hingga 100%, yang bermaksud ia hanya boleh menggunakan 20% daripada kapasiti undiannya.
Masa tindak balasnya yang sangat pantas juga menjadikan ia amat diperlukan untuk bekalan kuasa yang tidak terganggu, di mana ia boleh digunakan sebagai ganti bateri asid plumbum dan juga penjana diesel. Juga masa tindak balas yang pantas menjadikannya sesuai untuk kawalan frekuensi. Pada masa ini, UPS mahupun langkah pengurusan kekerapan tidak berkesan dengan sendirinya, tetapi kemungkinan besar bateri akan dapat mencari aplikasi dalam industri ini apabila dipermodalkan daripada pelbagai sumber pembiayaan. Di samping itu, keupayaan ini menjadikan bateri vanadium redoks sebagai penyelesaian "sekeping" yang berkesan untuk grid kuasa kecil yang bergantung pada operasi yang boleh dipercayai, kawalan frekuensi dan keperluan pensuisan beban (seperti penembusan tinggi bagi tenaga boleh diperbaharui, beban yang sangat turun naik, atau keinginan untuk mengoptimumkan kecekapan penjana dengan mengalihkan masa tindak balas).
Bateri vanadium redoks berfungsi terbesar
Pencawang "Minami Hyakita":
- Tarikh pelancaran: Disember 2015
- Tenaga: 60 MWj
- Kuasa: 15 MW
- Masa bekerja: 4 jam
- Negara: Jepun
Busuk, Wilayah Liaoning
- Tarikh Pelancaran: N/A
- Tenaga: 10 MWj
- Kuasa: 5 MW
- Masa bekerja: 2 jam
- Negara: China
Ladang Angin Tomamae
- Tarikh pelancaran: 2005
- Tenaga: 6 MWj
- Kuasa: 4 MW
- Masa bekerja: 1 jam 30 minit
- Negara: Jepun
Projek Zhangbei
- Tarikh pelancaran 2016
- Tenaga: 8 MWj
- Kuasa: 2 MW
- Masa bekerja: 4 jam.
- Negara: China
Projek SnoPUD MESA 2
- Tarikh Pelancaran: Mac 2017
- Tenaga: 8 MWj
- Kuasa: 2 MW
- Masa bekerja: 4 jam.
- Negara: Amerika Syarikat
Pencawang di Escondido
- Tarikh pelancaran: 2017
- Tenaga: 8 MWj
- Kuasa: 2 MW
- Masa bekerja: 4 jam.
- Negara: Amerika Syarikat
Pencawang di Pullman, Washington
- Tarikh pelancaran: April 2015
- Tenaga: 4 MWj
- Kuasa: 1 MW
- Masa bekerja: 4 jam
- Negara: Amerika Syarikat
Menjelang 2018, pembangunan bateri redoks vanadium dijangka siap di China. Tenaganya ialah 800 MWh, kuasa - 200 MW, dan masa operasi - 4 jam.
Syarat
- Sequential - elemen mengikut satu demi satu.
- Daya gerak elektrik (EMF) ialah voltan yang dihasilkan oleh bateri atau daya magnet mengikut hukum Faraday.
- Selari - Komponen elektrik disusun supaya arus mengalir di sepanjang dua atau lebih laluan.
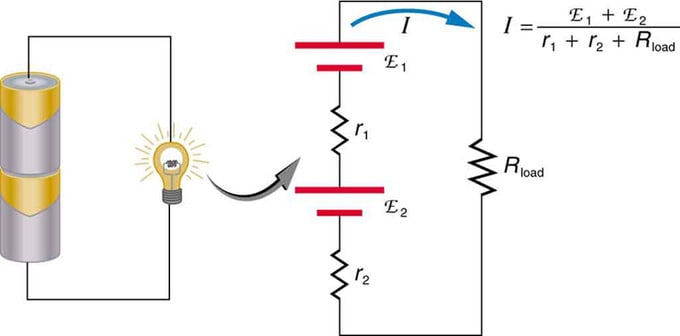
Jika anda menggunakan berbilang sumber voltan, ia boleh disambungkan secara bersiri atau selari. Dengan versi siri, mereka ditala ke arah yang sama, rintangan dalaman ditambah, dan daya gerak elektrik ditambah secara algebra. Jenis yang serupa adalah biasa dalam lampu suluh, mainan dan pelbagai peralatan lain. Sel diletakkan secara bersiri untuk meningkatkan jumlah emf.
Sambungan bersiri dua sumber voltan dalam arah yang sama. Rajah menunjukkan sebuah tanglung dengan dua sel dan satu lampu
Bateri - sambungan berbilang elemen volt. Tetapi terdapat satu kelemahan dalam sambungan bersiri, kerana rintangan dalaman ditambah. Kadang-kadang ini menimbulkan masalah. Katakan anda mempunyai dua bateri 6V yang anda masukkan dan bukannya 12V biasa. Akibatnya, anda telah menambah bukan sahaja EMF, tetapi juga rintangan dalaman daripada setiap bateri.
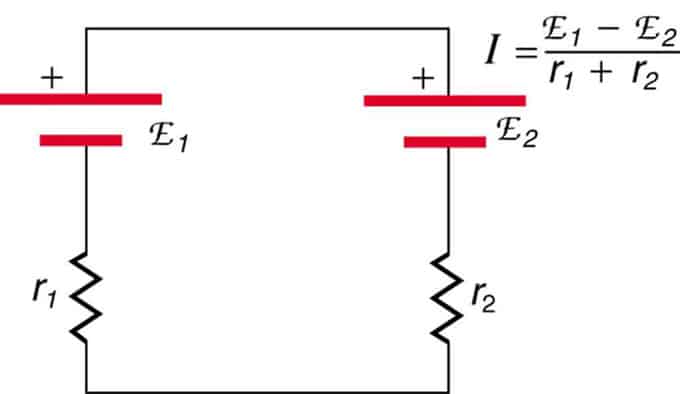
Jika sel terletak dalam pertentangan (satu terletak di belakang yang lain), maka jumlah EMF akan berkurangan.
Ini adalah dua sumber voltan yang disambungkan secara bersiri dengan pelepasan bertentangan. Arus mengalir ke arah EMF yang lebih besar dan dihadkan oleh penjumlahan rintangan dalaman. Contohnya ialah pengecas. Ia mesti mempunyai lebih banyak emf daripada bateri
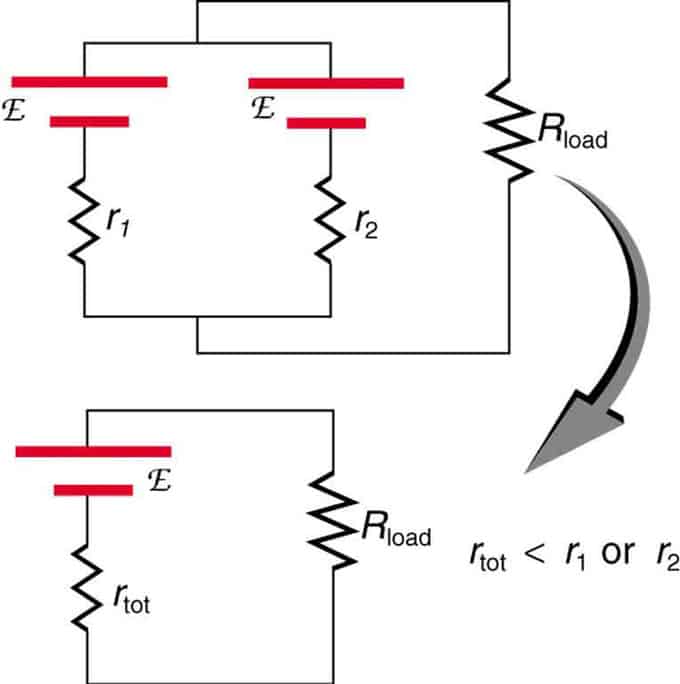
Jika dua sumber dengan daya gerak elektrik yang sama terletak selari dan disambungkan kepada rintangan beban, maka jumlah EMF kekal sama dengan sumber individu. Walau bagaimanapun, jumlah rintangan dalaman akan dikurangkan. Ternyata versi selari boleh menghasilkan lebih banyak arus.
Dua sumber voltan dengan EMF tunggal digabungkan dalam sambungan selari. Mereka membentuk satu EMF, tetapi mempunyai jumlah rintangan yang kurang daripada secara individu. Gabungan serupa digunakan jika anda perlu mencapai lebih semasa.
| Gambaran keseluruhan |
|
| Sambungan selari dan siri perintang |
|
| Peraturan Kirchhoff |
|
| Voltmeter dan ammeter |
|
| Litar RC |
|
Gambaran keseluruhan sejarah
Perkembangan sel galvanik pertama dikreditkan kepada ahli fizik Itali Alessandro Volta. Dia menjalankan satu siri eksperimen dengan fenomena elektrokimia pada tahun 1790-an dan sekitar tahun 1800 dia mencipta bateri pertama, yang dipanggil oleh sezamannya sebagai "lajur voltan". Peranti ini terdiri daripada cakera zink dan perak berselang seli yang dipisahkan oleh lapisan kertas atau kain yang direndam dalam larutan natrium hidroksida.
Eksperimen ini menjadi asas kepada kerja Michael Faraday mengenai undang-undang kuantitatif elektrokimia. Dia menerangkan prinsip operasi bateri dan, berdasarkan kerja saintis, sel elektrik komersial pertama dicipta. Evolusi selanjutnya kelihatan seperti ini:
- Pada tahun 1836, ahli kimia British John Daniel mempersembahkan model sel yang lebih baik, yang terdiri daripada elektrod kuprum dan zink yang direndam dalam asid hidroklorik. Elemen Daniel mampu membekalkan voltan malar dengan lebih cekap daripada peranti Volt.
- 1839 Kemajuan selanjutnya dibuat oleh ahli fizik Grove dengan sel dua cecairnya, yang terdiri daripada zink yang direndam dalam asid sulfurik cair dalam bekas berliang. Yang terakhir mengasingkan asid sulfurik daripada bekas yang mengandungi asid nitrik dengan katod platinum diletakkan di dalamnya. Asid nitrik berfungsi sebagai agen pengoksidaan untuk mengelakkan kehilangan voltan akibat pengumpulan hidrogen di katod.Ahli kimia Jerman Robert Bunsen menggantikan platinum dengan karbon murah dalam sel Grove dan dengan itu menggalakkan penerimaan meluas jenis bateri ini.
- Pada tahun 1859, Gaston Plante mencipta sel asid plumbum, pendahulu bateri kereta moden. Peranti Plante mampu menghasilkan arus yang luar biasa besar, tetapi hanya digunakan untuk eksperimen di makmal selama hampir dua dekad.
- 1895-1905 tahun. Ciptaan unsur alkali nikel-kadmium dan nikel-besi. Ini memungkinkan untuk mencipta sistem dengan sejumlah besar kitaran caj-nyahcas.
- Sejak tahun 1930-an, pembangunan bateri beralkali perak-zink dan merkuri-zink bermula, yang memberikan ketumpatan tenaga tinggi bagi setiap unit berat dan isipadu.
- Sejak pertengahan abad ke-20, kemajuan dalam teknologi pembuatan dan kemunculan bahan baharu telah membawa kepada bateri yang lebih berkuasa dan padat. Paling ketara ialah pengenalan nikel-logam hidrida dan bateri litium ke pasaran.
Mengecas bateri
Rencana utama: Pengecas
Apabila tenaga kimia habis, voltan dan arus jatuh, dan bateri tidak lagi berfungsi. Anda boleh mengecas bateri (bateri bateri) dari mana-mana sumber DC dengan voltan yang lebih tinggi sambil mengehadkan arus. Yang paling biasa ialah arus pengecasan (dalam ampere), berkadar dengan 1/10 daripada kapasiti nominal bersyarat bateri (dalam jam ampere).
Walau bagaimanapun, berdasarkan penerangan teknikal yang diedarkan oleh pengeluar bateri elektrik yang digunakan secara meluas (NiMH, NiCd), boleh diandaikan bahawa mod pengecasan ini, biasanya dirujuk sebagai standard, dikira berdasarkan tempoh lapan jam hari bekerja, apabila bateri, yang dinyahcas pada penghujung hari bekerja, disambungkan ke pengecas utama sebelum permulaan hari bekerja baharu. Penggunaan mod pengecasan sedemikian untuk jenis bateri ini dengan penggunaan sistematik membolehkan anda mengekalkan keseimbangan kos kualiti dalam pengendalian produk. Oleh itu, atas cadangan pengeluar, mod ini hanya boleh digunakan untuk bateri nikel-kadmium dan nikel-logam hidrida.
Banyak jenis bateri mempunyai had yang berbeza yang mesti diambil kira semasa pengecasan dan penggunaan seterusnya, contohnya, bateri NiMH sensitif terhadap pengecasan berlebihan, bateri litium sensitif terhadap pelepasan berlebihan, voltan dan suhu. Bateri NiCd dan NiMH mempunyai apa yang dipanggil kesan memori, yang terdiri daripada pengurangan kapasiti apabila pengecasan dijalankan apabila bateri tidak dinyahcas sepenuhnya. Juga, jenis bateri ini mempunyai pelepasan diri yang ketara, iaitu, ia secara beransur-ansur kehilangan cas tanpa disambungkan ke beban. Untuk memerangi kesan ini, pengecasan semula titisan boleh digunakan.
Kaedah Pengecasan Bateri
Beberapa kaedah digunakan untuk mengecas bateri; Secara amnya, kaedah pengecasan bergantung pada jenis bateri.
- Caj DC perlahan
Cas dengan arus terus yang berkadar dengan 0.1-0.2 daripada kapasiti nominal bersyarat Q selama kira-kira 15-7 jam, masing-masing.
Kaedah pengecasan terpanjang dan paling selamat. Sesuai untuk kebanyakan jenis bateri.
- pengecasan pantas
Cas dengan arus terus berkadar dengan 1/3 Q selama kira-kira 3-5 jam.
- Caj dipercepatkan atau "delta-V".
Caj dengan arus cas awal berkadar dengan kapasiti nominal nominal bateri, di mana voltan bateri sentiasa diukur dan cas tamat selepas bateri dicas sepenuhnya. Masa pengecasan adalah kira-kira satu setengah jam. Bateri boleh menjadi terlalu panas dan juga memusnahkannya.
- caj terbalik
Ia dilakukan dengan menukar denyutan cas panjang dengan denyutan nyahcas pendek. Kaedah terbalik adalah paling berguna untuk mengecas bateri NiCd dan NiMH, yang dicirikan oleh apa yang dipanggil.n. "kesan ingatan".