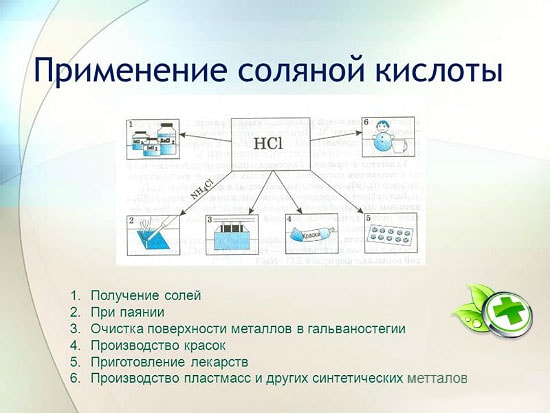
Stosowanie kwasu solnego
Kwas solny jest szeroko stosowany w przemyśle do wydobycia metali z rud, wytrawiania metali itp. Znajduje również zastosowanie w produkcji płynu lutowniczego, do osadzania srebra oraz jako integralna część akwa królewskiej.
Skala wykorzystania kwasu solnego w przemyśle jest mniejsza niż kwasu azotowego. Wynika to z faktu, że kwas solny powoduje korozję urządzeń stalowych. Ponadto jego lotne opary są dość szkodliwe i powodują korozję wyrobów metalowych. Należy to wziąć pod uwagę podczas przechowywania kwasu solnego. Kwas solny jest magazynowany i transportowany w zbiornikach i beczkach wyłożonych gumą, m.in. w naczyniach, których wewnętrzna powierzchnia pokryta jest gumą kwasoodporną, a także w butelkach szklanych i naczyniach polietylenowych.
Kwas solny służy do produkcji chlorków cynku, manganu, żelaza i innych metali oraz chlorku amonu. Kwas solny służy do oczyszczania powierzchni metali, naczyń, studni z węglanów, tlenków i innych osadów oraz zanieczyszczeń. W tym przypadku stosuje się specjalne dodatki - inhibitory, które chronią metal przed rozpuszczaniem i korozją, ale nie opóźniają rozpuszczania tlenków, węglanów i innych podobnych związków.
HCl jest wykorzystywany w przemysłowej produkcji żywic syntetycznych, gum. Stosowany jest jako surowiec do produkcji chlorku metylu z alkoholu metylowego, chlorku etylu z etylenu i chlorku winylu z acetylenu.
Pierwsza pomoc i metody leczenia
W przypadku stwierdzenia oznak zatrucia należy wezwać karetkę pogotowia. W domu dopuszcza się prowadzenie działań mających na celu poprawę stanu poszkodowanego. Pierwsza pomoc w zatruciu kwasem solnym powinna być przeprowadzona szybko, aby zmniejszyć ryzyko negatywnych konsekwencji.
Wydarzenia:
- Jeśli związek soli dostanie się na skórę, uszkodzone miejsca przemyj dużą ilością chłodnej wody. Czas przetwarzania to co najmniej pół godziny.
- W przypadku zatrucia oparami poszkodowany ma zapewniony dostęp do świeżego powietrza, otwarte okna, rozpięte obcisłe ubrania.
- Zaleca się monitorowanie stanu pacjenta, przy braku oznak życia przeprowadza się resuscytację.
- Ofiara z oparów może pić ciepłą herbatę, wodę. Zaleca się płukanie nosa i ust zimną wodą.
- W przypadku przedawkowania spowodowanego spożyciem kwasu, na brzuch umieszcza się okład z lodu, aby zapobiec lub ograniczyć ewentualne krwawienie.
- Żadne produkty lecznicze nie są dozwolone. Dozwolone jest podanie pacjentowi szklanki wody (można mineralnej alkalicznej). Płyn do picia jest wymagany małymi łykami.
- Nie wolno myć żołądka, próbować wywoływać wymioty w domu. Taka pierwsza pomoc może prowadzić do rozwoju oparzeń gardła, krwawienia.
Leczenie odbywa się w placówce medycznej pod nadzorem specjalistów.
Terapia:
- Oczyszczanie żołądka sondą,
- Stosowanie zakraplaczy z roztworami leczniczymi,
- Przepisywanie leków łagodzących ból
- stosowanie leków mających na celu przywrócenie funkcjonowania narządów i układów,
- W razie potrzeby inhalacja tlenowa i sztuczna wentylacja płuc,
- prowadzenie terapii resuscytacyjnej przy braku oznak życia,
- Dobór witamin i specjalne odżywianie.
Leczenie odbywa się na oddziale intensywnej terapii, a następnie w szpitalu. Czas trwania zależy od stanu pacjenta i stopnia zatrucia.
Oparzenia i zatrucia
Tak skuteczny, jak ten środek zaradczy, jest niebezpieczny. Kwas solny, w zależności od stężenia, może wywołać oparzenia chemiczne o czterech stopniach:
- Jest tylko zaczerwienienie i ból.
- Są pęcherze z przezroczystym płynem i obrzękiem.
- Powstała martwica górnych warstw skóry.Pęcherze wypełniają się krwią lub mętną zawartością.
- Uszkodzenie dociera do ścięgien i mięśni.
Jeśli substancja w jakiś sposób dostała się do oczu, należy je przepłukać wodą, a następnie roztworem sody. Ale w każdym razie pierwszą rzeczą do zrobienia jest wezwanie karetki pogotowia.
Spożycie kwasu w środku obfituje w ostre bóle w klatce piersiowej i brzuchu, obrzęk krtani, wymioty krwawymi masami. W rezultacie ciężkie patologie wątroby i nerek.
A pierwsze oznaki zatrucia w parach to suchy częsty kaszel, krztuszenie się, uszkodzenie zębów, pieczenie błon śluzowych i ból brzucha. Pierwszą pomocą w nagłych wypadkach jest mycie i płukanie jamy ustnej wodą oraz dostęp do świeżego powietrza. Prawdziwej pomocy może udzielić tylko toksykolog.
Właściwości widma chemicznego
Kwas oddziałuje z wieloma metalami, solami. Jest uważany za dość mocny i dorównuje zamszowi. Główna reakcja przejawia się we wszystkich grupach metali znajdujących się na lewo od wodoru (magnez, żelazo, cynk - potencjały elektryczne).
Roztwór chlorowodoru w postaci rozcieńczonej reaguje z solami, ale tylko z solami utworzonymi przez słabsze kwasy. Znane wszystkim węglanom sodu i wapnia, po interakcji z nim rozkładają się na wodę i tlenek węgla.
Kwas azotowy
- jakościowa reakcja na roztwór soli. Aby go uzyskać, konieczne jest dodanie azotanu srebra do tego odczynnika, w wyniku czego powstanie biały osad, z którego otrzymuje się substancję azotową.
Za pomocą tej mieszaniny wody i wodoru przeprowadza się wiele interesujących eksperymentów. Na przykład rozcieńczyć amoniakiem. W efekcie uzyskasz biały dym, gęsty, o konsystencji drobnych kryształków. Metyloamina, anilina, dwutlenek manganu, węglan potasu to odczynniki, na które oddziałuje również kwas.
Jak i dlaczego jest używany
Być może jest to słusznie jedna z ważnych substancji, które znajdują się i są niezbędne w prawie wszystkich gałęziach ludzkiego życia.
Lokalizacja obszaru zastosowania:
- Metalurgia. Czyszczenie powierzchni z obszarów utlenionych, rozpuszczanie rdzy, obróbka przed lutowaniem, cynowanie. Kwas solny pomaga wydobyć drobne wtrącenia metali z rud. Cyrkon i tytan otrzymuje się metodą konwersji tlenków na chlorki.
- Przemysł technologii żywności. Jako dodatek do żywności stosuje się roztwór o niskim stężeniu. Żelatyna, fruktoza dla diabetyków zawierają czysty emulgator. Zwykła soda ma również wysoką zawartość tej substancji. Na opakowaniu towaru zobaczysz go pod nazwą E507.
- Dziedzina medycyny. Z niewystarczającym wskaźnikiem kwaśnego środowiska w żołądku i problemami z jelitami. Niskie pH prowadzi do raka. Nawet przy prawidłowym odżywianiu, obfitości witamin, niebezpieczeństwo nie znika, konieczne jest przeprowadzenie testów w celu uzyskania soku z przewodu pokarmowego, ponieważ w niewystarczająco kwaśnym środowisku użyteczne substancje praktycznie nie są wchłaniane, trawienie jest zaburzone.
- Roztwór soli jest stosowany jako inhibitor - ochrona przed zabrudzeniami i infekcjami, działanie antyseptyczne. Do produkcji mieszanek klejowych, wyrobów ceramicznych. Płuka wymienniki ciepła.
- Procedura oczyszczania wody pitnej również nie jest kompletna bez udziału chloru.
- Produkcja gumy, bielenie podłoży tkaninowych.
- Dzięki temu rozwiązaniu możesz zadbać o swoje soczewki.
- Płyn do płukania jamy ustnej w domu
- Substancja jest doskonałym przewodnikiem elektryczności.
Jak dochodzi do zatrucia
Kwas solny jest bezbarwną cieczą o charakterystycznym ostrym zapachu. Jeden z najsilniejszych kwasów, zdolny do rozpuszczania niektórych metali. Łatwo zamienia się w gaz.
Chlorowodór znajduje zastosowanie w przemyśle tekstylnym, skórzanym, metalurgii metali szlachetnych, w produkcji kleju, kwasów.
Substancja występuje w żołądku w minimalnym stężeniu. Kwas przyczynia się do normalizacji procesu trawienia, chroni organizm przed szkodliwymi bakteriami i mikroorganizmami.
W stężeniu przekraczającym 24% kwas solny może powodować nieodwracalne szkody dla organizmu człowieka. Pary powstające w kontakcie z powietrzem powodują podrażnienie narządów układu wzrokowego i oddechowego.
Istnieje kilka czynników, które mogą wywołać rozwój zatrucia.
Czynniki:
Zatrucie parą jest możliwe podczas pracy w pomieszczeniach o słabej wentylacji,
Spożycie przez zaniedbanie, częściej u dzieci,
Wnikanie kwasu solnego na naskórek, błony śluzowe w przypadku nieprzestrzegania zasad stosowania odczynnika.
Zatrucie substancją w warunkach domowych u osób dorosłych następuje w wyniku stosowania bez wyposażenia ochronnego skóry, oczu i narządów układu oddechowego. Zatrucie może wystąpić, gdy kwas zostanie niedokładnie przeniesiony z jednego pojemnika do drugiego.
Farmakodynamika i farmakokinetyka
Czym jest kwasowość żołądka? Jest to charakterystyczne dla stężenia kwasu solnego w żołądku. Kwasowość wyrażona w pH
. Normalnie kwas powinien być wytwarzany w składzie soku żołądkowego i brać czynny udział w procesach trawienia. Formuła kwasu solnego: HCl
. Wytwarzany jest przez komórki okładzinowe zlokalizowane w gruczołach dna, przy udziale H+/K+-ATPaza
. Komórki te wyściełają dno i ciało żołądka. Sama kwasowość soku żołądkowego jest zmienna i zależy od liczby komórek okładzinowych oraz intensywności procesów neutralizacji substancji przez alkaliczne składniki soku żołądkowego. Stężenie wytworzone do - jesteś stabilny i równy 160 mmol/l. Zdrowa osoba powinna normalnie wytwarzać nie więcej niż 7 i co najmniej 5 mmol substancji na godzinę.
Przy niewystarczającej lub nadmiernej produkcji kwasu solnego dochodzi do chorób przewodu pokarmowego, pogarsza się zdolność przyswajania niektórych mikroelementów, takich jak żelazo. Lek pobudza wydzielanie soku żołądkowego, zmniejsza pH
. Aktywuje pepsynogen
, zamienia go w aktywny enzym pepsyna
. Substancja korzystnie wpływa na kwaśny odruch żołądka, spowalnia przejście nie do końca strawionego pokarmu do jelit. Spowalniają procesy fermentacji treści przewodu pokarmowego, znikają bóle i odbijanie, żelazo jest lepiej przyswajalne.
Po podaniu doustnym lek jest częściowo metabolizowany przez ślinę i śluz żołądkowy, zawartość dwunastnicy 12. Niezwiązana substancja wnika do dwunastnicy, gdzie jest całkowicie neutralizowana przez swoją alkaliczną zawartość.
Kolejne zastosowanie kwasu w życiu codziennym
Dzięki kwasowej kompozycji z łatwością usuniesz kamień i rdzę z fajansowych instalacji wodociągowych, usuniesz kamień moczowy i inne zanieczyszczenia. Aby uzyskać większy efekt, do środka dodaje się inhibitor (na przykład urotropinę), co spowalnia reakcję chemiczną.
Procedurę przeprowadza się w następujący sposób: kwas rozcieńcza się wodą do uzyskania stężenia 5% i dodaje się inhibitor w ilości 0,5 g na 1 litr cieczy. Powierzchnię traktuje się powstałą kompozycją i pozostawia na 30-40 minut (w zależności od stopnia zanieczyszczenia), po czym myje się wodą.
Łagodny roztwór kwasu służy również do usuwania plam z jagód, atramentu lub rdzy z tkanin. Aby to zrobić, materiał zanurza się na chwilę w kompozycji, po czym dokładnie spłukuje i myje w zwykły sposób.
Pozbywanie się kamienia w czajniku
W tym celu stosuje się 3-5% roztwór kwasu solnego, który wlewa się do czajnika i podgrzewa do 60-80°
C przez 1-2 godziny lub do momentu, gdy osady kamienia rozejdą się. Po tym łuska staje się luźna i można ją łatwo usunąć drewnianą szpatułką.
Skuteczność metody wynika z faktu, że odczynnik reaguje z węglanami magnezu i wapnia i przekształca je w rozpuszczalne sole. Uwalniany w tym samym czasie dwutlenek węgla niszczy warstwę kamienia i powoduje jego rozluźnienie. Po usunięciu osadów soli naczynia są dokładnie myte czystą wodą.
Ważny punkt!
Ta metoda nie jest odpowiednia do usuwania wyszczerbionych i pękniętych czajników emaliowanych lub aluminiowych: spowoduje to korozję metalu i poważne uszkodzenia.
Zdobywanie substancji
Teraz możemy porozmawiać o tym, co robią, aby utworzyć kwas solny.
Po pierwsze, spalając wodór w chlorze, otrzymuje się główny składnik, gazowy chlorowodór. który jest następnie rozpuszczany w wodzie. W wyniku tej prostej reakcji powstaje syntetyczny kwas.
Substancję tę można również otrzymać z gazów odlotowych. Są to chemiczne gazy odpadowe (boczne). Powstają w wyniku różnych procesów. Na przykład podczas chlorowania węglowodorów. Znajdujący się w ich składzie chlorowodór nazywa się gazem odlotowym. I odpowiednio otrzymany w ten sposób kwas.
Należy zauważyć, że w ostatnich latach udział substancji z gazów odlotowych w całkowitym wolumenie jej produkcji wzrasta. A kwas powstały w wyniku spalania wodoru w chlorze zostaje wyparty. Jednak uczciwie należy zauważyć, że zawiera mniej zanieczyszczeń.
Wykorzystanie produkcyjne
Ma szerokie zastosowanie w przemyśle metalurgicznym, spożywczym i medycznym.
- Metalurgia. Zastosowanie w lutowaniu, cynowaniu i czyszczeniu metali.
- Przemysł spożywczy. Zastosowanie w produkcji regulatorów kwasowości żywności np. E507.
- Elektrotyp. Używany do marynowania.
- Medycyna. Znajduje zastosowanie w produkcji sztucznego soku żołądkowego.
Zawarty w barwnikach syntetycznych. Znajduje zastosowanie w produkcji środków czystości i detergentów. Ale w płynach przeznaczonych do użytku domowego stężenie kwasu siarkowego jest znikome.
Jak powstaje kwas solny w laboratorium
Produkcja substancji odbywa się na dużą skalę, sprzedaż jest bezpłatna. W warunkach eksperymentów laboratoryjnych roztwór powstaje w wyniku działania kwasu siarkowego o wysokim stężeniu na zwykłą sól kuchenną (chlorek sodu).
Istnieją 2 metody rozpuszczania chlorowodoru w wodzie:
- Wodór spalany jest w chlorze (syntetycznym).
- Powiązane (gaz odlotowy). Jego istotą jest przeprowadzanie chlorowania organicznego, odchlorowodorowania.
Substancja dobrze nadaje się do syntezy podczas pirolizy odpadów chloroorganicznych. Dzieje się tak w wyniku rozpadu węglowodorów przy całkowitym braku tlenu. Możesz również użyć chlorków metali, które są surowcem substancji nieorganicznych. Jeśli nie ma stężonego kwasu siarkowego (elektrolitu), weź rozcieńczony.
Jeśli chodzi o ekstrakcję odczynnika w warunkach naturalnych, to najczęściej tę mieszaninę chemiczną można znaleźć w wodach odpadów wulkanicznych. Chlorowodór jest składnikiem minerałów sylvin (chlorek potasu, wygląda jak kości do gier), biszofit. Wszystko to są metody ekstrakcji substancji w przemyśle.
U ludzi enzym ten znajduje się w żołądku. Roztwór może być kwasem lub zasadą. Jedną z najczęstszych metod ekstrakcji jest siarczan.
Właściwości chemiczne
Kwas solny, chlorowodór lub kwas solny - roztwór HCl
w wodzie. Według Wikipedii substancja należy do grupy nieorganicznych silnych monozasadowych to-t. Pełna nazwa związku po łacinie: kwas chlorowodorowy.
Formuła kwasu solnego w chemii: HCl
. W cząsteczce atomy wodoru łączą się z atomami halogenu - Cl
. Jeśli weźmiemy pod uwagę konfigurację elektronową tych cząsteczek, można zauważyć, że związki biorą udział w tworzeniu orbitali molekularnych 1s
-orbitale wodorowe i jedno i drugie 3s
oraz 3p
-orbitale atomu Cl
. W chemicznym wzorze kwasu solnego 1s-
, 3s-
oraz 3r
-orbitale atomowe zachodzą na siebie i tworzą 1, 2, 3 orbitale. W którym 3s
-orbital nie jest wiążący. Następuje przesunięcie gęstości elektronowej na atom Cl
a polarność cząsteczki maleje, ale energia wiązania orbitali molekularnych wzrasta (jeśli weźmiemy to pod uwagę razem z innymi) halogenki wodoru
).
Właściwości fizyczne chlorowodoru. Jest to klarowny, bezbarwny płyn, który dymi pod wpływem powietrza. Masa molowa związku chemicznego = 36,6 grama na mol. W standardowych warunkach, przy temperaturze powietrza 20 stopni Celsjusza, maksymalne stężenie substancji wynosi 38% wagowo. Gęstość stężonego kwasu solnego w tego rodzaju roztworze wynosi 1,19 g/cm³. Ogólnie rzecz biorąc, właściwości fizyczne i cechy, takie jak gęstość, molarność, lepkość, pojemność cieplna, temperatura wrzenia i pH
, silnie zależą od stężenia roztworu. Te wartości są bardziej szczegółowo omówione w tabeli gęstości. Na przykład gęstość kwasu solnego 10% = 1,048 kg na litr. Po zestaleniu substancja tworzy się hydraty krystaliczne
różne kompozycje.
Właściwości chemiczne kwasu solnego. Z czym reaguje kwas solny? Substancja oddziałuje z metalami, które stoją przed wodorem w szeregu potencjałów elektrochemicznych (żelazo, magnez, cynk i inne). W tym przypadku powstają sole i są w postaci gazowej h
. Ołów, miedź, złoto, srebro i inne metale na prawo od wodoru nie reagują z kwasem solnym. Substancja reaguje z tlenkami metali tworząc wodę i rozpuszczalną sól. Wodorotlenek sodu pod działaniem tobie form i wody. Reakcja neutralizacji jest charakterystyczna dla tego związku.
Rozcieńczony kwas solny reaguje z solami metali, które tworzą słabsze kwasy. Na przykład, kwas propionowy
słabszy niż sól. Substancja nie reaguje z mocniejszymi kwasami. oraz węglan sodu
powstanie po reakcji z HCl
chlorek, tlenek węgla i wodę.
Dla związku chemicznego charakterystyczne są reakcje z silnymi środkami utleniającymi, przy czym dwutlenek manganu
, nadmanganian potasu
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. Substancja reaguje z amoniak
, który wytwarza gęsty biały dym, który składa się z bardzo drobnych kryształków chlorku amonu. Mineralny piroluzyt reaguje również z kwasem solnym, ponieważ zawiera dwutlenek manganu
: MnO2+4HCl=Cl2+MnO2+2H2O
(reakcja utleniania).
Zachodzi jakościowa reakcja na kwas solny i jego sole. Kiedy substancja wchodzi w interakcję z azotan srebra
biały osad chlorek srebra
i uformowany kwas azotowy
. Równanie reakcji interakcji metyloamina
z chlorowodorem wygląda tak: HCl + CH3NH2 = (CH3NH3)Cl
.
Substancja reaguje ze słabą zasadą anilina
. Po rozpuszczeniu aniliny w wodzie do mieszaniny dodaje się kwas solny. W rezultacie baza rozpuszcza się i tworzy chlorowodorek aniliny
(chlorek fenyloamoniowy
): (С6Н5NH3)Cl
. Reakcja oddziaływania węglika glinu z kwasem solnym: Al4C3+12HCL=3CH4+4AlCl3
. Równanie reakcji weglan potasu
z którym wygląda to tak: K2CO3 + 2HCl = 2KCl + H2O + CO2.
Podanie
w metalurgii do wydobywania rud, usuwania rdzy, zgorzeliny, brudu i tlenków, lutowania i cynowania;
w produkcji kauczuków syntetycznych i żywic;
w galwanotechnice;
jako regulator kwasowości w przemyśle spożywczym;
do uzyskania chlorków metali;
uzyskać chlor;
w medycynie w leczeniu niewystarczającej kwasowości soku żołądkowego;
jako środek czyszczący i dezynfekujący.
- (HCl), wodny roztwór chlorowodoru, bezbarwny gaz o ostrym zapachu. Otrzymywany w wyniku działania kwasu siarkowego na sól kuchenną, jako produkt uboczny chlorowania węglowodorów lub w reakcji wodoru i chloru. Kwas solny jest używany do ... ... Naukowy i techniczny słownik encyklopedyczny
Kwas chlorowodorowy
- - HCl (SC) (kwas solny, kwas solny, chlorowodór) to roztwór chlorowodoru (HCl) w wodzie, dodatek przeciw zamarzaniu. Jest to bezbarwna ciecz o ostrym zapachu, bez zawieszonych cząstek ... ... Encyklopedia terminów, definicji i objaśnień materiałów budowlanych
KWAS CHLOROWODOROWY
- (kwas solny) roztwór chlorowodoru w wodzie; mocny kwas. Bezbarwna ciecz dymiąca w powietrzu (techniczny kwas solny jest żółtawy z powodu zanieczyszczeń Fe, Cl2 itp.). Maksymalne stężenie (w 20 ° C) wynosi 38% masy, ... ... Wielki słownik encyklopedyczny
KWAS CHLOROWODOROWY
- (Acidum muriaticum, Acid, hydrochloricum), roztwór chlorowodoru (HC1) w wodzie. W naturze występuje w wodzie niektórych źródeł pochodzenia wulkanicznego, a także występuje w soku żołądkowym (do 0,5%). Chlorowodór można uzyskać ... Wielka encyklopedia medyczna
KWAS CHLOROWODOROWY
- (kwas solny, kwas solny) mocny jednozasadowy lotny kwas o ostrym zapachu, wodny roztwór chlorowodoru; maksymalne stężenie wynosi 38% masowych, gęstość takiego roztworu wynosi 1,19 g/cm3. Używany w ... ... Rosyjskiej encyklopedii ochrony pracy
KWAS CHLOROWODOROWY
- (kwas solny) HCl wodny roztwór chlorowodoru, mocnego kwasu jednozasadowego, lotny, o ostrym zapachu; zanieczyszczenia żelaza, chlor zabarwiają go na żółtawo. Skoncentrowany S. do sprzedania zawiera 37% ... ... Wielka Encyklopedia Politechniczna
kwas chlorowodorowy
— rzeczownik, liczba synonimów: 1 kwas (171) Słownik synonimów ASIS. V.N. Triszyn. 2013 ... Słownik synonimów
KWAS CHLOROWODOROWY
Współczesna encyklopedia
Kwas chlorowodorowy
- KWAS WODOROWY, wodny roztwór chlorowodoru HCl; dymiąca ciecz o ostrym zapachu. Kwas solny służy do otrzymywania różnych chlorków, wytrawiania metali, przetwarzania rud, w produkcji chloru, sody, gumy itp. ... ... Ilustrowany słownik encyklopedyczny
kwas chlorowodorowy
- (kwas solny), roztwór chlorowodoru w wodzie; mocny kwas. Bezbarwna ciecz „dymiąca” w powietrzu (techniczny kwas solny jest żółtawy z powodu zanieczyszczeń Fe, Cl2 itp.). Maksymalne stężenie (w 20 ° C) 38% masy, ... ... Słownik encyklopedyczny
Jakie jest niebezpieczeństwo zatrucia
Kwas solny stanowi szczególne zagrożenie dla organizmu człowieka. W przypadku zatrucia taką substancją mogą rozwinąć się poważne komplikacje i naruszenia funkcjonalności organizmu.
Komplikacje:
- Naruszenie wątroby w wyniku toksycznego zapalenia wątroby,
- Krwawienie w żołądku z powodu zniszczonych ścian narządu,
- Szok z bólu, gdy kwas dostanie się na duży obszar,
- w przypadku kontaktu z oczami, zaburzenia widzenia,
- Poważna awaria nerek,
- niewydolność oddechowa, uduszenie, duszność,
- Rozwój śpiączki.
Podobne konsekwencje rozwijają się stopniowo w zależności od stopnia zatrucia.
Wniosek
Jeśli będziesz przestrzegać środków ostrożności i zasad bezpieczeństwa, kwas solny stanie się nieodzownym pomocnikiem w życiu codziennym. I możesz go kupić w najbardziej przystępnych cenach w naszej firmie.
Jak kwasy. Program edukacyjny przewiduje zapamiętywanie przez uczniów imion i formuł sześciu przedstawicieli tej grupy. I przeglądając tabelę dostarczoną przez podręcznik, zauważasz na liście kwasów ten, który jest na pierwszym miejscu i interesuje Cię w pierwszej kolejności - kwas solny. Niestety, w klasie w szkole ani własność, ani żadne inne informacje na jej temat nie są badane. Dlatego ci, którzy chcą zdobywać wiedzę poza programem szkolnym, szukają dodatkowych informacji w różnego rodzaju źródłach. Ale często wielu nie znajduje potrzebnych informacji. I tak temat dzisiejszego artykułu poświęcony jest właśnie temu kwasowi.
Definicja
Kwas solny jest silnym kwasem jednozasadowym. W niektórych źródłach może być nazywany chlorowodorem i chlorowodorem, a także chlorowodorem.
Właściwości fizyczne
Jest to bezbarwna i dymiąca żrąca ciecz unosząca się w powietrzu (zdjęcie po prawej). Jednak kwas techniczny ma żółtawy kolor ze względu na obecność w nim żelaza, chloru i innych dodatków. Jego największe stężenie w temperaturze 20°C wynosi 38%. Gęstość kwasu solnego o takich parametrach wynosi 1,19 g/cm 3 . Ale ten związek w różnym stopniu nasycenia ma zupełnie inne dane.Wraz ze spadkiem stężenia maleje liczbowa wartość molarności, lepkości i temperatury topnienia, ale wzrasta ciepło właściwe i temperatura wrzenia. Zestalenie kwasu solnego o dowolnym stężeniu daje różne krystaliczne hydraty.
Właściwości chemiczne
Wszystkie metale znajdujące się przed wodorem w szeregu elektrochemicznym ich napięcia mogą oddziaływać z tym związkiem, tworząc sole i uwalniając gazowy wodór. Jeśli zostaną zastąpione tlenkami metali, produktami reakcji będą rozpuszczalna sól i woda. Ten sam efekt będzie dotyczył interakcji kwasu solnego z wodorotlenkami. Jeśli jednak doda się do niego jakąkolwiek sól metali (np. węglan sodu), której pozostałość została pobrana ze słabszego kwasu (węglowego), to chlorek tego metalu (sodu), woda i gaz odpowiadające kwasowi powstają pozostałości (w tym przypadku dwutlenek węgla).
Paragon fiskalny
Omawiany obecnie związek powstaje, gdy gazowy chlorowodór, który można otrzymać przez spalanie wodoru w chlorze, rozpuszcza się w wodzie. Kwas solny, który otrzymano tą metodą, nazywa się syntetycznym. Gazy odlotowe mogą również służyć jako źródło pozyskiwania tej substancji. A taki kwas solny będzie nazywany gazem odlotowym. Ostatnio poziom produkcji kwasu solnego tą metodą jest znacznie wyższy niż jego wytwarzanie metodą syntetyczną, chociaż ta ostatnia daje związek w czystszej postaci. To wszystko są sposoby na zdobycie go w przemyśle. Jednak w laboratoriach kwas solny wytwarzany jest na trzy sposoby (pierwsze dwa różnią się jedynie temperaturą i produktami reakcji) z wykorzystaniem różnego rodzaju oddziaływań chemicznych, takich jak:
- Wpływ nasyconego kwasu siarkowego na chlorek sodu w temperaturze 150 o C.
- Oddziaływanie powyższych substancji w warunkach o temperaturze 550 ° C i wyższej.
- Hydroliza chlorków glinu lub magnezu.
Podanie
Hydrometalurgia i elektroformowanie nie może obejść się bez użycia kwasu solnego tam, gdzie jest to potrzebne do oczyszczenia powierzchni metali podczas cynowania i lutowania oraz uzyskania chlorków manganu, żelaza, cynku i innych metali. W przemyśle spożywczym związek ten znany jest jako dodatek do żywności E507 - tam jest regulatorem kwasowości niezbędnym do wytworzenia wody sodowej. Stężony kwas solny znajduje się również w soku żołądkowym każdej osoby i pomaga trawić pokarm. Podczas tego procesu zmniejsza się jego stopień nasycenia, ponieważ. ta kompozycja jest rozcieńczana pokarmem. Jednak przy przedłużonym poście stężenie kwasu solnego w żołądku stopniowo wzrasta. A ponieważ ten związek jest bardzo żrący, może prowadzić do wrzodów żołądka.
Wniosek
Kwas solny może być zarówno korzystny, jak i szkodliwy dla ludzi. Jego kontakt ze skórą prowadzi do pojawienia się ciężkich oparzeń chemicznych, a opary tego związku podrażniają drogi oddechowe i oczy.
Ale jeśli ostrożnie obchodzisz się z tą substancją, może się przydać więcej niż raz w