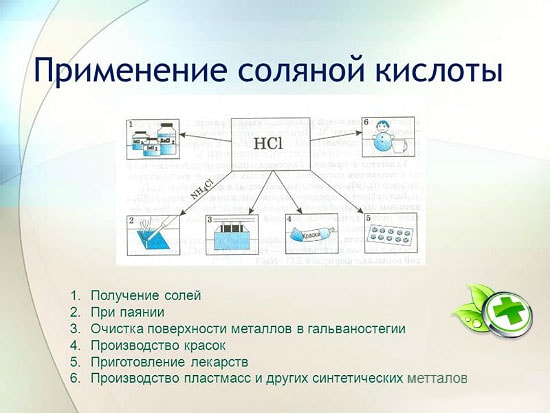
L'utilisation de l'acide chlorhydrique
L'acide chlorhydrique est largement utilisé dans l'industrie pour extraire les métaux des minerais, décaper les métaux, etc. Il est également utilisé dans la fabrication de liquide de soudure, dans le dépôt d'argent et en tant que partie intégrante de l'eau régale.
L'échelle d'utilisation de l'acide chlorhydrique dans l'industrie est inférieure à celle de l'acide nitrique. Cela est dû au fait que l'acide chlorhydrique provoque la corrosion des équipements en acier. De plus, ses vapeurs volatiles sont assez nocives et provoquent également la corrosion des produits métalliques. Ceci doit être pris en compte lors du stockage de l'acide chlorhydrique. L'acide chlorhydrique est stocké et transporté dans des réservoirs et des fûts doublés de caoutchouc, c'est-à-dire dans des récipients dont la surface intérieure est recouverte de caoutchouc résistant aux acides, ainsi que dans des bouteilles en verre et des ustensiles en polyéthylène.
L'acide chlorhydrique est utilisé pour produire des chlorures de zinc, de manganèse, de fer et d'autres métaux, ainsi que du chlorure d'ammonium. L'acide chlorhydrique est utilisé pour nettoyer les surfaces des métaux, des récipients, des puits des carbonates, des oxydes et d'autres sédiments et contaminants. Dans ce cas, des additifs spéciaux sont utilisés - des inhibiteurs qui protègent le métal de la dissolution et de la corrosion, mais ne retardent pas la dissolution des oxydes, carbonates et autres composés similaires.
HCl est utilisé dans la production industrielle de résines synthétiques, de caoutchoucs. Il est utilisé comme matière première dans la production de chlorure de méthyle à partir d'alcool méthylique, de chlorure d'éthyle à partir d'éthylène et de chlorure de vinyle à partir d'acétylène.
Premiers soins et méthodes de traitement
Si des signes d'empoisonnement sont constatés, une ambulance doit être appelée. À domicile, il est permis de mener des activités visant à améliorer la condition de la victime. Les premiers soins en cas d'empoisonnement à l'acide chlorhydrique doivent être effectués rapidement pour réduire le risque de conséquences négatives.
Événements:
- Si le composé de sel entre en contact avec la peau, les zones endommagées sont lavées à grande eau froide. Le temps de traitement est d'au moins une demi-heure.
- En cas d'intoxication par les vapeurs, la victime a accès à l'air frais, les fenêtres sont ouvertes, les vêtements serrés sont déboutonnés.
- Il est recommandé de surveiller l'état du patient, en l'absence de signes de vie, une réanimation est effectuée.
- La victime des vapeurs est autorisée à boire du thé chaud, de l'eau. Il est recommandé de se rincer le nez et la bouche à l'eau froide.
- En cas de surdosage résultant de l'ingestion d'acide, un sac de glace est placé sur l'abdomen pour prévenir ou réduire les éventuels saignements.
- Aucun médicament n'est autorisé. Il est permis de donner au patient un verre d'eau (vous pouvez minéral alcalin). Boire du liquide est nécessaire par petites gorgées.
- Il est interdit de laver l'estomac, essayez de faire vomir à la maison. Ces premiers secours peuvent entraîner le développement de brûlures de la gorge, des saignements.
Le traitement est effectué dans un établissement médical sous la supervision de spécialistes.
Thérapie:
- Nettoyer l'estomac avec une sonde,
- Utilisation de compte-gouttes avec des solutions médicamenteuses,
- Prescrire des médicaments pour soulager la douleur
- L'utilisation de médicaments visant à rétablir le fonctionnement des organes et des systèmes,
- Si nécessaire, inhalation d'oxygène et ventilation artificielle des poumons,
- Effectuer une thérapie de réanimation en l'absence de signes de vie,
- Sélection de vitamines et nutrition spéciale.
Le traitement est effectué en soins intensifs, puis dans un hôpital. La durée dépend de l'état du patient et du degré d'intoxication.
Brûlures et empoisonnement
Aussi efficace que soit ce remède, il est dangereux. L'acide chlorhydrique, selon la concentration, peut provoquer des brûlures chimiques de quatre degrés :
- Il n'y a que des rougeurs et des douleurs.
- Il y a des cloques avec un liquide clair et un gonflement.
- Nécrose formée des couches supérieures de la peau.Les ampoules se remplissent de sang ou de contenu trouble.
- La lésion atteint les tendons et les muscles.
Si la substance pénètre d'une manière ou d'une autre dans les yeux, il est nécessaire de les rincer à l'eau, puis avec une solution de soude. Mais dans tous les cas, la première chose à faire est d'appeler une ambulance.
L'ingestion d'acide à l'intérieur est lourde de douleurs aiguës dans la poitrine et l'abdomen, un gonflement du larynx, des vomissements de masses sanglantes. En conséquence, des pathologies graves du foie et des reins.
Et les premiers signes d'empoisonnement par paires comprennent une toux sèche fréquente, des étouffements, des dommages aux dents, des brûlures dans les muqueuses et des douleurs abdominales. La première aide d'urgence est le lavage et le rinçage de la bouche avec de l'eau, ainsi que l'accès à l'air frais. Seul un toxicologue peut apporter une réelle aide.
Propriétés du spectre chimique
L'acide interagit avec de nombreux métaux, sels. Il est considéré comme assez fort et est à égalité avec le chamois. La réaction principale se manifeste dans tous les groupes de métaux situés à gauche de l'hydrogène (magnésium, fer, zinc - potentiels électriques).
La solution de chlorure d'hydrogène sous forme diluée réagit avec les sels, mais uniquement avec ceux formés par des acides moins forts. Connus de tous les carbonates de sodium et de calcium, après interaction avec celui-ci, ils se décomposent en eau et en monoxyde de carbone.
Acide nitrique
- une réaction qualitative à la solution saline. Pour l'obtenir, il est nécessaire d'ajouter du nitrate d'argent à ce réactif, en conséquence, un précipité blanc se formera, à partir duquel une substance azotée est obtenue.
A l'aide de ce mélange d'eau et d'hydrogène, de nombreuses expériences intéressantes sont réalisées. Par exemple, diluez-le avec de l'ammoniac. De ce fait, vous obtiendrez une fumée blanche, épaisse, ayant la consistance de petits cristaux. La méthylamine, l'aniline, le dioxyde de manganèse, le carbonate de potassium sont des réactifs qui sont également affectés par l'acide.
Comment et pourquoi est-il utilisé
C'est peut-être à juste titre l'une des substances importantes que l'on trouve et qui sont nécessaires dans presque toutes les branches de la vie humaine.
Localisation de la zone d'application :
- Métallurgie. Nettoyage de surface des zones oxydées, dissolution de la rouille, traitement de pré-soudure, étamage. L'acide chlorhydrique aide à extraire les petites inclusions de métaux des minerais. Le zirconium et le titane sont obtenus par la méthode de conversion des oxydes en chlorures.
- Industrie de la technologie alimentaire. Une solution à faible concentration est utilisée comme additif alimentaire. La gélatine, le fructose pour les diabétiques contiennent un émulsifiant pur. La soude ordinaire a également une teneur élevée en cette substance. Sur l'emballage des marchandises, vous le verrez sous le nom E507.
- Le domaine de la médecine. Avec un indicateur insuffisant de l'environnement acide dans l'estomac et des problèmes d'intestins. Un pH bas conduit au cancer. Même avec une bonne nutrition, des vitamines en abondance, le danger ne disparaît pas, il est nécessaire d'effectuer des tests pour obtenir du jus du tractus gastrique, car dans un environnement insuffisamment acide, les substances utiles ne sont pratiquement pas absorbées, la digestion est perturbée.
- La solution saline est utilisée comme inhibiteur - protection contre la saleté et les infections, action antiseptique. Pour la fabrication de mélanges adhésifs, de produits céramiques. Il rince les échangeurs de chaleur.
- La procédure de purification de l'eau potable n'est pas non plus complète sans la participation du chlore.
- Production de caoutchouc, blanchiment de bases de tissus.
- Vous pouvez prendre soin de vos lentilles avec cette solution.
- Bain de bouche à la maison
- La substance est un excellent conducteur d'électricité.
Comment se produit l'empoisonnement
L'acide chlorhydrique est un liquide incolore avec une odeur piquante caractéristique. L'un des acides les plus forts, capable de dissoudre certains métaux. Se transforme facilement en gaz.
Le chlorure d'hydrogène est utilisé dans l'industrie textile, le travail du cuir, la métallurgie des métaux précieux, dans la production de colle, d'acides.
La substance est présente dans l'estomac en concentration minimale. L'acide contribue à la normalisation du processus digestif, protège le corps des bactéries et des micro-organismes nocifs.
À une concentration supérieure à 24%, l'acide chlorhydrique peut causer des dommages irréversibles au corps humain. Les vapeurs formées au contact de l'air provoquent une irritation des organes des systèmes visuel et respiratoire.
Plusieurs facteurs peuvent provoquer le développement d'un empoisonnement.
Les facteurs:
Une intoxication aux vapeurs est possible lorsque vous travaillez dans des pièces mal ventilées,
Ingestion par négligence, plus fréquente chez les enfants,
La pénétration d'acide chlorhydrique sur l'épiderme, les muqueuses en cas de non-respect des règles d'utilisation du réactif.
L'empoisonnement par une substance à domicile chez l'adulte se produit à la suite de l'utilisation sans équipement de protection de la peau, des yeux et des organes du système respiratoire. L'intoxication peut se produire lorsque l'acide est transféré de manière inexacte d'un récipient à un autre.
Pharmacodynamique et pharmacocinétique
Qu'est-ce que l'acidité gastrique ? C'est une caractéristique de la concentration d'acide chlorhydrique dans l'estomac. L'acidité s'exprime en pH
. Normalement, l'acide doit être produit dans la composition du suc gastrique et jouer un rôle actif dans les processus de digestion. Formule de l'acide chlorhydrique : HCl
. Il est produit par des cellules pariétales situées dans les glandes fundiques, avec la participation de H+/K+-ATPase
. Ces cellules tapissent le fond d'œil et le corps de l'estomac. L'acidité du suc gastrique lui-même est variable et dépend du nombre de cellules pariétales et de l'intensité des processus de neutralisation de la substance par les composants alcalins du suc gastrique. La concentration produite à - tu est stable et égale à 160 mmol/l. Une personne en bonne santé ne devrait normalement pas produire plus de 7 et au moins 5 mmol d'une substance par heure.
Avec une production insuffisante ou excessive d'acide chlorhydrique, des maladies du tube digestif surviennent, la capacité d'absorption de certains micro-éléments, comme le fer, se détériore. Le médicament stimule la sécrétion du suc gastrique, réduit pH
. Active pepsinogène
, le transforme en une enzyme active pepsine
. La substance a un effet bénéfique sur le réflexe acide de l'estomac, ralentit la transition des aliments incomplètement digérés dans les intestins. Les processus de fermentation du contenu du tube digestif ralentissent, la douleur et les éructations disparaissent, le fer est mieux absorbé.
Après administration orale, le médicament est partiellement métabolisé par la salive et le mucus gastrique, le contenu du duodénum 12. La substance non liée pénètre dans le duodénum, où elle est complètement neutralisée par son contenu alcalin.
Une autre utilisation de l'acide dans la vie de tous les jours
Avec une composition acide, vous pouvez facilement nettoyer le calcaire et la rouille de la plomberie en faïence, éliminer les calculs urinaires et autres contaminants. Pour un effet plus important, un inhibiteur (par exemple, l'urotropine) est ajouté à l'agent, ce qui ralentit la réaction chimique.
Le mode opératoire se déroule comme suit : l'acide est dilué avec de l'eau jusqu'à atteindre une concentration de 5 % et un inhibiteur est ajouté à raison de 0,5 g pour 1 litre de liquide. La surface est traitée avec la composition résultante et laissée pendant 30 à 40 minutes (selon le degré de contamination), après quoi elle est lavée à l'eau.
Une solution acide douce est également utilisée pour enlever les taches de baies, d'encre ou de rouille des tissus. Pour ce faire, le matériau est trempé dans la composition pendant un certain temps, après quoi il est soigneusement rincé et lavé de la manière habituelle.
Se débarrasser du calcaire dans la bouilloire
A cet effet, une solution d'acide chlorhydrique à 3-5% est utilisée, qui est versée dans une bouilloire et chauffée à 60-80°
C pendant 1 à 2 heures ou jusqu'à ce que les dépôts de tartre se désintègrent. Après cela, le tartre se détache et s'enlève facilement avec une spatule en bois.
L'efficacité de la méthode est due au fait que le réactif réagit avec les carbonates de magnésium et de calcium et les transforme en sels solubles. Le dioxyde de carbone libéré en même temps détruit la couche de tartre et la détache. Après avoir éliminé les dépôts de sel, la vaisselle est soigneusement lavée à l'eau claire.
Point important!
Cette méthode n'est pas adaptée au détartrage des bouilloires en émail ou en aluminium ébréchées et fissurées : cela corroderait le métal et causerait de graves dommages.
Obtenir une substance
Maintenant, nous pouvons parler de ce qu'ils font pour former de l'acide chlorhydrique.
Tout d'abord, en brûlant de l'hydrogène dans du chlore, le composant principal, le chlorure d'hydrogène gazeux, est obtenu. qui est ensuite dissous dans l'eau. Le résultat de cette simple réaction est la formation d'un acide synthétique.
Cette substance peut également être obtenue à partir de gaz de dégagement. Ce sont des gaz de déchets chimiques (secondaires). Ils sont formés par une variété de processus. Par exemple, lors de la chloration des hydrocarbures. Le chlorure d'hydrogène dans leur composition est appelé gaz de dégagement. Et l'acide ainsi obtenu, respectivement.
Il convient de noter que ces dernières années, la part de la substance de dégagement gazeux dans le volume total de sa production a augmenté. Et l'acide formé à la suite de la combustion de l'hydrogène dans le chlore est déplacé. Cependant, en toute justice, il convient de noter qu'il contient moins d'impuretés.
Utilisation en production
Il a une large application dans les industries métallurgiques, alimentaires et médicales.
- Métallurgie. Utilisation pour le soudage, l'étamage et le nettoyage des métaux.
- Industrie alimentaire. Application à la fabrication de régulateurs d'acidité alimentaire, par exemple E507.
- Galvanotype. Utilisé pour le marinage.
- Médicament. Il trouve son application dans la production de suc gastrique artificiel.
Inclus dans les colorants synthétiques. Il est utilisé dans la fabrication de produits de nettoyage et de détergents. Mais dans les liquides destinés à un usage domestique, la concentration en acide sulfurique est négligeable.
Comment l'acide chlorhydrique est produit en laboratoire
La production de la substance est à grande échelle, la vente est libre. Dans les conditions des expériences de laboratoire, une solution est produite par l'action d'acide sulfurique à haute concentration sur du sel de cuisine ordinaire (chlorure de sodium).
Il existe 2 méthodes pour dissoudre le chlorure d'hydrogène dans l'eau :
- L'hydrogène est brûlé dans le chlore (synthétique).
- Associé (gaz d'échappement). Son essence est de réaliser la chloration organique, la déshydrochloration.
La substance se prête bien à la synthèse lors de la pyrolyse des déchets d'organochlorés. Cela se produit à la suite de la décomposition des hydrocarbures avec un manque total d'oxygène. Vous pouvez également utiliser des chlorures métalliques, qui sont les matières premières des substances inorganiques. S'il n'y a pas d'acide sulfurique concentré (électrolyte), prendre dilué.
Quant à l'extraction du réactif dans des conditions naturelles, le plus souvent ce mélange chimique se retrouve dans les eaux des déchets volcaniques. Le chlorure d'hydrogène est un composant des minéraux sylvin (chlorure de potassium, ressemble à des os pour les jeux), bischofite. Ce sont toutes des méthodes pour extraire la substance dans l'industrie.
Chez l'homme, cette enzyme se trouve dans l'estomac. Une solution peut être soit un acide, soit une base. L'une des méthodes d'extraction les plus courantes est appelée sulfate.
Propriétés chimiques
Acide chlorhydrique, chlorure d'hydrogène ou acide chlorhydrique - solution HCl
dans l'eau. Selon Wikipedia, la substance appartient au groupe des to-t monobasiques forts inorganiques. Le nom complet du composé en latin : acide hydrochlorique.
Formule de l'acide chlorhydrique en chimie : HCl
. Dans une molécule, les atomes d'hydrogène se combinent avec des atomes d'halogène - CL
. Si l'on considère la configuration électronique de ces molécules, on peut noter que des composés participent à la formation d'orbitales moléculaires 1s
- les orbitales d'hydrogène et les deux 3s
et 3p
-orbitales d'un atome CL
. Dans la formule chimique de l'acide chlorhydrique 1s-
, 3s-
et 3r
-les orbitales atomiques se chevauchent et forment 1, 2, 3 orbitales. Où 3s
-orbital n'est pas contraignant. Il y a un déplacement de la densité électronique vers l'atome CL
et la polarité de la molécule diminue, mais l'énergie de liaison des orbitales moléculaires augmente (si nous la considérons avec d'autres halogénures d'hydrogène
).
Propriétés physiques du chlorure d'hydrogène. C'est un liquide clair et incolore qui fume lorsqu'il est exposé à l'air. Masse molaire d'un composé chimique = 36,6 grammes par mole. Dans des conditions standard, à une température de l'air de 20 degrés Celsius, la concentration maximale d'une substance est de 38% en poids. La densité de l'acide chlorhydrique concentré dans ce type de solution est de 1,19 g/cm³. En général, les propriétés physiques et les caractéristiques telles que la densité, la molarité, la viscosité, la capacité calorifique, le point d'ébullition et pH
, dépendent fortement de la concentration de la solution. Ces valeurs sont discutées plus en détail dans le tableau des densités. Par exemple, la densité de l'acide chlorhydrique 10 % = 1,048 kg par litre. Une fois solidifiée, la substance forme hydrates cristallins
compositions différentes.
Propriétés chimiques de l'acide chlorhydrique. Avec quoi réagit l'acide chlorhydrique ? La substance interagit avec les métaux qui se trouvent devant l'hydrogène dans une série de potentiels électrochimiques (fer, magnésium, zinc et autres). Dans ce cas, des sels sont formés et gazeux H
. Le plomb, le cuivre, l'or, l'argent et les autres métaux à droite de l'hydrogène ne réagissent pas avec l'acide chlorhydrique. La substance réagit avec les oxydes métalliques produisant de l'eau et un sel soluble. Hydroxyde de sodium sous l'action des formes à vous et de l'eau. La réaction de neutralisation est caractéristique de ce composé.
L'acide chlorhydrique dilué réagit avec les sels métalliques, qui sont formés par des acides plus faibles. Par exemple, l'acide propionique
plus faible que le sel. La substance ne réagit pas avec des acides plus forts. et le carbonate de sodium
se formera après réaction avec HCl
chlorure, monoxyde de carbone et eau.
Pour un composé chimique, les réactions avec les agents oxydants forts sont caractéristiques, avec dioxyde de manganèse
, le permanganate de potassium
: 2KMnO4 + 16HCl = 5Cl2 + 2MnCl2 + 2KCl + 8H2O
. La substance réagit avec ammoniac
, qui produit une épaisse fumée blanche constituée de très fins cristaux de chlorure d'ammonium. La pyrolusite minérale réagit également avec l'acide chlorhydrique, car elle contient dioxyde de manganèse
: MnO2+4HCl=Cl2+MnO2+2H2O
(réaction d'oxydation).
Il y a une réaction qualitative à l'acide chlorhydrique et à ses sels. Lorsqu'une substance interagit avec nitrate d'argent
un précipité blanc chlorure d'argent
et formé acide nitrique
. Équation de réaction d'interaction méthylamine
avec du chlorure d'hydrogène ressemble à ceci : HCl + CH3NH2 = (CH3NH3)Cl
.
Une substance réagit avec une base faible aniline
. Après dissolution de l'aniline dans l'eau, de l'acide chlorhydrique est ajouté au mélange. En conséquence, la base se dissout et forme chlorhydrate d'aniline
(chlorure de phénylammonium
): (С6Н5NH3)Cl
. La réaction d'interaction du carbure d'aluminium avec l'acide chlorhydrique : Al4C3+12HCL=3CH4+4AlCl3
. Équation de réaction carbonate de potassium
avec qui ça ressemble à ça : K2CO3 + 2HCl = 2KCl + H2O + CO2.
Application
en métallurgie pour l'extraction des minerais, l'élimination de la rouille, du tartre, de la saleté et des oxydes, la soudure et l'étamage ;
dans la fabrication de caoutchoucs synthétiques et de résines ;
en galvanoplastie;
comme régulateur d'acidité dans l'industrie alimentaire;
pour obtenir des chlorures métalliques;
obtenir du chlore;
en médecine pour le traitement de l'acidité insuffisante du suc gastrique;
comme nettoyant et désinfectant.
- (HCl), une solution aqueuse de chlorure d'hydrogène, un gaz incolore à odeur piquante. Obtenu par l'action de l'acide sulfurique sur le sel commun, comme sous-produit de la chloration des hydrocarbures, ou par la réaction de l'hydrogène et du chlore. L'acide chlorhydrique est utilisé pour ... ... Dictionnaire encyclopédique scientifique et technique
Acide hydrochlorique
- - HCl (SC) (acide chlorhydrique, acide chlorhydrique, chlorure d'hydrogène) est une solution de chlorure d'hydrogène (HCl) dans l'eau, un additif antigel. C'est un liquide incolore avec une odeur piquante, sans particules en suspension. ... ... Encyclopédie des termes, définitions et explications des matériaux de construction
ACIDE HYDROCHLORIQUE
- (acide chlorhydrique) solution de chlorure d'hydrogène dans l'eau ; acide fort. Un liquide incolore fumant dans l'air (l'acide chlorhydrique technique est jaunâtre en raison des impuretés de Fe, Cl2, etc.). La concentration maximale (à 20 ° C) est de 38% en masse, ... ... Grand dictionnaire encyclopédique
ACIDE HYDROCHLORIQUE
- (Acidum muriaticum, Acid, hydrochloricum), une solution de chlorure d'hydrogène (HC1) dans l'eau. Dans la nature, il est présent dans l'eau de certaines sources d'origine volcanique et se retrouve également dans le suc gastrique (jusqu'à 0,5%). Le chlorure d'hydrogène peut être obtenu ... Big Medical Encyclopedia
ACIDE HYDROCHLORIQUE
- (acide chlorhydrique, acide chlorhydrique) un acide volatil monobasique fort à odeur piquante, une solution aqueuse de chlorure d'hydrogène ; la concentration maximale est de 38 % en masse, la masse volumique d'une telle solution est de 1,19 g/cm3. Utilisé dans ... ... Encyclopédie russe de la protection du travail
ACIDE HYDROCHLORIQUE
- (acide chlorhydrique) HCl solution aqueuse de chlorure d'hydrogène, acide monobasique fort, volatil, à odeur piquante ; les impuretés de fer, le chlore le tachent de jaunâtre. Le concentré S. à vendre contient 37% ... ... Grande Encyclopédie Polytechnique
acide hydrochlorique
— nom, nombre de synonymes: 1 acide (171) ASIS Synonym Dictionary. V.N. Trichine. 2013 ... Dictionnaire des synonymes
ACIDE HYDROCHLORIQUE
Encyclopédie moderne
Acide hydrochlorique
- ACIDE HYDROGÉNIQUE, solution aqueuse de chlorure d'hydrogène HCl ; un liquide fumant avec une odeur piquante. L'acide chlorhydrique est utilisé pour obtenir divers chlorures, décaper les métaux, traiter les minerais, dans la production de chlore, de soude, de caoutchoucs, etc. ... ... Dictionnaire encyclopédique illustré
acide hydrochlorique
- (acide chlorhydrique), une solution de chlorure d'hydrogène dans l'eau ; acide fort. Un liquide incolore "fumant" dans l'air (l'acide chlorhydrique technique est jaunâtre en raison des impuretés de Fe, Cl2, etc.). Concentration maximale (à 20 ° C) 38% en masse, ... ... Dictionnaire encyclopédique
Quel est le danger d'intoxication
L'acide chlorhydrique est un danger particulier pour le corps humain. En cas d'empoisonnement avec une telle substance, des complications graves et des violations de la fonctionnalité du corps peuvent se développer.
Complications:
- Violation du foie, à la suite d'une hépatite toxique,
- Saignement dans l'estomac dû aux parois détruites de l'organe,
- Choc de douleur lorsque l'acide pénètre dans une grande zone,
- En cas de contact avec les yeux, déficience visuelle,
- Dysfonctionnement grave des reins,
- Insuffisance respiratoire, suffocation, essoufflement,
- Le développement d'un coma.
Des conséquences similaires se développent progressivement en fonction du degré d'empoisonnement.
Conclusion
Si vous respectez les précautions et les règles de sécurité, l'acide chlorhydrique deviendra un assistant indispensable au quotidien. Et vous pouvez l'acheter aux prix les plus abordables de notre société.
Comme les acides. Le programme d'enseignement prévoit la mémorisation par les élèves des noms et formules de six représentants de ce groupe. Et, en parcourant le tableau fourni par le manuel, vous remarquez dans la liste des acides celui qui vient en premier et qui vous intéresse en premier lieu - l'acide chlorhydrique. Hélas, dans la salle de classe à l'école, ni la propriété ni aucune autre information à son sujet ne sont étudiées. Par conséquent, ceux qui souhaitent acquérir des connaissances en dehors du programme scolaire recherchent des informations supplémentaires dans toutes sortes de sources. Mais souvent, beaucoup ne trouvent pas les informations dont ils ont besoin. Et donc le sujet de l'article d'aujourd'hui est dédié à cet acide particulier.
Définition
L'acide chlorhydrique est un acide monobasique fort. Dans certaines sources, il peut être appelé chlorhydrique et chlorhydrique, ainsi que chlorure d'hydrogène.
Propriétés physiques
C'est un liquide caustique incolore et fumant dans l'air (photo de droite). Cependant, l'acide technique a une couleur jaunâtre en raison de la présence de fer, de chlore et d'autres additifs. Sa plus grande concentration à une température de 20°C est de 38 %. La masse volumique de l'acide chlorhydrique avec de tels paramètres est de 1,19 g/cm 3 . Mais ce composé à divers degrés de saturation a des données complètement différentes.Avec une diminution de la concentration, la valeur numérique de la molarité, de la viscosité et du point de fusion diminue, mais la capacité thermique spécifique et le point d'ébullition augmentent. La solidification de l'acide chlorhydrique de toute concentration donne divers hydrates cristallins.
Propriétés chimiques
Tous les métaux qui précèdent l'hydrogène dans la série électrochimique de leur tension peuvent interagir avec ce composé, formant des sels et libérant de l'hydrogène gazeux. S'ils sont remplacés par des oxydes métalliques, les produits de réaction seront du sel soluble et de l'eau. Le même effet sera dans l'interaction de l'acide chlorhydrique avec les hydroxydes. Si, cependant, on y ajoute un sel de métaux (par exemple, du carbonate de sodium), dont le résidu a été prélevé sur un acide plus faible (carbonique), alors le chlorure de ce métal (sodium), l'eau et le gaz correspondant à l'acide des résidus (dans ce cas, du dioxyde de carbone) se forment.
Reçu
Le composé dont il est maintenant question se forme lorsque du chlorure d'hydrogène gazeux, qui peut être obtenu en brûlant de l'hydrogène dans du chlore, est dissous dans de l'eau. L'acide chlorhydrique, qui a été obtenu à l'aide de cette méthode, est appelé synthétique. Les gaz de dégagement peuvent également servir de source pour obtenir cette substance. Et cet acide chlorhydrique sera appelé dégagement gazeux. Récemment, le niveau de production d'acide chlorhydrique par cette méthode est bien supérieur à sa production par une méthode de synthèse, bien que cette dernière donne le composé sous une forme plus pure. Ce sont toutes des façons de l'obtenir dans l'industrie. Cependant, dans les laboratoires, l'acide chlorhydrique est produit de trois manières (les deux premières ne diffèrent que par la température et les produits de réaction) en utilisant divers types d'interactions chimiques, telles que :
- Effet de l'acide sulfurique saturé sur le chlorure de sodium à une température de 150 o C.
- L'interaction des substances ci-dessus dans des conditions de température de 550 ° C et plus.
- Hydrolyse des chlorures d'aluminium ou de magnésium.
Application
L'hydrométallurgie et l'électroformage ne peuvent se passer de l'utilisation d'acide chlorhydrique, là où il est nécessaire, pour nettoyer la surface des métaux lors de l'étamage et du brasage et pour obtenir des chlorures de manganèse, de fer, de zinc et d'autres métaux. Dans l'industrie alimentaire, ce composé est connu sous le nom d'additif alimentaire E507 - il s'agit d'un régulateur d'acidité nécessaire pour fabriquer de l'eau de Seltz (soude). L'acide chlorhydrique concentré se trouve également dans le suc gastrique de toute personne et aide à digérer les aliments. Au cours de ce processus, son degré de saturation diminue, car. cette composition est diluée avec de la nourriture. Cependant, avec un jeûne prolongé, la concentration d'acide chlorhydrique dans l'estomac augmente progressivement. Et comme ce composé est très caustique, il peut entraîner des ulcères d'estomac.
Conclusion
L'acide chlorhydrique peut être à la fois bénéfique et nocif pour l'homme. Son contact avec la peau entraîne l'apparition de brûlures chimiques graves, et les vapeurs de ce composé irritent les voies respiratoires et les yeux.
Mais si vous manipulez cette substance avec précaution, elle peut être utile plus d'une fois dans