Exploitation

Dans les batteries à flux de vanadium, les deux électrodes de référence sont en outre connectées à des réservoirs de stockage et à des pompes afin que de très grands volumes d'électrolyte puissent circuler à travers la cellule. La circulation de l'électrolyte liquide est quelque peu difficile et limite l'utilisation des batteries à flux de vanadium dans les industries nécessitant de la mobilité, ce qui les rend efficaces dans les grands bâtiments fixes.
Lorsqu'une batterie au vanadium est chargée, les ions VO2+ de l'électrode de référence chargée positivement se transforment en ions VO2+ lorsque les électrons se détachent de la borne positive de la batterie. De même, dans l'électrode de référence négative, les électrons convertissent les ions V3+ en V2+. Pendant la décharge, ce processus est inversé, ce qui donne une tension en circuit ouvert de 1,41 V à 25°C.
Les autres propriétés utiles des batteries à flux de vanadium comprennent une réponse très rapide aux changements de charge et une capacité de surcharge extrêmement élevée. Des recherches menées à l'Université de Nouvelle-Galles du Sud ont montré qu'ils peuvent atteindre des temps de réponse inférieurs à une demi-milliseconde à des changements de charge de 100 % et résister à une surcharge de 400 % pendant plus de 10 secondes. Le temps de réponse est dans la plupart des cas limité par l'équipement électrique. Les batteries au vanadium à base d'acide sulfurique ne fonctionnent qu'à des températures de 10 à 40 °C. Si la température est inférieure à cette plage, les ions d'acide sulfurique cristallisent. L'efficacité du mouvement alternatif dans l'utilisation quotidienne reste au niveau de 65-75%.
Caractéristiques de charge et de décharge
Les algorithmes de charge dépendent directement de la disposition de la batterie et du type auquel elle appartient. Par exemple, certaines batteries peuvent reconstituer leur capacité en toute sécurité à partir de sources de tension constante. D'autres fonctionnent uniquement avec une source de courant réglable qui peut modifier les paramètres en fonction du niveau de charge.
Un processus de charge mal organisé peut endommager la batterie. Dans des cas extrêmes, la batterie peut s'enflammer ou exploser. Il existe des batteries intelligentes équipées de dispositifs de surveillance de la tension. Les principaux paramètres à prendre en compte lors du fonctionnement des batteries galvaniques réversibles sont :
- Durée de vie. Même avec une bonne manipulation, le nombre de cycles de charge d'une batterie est limité. Différents systèmes de batterie ne s'usent pas toujours pour les mêmes raisons. Mais en général, la durée de vie de la batterie est limitée d'abord par le nombre de cycles complets de charge-décharge, et d'autre part par la durée de vie de conception sans référence à l'intensité d'utilisation.
- Temps de charge. La conception fondamentale de la batterie n'implique pas une charge à une vitesse arbitrairement élevée : la résistance interne de la cellule galvanique conduira à la conversion du courant de charge excessif en chaleur, ce qui peut endommager l'appareil de manière irréversible. D'un point de vue physique, le temps de charge est limité par la vitesse de diffusion maximale de la matière active à travers l'électrolyte.De manière simpliste, on peut supposer que la restauration de la pleine capacité en une heure est un bon indicateur.
- Profondeur de décharge. Spécifié en pourcentage de la puissance nominale. Décrit la capacité utilisable. Pour différents types de batteries, le niveau de décharge de fonctionnement recommandé peut varier. En raison de changements de fonctionnement ou de vieillissement, l'indicateur de profondeur maximale perd sa valeur d'origine.
processus de diffusion.
En raison du processus de diffusion, de l'alignement de la densité d'électrolyte dans la cavité du boîtier de la batterie et dans les pores de la masse active des plaques, la polarisation des électrodes peut être maintenue dans la batterie lorsque le circuit externe est éteint.
La vitesse de diffusion dépend directement de la température de l'électrolyte, plus la température est élevée, plus le processus se déroule rapidement et peut varier considérablement dans le temps, de deux heures à une journée. La présence de deux composants du potentiel d'électrode dans des conditions transitoires a conduit à la division en EMF d'équilibre et de non-équilibre de la batterie. La FEM d'équilibre de la batterie est affectée par la teneur et la concentration en ions des substances actives dans l'électrolyte, ainsi que par les propriétés chimiques et physiques des substances actives. Le rôle principal dans l'amplitude de l'EMF est joué par la densité de l'électrolyte et la température ne l'affecte pratiquement pas. La dépendance de l'EMF à la densité peut être exprimée par la formule :
La force électromotrice de la batterie n'est pas égale à la tension de la batterie, qui dépend de la présence ou de l'absence d'une charge à ses bornes.
admin25/07/2011
Un commentaire
Nom *
Site
Ce site utilise Akismet pour lutter contre le spam. Découvrez comment les données de vos commentaires sont traitées.
« Tachymètre mécanique
Voltage de batterie "
Mots clés
VAZ, dysfonctionnements VAZ Capteurs Allumage Injecteur Dispositifs Schémas de démarrage Voitures électriques Alimentation électrique vaz 2110 gazelle registres d'entreprises de gazelle réparation automobile
Entrées récentes
- Capteurs dans la voiture : types et objectifs
- Le plus grand EDumper de voiture électrique au monde,
- Lumières lasers.
- Avantages et inconvénients des lampes halogènes
- Le dispositif et le principe de fonctionnement des capteurs de stationnement
Les archives
Archives Selece Septembre 2016 Août 2017 Juillet 2017 Juin 2017 Mai 2017 En avril 2017 mars 2017 Décembre 2016 novembre 2016 octobre 2016 septembre 2016 août 2016 avril 2016 mars 2016 février 2016 novembre 2015 octobre 2015 août 2015 juillet 2015 juin 2015 mai 2015 Janvier 2015 Décembre 2014 Novembre 2014 Octobre 2014 Septembre 2014 Août 2014 Juillet 2014 Juin 2014 Mai 2014 Avril 2014 Février 2014 Janvier 2014 Décembre 2013 Novembre 2013 Octobre 2013 Août 2013 Juin 2013 Mai 2013 Mars Septembre 2012, 2013, 2012, 2012, 2012 2012, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011, 2011 Septembre 2012, 2011, 2011, 2011, 2011, 2011, 2011
Catégories
- Batterie d'accumulateur
- Vidéo
- Générateur
- Capteurs
- Diagnostique
- Allumage
- des nouvelles
- Équipement
- Dispositifs
- réparation
- Bougie d'allumage
- Entrée
- Schème
- Dispositifs
- voiture électrique
- Source de courant
Nous sommes sur les réseaux sociaux
Électricien automobile @ Tous droits réservés. Lorsque vous copiez des éléments du site, vous devez fournir un lien vers le site.
Appareil et principe de fonctionnement
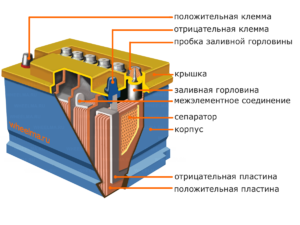
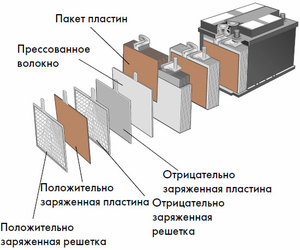
Chacune de ces cellules possède une cathode (électrode positive) et une anode (négative). Ces électrodes sont séparées par un électrolyte qui assure l'échange d'ions entre elles. Les matériaux d'électrode et la composition de l'électrolyte sont choisis pour fournir une force électromotrice suffisante entre les bornes de la batterie.
Étant donné que les électrodes contiennent un potentiel limité d'énergie chimique, la batterie s'épuise pendant le fonctionnement. Le type de cellules galvaniques, adapté au réapprovisionnement après une décharge partielle ou complète, s'appelle une batterie. Un ensemble de telles cellules interconnectées est une batterie.Le fonctionnement sur batterie implique un changement cyclique de deux états :
- Chargement - la batterie fonctionne comme un récepteur d'électricité, à l'intérieur des cellules l'énergie électrique est réalisée par des changements chimiques.
- Décharge - l'appareil fonctionne comme une source de courant électrique en convertissant l'énergie des réactions chimiques en énergie électrique.
Domaines d'utilisation
La caractéristique de capacité ultra élevée des batteries redox au vanadium les rend bien adaptées à une utilisation dans les industries nécessitant un stockage d'énergie élevé. Par exemple, aider à équilibrer le volume de production de telles sources d'énergie telles que l'éolien ou le solaire, ou aider les générateurs à absorber de grandes surtensions d'énergie en cas de besoin, ou équilibrer l'offre et la demande d'énergie pour les régions éloignées.
Les caractéristiques d'autodécharge limitées des batteries redox au vanadium les rendent utiles dans les industries où les batteries doivent être stockées pendant de longues périodes avec un minimum de maintenance et de préparation. Cela a conduit à leur utilisation dans certains types d'électronique militaire, par exemple dans les capteurs du système minier GATOR. Leur capacité à parcourir et à rester à zéro les rend adaptées aux applications solaires et aux industries où les batteries doivent commencer la journée vides et se recharger en fonction de la charge et des conditions météorologiques. Par exemple, les batteries lithium-ion sont souvent endommagées lorsqu'elles sont autorisées à se décharger en dessous de 20 % de leur volume, elles fonctionnent donc le plus souvent dans la plage de 20 à 100 %, ce qui signifie qu'elles ne peuvent utiliser que 20 % de leur capacité nominale.
Leur temps de réponse extrêmement rapide les rend également pratiquement indispensables pour les alimentations sans interruption, où ils peuvent être utilisés à la place des batteries au plomb et même des générateurs diesel. De plus, le temps de réponse rapide les rend adaptés au contrôle de fréquence. À l'heure actuelle, ni les onduleurs ni les mesures de gestion des fréquences ne sont efficaces par eux-mêmes, mais il est probable que la batterie pourra trouver des applications dans ces industries lorsqu'elle sera capitalisée à partir de diverses sources de financement. De plus, ces capacités font des batteries redox au vanadium une solution « monobloc » efficace pour les petits réseaux électriques qui dépendent d'un fonctionnement fiable, d'un contrôle de fréquence et de besoins de commutation de charge (tels qu'une forte pénétration des énergies renouvelables, des charges très fluctuantes ou le désir de optimiser l'efficacité du générateur en décalant le temps de réponse).
Les plus grandes batteries redox au vanadium en état de marche
Sous-station "Minami Hyakita":
- Date de lancement : Décembre 2015
- Énergie : 60 MWh
- Puissance : 15 MW
- Temps de travail : 4 heures
- Pays : Japon
Puant, province du Liaoning
- Date de lancement : N/A
- Énergie : 10 MWh
- Puissance : 5 MW
- Temps de travail : 2 heures
- Pays : Chine
Parc éolien de Tomamae
- Date de lancement : 2005
- Énergie : 6 MWh
- Puissance : 4 MW
- Temps de travail : 1h30
- Pays : Japon
Projet Zhangbei
- Date de lancement 2016
- Énergie : 8 MWh
- Puissance : 2 MW
- Temps de travail : 4 heures.
- Pays : Chine
Projet SnoPUD MESA 2
- Date de lancement : Mars 2017
- Énergie : 8 MWh
- Puissance : 2 MW
- Temps de travail : 4 heures.
- Pays : États-Unis
Sous-station à Escondido
- Date de lancement : 2017
- Énergie : 8 MWh
- Puissance : 2 MW
- Temps de travail : 4 heures.
- Pays : États-Unis
Sous-station à Pullman, Washington
- Date de lancement : avril 2015
- Énergie : 4 MWh
- Puissance : 1 MW
- Temps de travail : 4 heures
- Pays : États-Unis
D'ici 2018, le développement d'une batterie redox au vanadium devrait être achevé en Chine. Son énergie sera de 800 MWh, sa puissance - 200 MW et sa durée de fonctionnement - 4 heures.
termes
- Séquentiel - les éléments se succèdent.
- La force électromotrice (FEM) est la tension générée par une batterie ou une force magnétique conformément à la loi de Faraday.
- Parallèle - Les composants électriques sont disposés de manière à ce que le courant circule le long de deux chemins ou plus.
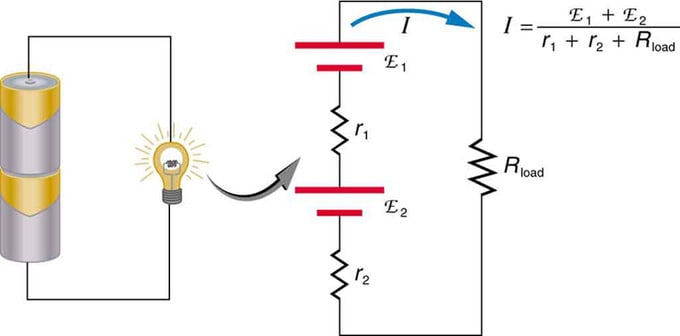
Si vous utilisez plusieurs sources de tension, elles peuvent être connectées en série ou en parallèle. Avec la version série, ils sont accordés dans le même sens, la résistance interne est augmentée et la force électromotrice est ajoutée algébriquement. Des types similaires sont courants dans les lampes de poche, les jouets et une variété d'autres appareils. Les cellules sont placées en série pour augmenter la fem totale.
Connexion en série de deux sources de tension dans le même sens. Le schéma montre une lanterne avec deux cellules et une lampe
Batterie - connexion multiple d'éléments volts. Mais il y a un inconvénient dans la connexion en série, car des résistances internes sont ajoutées. Cela crée parfois des problèmes. Disons que vous avez deux piles 6V que vous insérez au lieu des 12V habituels. En conséquence, vous avez ajouté non seulement l'EMF, mais également la résistance interne de chaque batterie.
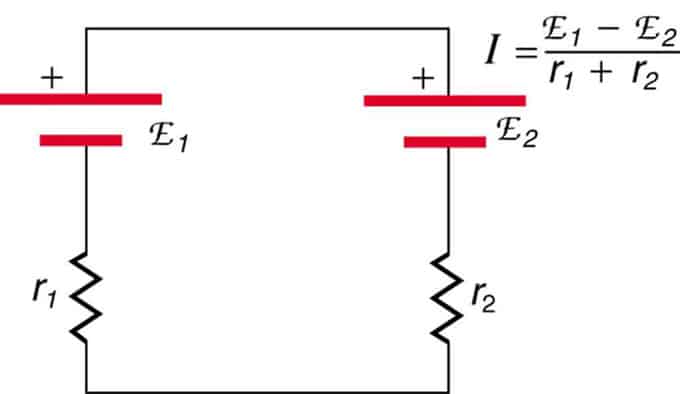
Si les cellules sont situées en opposition (l'une est située derrière l'autre), alors l'EMF total diminuera.
Ce sont deux sources de tension connectées en série avec des émissions opposées. Le courant circule dans la direction d'une plus grande force électromotrice et est limité par la somme des résistances internes. Un exemple est un chargeur. Il doit avoir plus d'emf que la batterie
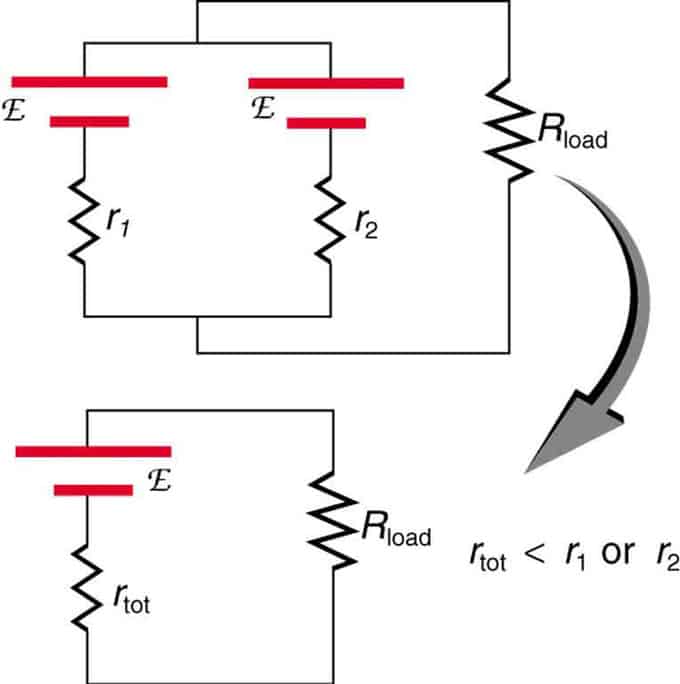
Si deux sources avec la même force électromotrice sont situées en parallèle et connectées à la résistance de charge, alors la FEM totale reste la même que les différentes. Cependant, la résistance interne totale sera réduite. Il s'avère que la version parallèle peut générer plus de courant.
Deux sources de tension avec une seule FEM sont combinées en parallèle. Ils forment un EMF, mais ont moins de résistance totale qu'individuellement. Des combinaisons similaires sont utilisées si vous avez besoin d'obtenir plus de courant.
| Aperçu |
|
| Connexion en parallèle et en série des résistances |
|
| Règles de Kirchhoff |
|
| Voltmètres et ampèremètres |
|
| Circuits RC |
|
Aperçu historique
Le développement de la première cellule galvanique est attribué au physicien italien Alessandro Volta. Il mena une série d'expériences sur les phénomènes électrochimiques au cours des années 1790 et vers 1800 il créa la première batterie, que ses contemporains appelaient la "colonne voltaïque". Le dispositif consistait en une alternance de disques de zinc et d'argent séparés par des couches de papier ou de tissu trempées dans une solution d'hydroxyde de sodium.
Ces expériences sont devenues la base des travaux de Michael Faraday sur les lois quantitatives de l'électrochimie. Il a décrit le principe de fonctionnement de la batterie et, sur la base des travaux du scientifique, les premières cellules électriques commerciales ont été créées. L'évolution ultérieure ressemblait à ceci:
- En 1836, le chimiste britannique John Daniel a présenté un modèle amélioré de la cellule, composé d'électrodes de cuivre et de zinc immergées dans de l'acide chlorhydrique. L'élément de Daniel était capable de fournir une tension constante de manière incomparablement plus efficace que les appareils de Volt.
- 1839 De nouveaux progrès ont été réalisés par le physicien Grove avec sa cellule à deux fluides, constituée de zinc immergé dans de l'acide sulfurique dilué dans un récipient poreux. Ce dernier a séparé l'acide sulfurique d'un récipient contenant de l'acide nitrique dans lequel était placée une cathode de platine. L'acide nitrique a servi d'agent oxydant pour empêcher la perte de tension due à l'accumulation d'hydrogène à la cathode.Le chimiste allemand Robert Bunsen a remplacé le platine par du carbone bon marché dans la cellule Grove et a ainsi favorisé l'acceptation généralisée de ce type de batterie.
- En 1859, Gaston Plante invente la pile au plomb, ancêtre de la batterie de voiture moderne. L'appareil de Plante était capable de produire un courant inhabituellement important, mais n'a été utilisé que pour des expériences en laboratoire pendant près de deux décennies.
- 1895-1905 ans. Invention des éléments alcalins nickel-cadmium et nickel-fer. Cela a permis de créer des systèmes avec un nombre important de cycles de charge-décharge.
- Depuis les années 1930, le développement des piles alcalines argent-zinc et mercure-zinc a commencé, qui fournissaient une densité d'énergie élevée par unité de poids et de volume.
- Depuis le milieu du XXe siècle, les progrès de la technologie de fabrication et l'avènement de nouveaux matériaux ont conduit à des batteries encore plus puissantes et compactes. Le plus notable a été l'introduction sur le marché des batteries au nickel-hydrure métallique et au lithium.
Chargement des piles
Article principal : Chargeur
Lorsque l'énergie chimique s'épuise, la tension et le courant chutent et la batterie cesse de fonctionner. Vous pouvez charger la batterie (batterie de batteries) à partir de n'importe quelle source DC avec une tension plus élevée tout en limitant le courant. Le plus courant est le courant de charge (en ampères), proportionnel à 1/10 de la capacité nominale conditionnelle de la batterie (en ampères heures).
Cependant, sur la base de la description technique diffusée par les fabricants de batteries électriques largement utilisées (NiMH, NiCd), on peut supposer que ce mode de charge, communément appelé la norme, est calculé sur la durée d'une journée de travail de huit heures, lorsque la batterie, déchargée à la fin de la journée de travail, est connectée au chargeur secteur avant le début d'une nouvelle journée de travail. L'utilisation d'un tel mode de charge pour ces types de batteries à usage systématique permet de maintenir un équilibre qualité-coût dans le fonctionnement du produit. Ainsi, à la suggestion du fabricant, ce mode ne peut être utilisé que pour les batteries nickel-cadmium et nickel-hydrure métallique.
De nombreux types de batteries ont des limitations différentes qui doivent être prises en compte lors de la charge et de l'utilisation ultérieure, par exemple, les batteries NiMH sont sensibles à la surcharge, les batteries au lithium sont sensibles à la décharge excessive, à la tension et à la température. Les batteries NiCd et NiMH ont ce que l'on appelle un effet mémoire, qui consiste en une diminution de la capacité lors de la charge lorsque la batterie n'est pas complètement déchargée. De plus, ces types de batteries ont une autodécharge notable, c'est-à-dire qu'elles perdent progressivement leur charge sans être connectées à la charge. Pour lutter contre cet effet, la recharge goutte à goutte peut être utilisée.
Méthodes de charge de la batterie
Plusieurs méthodes sont utilisées pour charger les batteries; Généralement, la méthode de charge dépend du type de batterie.
- Charge CC lente
Chargez avec un courant continu proportionnel à 0,1-0,2 de la capacité nominale conditionnelle Q pendant environ 15-7 heures, respectivement.
La méthode de charge la plus longue et la plus sûre. Convient à la plupart des types de batteries.
- charge rapide
Chargez avec un courant continu proportionnel à 1/3 Q pendant environ 3 à 5 heures.
- Charge accélérée ou "delta-V"
Une charge avec un courant de charge initial proportionnel à la capacité nominale nominale de la batterie, à laquelle la tension de la batterie est constamment mesurée et la charge se termine une fois la batterie complètement chargée. Le temps de charge est d'environ une heure et demie. La batterie peut surchauffer et même la détruire.
- autoliquidation
Elle est réalisée en alternant des impulsions de charge longues avec des impulsions de décharge courtes. La méthode inverse est la plus utile pour charger les batteries NiCd et NiMH, qui sont caractérisées par ce qu'on appelle.n.m. "effet mémoire".